Российские нанотехнологии, 2022, T. 17, № 4, стр. 486-492
Получение порошков карбидов тантала реакцией тантала с толуолом
В. Н. Колосов 1, *, М. Н. Мирошниченко 1
1 Институт химии и технологии редких элементов и минерального сырья им. И.В. Тананаева –
обособленное подразделение Федерального государственного бюджетного учреждения науки
Федерального исследовательского центра “Кольский научный центр Российской академии наук”
Апатиты, Россия
* E-mail: v.kolosov@ksc.ru
Поступила в редакцию 03.12.2021
После доработки 15.12.2021
Принята к публикации 07.01.2022
Аннотация
Исследован процесс получения порошков карбидов тантала с использованием в качестве прекурсора танталового порошка, а в качестве источника углерода паров толуола. При использовании магния в качестве in situ-раскислителя тантала в температурном интервале 650–850°С получены порошки карбидов тантала TaC и Ta2C. Удельная поверхность порошков находится на уровне 8–25 м2/г. Средние размеры кристаллитов карбидов составляют 7–16 нм. Порошки характеризуются мезопористой структурой.
ВВЕДЕНИЕ
Карбиды тантала характеризуются высокими твердостью и температурой плавления [1], хорошей стойкостью к окислению и химическому воздействию [2, 3], высокой электронной проводимостью [4] и каталитической активностью [5, 6]. Благодаря этим свойствам они имеют широкий спектр промышленного применения. Обычно карбиды тантала получают с использованием графита или аморфного углерода в твердофазной реакции науглероживания с танталом или оксидом тантала [7]. Процесс идет при температурах 1550–1750°С в атмосфере водорода или в вакууме по реакции
(1)
${\text{T}}{{{\text{a}}}_{x}}{{{\text{O}}}_{y}} + (x + y){\text{C}} \to x{\text{TaC}} + y{\text{CO}}{\kern 1pt} \uparrow {\kern 1pt} .$Метод является энергоемким, а размеры частиц полученных продуктов находятся в диапазоне десятков микрометров. Снижение размера частиц с микронного до субмикронного или нанометрового диапазона дает дополнительные преимущества, такие как упрощенная обработка порошка после синтеза и снижение температуры спекания. Кроме того, производство керамических материалов из порошков с субмикронными или наноразмерными зернами способствует улучшению таких механических характеристик керамики, как прочность, твердость и ударная вязкость [8].
Известны методы получения субмикронных и нанокристаллических порошков карбида тантала, включающие в себя золь-гель-синтез, плазменные методы, самораспространяющийся высокотемпературный синтез (СВС) и механосинтез [9–14]. Каждый из них наряду с достоинствами имеет определенные недостатки с точки зрения стоимости, качества продукта или безопасности процесса. Золь-гель-метод получения карбидов основан на использовании металлоорганических соединений-прекурсоров [9]. Суть метода заключается в получении тантал-углеродсодержащего геля путем гидролиза алкоксидов тантала в присутствии фенолформальдегидной смолы в спирте. Получение алкоксида тантала происходит при взаимодействии пентахлорида тантала с н-амиловым спиртом. Гидролиз проводят раствором этанола в воде. Затем полученный гель сушат и подвергают предварительной карбонизации при 400–450°С в условиях динамического вакуума и проводят синтез карбида тантала при 850–1200°С в вакууме. При синтезе наноразмерных порошков TaC с использованием метода высокочастотной плазмы также используют дорогостоящие металлоорганические прекурсоры [11]. Другими недостатками этого метода являются использование газообразного водорода и необходимость выполнять подготовку прекурсоров в перчаточном боксе. Метод СВС предполагает быстрый процесс изготовления карбидов тантала [12, 13]. Однако он имеет ограничения, обусловленные характером периодического процесса и сложностью его управления из-за слишком короткого времени реакции. В [14] использовали механохимический процесс для получения ультратонких порошков TaC, в котором оксид тантала и порошок углерода размалывали в течение 24 ч, а затем проводили синтез карбида при 900–1100°C в течение нескольких часов. Недостатками этого метода являются долговременное потребление энергии и риск загрязнения полученного продукта материалами измельчающей среды.
Для получения порошков карбидов тантала с развитой поверхностью также используют метод температурно-программируемых реакций (ТПР) науглероживания металла или его оксида смесями водорода и углеводородных газов [5, 6, 15, 16]. Его недостатком является то, что для получения воспроизводимых характеристик конечного продукта следует контролировать много параметров процесса. Кроме того, при получении карбидов методом ТПР используют горючие и взрывоопасные газы.
Ранее была показана возможность синтеза карбида молибдена Mo2C [17] и карбида вольфрама WC [18] науглероживанием порошков молибдена и вольфрама продуктами пиролиза органической жидкости (ОЖ) – этилового спирта (C2H5OH). По сравнению с традиционным методом синтеза этих карбидов путем твердофазных реакций температура процесса ниже на 500–700°C. По отношению к синтезу карбидов методом ТПР способ является более простым и безопасным.
Цель настоящей работы – изучение возможности синтеза карбида тантала науглероживанием порошка тантала продуктами пиролиза ОЖ. В качестве ОЖ выбран толуол (C7H8), который является доступным реагентом, и его химическая формула не содержит кислорода.
МАТЕРИАЛЫ И МЕТОДИКА ЭКСПЕРИМЕНТА
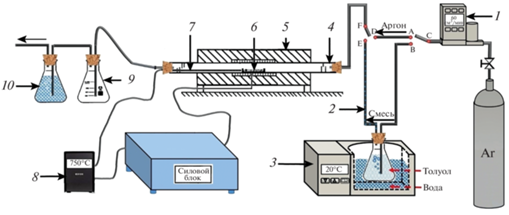
В качестве прекурсора использовали мезопористые порошки Ta, полученные магниетермическим восстановлением танталатов [19]. Удельная поверхность прекурсоров составляла 19 и 63 м2/г. Источник углерода – C7H8 “ч.д.а.”. Принципиальная схема экспериментальной установки показана на рис. 1. Установка представляет собой кварцевую трубку-реактор 4, в которую помещают кварцевую лодочку с металлическим порошком 6. Нагрев осуществляется трубчатой печью 5, температура контролируется термопарой 7. Инертный газ (аргон “вч”), несущий пары толуола в зону реакции, подается из баллона через трубопровод 2. Скорость подачи аргона регулируется ротаметром 1. Диаметр кварцевой трубки-реактора 22 мм. Рабочая зона печи составляет 70 мм. Процесс науглероживания тантала вели при температуре (T) 650–850°С в течение времени (t) 1–3 ч. Продукты реакции охлаждали в печи до комнатной температуры в атмосфере аргона. Масса загружаемого прекурсора составляла 0.6 г. Измерения масс проводили при комнатной температуре на лабораторных весах ВМР 200 (Россия) с погрешностью ±1 × 10–4 г. Порошок тантала нагревали в проточной атмосфере аргона (40 см3/мин) до температуры науглероживания, затем поток аргона направляли в колбу с жидким толуолом. Скорость потока аргона (VAr) в процессе науглероживания составляла 50–80 см3/мин. Температуру толуола поддерживали на уровне 20.0 ± ± 0.3°С. При этом парциальное давление его пара составляло 2.9 ± 0.1 кПа.
Рис. 1.
Схема экспериментальной установки: 1 – ротаметр, 2 – трубопровод толуола, 3 – термостат для толуола, 4 – трубка-реактор, 5 – трубчатая печь, 6 – кварцевый тигель, 7 – термопара, 8 – термодат, 9 – буферная емкость, 10 – водяной затвор.
Фазовый состав продуктов реакции определяли на дифрактометре SHIMADZU XRD-6000 (Япония) (CuKα-излучение). Идентификацию фаз осуществляли по базе дифрактометрических данных PDF-4 ICPDS-ICCD 2021. На приборе Micromeritics TriStar II 3020 (США) измеряли удельную поверхность адсорбционным статическим методом БЭТ (метод Брунауэра–Эммета–Теллера) и параметры пористости – методом BJH (метод Barrett–Joyner–Halenda). Средний размер кристаллитов карбидов тантала (d) оценивали рентгеновским методом по формуле Шерера [20].
ЛИТЕРАТУРНЫЕ ДАННЫЕ ПО ПИРОЛИЗУ ТОЛУОЛА
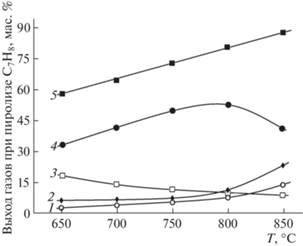
Газофазные реакции, протекающие при пиролизе толуола, исследовали в [21–25]. Как и при пиролизе других циклических ароматических соединений, при разложении C7H8 основными продуктами являются углеводороды с меньшим числом атомов углерода [21, 22]. Выход газов при пиролизе толуола в температурном интервале 650–850°C приведен на рис. 2. Видно, что при изменении температуры в этом интервале общий выход газов постепенно повышается с 58 до 88 мас. %. При высоких температурах в процессе газификации толуол в значительной степени может быть расщеплен на водород (H2) и углеводородные газы, такие как метан (CH4), этилен (C2H4) и пропан (C3H8). При пиролизе толуола в рассматриваемом температурном интервале из углеводородных газов больше всего составляет выход C2H4. При 800°C его доля в газовой смеси составляет 52 мас. %. При повышении температуры с 650 до 850°C выход C3H8 монотонно снижается с 18 до 9.7 мас. %. В то же время доля H2 и наиболее легкого углеводородного газа CH4 увеличивается соответственно с 1.7 до 12.1 и с 5.8 до 23.8 мас. %. При температуре выше 850°C основными газовыми продуктами разложения толуола являются CH4 и C2H4 [25]. Из анализа литературных данных следует, что при использовании продуктов пиролиза толуола для синтеза карбидов тантала непосредственными источниками углерода будут газы CH4, C2H4 и С3Н8. Массовое отношение между ними в науглероживающей смеси будет зависеть от температуры процесса.
Рис. 2.
Выход газов при пиролизе толуола в зависимости от температуры: 1 – H2, 2 – CH4, 3 – C3H8, 4 – C2H4, 5 – общий выход газов (на основе данных [24]).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
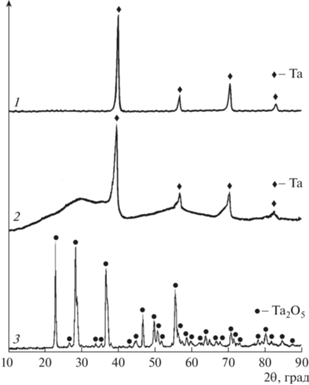
На рис. 3 приведены дифрактограммы исходных танталовых порошков и после науглероживания. Видно, что конечный продукт представляет собой пентаоксид тантала Та2О5. Он являлся единственным продуктом реакций при варьировании температуры науглероживания в интервале 650–850°С независимо от удельной поверхности прекурсора. Образование Та2О5 обусловлено наличием значительного количества кислорода в исходных танталовых порошках. Известно, что на воздухе поверхность металлического тантала всегда покрывается слоем естественного аморфного оксида Та2О5 толщиной ~2 нм [26]. Это означает, что в 1 г порошка с поверхностью 1 м2 содержится 0.3 мас. % кислорода. На присутствие большого количества поверхностного оксида указывает аморфная составляющая в области углов 2θ от 10° до 70° на дифрактограмме порошка тантала с удельной поверхностью 63 м2/г (рис. 3, кривая 2). Кроме того, количество сорбированного молекулярного кислорода па поверхности танталового порошка может достигать 40% от его содержания в поверхностном оксиде [27]. В процессе нагрева танталового порошка до температуры науглероживания за счет сорбированного кислорода происходит окисление металла. Процесс окисления тантала в температурном диапазоне 300–1300°C исследовали в [28–30]. Общую схему его окисления можно записать как [30]:
Рис. 3.
Дифрактограммы исходных танталовых порошков с поверхностью 19 (1), 63 м2/г (2) и после науглероживания порошка с поверхностью 63 м2/г (3); T = 750°С, VAr = 80 см3/мин, t = 2 ч.
При температуре ниже 500°C после образования упорядоченных твердых растворов Ta–O образуется субоксид TaOy, имеющий ромбическую структуру. При дальнейшем повышении температуры в виде пластинок формируется субоксид TaOz. Он имеет тригональную структуру. На поверхности TaOz зарождается пентаоксид Ta2O5, который является пористым и не защищает металл от дальнейшего окисления. При наличии достаточного количества кислорода металлический тантал полностью превращается в Ta2O5, который не восстанавливается газами, образующимися при пиролизе толуола.
Для обеспечения возможности науглероживания тантала следовало провести его in situ-раскисление до подачи паров толуола в реактор. С целью раскисления танталовый порошок перед загрузкой в установку смешивали с порошком магния (МГ95). Массу магния брали с избытком 100% по отношению к расчетному количеству, необходимому для полного раскисления тантала.
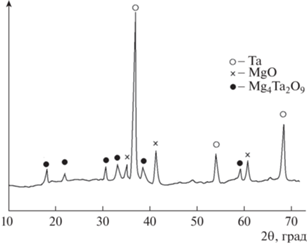
В первоначальных экспериментах с добавками Mg в качестве прекурсора использовали порошок Ta с удельной поверхностью 63 м2/г. Дифрактограмма продуктов реакции после науглероживания его в смеси с магнием приведена на рис. 4. Видно, что конечный продукт представляет собой смесь Ta, MgО и Mg4Ta2О9. При науглероживании этого порошка при различных температурах из интервала 750–850°С фазовый состав продуктов не изменялся. Образования карбидов не происходило. Полученный результат обусловлен особенностью раскисления тантала, имеющего высокую удельную поверхность. На начальном этапе его нагрева в результате раскисления образуется MgO. При более высоких температурах образовавшийся на начальном этапе раскисления оксид магния взаимодействует с Та2О5 по реакции
(2)
$\begin{gathered} 4{\text{MgO}} + {\text{T}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}} = {\text{M}}{{{\text{g}}}_{{\text{4}}}}{\text{T}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{9}}, \\ \Delta H_{{298}}^{^\circ } = - 4455\;{\text{кДж/моль}}. \\ \end{gathered} $Рис. 4.
Дифрактограмма продуктов реакции науглероживания порошка тантала с поверхностью 63 м2/г в смеси с магнием; T = 750°С, VAr = 80 см3/мин, t = 2 ч.
Возможность протекания реакции (2) обусловлена наличием значительного количества аморфного оксида Ta2O5 в исходном металле. В результате в структуре частиц раскисленного тантала величина зазора между частицами металла и прилегающими к нему частицами оксидных соединений MgО и Mg4Ta2О9 меньше диаметра молекул углеводородных газов, образующихся при пиролизе толуола. Таким образом, науглероживания тантала не происходит.
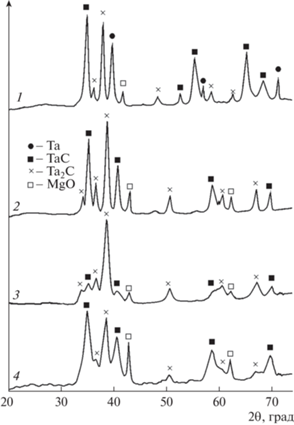
Для уменьшения количества MgО, образующегося в результате раскисления и снижения вероятности синтеза танталата Mg4Ta2О9, в последующих экспериментах в качестве прекурсора использовали танталовый порошок с меньшей удельной поверхностью. Дифрактограммы продуктов реакций, полученных при науглероживании порошка с удельной поверхностью 19 м2/г, приведены на рис. 5. Видно, что при использовании этого прекурсора из оксидных соединений образуется только MgО, а синтеза танталата Mg4Ta2О9 не происходит. При исследованных режимах науглероживания формируются карбиды TaC и Ta2C соответственно с кубической (пр. гр. Fm3m) и тригональной (пр. гр. Pm31) кристаллическими структурами. При времени науглероживания t ≤ 1.5 ч реакционная масса содержала значительное количество тантала (рис. 5, кривая 1).
Рис. 5.
Дифрактограммы продуктов реакций науглероживания танталового порошка с поверхностью 19 м2/г в смеси с магнием: 1 – T = 800°С, VAr = = 80 см3/мин, t = 1.5 ч; 2 – T = 750°С, VAr = = 80 см3/мин, t = 2 ч; 3 – T = 650°С, VAr = 60 см3/мин, t = 3 ч; 4 – T = 850°С, VAr = 70 см3/мин, t = 2.5 ч.
Для удаления оксида магния продукты восстановления, содержащие карбиды тантала, обрабатывали 15%-ным раствором соляной кислоты (“х.ч.”), а затем отмывали дистиллированной водой до нейтральной реакции раствора и сушили на воздухе при температуре 80°C.
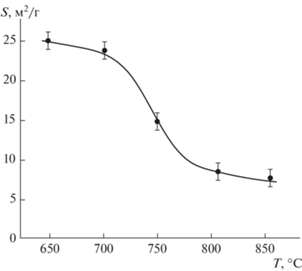
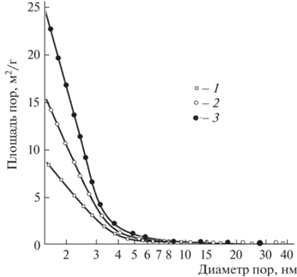
В зависимости от режимов реакций содержание карбида TaC в отмытой смеси карбидов изменялось от 5 до 53 мас. %. Удельная поверхность порошков составляла 8–25 м2/г (рис. 6). Развитая поверхность карбидов обусловлена их нанопористой структурой. Причем рост удельной поверхности происходит в основном за счет увеличения количества нанопор меньшего диаметра (рис. 7).
Рис. 7.
Зависимость суммарной поверхности пор порошков карбидов тантала от их среднего диаметра. Удельная поверхность порошков карбидов тантала: 1 – 8, 2 – 14, 3 – 24 м2/г.
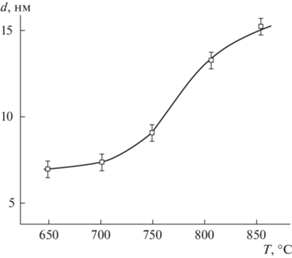
Кривые адсорбции порошков карбидов тантала соответствуют типу IV по IUPAC. Они отличаются наличием петли гистерезиса и характерны для материалов с мезопористой структурой. Количество вещества, адсорбируемого порошками карбидов, больше для порошков, полученных при низких температурах (рис. 8). Это обусловлено более развитой поверхностью порошка и меньшим размером кристаллитов карбидов тантала. Согласно расчетам в зависимости от температуры науглероживания средний размер кристаллитов карбидов изменяется в интервале 7–16 нм (рис. 9).
Рис. 8.
Изотермы адсорбции–десорбции азота для порошков карбидов тантала. Удельная поверхность порошков карбидов тантала: 1 – 8, 2 – 14, 3 – 24 м2/г.
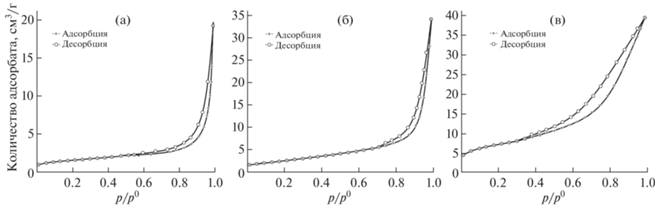
Рис. 9.
Зависимость среднего размера кристаллитов порошков карбидов тантала от температуры науглероживания тантала.
Таким образом, результаты проведенных исследований показали возможность использования продуктов пиролиза толуола в качестве источника углерода для синтеза наноструктурных порошков карбида тантала с развитой поверхностью.
ЗАКЛЮЧЕНИЕ
При температуре 650–850°С с использованием в качестве источника углерода углеводородных газов, образующихся при термическом разложении толуола, а магния в качестве in situ-раскислителя тантала показана возможность получения порошков карбидов тантала. Синтезированы карбиды тантала TaC и Ta2C соответственно с кубической (пр. гр. Fm3m) и тригональной (пр. гр. Pm31) кристаллическими структурами. Удельная поверхность порошков находится в интервале 8–25 м2/г. Средние размеры кристаллитов карбидов тантала, определенные рентгеновским методом, находятся на уровне 7–16 нм.
По сравнению с традиционным методом синтеза карбидов путем твердофазных реакций порошков тантала или оксида тантала с углеродом температура процесса снижена на 700–900°C. По отношению к методам получения этих материалов восстановлением оксидных прекурсоров смесями горючих газов (метана, этана, пропана и др.) с водородом способ получения с использованием в качестве углерода паров толуола является более простым и безопасным.
Список литературы
Lengauer W. // Transition Metal Carbides, Nitrides, and Carbonitrides. Handbook of Ceramic Hard Materials. Weinheim: Wiley-VCH Verlag GmbH, 2000. P. 202. https://doi.org/10.1002/9783527618217.ch7
Desmaison-Brut M., Alexandre N., Desmaison J. // J. Eur. Ceram. Soc. 1997. V. 11. № 1. P. 1325. https://doi.org/10.1016/S0955-2219(96)00235-X
Chen Z., Xiong X., Li G., Wang Y. // J. Mater. Sci. 2010. V. 45. № 13. P. 3477. https://doi.org/10.1007/s10853-010-4376-9
Guo Q.-W. Tantalum Compounds. Encyclopedia of Chemical Industry. Beijing: Chemical Industry Press, 1997. 636 p.
Claridge J.B., York A.P., Brungs A.J., Green M.L.H. // Chem. Mater. 2000. V. 12. № 1. P. 132. https://doi.org/10.1021/cm9911060
Choi J.-G. // J. Porous Mater. 2013. V. 20. № 5. P. 1059. https://doi.org/10.1007/s10934-013-9687-1
Kosolapova T.Y. Carbides. Properties, Production, and Applications. New York: Plenum Press, 1971. 298 p. https://doi.org/10.1007/978-1-4684-8006-1
Wollmershauser J.A., Feigelson B.N., Gorzkowski E.P. et al. // Acta Mater. 2014. V. 69. P. 9. https://doi.org/10.1016/j.actamat.2014.01.030
Севастьянов В.Г., Симоненко Е.П., Игнатов Н.А. и др. // Неорган. материалы. 2010. Т. 14. № 5. С. 563. https://doi.org/10.1134/S0002337X10050106
Chatterjee T., Bhattacharjee K., Chaudhuri M.G. et al. // J. Sol-Gel Sci. Technol. 2014. V. 72. № 6. P. 1706. https://doi.org/10.1007/s10971-014-3458-6
Ishigaki T., Oh S.M., Li J.G., Park D.W. // Sci. Technol. Adv. Mater. 2005. V. 6. P. 111. https://doi.org/10.1016/j.stam.2004.11.001
Liu E.W., Yeh C.L. // J. Alloys Compd. 2006. V. 415. P. 66. https://doi.org/10.1016/j.jallcom.2005.07.058
Lee Y.-J., Kima S.H., Lee T.-H. et al. // Chem. Eng. Sci. 2014. V. 17. № 7. P. 227. https://doi.org/10.1016/j.ces.2013.12.015
Kwon D.-H., Hong S.-H., Kim B.-K. // J. Sol-Gel Sci. Technol. 2004. V. 30. № 12. P. 3863. https://doi.org/10.1016/j.matlet.2004.07.038
Schwartz V., Oyama S.T., Chen J.G. // J. Phys. Chem. B. 2000. V. 104. № 37. P. 8800. https://doi.org/10.1021/jp0010233
Wang X.-H., Hao H.-L., Zhang M.-H. et al. // J. Solid State Chem. 2006. V. 179. P. 538. https://doi.org/10.1016/j.jssc.2005.11.009
Колосов В.Н., Мирошниченко М.Н. // Сборник научных трудов XVIII Российской конф. “Физическая химия и электрохимия расплавленных и твердых электролитов” (с международным участием). Екатеринбург: Издательский Дом “Ажур”, 2020. С. 383.
Miroshnichenko M.N., Kolosov V.N. // J. Phys.: Conf. Ser. 2021. V. 1942. P. 012009. https://doi.org/10.1088/1742-6596/1942/1/012009
Орлов В.М., Крыжанов М.В. // Металлы. 2015. № 4. С. 93.
Jenkins R., Snyder R.L. Introduction to X-ray Powder Diffractometry. N. Y.: John Wiley & Sons Inc., 1996, 89 p.
Price S. // Can. J. Chem. 1962. V. 40. № 7. P. 1310. https://doi.org/10.1139/v62-201
Jess A. // Fuel. 1996. V. 75. № 12. P. 1441. https://doi.org/10.1016/0016-2361(96)00136-6
Fagbemi L, Khezami L., Capart R. // Appl. Energy. 2001. V. 69. P. 293. https://doi.org/10.1016/0016-2361(96)00136-6
Gai C., Dong Y., Fan P. et al. // Energy Convers. Manage. 2015. V. 106. P. 721. https://doi.org/10.1016/j.enconman.2015.09.038
Pant K.K., Kunzrp D. // Can. J. Chem. Eng. 1999. V. 77. P. 150. https://doi.org/10.1002/cjce.5450770125
Одынец Л.Л., Орлов В.М. Анодные оксидные пленки. Л.: Наука, 1990. 200 с.
Розенберг Л.А., Штельман С.В. // Изв. АН СССР. Металлы. 1985. № 4. С. 163.
Kofstad P., Krudtaa O.J. // J. Less-Com. Met. 1963. V. 5. P. 477. https://doi.org/10.1016/0022-5088(63)90061-4
Norman N., Kofstad P., Krudtaa O.J. // J. Less-Com. Met. 1962. V. 4. P. 124. https://doi.org/10.1016/0022-5088(62)90011-5
Lawless K.R. // Rep. Prog. Phys. 1974. V. 37. № 7. P. 231. https://doi.org/10.1088/0034-4885/37/2/002
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии