Российские нанотехнологии, 2022, T. 17, № 6, стр. 829-839
СВЯЗЬ ФИЗИЧЕСКИХ СВОЙСТВ С МЕХАНИЗМАМИ ТОКСИЧЕСКОГО ДЕЙСТВИЯ ДЛЯ НАНО- И МИКРОПОРОШКОВ ДИОКСИДА ТИТАНА В ФОРМЕ АНАТАЗА
М. С. Рябцева 1, В. С. Кривобок 1, А. В. Колобов 1, *, С. Е. Димитриева 1, М. А. Шевченко 1, С. И. Ченцов 1, И. Ю. Николаева 2, М. Е. Тарнопольская 2
1 Физический институт им. П.Н. Лебедева РАН
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: kolob7040@gmail.com
Поступила в редакцию 09.03.2022
После доработки 15.04.2022
Принята к публикации 14.06.2022
Аннотация
Для порошков диоксида титана в форме анатаза со средним размером частиц ~10 мкм и ~10 нм проведены комплексные исследования, демонстрирующие взаимосвязь между физическими свойствами частиц и их биологическим действием на живые организмы. Данные, полученные в 28-дневном исследовании пероральной токсичности на крысах, показывают, что независимо от размера частиц TiO2 в форме анатаза обладает слабо выраженным токсическим действием, в основном связанным с нарушениями азотистого обмена и системы гидратации организма. Подтверждена системная биодоступность TiO2 из желудочно-кишечного тракта с выраженным тропизмом к тканям печени. Признаков зависимости от размера частиц при этом зарегистрировано не было. Для 5% животных обнаружено значительное взаимосвязанное повышение концентрации титана в крови и в головном мозге, указывающее на наличие внутреннего фактора, влияющего на биодоступность TiO2. Полученные экспериментальные данные указывают на то, что при алиментарном поступлении наночастиц анатазной фазы TiO2 реализация токсических эффектов, связанных с химической и каталитической активностью поверхности наноструктур, затруднена. Модельные эксперименты показали, что схожее токсикологическое действие нано- и микрофракции вызвано коллоидной неустойчивостью и склонностью к агломерации наночастиц TiO2 в водных растворах с pH ~ 3–7. Способность исследуемых частиц к агломерации также позволяет теоретически исключить парацеллюлярный перенос TiO2 из желудочно-кишечного тракта во внутреннюю среду организма. Однако вопрос о механизмах накопления диоксида титана в организме и его токсичности при более длительном воздействии остается открытым.
ВВЕДЕНИЕ
Существуют исследования, в которых обсуждается вредное воздействие диоксида титана на организм человека [1–4]. Один из механизмов такого воздействия связан с химической и каталитической активностью наночастиц кристаллического TiO2, их способностью проникать через биологические барьеры и накапливаться в организме [1]. Подчеркивается связь между попаданием наночастиц TiO2 в организм и возникновением целого ряда заболеваний [5]. Тем не менее взаимное отношение физических свойств диоксида титана в наноформе и конкретных механизмов токсического воздействия остается не до конца изученным. В то же время для стандартных микропорошков TiO2, активно применяемых в качестве белого красителя Е171 в пищевой индустрии, физические и структурные свойства, в том числе распределение частиц по размерам, не регулируются международной нормативной базой. Так как в этих порошках возможно содержание частиц в наноформе [6], следует признать высоко вероятным поступление наночастиц TiO2 в организм пероральным путем [7]. Таким образом, необходимо исследование как потенциальных сценариев токсического действия наночастиц TiO2 на организм человека, так и развитие физических методов, позволяющих оценивать наличие токсичных фракций в стандартных микропорошках, применяемых в пищевой промышленности.
Данная задача осложняется тем, что в современной литературе практически отсутствуют данные о том, какие процессы происходят с наночастицами при их попадании в пищеварительную систему человека. В то же время при различных значениях pH и/или ионной силы среды, в которой находятся частицы, происходит изменение их электростатического взаимодействия. Это может приводить как к распаду агломератов наночастиц, что вызовет увеличение проникающей способности, так и, наоборот, к формированию агломератов большого размера и/или агломерации наночастиц на поверхности более крупных кристаллов. В последнем случае вероятность прямого парацеллюлярного проникновения наночастиц снижается. Как агломерация, так и распад частиц могут быть существенны для фагоцитоза М-клетками Пейеровых бляшек, а также переноса по пути межклеточного транспорта по градиенту концентраций [8–10].
В настоящей работе проведено исследование, направленное на установление взаимосвязи между (измеряемыми) физическими свойствами частиц TiO2, включая их структурные особенности, средний размер, а также коллоидную устойчивость, и их токсическим воздействием на живые организмы.
ФИЗИЧЕСКИЕ СВОЙСТВА
Кристаллическая структура. Исследуемые материалы представляли собой порошки анатазной фазы TiO2, полученные с помощью жидкофазного метода и различающиеся средним размером частиц. Первый (E) является распространенной на Российском рынке пищевой добавкой E171 (Evonik Degussa GmbH, Германия). Второй (НЧ) использовался для имитации нанофракции, в небольшом (~0.1%) количестве содержащейся в первом порошке. Данный порошок был изготовлен Guangzhou Hongwu Material Technology Co., Ltd (Китай).
Измерения, выполненные с помощью электронной микроскопии, показали, что пищевая добавка в основном состоит из частиц TiO2 размером ~1–20 мкм (рис. 1a). Второй порошок состоял из наночастиц анатазной фазы размером не более 10 нм. Тем не менее из-за склонности данных частиц к слипанию (рис. 1б) прямые измерения их среднего размера с помощью электронного микроскопа оказались затруднительны. Размер частиц качественно подтвержден измерениями, проведенными с помощью метода динамического рассеяния света (ДРС) (рис. 1в). Содержание примесей в исследованных порошках контролировали методом комбинационного рассеяния света (КРС) (“Инспектр” R532 (Россия) в составе микроскопа “Olympus CX-41” (Япония)) и методом масс-спектрометрии высокого разрешения с ионизацией в индуктивно-связанной плазме (МС-ИСП) (Finnigan Element-2, Thermo Scientific, США). В исследовании методом КРС регистрировали следы углеводородов, сопоставимые по интенсивности для обоих исследуемых образцов, качественный состав расшифрован не был. Профиль неорганических примесей для обоих образцов оказался качественно схожим.
Рис. 1.
Структурные свойства порошков TiO2. Изображения, полученные с помощью электронного микроскопа для микро- (a) и нанофракции (б). Распределение частиц нанопорошка в щелочной среде с pH = 9.6, измеренное с помощью ДРС (в). Рентгеновские дифрактограммы с обозначением рефлексов тетрагональной фазы анатаза (г). Спектры КРС, записанные при температуре 77 К (д). На вставке фрагмент спектров КРС в области Eg(ν6) фононной моды.
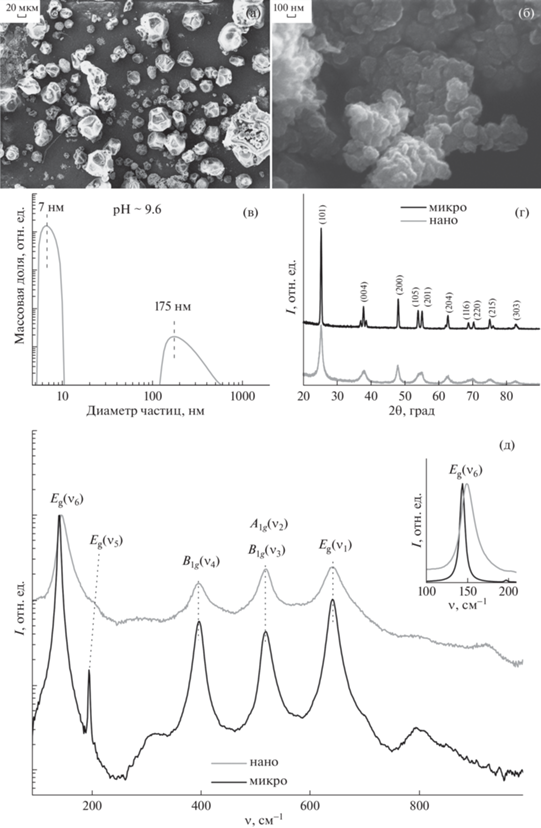
Для оценки кристалличности изучаемых порошковых материалов использовали КРС и рентгеноструктурный анализ (РСА). Рентгеноструктурные исследования проводили на рентгеновском дифрактометре Panalytical Expert Pro MRD (PANAlytical BV, Нидерланды). Порошки помещали на малошумящую подложку монокристаллического кремния, параметры прописанных дифрактограмм уточняли методом Ритвельда в программе Panalytical Highscore (Нидерланды). Для каждого из порошков регистрировали рефлексы только тетрагональной фазы анатаза (рис. 1г). В случае микропорошка параметры решетки a = b = = 3.7781 ± 0.0003, c = 9.4944 ± 0.0003 Å, для нанопорошка – a = b = 3.7990 ± 0.0003, c = 9.4535 ± ± 0.0003 Å. Для микропорошка уширения рефлексов не регистрировались, в то время как для нанопорошка рефлексы были заметно уширены. Измерения полуширины отдельных рефлексов и аппроксимация рентгеновских кривых позволили независимо определить средний размер нанокристаллов, который составил ∼10 ± 1 нм.
Для измерений спектров КРС лазерный пучок (длина волны 532 нм) заводили в конфокальный оптический микроскоп и фокусировали с помощью объектива на образец, размещенный на регулируемом столике. Неупруго рассеянное излучение регистрировалось ПЗС-матрицей (прибор с зарядовой связью). Спектрограф обеспечивал запись спектров КРС в диапазоне 150–4000 см–1 при спектральном разрешении 4 см–1.
Спектры КРС нано- и микропорошков показаны на рис. 1д. В спектрах КРС как микро-, так и нанофракции доминировала линия, соответствующая моде Eg(ν6), которая включает в себя растяжение O–Ti–O-связи вдоль оси a решетки анатаза. Положение линии Eg(ν6) для микрофракции составляло 143 см–1, в то время как для нанофракции линия Eg(ν6) была сдвинута в длинноволновую область за счет размерных эффектов (вставка на рис. 1д). Линия Eg(ν5) в области 196 см–1, расположенная на длинноволновом плече Eg(ν6), принадлежит изгибным колебаниям O–Ti–O-связей. Данная линия почти не видна в спектре нанофракции за счет заметного уширения. Далее следует триплет 395, 514 и 637 см–1, отвечающий модам B1g(ν4), смеси мод A1g(ν3), B1g(ν2) и моде Eg(ν1) соответственно. Все описанные линии соответствуют разрешенным процессам рассеяния первого порядка с участием длинноволновых оптических фононов анатазной фазы TiO2 [11, 12]. Признаков других фаз TiO2 не регистрировалось как для нано-, так и для микропорошков. Отметим, что сдвиг и уширение линии Eg(ν6) на ∼5 см–1 также позволяют подтвердить средний размер ∼10 нм кристаллических зерен в нанопорошке [13].
Коллоидная устойчивость нанофракции. Так как для исследования воздействия на живые организмы использовали водные суспензии описанных выше порошков, особое внимание было уделено анализу коллоидной устойчивости и распределению частиц и/или их агрегатов по размерам.
Распределение наночастиц по размерам при различных значениях pH раствора определяли методом ДРС с помощью Photocor Compact-Z (Россия). Изменение pH проводили добавлением в бидистиллированную воду HCl и NaOH (Компонент-Реактив, Россия) и контролировали pH-метром (Россия). Все измерения проводили при температуре 23°С. Концентрация измеряемого образца в водной суспензии составляла 100 мг/л, что приблизительно соответствует содержанию E171 в восстановленных молочных продуктах.
Устойчивость коллоидного раствора определяется ζ-потенциалом, который представляет собой разность потенциалов между неподвижным слоем жидкости, окружающим частицу, и дисперсионной средой. Коллоидная система считается устойчивой, если абсолютное значение ζ-потенциала превышает 30 мВ. Зависимость ζ-потенциала полученных водных растворов от значения pH показана на рис. 2. Измерения ζ-потенциала также проводили на Photocor Compact-Z.
Рис. 2.
Зависимость ζ-потенциала водной суспензии TiO2 нанофракции (порошок НЧ) от активной кислотности.
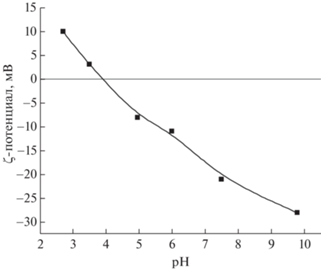
Как видно из рис. 2, в нейтральной водной суспензии TiO2 (pH = 6.2) значение потенциала составляло –20 мВ. Наиболее нестабильным водный раствор является при pH ~ 3.5, при котором значение потенциала приближается к нулю (изоэлектрическая точка). При уменьшении pH от 3.5 до 2.6 наблюдался рост ζ-потенциала до +10 мВ. Это означает, что при попадании продуктов с нейтральным pH в желудок значение ζ-потенциала проходит через ноль. Отметим, что устойчивость водного раствора, соответствующая ζ-потенциалу –30 мВ, достигается в щелочной среде при pH ~ 9.6.
На рис. 3 показаны распределения по размерам, полученные для нанопорошка TiO2 при разных значениях активной кислотности. Как видно из рисунка, при pH = 9.6 доминируют частицы диаметром 6.7 нм, что качественно согласуется со средним размером кристаллических зерен, измеренным с помощью КРС и РСА. Это подтверждает вывод о том, что при pH = 9.6 коллоидная система наночастиц является устойчивой. Также наблюдается незначительная доля крупных частиц размером ~180 нм. Уменьшение pH до 6.2 слабо сказывается на больших частицах, но приводит к заметному укрупнению мелких. Это означает, что в нейтральных растворах наночастицы существуют в форме агломератов диаметром ~20 нм. Наконец, при уменьшении pH до 3.5 (соответствует нулю ζ-потенциала) наблюдается резкое укрупнение как мелких, так и крупных агломератов. В этом случае доля нанофракции должна резко подавляться.
Рис. 3.
Распределение по размерам водной суспензии наночастиц TiO2 в зависимости от активной кислотности водного раствора.
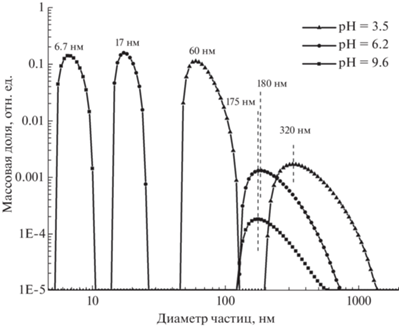
Таким образом, стабильность суспензии наночастиц достигается при pH ~9.6, что соответствует щелочной среде, близкой по параметрам к кислотности среды толстого кишечника и несколько выше того же параметра для тонкого кишечника. Уменьшение pH от 9.6 до 6.2 (нейтральный) приводит к формированию наноагломератов размером ~17 нм. По мере смещения pH до значения ~2.6, соответствующего желудку, наблюдается дальнейшее укрупнение наноагломератов до ~60 нм. Полученные данные указывают на то, что нанофракция быстро агломерирует в желудке. Однако ее дальнейший переход вместе с пищей в тонкий кишечник, где уровень pH может достигать ~8, снова приводит к повышению доли свободных наночастиц или мелких агломератов.
Серия аналогичных экспериментов с микропорошком показала, что в нейтральных или кислых растворах также возможна агломерация частиц. При переходе к щелочным растворам с pH ~9 после микрофильтрации удалось обнаружить нанофракцию со средним размером ~200 нм. Доля нанофракции была менее 0.1%. Частиц размером менее 50 нм обнаружено не было. Это означает, что биодоступность титана в микропорошке не может быть связана с прямой диффузией через клеточные мембраны [9]. Возможный механизм его попадания в кровь определяется захватом М-клетками Пейеровых бляшек [8, 10].
ЭКСПЕРИМЕНТЫ НА ЛАБАРАТОРНЫХ ЖИВОТНЫХ
Описание экспериментов. Исследование токсического действия порошков TiO2 было проведено на клинически здоровых половозрелых крысах-самцах стока Wistar (Charles River, Германия, Гёттинген) возрастом 16 нед. Вес крыс на начало исследования составлял 300–350 г. Животных содержали по три особи в клетке. Условия окружающей среды: температура воздуха 21 ± 2°С, относительная влажность – 50–60%, освещение искусственное (12 ч – день, 12 ч – ночь). Комбикорм полнорационный по ТУ 9296-002-70941247 и питьевая вода ad libitum. Подготовку питьевой воды до физиологически полноценного уровня минерализации проводили на установке EMD Millipore RiO™ 50 (Merc Millipore, Германия). Разделение животных на группы (пять групп по шесть животных) проводили за семь дней до начала исследования.
Исследование выполнено в соответствии с требованиями Приказа МЗ РФ № 267 от 19.06.2003 “Об утверждении правил лабораторной практики”, Приказа МЗ СССР № 742 от 13.11.84 “Об утверждении правил проведения работ с использованием экспериментальных животных”, Приказа МЗ СССР № 48 от 23.01.85 “О контроле за проведением работ с использованием экспериментальных животных”, Международными правилами гуманного обращения с животными – Директивой 2010/63/ЕU Европейского Парламента и Совета Европейского Союза и одобрено Комиссией по биоэтике ФГБНУ “ФНЦ пищевых систем им. В.М. Горбатова” РАН (протокол № 2/2021 от 15.04.2021).
Для сравнения действия микро- и нанопорошков были выбраны два уровня доз 10 и 100 мг/кг массы тела животных. Дозы выбраны на основе данных о среднесуточном потреблении человеком TiO2 в составе продуктов питания [14] с учетом коэффициента межвидового переноса доз относительно площади поверхности тела [15]. Исследуемые образцы вводили животным в диспергированном виде внутрижелудочно с помощью внутрижелудочного атравматического зонда ежедневно в течение 28 сут. Объем введения составлял 10 мл/кг. Животные контрольной группы получали дистиллированную воду в эквивалентном объеме.
Токсическое действие оценивали по развитию клинических признаков интоксикации, динамике массы тела, изменению относительной массы внутренних органов, изменению гематологических, цитометрических и биохимических показателей крови, развитию макро- и микроскопических морфологических изменений внутренних органов.
Дисперсии испытуемых образцов готовили на группу животных, непосредственно перед введением. В качестве растворителя использовали дистиллированную воду. Для уменьшения роли агрегации частиц растворы помещали в ультразвуковую ванну “Сапфир” УЗВ 1.3 (ООО Сапфир, Россия) на 10 мин при температуре +23°C.
На 29-е сутки после начала введения испытуемых образцов животных усыпляли углекислым газом в камере для эвтаназии (VetTech, Великобритания). За 4 ч до эвтаназии животных лишали корма при свободном доступе к воде. Образцы крови отбирали из правого предсердия методом внутрисердечной пункции: 0.5 мл крови – в пробирки с ЭДТА для дальнейшего гематологического исследования, 1.5 мл крови – в стеклянные пробирки для приготовления сыворотки, 1.0 мл цельной крови замораживали при –28°С для дальнейших исследований методом МС-ИСП.
Проводили полную патологоанатомическую аутопсию. Внутренние органы (печень, левая почка, левый надпочечник, тимус, легкие, сердце, селезенка, семенники, эпидидимис, головной мозг) отделяли от прилегающих тканей, взвешивали во влажном состоянии на электронных весах (Adventurer Pro, США). Образцы тканей печени фиксировали в 10%-ном нейтральном формалине (Биовитрум, Россия) для дальнейшего гистологического исследования. Фрагменты печени, почек и головного мозга замораживали при –28°С для дальнейших исследований методом МС-ИСП.
Гематологический анализ крови проводили на гематологическом анализаторе Abacus junior vet 2.7 (Diatron Messtechnik GmbH, Австрия) с реактивами (Diatron Messtechnik GmbH, Австрия). Общее число лейкоцитов и содержание клеток отдельных популяций: лимфоцитов, гранулоцитов и моноцитов, определяли на проточном цитометре Guava Easy Cyte (Merc Millipore, Германия).
Сыворотку крови получали после гемокоагуляции в течение 20 мин путем центрифугирования в течение 10 мин при 3000–3500 об./мин. Биохимический анализ сыворотки проводили с помощью автоматического биохимического анализатора BioChem FС-360 (High Technology, США) и наборов реактивов (High Technology, США). Часть сыворотки замораживали при –28°С для дальнейших исследований методом МС-ИСП.
Стандартную проводку и заливку в парафин проводили с использованием автоматического гистологического процессора Tissue-Tek (Sakura, Япония). Парафиновые срезы толщиной 7–8 мкм получали на микротоме MICROM (Германия). Окрашивали срезы гематоксилин-эозином (Биовитрум, Россия). Анализ образцов и морфометрические исследования проводили на микроскопе Axio Imager A1 (CarlZeiss, Германия) с использованием программы для анализа графических изображений. Морфометрические измерения проводили при увеличении 10 × 10 не менее чем в трех полях зрения.
Статистический анализ проводили с использованием программы STATISTICA 10. Статистическую достоверность рассчитывали с применением непараметрического критерия U Манна–Уитни. Вероятность 0.10 была выбрана в качестве значимого уровня.
Содержание титана в биологических образцах определяли в лаборатории экспериментальной геохимии (Московский государственный университет имени М.В. Ломоносова) методом МС-ИСП. Измерения проводили на масс-спектрометре высокого разрешения Finnigan Element-2 (Thermo Scientific, США) в потоке аргона. В качестве внутреннего стандарта использовали 115In. Титан определяли при среднем разрешении по изотопу 47Ti. Для калибровки использовали мультиэлементный раствор для МС-ИСП с концентрациями элементов 0.03–10 ppb. Погрешность оценивали по девяти параллельным измерениям каждого образца, она не превышала 0.2%.
Разложение биологических образцов проводили методом мокрого озоления. Навески биологического материала (0.3–1 г) помещали в 50 мл полипропиленовые пробирки и заливали 4 мл концентрированной HNO3 и 0.1 мл концентрированной HF. Реакцию проводили при 80°С в течение 24 ч под ИК-лампой с терморегулятором. Затем в каждую пробирку добавляли деионизированную воду (EasyPure, Thermo Scientific, США) до общего объема 50 мл. Все операции выполняли весовым методом. Для разложения использовали концентрированные HCl и HNO3 категории “ос.ч.” (Компонент-Реактив, Россия), подвергшиеся перегонке без кипения.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В течение всего периода наблюдения ни в одной из групп не наблюдалось гибели, а также признаков интоксикации животных, проявляющихся в виде явно выраженных поведенческих или локомоторных отклонений от животных контрольной группы. Динамика массы тела животных опытных групп не отличалась от таковой в контрольной группе.
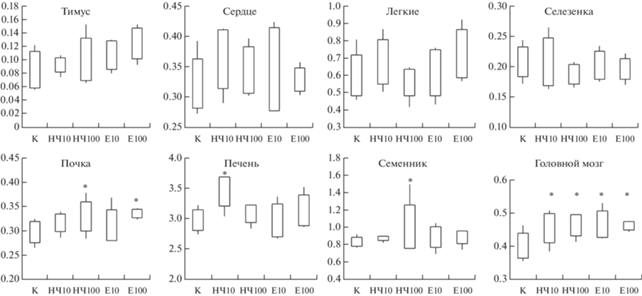
После аутопсии крыс макроскопических изменений внутренних органов обнаружено не было. Относительная масса сердца, легких, селезенки и тимуса была сопоставима для животных опытных и контрольной групп. Относительная масса головного мозга достоверно (р < 0.1) увеличилась по сравнению с контролем во всех опытных группах. Также выявлено достоверное (р < 0.1) увеличение относительных масс почек у животных, получавших высшие дозы испытуемых образцов, печени – у крыс, получавших НЧ TiO2 в дозе 10 мг/кг, и семенников – у крыс, получавших НЧ TiO2 в дозе 100 мг/кг (рис. 4).
Рис. 4.
Относительная масса внутренних органов крыс (в %). * – достоверное отличие от группы контроля при уровне значимости p < 0.1.
Введение испытуемых образцов не оказало влияния на лейкоцитарное звено гемограммы крыс (табл. 1). Абсолютное содержание лейкоцитов, лимфоцитов, моноцитов и гранулоцитов в крови, а также относительное содержание всех трех популяций лейкоцитов были сопоставимы для животных опытных и контрольной групп и не выходили за рамки внутривидовой нормы.
Таблица 1.
Результаты оценки гематологических показателей крови крыс после внутрижелудочного введения в течение 28 дней
| Показатели | Контроль | НЧ 10, мг/кг Группа 1 |
НЧ 100, мг/кг Группа 2 |
Е, 10 мг/кг Группа 3 |
Е, 100 мг/кг Группа 4 |
|---|---|---|---|---|---|
| Лейкоциты, 109/л | 9.5 ± 5.5 | 8.8 ± 3.5 | 12.7 ± 4.6 | 6.9 ± 3.5 | 10.8 ± 3.0 |
| Лимфоциты, 109/л | 6.8 ± 4.2 | 6.4 ± 2.6 | 9.8 ± 3.6 | 4.5 ± 3.0 | 7.9 ± 2.5 |
| Моноциты, 109/л | 0.30 ± 0.2 | 0.3 ± 0.1 | 0.4 ± 0.2 | 0.2 ± 0.1 | 0.4 ± 0.1 |
| Гранулоциты, 109/л | 2.5 ± 1.2 | 1.7 ± 1.1 | 2.6 ± 1.0 | 1.6 ± 0.7 | 2.7 ± 0.7 |
| Относительное содержание лимфоцитов, % | 72.2 ± 4.0 | 73.4 ± 5.1 | 75.1 ± 3.7 | 71.8 ± 7.4 | 74.3 ± 4.7 |
| Относительное содержание моноцитов, % | 2.8 ± 1.0 | 2.9 ± 0.7 | 3.1 ± 0.3 | 2.8 ± 0.3 | 3.1 ± 0.5 |
| Относительное содержание гранулоцитов,% | 24.2 ± 4.1 | 23.6 ± 5.5 | 22.0 ± 3.7 | 25.6 ± 7.5 | 22.5 ± 4.7 |
| Эритроциты, 1012/л | 9.1 ± 0.8 | 9.8 ± 0.6 | 9.7 ± 0.2 | 8.9 ± 0.3 | 9.5 ± 1.0 |
| Гемоглобин, г/л | 162 ± 15.0 | 176 ± 9 | 170 ± 6 | 159 ± 6 | 169 ± 17 |
| Гематокрит, % | 46.4 ± 4.6 | 50.1 ± 2.1 | 49.5 ± 1.7 | 44.9 ± 1.6 | 47.5 ± 4.7 |
| Средний объем эритроцита, мкм3 | 52.0 ± 2.6 | 50.5 ± 1.4 | 51.3 ± 1.4 | 50.3 ± 1.6 | 51.3 ± 2.1 |
| Среднее содержание гемоглобина в эритроците, пг | 18.2 ± 0.7 | 17.8 ± 0.3 | 17.7 ± 0.5 | 17.8 ± 0.6 | 17.8 ± 0.8 |
| Средняя концентрация гемоглобина в эритроцитах, г/л | 353 ± 7 | 346 ± 20 | 344 ± 3* | 351 ± 3 | 349 ± 8 |
| Тромбоциты, 109/л | 1066 ± 167 | 1065 ± 142 | 1192 ± 170 | 1243 ± 155 | 1116 ± 186 |
| Тромбокрит, % | 0.7 ± 0.1 | 0.6 ± 0.1 | 0.7 ± 0.1 | 0.76 ± 0.1 | 0.7 ± 0.1 |
| Средний объем тромбоцита, мкм3 | 6.5 ± 0.3 | 6.2 ± 0.15* | 6.2 ± 0.2 | 6.3 ± 0.2 | 6.5 ± 0.3 |
Введение образцов НЧ TiO2 в дозах 10 и 100 мг/кг оказало влияние на эритропоэз, что проявилось в степени насыщения эритроцитов гемоглобином. В группе, получавшей НЧ TiO2 в высокой дозе, средняя концентрация гемоглобина в эритроцитах достоверно снизилась по сравнению с контролем (снижение составило 2.4%). В группе, получавшей НЧ в низкой дозе, отмечена только тенденция к снижению показателя по сравнению с контролем (снижение составило 2.0%). Данный эритроцитарный индекс является наиболее стабильным при патологических состояниях, поэтому тенденция, проявившаяся в группе НЧ 10 мг/кг, в долгосрочной перспективе может стать статистически значимой. Подобная реакция отмечена и со стороны тромбоцитарного звена гемограммы. Введение крысам НЧ TiO2 в дозах 10 и 100 мг/кг сопровождалось снижением среднего объема тромбоцита относительно контрольной группы.
Результаты биохимического исследования сыворотки крови крыс представлены в табл. 2. Независимо от дозы введение TiO2 как в наноформе, так и в форме микропорошка привело к нарушению азотистого обмена. Отмечено достоверное увеличение концентрации мочевины у животных всех опытных групп по сравнению с контролем. При этом уровень креатинина оставался неизменным.
Таблица 2.
Результаты оценки биохимических показателей крови крыс после внутрижелудочного введения в течение 28 дней
| Показатели | Контроль | НЧ, 10 мг/кг Группа 1 |
НЧ, 100 мг/кг Группа 2 |
Е, 10 мг/кг Группа 3 |
Е, 100 мг/кг Группа 4 |
|---|---|---|---|---|---|
| Белок, г/л | 51.4 ± 3.0 | 57.8 ± 2.4* | 52.9 ± 2.7 | 51.4 ± 2.5 | 51.1 ± 1.3 |
| Альбумин, г/л | 40.0 ± 2.4 | 44.0 ± 1.6* | 43.0 ± 2.0* | 40.5 ± 1.9 | 41.0 ± 1.5 |
| АлАт, ЕД/л | 50.9 ± 7.2 | 53.2 ± 6.2 | 47.7 ± 6.4 | 44.3 ± 4.7* | 44.9 ± 6.2* |
| Щелочная фосфатаза, ЕД/л | 82.6 ± 27.6 | 150 ± 27* | 107 ± 11* | 93.30 ± 6.6 | 87.2 ± 14.7 |
| АсАт, ЕД/л | 85.8 ± 32.2 | 94.7 ± 10.6 | 81.3 ± 7.8 | 95.7 ± 12.6 | 95.9 ± 35.4 |
| Прямой билирубин, мкМоль/л | 2.5 ± 0.5 | 2.3 ± 0.3 | 2.5 ± 0.2 | 2.7 ± 0.1 | 2.6 ± 0.4 |
| Общий билирубин, мкМоль/л | 4.4 ± 0.5 | 4.1 ± 0.6 | 4.2 ± 0.4 | 5.4 ± 0.6* | 4.2 ± 0.4 |
| Глюкоза, мМоль/л | 12.7 ± 4.1 | 13.5 ± 4.8 | 11.0 ± 3.7 | 6.0 ± 1.1* | 9.7 ± 1.1 |
| Триглицериды, мМоль/л | 1.3 ± 0.9 | 1.7 ± 0.4 | 1.3 ± 0.5 | 0.7 ± 0.2* | 0.6 ± 0.4* |
| Холестерин, мМоль/л | 2.0 ± 0.5 | 2.6 ± 0.6 | 2.2 ± 0.7 | 2.4 ± 0.7 | 3.0 ± 0.9 |
| Креатинин, мкМоль/л | 90.8 ± 5.4 | 88.9 ± 3.8 | 83.6 ± 5.8 | 82.6 ± 7.06 | 84.7 ± 3.3 |
| Мочевина, мМоль/л | 7.4 ± 0.4 | 9.7 ± 0.8* | 10.2 ± 0.6* | 9.1 ± 0.6* | 9.0 ± 0.8* |
Мочевина крови в паре с креатинином являются биохимическими маркерами нарушения функции почек и отражают их фильтрационную способность. Как правило, повышение уровня мочевины без креатинина характерно для преренальной патологии, сопровождающейся снижением объема циркулирующей крови или высоким поступлением белка в организм (например, в результате высокобелковой диеты или повреждения слизистой оболочки ЖКТ), что частично согласуется с результатами гематологического анализа крови. Однако оценка уровня креатинина является низкочувствительным показателем, который становится значимым при снижении фильтрационной способности почек на 40–50%. Поэтому полностью исключить зачатки патологии почек нельзя. Важно отметить, что и само по себе длительное состояние уремии способно вызывать значительные метаболические изменения в организме, вплоть до терминальных состояний.
В остальном изменения основных биохимических показателей крови носят умеренный характер и не превышают внутривидовую норму. Курсовое введение НЧ TiO2 в обоих дозировках сопровождалось увеличением концентрации белка за счет альбуминовой фракции. Эти результаты согласуются с повышением гематокрита, концентрации эритроцитов и гемоглобина у животных тех же групп и позволяют предположить гипогидратацию организма. Уровень активности трансаминаз (АсАт, АлАт) во всех опытных группах не превышает значения контроля, что свидетельствует о целостности гепатобиллиарной системы. Более того, у животных, получавших Е171 в дозах 10 и 100 мг/кг, наоборот, отмечено снижение активности АлАт по сравнению с контролем на 12.9% (р < 0.1) и 11.8% (р > 0.1) соответственно, что позволяет предположить ослабление биохимических механизмов трансаминирования. Увеличение активности щелочной фосфатазы было отмечено только у животных, получавших НЧ TiO2 в дозах 10 и 100 мг/кг, на 81.4% (р < 0.1) и 29.4% (р > 0.1) соответственно. Повышение общего билирубина крови крыс на фоне введения Е171 в дозе 10 мг/кг происходит за счет непрямого билирубина, что является маркером внутрисосудистого гемолиза эритроцитов и согласуется с некоторым снижением уровня эритроцитов и гемоглобина у животных этой группы.
Гистологическая картина печени животных, получавших исследуемые образцы, соответствовала повышенной функциональной нагрузке на орган и кореллировала с результатами исследования биохимических показателей крови и оценки массовых коэффициентов органа. Были отмечены умеренные дистрофические изменения, без признаков разрушения гепатоцитов.
Курсовое введение образцов НЧ TiO2 в дозах 10 и 100 мг/кг сопровождалось сохранением долькового строения при сглаживании балочной структуры органа, частичным набуханием гепатоцитов и их слиянием. Портальные венозные сосуды были кровенаполнены, без воспалительной инфильтрации. Ядра гепатоцитов светлые с признаками кариомегалии. В цитоплазме визуализировались признаки мелкозернистой белковой дистрофии.
Ткани печени крыс, получавших Е171, характеризовались меньшими дистрофическими изменениями. Гистологическая картина печени крыс, получавших Е171 в дозе 10 мг/кг, в целом не отличалась от контроля. Введение Е171 в дозе 100 мг/кг сопровождалось сохранением дольчатой и балочной структуры печени, частичным набуханием гепатоцитов, признаками кариомегалии.
Проводя общую оценку действия различных фракций TiO2 на организм крыс при курсовом внутрижелудочном введении в течение 28 дней, можно заключить, что в независимости от фракции TiO2 ведущее токсическое действие проявляется однонаправленно, вызывая достоверные изменения, которые не укладываются в рамки внутривидовой нормы. Если рассматривать в качестве критерия степени токсического действия различных фракций TiO2 дозу, не оказывающую явного нежелательного действия (NOAEL), в обоих случаях она будет ниже минимальной исследованной. В то же время по отдельным показателям отмечены различия между группами НЧ и микропорошка, не превышающие внутривидовой разброс. Изменения отдельных показателей носят взаимосвязанный характер, что позволяет как в случае образцов НЧ (нарушение эритропоэза), так и в случае Е171 (снижение резистентности эритроцитов к внутрисосудистому гемолизу, ослабление системы трансаминирования) предположить наличие признаков алиментарной недостаточности. Различные механизмы компенсации недостаточности могут быть связаны как с особенностями действия фракций, так и с индивидуальными особенностями животных, что требует дальнейшего изучения.
Содержание титана в биологических образцах крыс после введения испытуемых образцов в течение 28 дней представлено на рис. 5.
Рис. 5.
Содержание титана в биологических пробах крыс после введения испытуемых образцов в течение 28 дней. Взаимосвязанное повышение концентрации титана в крови и головном мозге трех животных, получавших НЧ TiO2 в дозах 10, 100 мг/кг и микропорошок в дозе 100 мг/кг отмечены кругом, треугольником и ромбом соответственно. * – достоверное отличие от группы контроля; + – достоверное отличие между дозами в рамках одного образца (уровень значимости p < 0.1).
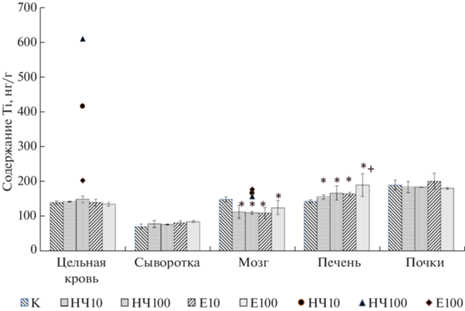
Курсовое введение исследуемых образцов TiО2 в наноформе и в форме микропорошка не сопровождалось повышением концентрации титана в сыворотке, цельной крови, а также его накоплением в тканях почек, где он обнаружен в количествах, сопоставимых с контролем. Концентрация титана в цельной крови значительно превышала концентрацию в сыворотке, что косвенно свидетельствует о преимущественной роли клеточных компонентов крови в транспорте элемента. В печени отмечено закономерное накопление Тi. При этом для макропорошка наблюдали дозозависимый эффект.
В тканях головного мозга, напротив, отмечалось снижение концентрации титана по сравнению с контролем в среднем на 20%, которая составила 114.0 ± 18.7, 110.7 ± 4.6, 110.3 ± 16.0, 125.6 ± 20.2 нг/г для групп, получавших НЧ в дозе 10 мг/кг (НЧ10), 100 мг/кг (НЧ100) или пищевую добавку Е171 в дозе 10 мг/кг (Е10) и 100 мг/кг (Е100) соответственно. Изменение концентрации обратно коррелирует с относительной массой органа, где отмечено достоверное увеличение во всех экспериментальных группах. Головной мозг является весьма чувствительной структурой и реагирует даже на незначительное изменение гемостаза. Гипоксия, метаболический ацидоз, уремия и другие метаболические нарушения, затрагивающие водно-электролитный обмен, как правило, приводят к перераспределению воды во внеклеточном и внутриклеточном пространстве головного мозга, ее миграции через гематоэнцефалический барьер и, как следствие, набуханию клеток мозга. Это, по-видимому, стало причиной повышения относительной массы органа и привело к уменьшению концентрации Ti в тканях головного мозга за счет разбавления. Наблюдаемая динамика может рассматриваться как подтверждение барьерной функции гематоэнцефалического барьера для Тi не зависимо от исходного размера частиц.
У единичных животных как в группах, получавших НЧ, так и в группах, получавших пищевую добавку, было отмечено значительное взаимосвязанное повышение концентрации титана в крови (четырех–шестикратное) и в головном мозге (двукратное). TiO2 обладает крайне низкой степенью ионизации, за счет чего его биодоступность из желудочно-кишечного тракта в зависимости от размера частиц может реализоваться посредством фагоцитоза М-клетками Пейеровых бляшек (могут захватывать частицы 0.05–10 мкм), а также путем межклеточного переноса между эпителиальными клетками по градиенту концентраций [10, 16, 17]. Резкое повышение проницаемости гистогематического барьера и, как следствие, межклеточного транспорта, как правило, наблюдается в условиях воспалительной реакции за счет действия медиаторов воспаления и образования активных форм кислорода. Тем не менее выраженных клинических признаков воспаления ЖКТ у животных с резким повышением концентрации Ti в крови выявлено не было. Это позволяет предположить наличие иного внутреннего физиологического или патофизиологического фактора организма (не связанного напрямую с размером частиц), определяющего повышение биодоступности титана у отдельных животных.
ЗАКЛЮЧЕНИЕ
Проведены комплексные исследования, демонстрирующие взаимосвязь между физическими свойствами частиц анатазной фазы диоксида титана и их биологическим действием на живые организмы. В макродисперсном порошке средний размер частиц составлял ~10 мкм, в нанопорошке ~10 нм. Физические свойства частиц, включая их средний размер и кристаллическое строение, были охарактеризованы с помощью электронной микроскопии, РСА, измерения спектров КРС и измерения ДРС в коллоидных растворах.
Данные, полученные в 28-дневном исследовании пероральной токсичности на крысах, показывают, что TiO2 независимо от размера частиц обладает слабо выраженным токсическим действием, которое проявляется в нарушениях со стороны азотистого обмена и системы гидратации организма. Статистически достоверных признаков дозозависимости не наблюдали. Выявлены некоторые тенденции в различиях гематологической и биохимической картины крови, свойственные для биологического действия частиц TiO2 разного размера. С учетом характера изменений наиболее вероятными причинами их возникновения представляется развитие алиментарной недостаточности, а также влияние различия в качественном составе органических примесей в исследуемых образцов. Различные механизмы компенсации недостаточности могут быть связаны как с особенностями действия фракций, так и с индивидуальными особенностями животных. Можно ожидать, что в более длительном исследовании выявленные тенденции могут приобрести статистическую значимость.
Оценка накопления Тi в органах крыс позволила подтвердить наличие биодоступности TiO2. Вне зависимости от исходного размера частиц TiO2 обладает сопоставимой биодоступностью и выраженным тропизмом к тканям печени как основного органа детоксикации ксенобиотиков. Цельная кровь, сыворотка, ткани почек и головного мозга не депонируют Ti в детектируемых количествах. При этом гематоэнцефалический барьер обладает выраженной барьерной функцией в отношении Ti при алиментарном поступлении не зависимо от исходного размера частиц анатазной фазы TiO2. Отмеченное у единичных животных значительное взаимосвязанное повышение концентрации титана в крови (четырех–шестикратное) и в головном мозге (двукратное) позволяет предположить наличие внутреннего физиологического или патофизиологического фактора облегченного транспорта, не связанного напрямую с размером частиц.
В целом можно заключить, что при алиментарном поступлении НЧ анатазной фазы TiO2 реализация токсических эффектов, связанных с химической и каталитической активностью поверхности, затруднена. По-видимому, основная причина этого состоит в том, что в условиях ЖКТ частицы TiO2 склонны к образованию крупных агломератов, которые нивелируют разницу между биодоступностью и биологическим действием нано- и микрофракций. Данный вывод подтверждается проведенными in vivo-исследованиями, в которых регистрируется слабо выраженный токсический эффект без достоверной разницы между нано- и микрофракцией TiO2 в форме анатаза. Способность исследуемых частиц к агломерации также позволяет теоретически исключить парацеллюлярный перенос TiO2 из ЖКТ во внутреннюю среду организма. Однако вопрос о механизмах накопления диоксида титана в организме и его токсичности при более длительном воздействии остается открытым, что планируется исследовать в дальнейшем.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (грант № 19-05-50145).
Список литературы
Mano S.S., Kanehira K., Sonezaki S. et al. // Int. J. Mol. Sci. 2012. V. 13. № 3. P. 3703. https://doi.org/10.3390/ijms13033703
Bello D., Warheit D.B. // Nanotoxicology. 2017. V. 11. № 4. P. 431. https://doi.org/10.1080/17435390.2017.1330436
Grande F., Tucci P. // Mini-Rev. Med. Chem. 2016. V. 16. № 9. P. 762. https://doi.org/10.2174/1389557516666160321114341
Christensen F.M., Johnston F.M., Stone H.J. et al. // Nanotoxicology. 2011. V. 5. № 2. P. 110. https://doi.org/10.3109/17435390.2010.504899
Rashid M.M., Forte Tavčer P., Tomšič B. // Nanomaterials. 2021. V. 11. № 9. P. 2354. https://doi.org/10.3390/nano11092354
Peters R.J.B., Bouwmeester H., Gottardo S. et al. // Trends Food Sci. Tech. 2016. V. 54. P. 155. https://doi.org/10.1016/j.tifs.2016.06.008
Nohynek G.J., Lademann J., Ribaud C., Roberts M.S. // Crit. Rev. Toxicol. 2007. V. 37. № 3. P. 251. https://doi.org/10.1080/10408440601177780
Быков А.С., Караулов А.В., Цомартова Д.А. и др. // Инфекция и иммунитет. 2018. Т. 8. № 3. С. 263. https://doi.org/10.15789/2220-7619-2018-3-263-272
Alberts B., Johnson A., Lewis J. et al. Molecular Biology of the Cell. 4th edition. New York: Garland Science, 2002.
Bellmann S., Carlander D., Fasano A. et al. // Wiley Interdiscip. Rev.: Nanomed. Nanobiotechnol. 2015. V. 7. № 5. P. 609. https://doi.org/10.1002/wnan.1333
Zhao B., Yang T., Zhang Z. et al. // Environ. Sci. Technol. 2018. V. 52. № 5. P. 2863. https://doi.org/10.1021/acs.est.7b05403
Moreno V., Zougagh M., Ríos Á. // Anal. Chim. Acta. 2019. V. 1050. P. 169. https://doi.org/10.1016/j.aca.2018.10.067
Alcántara R., Navas J., Fernández-Lorenzo C. et al. // Phys. Status Solidi. C. 2011. V. 8. № 6. P. 1970. https://doi.org/10.1002/pssc.201000319
Winkler H.C., Notter T., Meyer U., Naegeli H. // J. Nanobiotechnol. 2018. V. 16. № 1. P. 1. https://doi.org/10.1186/s12951-018-0376-8
Shekunova E.V., Kovaleva M.A., Makarova M.N. et al. // Bull. Sci. Cent. Expert Eval. Med. Prod. 2020. V. 10 № 1. P. 19. https://doi.org/10.30895/1991-2919-2020-10-1-19-28
Guo Z., Martucci N.J., Moreno-Olivas F. et al. // NanoImpact. 2017. V. 5. P. 70. https://doi.org/10.1016/j.impact.2017.01.002
Brun E., Barreau F., Veronesi G. et al. // Part. Fibre Toxicol. 2014. V. 11. № 1. P. 1. https://doi.org/10.1186/1743-8977-11-13
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


