Российские нанотехнологии, 2022, T. 17, № 6, стр. 785-790
ВЛИЯНИЕ УСЛОВИЙ СТЕРИЛИЗАЦИИ С ИСПОЛЬЗОВАНИЕМ ГАММА-ОБЛУЧЕНИЯ НА СВОЙСТВА ПОЛИЛАКТИДНЫХ ГУБЧАТЫХ МАТЕРИАЛОВ
Ю. Д. Загоскин 1, 2, *, С. В. Крашенинников 1, А. А. Несмелов 1, А. И. Бузин 3, П. В. Дмитряков 1, К. В. Токаев 2, Т. К. Токаев 2, С. Н. Малахов 1, С. Н. Чвалун 1, 3, Т. Е. Григорьев 1, 4
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний Минздрава
Москва, Россия
3 Институт синтетических полимерных материалов им. Н.С. Ениколопова РАН
Москва, Россия
4 МИРЭА – Российский технологический университет
Москва, Россия
* E-mail: zagos@inbox.ru
Поступила в редакцию 05.04.2022
После доработки 16.08.2022
Принята к публикации 16.08.2022
Аннотация
Изучено влияние дозы стерилизующего γ-облучения на свойства губчатых материалов из полилактида. Установлено, что облучение существенным образом влияет на среднемассовую молекулярную массу, которая снижается со 180 до 83 кДа при дозе облучения 60 кГр, а также на механические свойства материалов. Модуль упругости заметно снижается при дозе облучения 25 кГр и выше.
ВВЕДЕНИЕ
Биосовместимые биоразлагаемые полимеры все больше применяются в качестве основы для биомедицинских изделий. Материалы на их основе выполняют свою функцию ограниченное время, а затем разлагаются и выводятся из организма естественным путем. Одним из представителей данного класса полимеров является полилактид (ПЛА) – синтетический полиэфир, используемый при получении шовных материалов [1] и остеофиксирующих изделий [2, 3], его применение в биомедицине обусловлено высокой биосовместимостью как исходного материала, так и продуктов его разложения [4].
Губчатые материалы на основе ПЛА представляют большой интерес ввиду их биосовместимости и биорезорбируемости, низкой удельной массы, возможности регулирования модуля упругости в широком диапазоне величин [5–7]. Предложено множество способов получения таких материалов, включая аддитивные [8] и сверхкритические технологии [9], однако применение методов температурно-индуцированного микрофазного расслоения с фазовыми переходами жидкость–жидкость и жидкость–твердое тело позволяет наилучшим образом контролировать морфологию и физико-механические свойства систем [5, 10]. Губчатые материалы на основе полиэфиров имеют перспективы в области регенерации костной [11] и хрящевой ткани [12], кожи [13], в качестве имплантатов для замещения большого объема тканей [14], а также в роли эффективного наполнителя для костно-пластических материалов [15, 16].
Помимо соответствия материалов необходимым для биомедицинских приложений свойствам немаловажную роль играет способ их стерилизации. На данный момент в промышленности используются следующие методы стерилизации: стерилизация этиленоксидом (ГОСТ Р ИСО 11135-2017), γ-стерилизация (ГОСТ Р ИСО 11137-2017), температурная стерилизация паром (ГОСТ Р ИСО 17665-2016) или сухим воздухом (ГОСТ Р ИСО 20857-2016), а также нерегистрируемые технологии, такие как обработка озоном, перекисью водорода, газовой плазмой, применение СКФ СО2-технологии (сверхкритическая флюидная экстракция). У всех методов стерилизации в применении к биомедицинским полимерным материалам есть свои ограничения. Так, обработка паром и горячим воздухом влияет на поверхностные свойства [17] и вызывает изменение степени кристалличности ПЛА, так как температура его стеклования лежит в диапазоне 50–60°C [18]. Применение этиленоксида сопровождается лишь небольшим изменением теплофизических свойств ПЛА [19], однако остаточные количества соединения высокотоксичны и сложно удаляются из губчатых материалов [20], что накладывает ограничения на использование данного метода стерилизации.
γ-Облучение остается наиболее простым и универсальным способом стерилизации полимерных конструкций для медицины. Ранее было показано влияние γ-лучей на ПЛА. Обработка γ‑лучами пластин из ПЛА сопровождается снижением молекулярной массы (ММ) и изменением механических характеристик образцов, особенно при дозах облучения свыше 60 кГр [21]. Изменение механических свойств выражается в первую очередь в сильном уменьшении прочности материалов и небольшом уменьшении модуля Юнга [22]. Известно, что кроме радикального снижения ММ с увеличением дозы облучения протекают процессы химической сшивки [23]. Несмотря на большое число исследований, посвященных влиянию γ-облучения на свойства ПЛА-материалов, изменения свойств высокопористых (губчатых) материалов до сих пор не изучены. В данной работе исследовано влияние γ-облучения на свойства губчатых ПЛА материалов, что принципиально важно в случае применения в биомедицине.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Полимеры. Поли(L-)лактид марки 4032D “NatureWorks” с ММ 200 кДа использовали для получения губчатых материалов. ММ, индекс полидисперсности и влияние на них γ-облучения устанавливали методом гель-проникающей хроматографии (ГПХ) на высокоэффективном жидкостном хроматографе (Knauer, Германия) с универсальной колонкой (“PL gel 5um MIXED-C” (размер пор – смешанный, ММ 200–2 000 000 Да) и детектором показателя преломления. Стандартизацию проводили по полистирольным стандартам.
Губчатые материалы получали методом температурно-индуцированного микрофазного расслоения с переходом жидкость–твердое тело из 3.0 мас. %-ного раствора поли(L-)лактида в 1,4‑диоксане с последующей лиофилизацией. Лиофилизацию проводили на установке Alpha 2-4 LSC (Martin Christ, Германия) при давлении в рабочей камере 200 мБар в течение 3 сут. Образцы имели цилиндрическую форму диаметром 25 ± ± 1 мм и высотой ±15 мм.
Методы
Термогравиметрический анализ (ТГА) проводили на приборе Pyris 1 TGA (PerkinElmer, США) в динамическом режиме в температурном диапазоне 30–700°С в потоке осушенного азота 100 мл/мин. Скорость нагрева составляла 10°С/мин, масса навески 1.70–1.86 мг.
γ-Облучение. Губчатые образцы запаковывали в герметичные пакеты “СтериТ” и помещали в стерилизационную установку с источником γ-излучения 60Co. Расстояние и время облучения рассчитывали таким образом, чтобы мощность дозы соответствовала 1 Гр/с. Поглощенные дозы – 10, 15, 25, 60 кГр.
Механические испытания на одноосное сжатие проводили на универсальной машине 5965 (Instron, США). Исследования проводили на воздухе при комнатной температуре. Скорость сжатия составляла 50% деформации/мин.
Дифференциально-сканирующая калориметрия (ДСК). Фазовые и релаксационные переходы в полимерах исследовали на дифференциальном сканирующем калориметре DSC8500 (PerkinElmer, США) в диапазоне температур от 0 до 200°С в потоке осушенного азота 20 мл/мин. Скорость нагрева и охлаждения составляла 20°С/мин.
ИК-спектроскопию проводили в режиме нарушенного полного внутреннего отражения (НПВО) на ИК-фурье-спектрометре Nicolet iS5 (ThermoFisher Scientific, США) с приставкой iD5 ATR (кристалл – алмаз) в диапазоне 4000–600 см–1. Спектральное разрешение – 4 см–1, количество сканирований – 32.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
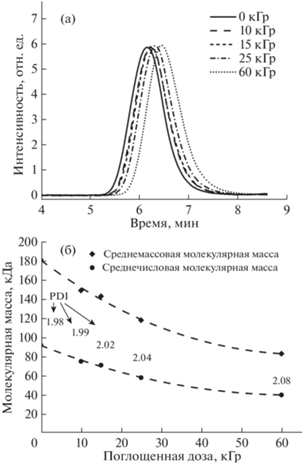
Молекулярные характеристики полимеров до и после γ-облучения определяли методом ГПХ. Из рис. 1 видно, что при увеличении дозы облучения наблюдается смещение пика на хроматограмме в сторону больших времен выхода, что соответствует уменьшению MМ с 180 до 83 кДа. Индекс полидисперсности при этом незначительно увеличивается с 1.98 до 2.08. Отметим, что установленное согласно ГОСТ Р ИСО 11137-2-2017 минимальное значение дозы стерилизации 25 кГр при средней бионагрузке продукции 1000 приводит к падению ММ полимера на 35%, что необходимо учитывать при использовании материалов на практике.
Рис. 1.
Гель-проникающие хроматограммы для губчатых материалов с различной дозой γ-облучения (а); зависимость ММ от поглощенной дозы (б); PDI – индекс полидисперсности.
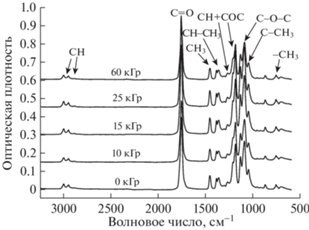
Так как после облучения в данном диапазоне поглощенных доз наблюдается существенная потеря ММ, ожидаются соответствующие изменения в ИК-спектрах: смещения полос поглощения или изменения их интенсивности. Однако из рис. 2 видно, что для всех образцов вне зависимости от дозы облучения характерные спектры ПЛА слабо отличаются друг от друга: не наблюдается образования новых полос поглощения либо значительного изменения интенсивности имеющихся. В данном случае для анализа изменения структуры метод НПВО-ИК-спектроскопии может быть недостаточно чувствительным, так как вклад в интенсивность поглощения от новых химических связей, образующихся в процессе облучения, значительно ниже вклада групп лактидного звена. Аналогичные результаты были получены при изучении пленок ПЛА [24, 25]. Отметим, что несмотря на одновременное протекание процессов деструкции полимерных цепей и их сшивки, при выбранных дозах облучения (менее 250 кГр) преимущественно протекает первый процесс [23], особенно на воздухе, так как молекулы кислорода вызывают обрыв радикальной цепи.
Рис. 2.
ИК-спектры губчатых материалов на основе полилактида в зависимости от поглощенной дозы γ‑облучения.
Губчатые материалы после облучения исследовали методом ДСК. Из рис. 3а видно, что все образцы являются частично кристаллическими. Во время первого нагрева все образцы расстекловываются при температуре ~65°С, при этом определить значение скачка теплоемкости не представляется возможным. Это может быть связано с релаксацией напряжений, возникающих в структуре пористых материалов во время получения, а также улетучивания низкомолекулярных соединений (рис. 4). Далее наблюдается эндотермический пик плавления кристаллической фазы ПЛА с максимумом при 165°С. Степень кристалличности рассчитывали по формуле
Рис. 3.
Данные ДСК губчатых материалов на основе полилактида с различной поглощенной дозой γ-облучения; а – первый нагрев со скоростью 20°С/мин, б – второй нагрев со скоростью 20°С/мин после охлаждения со скоростью 20°С/мин. Кривые на рисунке смещены по вертикали для ясности.
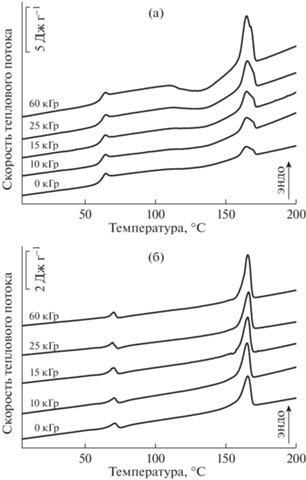
В качестве $\Delta H_{{{\text{пл}}}}^{{{\text{теор}}}}$ было выбрано 93 Дж/г согласно расчетам [26]. Отметим, что степень кристалличности для всех образцов облученных губчатых материалов лежит в диапазоне 40.3–43.9%. Наблюдается тенденция к увеличению степени кристалличности при больших дозах γ-облучения. Параметры фазовых и релаксационных переходов губчатых ПЛА-материалов с различной поглощенной дозой γ-облучения, определенные методом ДСК, суммированы в табл. 1.
Таблица 1.
Параметры фазовых и релаксационных переходов губчатых материалов на основе полилактида с различной поглощенной дозой γ-облучения, определенные методом ДСК
| Образец | Первый нагрев | Второй нагрев | ||||
|---|---|---|---|---|---|---|
| Tпл °С | ΔHпл (α), Дж г–1 (%) | Tc, °С | ΔCp, Дж г–1 °С–1 | Tпл, °С | ΔHпл, (α), Дж г–1 (%) | |
| 0 кГр | 165 | 38.5 (41.4) | 61 | 0.54 | 164 | 5 (5) |
| 10 кГр | 165 | 37.7 (40.5) | 61 | 0.53 | 164 | 7 (7) |
| 15 кГр | 165 | 37.5 (40.3) | 60 | 0.54 | 164 | 9 (10) |
| 25 кГр | 166 | 40.0 (43.0) | 60 | 0.53 | 165 | 14 (15) |
| 60 кГр | 165 | 40.8 (43.9) | 60 | 0.54 | 164 | 24 (26) |
На кривых второго нагрева (рис. 3б) отчетливо наблюдается расстекловывание при температуре 60–61°С, скачок теплоемкости 0.53–0.54 Дж/(г °С). Далее для всех образцов наблюдается экзотермический пик холодной кристаллизации, плавно переходящий в эндотермический пик плавления. Площади обоих пиков совпадают, что говорит о полной аморфизации образца в процессе предшествующего охлаждения. Видно, что пик плавления состоит из двух накладывающихся друг на друга пиков, по всей видимости, относящихся к разным кристаллическим модификациям ПЛА.
Степень кристалличности, достигаемую в процессе нагрева после охлаждения со скоростью 20°С/мин, оценивали путем вычитания прямой базовой линии от линейного участка пика холодной кристаллизации до линейного участка после пика плавления и интегрирования только положительной части пика. С ростом степени облучения степень кристалличности растет пятикратно: от 5% для исходного образца до 26% для образца, облученного дозой 60 кГр. Данный результат коррелирует с отмеченным выше значительным падением ММ материала в процессе облучения. Данные ДСК, на первый взгляд, производят противоречивое впечатление. С одной стороны, можно отметить, что на теплофизические свойства полилактидных губчатых материалов γ-облучение в данном диапазоне доз существенно не влияет (по данным первого нагрева), с другой стороны, падение ММ в результате облучения приводит к значительному облегчению процесса кристаллизации полимера, из которого состоит губчатый материал (по данным второго нагрева). Исходя из области применения данных материалов в качестве различных имплантатов, рабочий температурный диапазон лежит ниже их температуры стеклования, так что отмеченные изменения не должны влиять на эксплуатационные свойства.
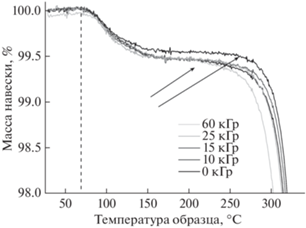
Методом ТГА установили влияние γ-стерилизации на температурную устойчивость полимерного материала. Из рис. 4 видно, что для всех образцов после 70°С наблюдается небольшая потеря массы за счет улетучивания низкомолекулярных примесей. После 200°С наблюдается потеря массы образца за счет термической деструкции ПЛА. Видно, что с увеличением дозы γ-облучения наблюдается уменьшение температуры начала термической деструкции, что связано со снижением ММ полимера при облучении.
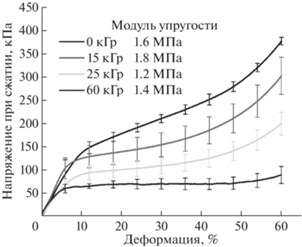
На кривых сжатия губчатых материалов можно выделить несколько участков (рис. 5): начальный линейный участок упругой деформации, нелинейная область необратимой деформации и участок с плавным увеличением напряжения за счет уплотнения материала. Видно, что увеличение дозы облучения приводит к уменьшению прочности материалов. Модуль упругости с учетом погрешности изменяется не сильно, однако можно выделить тенденцию к его увеличению при облучении дозой 15 кГр и дальнейшем снижении при больших дозах облучения. В данном случае на модуль упругости и прочность материалов влияет как изменение степени кристалличности образцов и возможное появление дополнительных сшивок, так и падение ММ полимера. При дозах облучения 25 кГр и выше уменьшение прочности и модуля упругости за счет падения ММ полимера начинает превалировать над увеличением этих свойств за счет роста степени кристалличности. Такая тенденция может играть ключевую роль при практическом применении данных материалов, особенно в тех случаях, где каркас будет нести основную механическую нагрузку.
ЗАКЛЮЧЕНИЕ
Значения модуля упругости губчатых материалов из ПЛА, достаточные для широкого ряда применений, позволяют рассматривать эти материалы как одни из перспективных в биомедицине. В то же время применение лучевой стерилизации приводит к изменениям в структуре и свойствах данных изделий. Так, наблюдаются небольшое увеличение степени кристалличности ПЛА, уменьшение ММ и ухудшение физико-механических характеристик. Как следствие, необходимо учитывать данные факты при дальнейшем исследовании и практическом применении материалов.
Изучение влияния стерилизующего излучения на физико-химические и механические свойства было выполнено при поддержке НИЦ “Курчатовский институт” (приказ № 2755 от 28.10.2021), оценка изменения молекулярных характеристик выполнена при поддержке ФГБУ “НМИЦ фтизиопульмонологии и инфекционных заболеваний” Минздрава России (приказ № 056-00006-20-01 от 27.12.2019 г.). Исследования выполнены с использованием оборудования ресурсных центров НИЦ “Курчатовский институт”.
Список литературы
Malafeev K.V., Moskalyuk O.A., Yudin V.E. et al. // Fibre Chem. 2017. V. 48. № 6. P. 456. https://doi.org/10.1007/s10692-017-9816-8
Middleton J.C., Tipton A.J. // Biomaterials. 2000. V. 21. № 23. P. 233. https://doi.org/10.1016/s0142-9612(00)00101-0
Demina V.A., Krasheninnikov S.V., Buzin A.I. et al. // Mater. Sci. Eng. C. 2020. V. 112. P. 110813. https://doi.org/10.1016/j.msec.2020.110813
Ramot Y., Haim-Zada M., Domb A.J., Nyska A. // Adv. Drug Deliv. Rev. 2016. V. 107. P. 153. https://doi.org/10.1016/j.addr.2016.03.012
Grigoriev T.E., Bukharova T.B., Vasilyev A.V. et al. // Bionanoscience. 2018. V. 8. № 4. P. 977. https://doi.org/10.1007/s12668-018-0557-9
Севастьянов В.И., Григорьев А.М., Басок Ю.Б. и др. // Вестн. трансплантологии и искусственных органов. 2018. Т. 20. № 2. С. 82. https://doi.org/10.15825/1995-1191-2018-2-82-90
Загоскин Ю.Д., Григорьев Т.Е., Крашенинников С.В. и др. // Докл. РАН. 2019. Т. 486. № 4. С. 433. https://doi.org/10.31857/S0869-56524864433-436
Jakus A.E., Geisendorfer N.R., Lewis P.L., Shah R.N. // Acta Biomater. 2018. V. 72. P. 94. https://doi.org/10.1016/j.actbio.2018.03.039
Chumakova N.A., Golubeva E.N., Ivanova T. A. et al. // Russ. J. Phys. Chem. B. 2018. V. 12. № 8. P. 1255. https://doi.org/10.1134/S1990793118080031
Kim J.W., Taki K., Nagamine S., Ohshima M. // Chem. Eng. Sci. 2008. V. 63. № 15. P. 3858. https://doi.org/10.1016/j.ces.2008.04.036
Karageorgiou V., Kaplan D. // Biomaterials. 2005. V. 26. P. 5474. https://doi.org/10.1016/j.biomaterials.2005.02.002
Freed L.E., Marquis J.C., Nohria A. et al. // J. Biomed. Mater. Res. 1993. V. 27. № 1. P. 11. https://doi.org/10.1002/jbm.820270104
Santos A.R., Barbanti S.H., Duek E.A. et al. // Artif. Organs 2001. V. 25. № 1. P. 7. https://doi.org/10.1046/j.1525-1594.2001.025001007.x
Tokaev K.V., Vasilieva I.A., Zyuzya Ju.R. // Eur. Respir. J. 2020. V. 56. № 64. P. 3136. https://doi.org/10.1183/13993003.congress-2020.3136
Vasilyev A.V., Kuznetsova V.S., Bukharova T.B. et al. // IOP Conf. Ser.: Earth Environ. Sci. 2020. V. 421. № 5. P. 052035. https://doi.org/10.1088/1755-1315/421/5/052035
Vasilyev A.V., Kuznetsova V.S., Bukharova T.B. et al. // Molecules. 2021. V. 26. № 2. P. 261. https://doi.org/10.3390/molecules26020261
Filippova E.O., Ivanova N.M. // AIP Conf. Proc. 2019. V. 2167. № 11. P. 020104. https://doi.org/10.1063/1.5131971
Zhao Y., Zhu B., Wang Y. et al. // Mater. Sci. Eng. C. 2019. V. 105. № 6. P. 110041. https://doi.org/10.1016/j.msec.2019.110041
Savaris M., Braga G.L., Santos V. et al. // Int. J. Polym. Sci. 2017. V. 2017. P. 7158650. https://doi.org/10.1155/2017/7158650
Mendes G.C.C., Brandao T.R.S., Silva C.L.M. // Am. J. Infect. Control. 2007. V. 35. № 9. P. 574. https://doi.org/10.1016/j.ajic.2006.10.014
Madera-Santana T.J., Melendrez R., Gonzalez-Garcia G. et al. // Radiat. Phys. Chem. 2016. V. 123. P. 6. https://doi.org/10.1016/j.radphyschem.2016.02.001
Jo S.Y., Park J.-S., Gwon H.-J. et al. // Radiat. Phys. Chem. 2012. V. 81. № 7. P. 846. https://doi.org/10.1016/j.radphyschem.2012.03.013
Gupta M.C., Deshmukh V.G. // Polymer. 1983. V. 24. № 7. P. 827.
Razavi S.M., Dadbin S., Frounchi M. // Radiat. Phys. Chem. 2014. V. 96. P. 12. https://doi.org/10.1016/j.radphyschem.2013.08.010
Kodama Y., Machado L.D.B., Giovedi C. et al. // Nukleonika. 2009. V. 54. № 2. P. 107.
Fischer E.W., Sterzel H.J., Wegner G. // Kolloid-Zeitschrift Zeitschrift für Polym. 1973. V. 251. № 11. P. 980.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии