Российские нанотехнологии, 2023, T. 18, № 1, стр. 135-144
НАНОЧАСТИЦЫ СЕРЕБРА, СТАБИЛИЗИРОВАННЫЕ ОБОЛОЧКОЙ ХИТОЗАНА, – ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА И ОСОБЕННОСТИ ТОКСИЧЕСКОГО ДЕЙСТВИЯ IN VIVO
В. М. Василькевич 1, *, Р. В. Богданов 1, К. С. Гилевская 2, В. И. Куликовская 2, Е. А. Степанова 3, И. И. Кузьминский 3
1 Научно-практический центр гигиены, Министерство здравоохранения Республики Беларусь
Минск, Республика Беларусь
2 Институт химии новых материалов НАН Беларуси
Минск, Республика Беларусь
3 Институт экспериментальной ветеринарии им. С.Н. Вышелесского
Минск, Республика Беларусь
* E-mail: sabas2004@mail.ru
Поступила в редакцию 25.04.2022
После доработки 08.09.2022
Принята к публикации 09.09.2022
Аннотация
Представлены результаты изучения in vivo токсичности и опасности коллоидных растворов нанокомпозитов хитозан–серебро c различным содержанием Ag (0.19 и 1.9 мг/мл), полученных методом “зеленой химии” путем химического восстановления нитрата серебра хитозаном в гидротермальных условиях. Синтезированные образцы обладали высокой агрегативной устойчивостью (величина их ζ-потенциала – 37.3 ± 0.2 и 43.2 ± 2.5 мВ) и выраженными антимикробными свойствами в отношении Staphylococcus aureus, Salmonella dublin и Escherichia coli (зоны ингибирования – 11–16 мм). Установлено, что нанокомпозиты малоопасны при остром внутрижелудочном воздействии, относительно безвредны при внутрибрюшинном введении, не обладают кожно-раздражающим действием. Гидрозоль нанокомпозита с высоким содержанием серебра (1.9 мг/мл) вызывал у лабораторных животных обратимое раздражение глаз, а также оказывал выраженное сенсибилизирующее действие, индуцируя развитие аллергии по механизму гиперчувствительности замедленного типа.
ВВЕДЕНИЕ
Быстрое распространение штаммов со множественной лекарственной устойчивостью (МЛУ) патогенных и условно-патогенных микроорганизмов признано ВОЗ одной из самых серьезных угроз для глобального общественного здравоохранения. Появление штаммов МЛУ-бактерий в последние десятилетия в основном связано с широким и неконтролируемым применением антибиотиков и отсутствием производства новых антибактериальных препаратов. В связи с этим потребность в эффективных антимикробных стратегиях, альтернативных традиционной антибактериальной терапии, которые могли бы помочь в лечении резистентных к лекарственным препаратам бактериальных инфекций, стала еще более актуальной. Одно из наиболее перспективных инновационных направлений антимикробной стратегии связано с нанотехнологиями. Эти современные технологии направлены на конструирование и синтез наноматериалов и систем, функционирование которых опосредовано структурой наночастиц (НЧ) размером от 1 до 100 нм. Отмечено, что применение НЧ с выраженным антибактериальным эффектом характеризуется появлением новых возможностей в борьбе с инфекционными агентами и биологическими загрязнителями [1].
В современной нанотехнологии выделяется направление – создание и использование нанокомпозитов на основе металлических частиц и полимеров в качестве противомикробных препаратов [1]. Они должны объединять в себе такие свойства, как высокая антибактериальная активность, экологичность, низкая токсичность, безопасность, простота изготовления и использования. Особое внимание в последнее время уделяется материалам на основе наночастиц серебра (НЧ Ag), обладающих антимикробным действием [2, 3]. Выявленные многовекторные антимикробные эффекты дают основания для широких перспектив использования НЧ Ag в клинической практике, а не только как альтернатива обработке инфицированных ран. Антимикробные механизмы этих НЧ связаны со взаимодействием с липидами, полисахаридами или мембранными белками бактериальной клетки, в то же время окислительный стресс является ключевым фактором в изменении проницаемости и повреждении бактериальной стенки. НЧ Ag могут действовать и на биопленки, эффективность в отношении которых, однако, зависит от многих факторов, включая зрелость и химический состав биопленок.
К настоящему моменту описано большое количество методов синтеза (традиционных и нетрадиционных) НЧ Ag [2], но в связи с мировой тенденцией экологизации производства актуальна разработка методов “зеленого” синтеза НЧ, когда для стабилизации синтезируемых НЧ Ag используются малотоксичные полисахариды природного происхождения (в частности, пектины и хитозан).
Хитозан является биосовместимым для живых организмов, обладает широким спектром физиологической активности, в том числе антимикробной [4–6]. Кроме собственного антибактериального действия хитозан способен повышать чувствительность к антибиотикам некоторых устойчивых к ним микроорганизмов [7]. Данное свойство позволяет рассматривать его как перспективное биологически активное соединение для решения проблемы развития микроорганизмов с МЛУ и их биопленок на колонизируемых поверхностях, приводящих в условиях оказания амбулаторной и стационарной медицинской помощи к росту числа случаев нозокомиальных инфекций.
Все эти достоинства хитозана обусловливают его широкое применение для синтеза НЧ Ag, при этом в данной реакции он выступает одновременно в качестве восстановителя и стабилизатора формирующихся НЧ. Однако, несмотря на большое количество публикаций, касающихся получения НЧ Ag, стабилизированных оболочкой хитозана, они в основном посвящены методологическим аспектам синтеза и исследованию физико-химических характеристик и антимикробной активности получаемых материалов [8–12]. В единичных работах поднимаются вопросы токсичности НЧ Ag с оболочкой хитозана, при этом эксперименты проводятся на клеточных линиях [13]. Так, в [14] с помощью изучения лизосомальной активности смеси олигосахаридов хитозана в клетках фибробластов V79 методом нейтрального красного анализа (NRU assay) установлено отсутствие выраженного цитотоксического действия. В дальнейших исследованиях было продемонстрировано, что токсичность хитозана увеличивалась при введении в молекулу хитозана гидрофобных заместителей, увеличении молекулярной массы и степени ацетилирования молекулы [15]. А способность хитозана к биодеградации тканевыми и клеточными ферментами была эффективнее у низкомолекулярных производных с высокой степенью ацетилирования [16].
В целом низкая степень токсичности хитозана позволяет использовать его в разных областях, в том числе в медицинской практике (для создания гемостатических препаратов, носителей для доставки лекарств, применяемых при терапии различных заболеваний и др.), где предъявляются высокие требования к безопасности и оценке биологического действия фармакологических препаратов и медицинских изделий.
Цель данной работы заключалась в токсикологической оценке в исследованиях in vivo коллоидных растворов НЧ Ag, стабилизированных оболочкой хитозана с учетом потенциальной возможности их практического применения в медицине.
МАТЕРИАЛЫ И МЕТОДЫ
Синтез нанокомпозитов хитозан–Ag. Нанокомпозиты хитозан–Ag получали методом “зеленой химии” путем химического восстановления нитрата серебра хитозаном в гидротермальных условиях [17]. Для этого готовили 100 мл раствора хитозана (30 кДа) с концентрацией 34 мг/мл в 2%-ной уксусной кислоте. Далее к раствору при перемешивании добавляли 10 мл водного раствора нитрата серебра (3.4 или 34 мг/мл) и через 15 мин реакционную смесь помещали в автоклав. Гидротермальный синтез проводили в стерилизаторе паровом ГК-100-3 в течение 1 ч при 1.5 атм и 121°С (“ТЗМОИ”, Россия). Синтезированные нанокомпозиты хитозан–Ag очищали путем диализа против дистиллированной воды (6 ч). Таким образом синтезированы коллоидные растворы нанокомпозитов хитозан–Ag c различным содержанием серебра: нанокомпозит 1 – 0.19 мг/мл; нанокомпозит 2 – 1.9 мг/мл. Концентрация хитозана в обоих растворах была одинаковой и составляла 19.4 мг/мл.
Характеризация нанокомпозитов хитозан–Ag. Спектры оптического поглощения гидрозолей нанокомпозитов хитозан–Ag регистрировали с помощью спектрофлуориметра CM2203 (Солар, Беларусь) в диапазоне длин волн λ = 300–600 нм. Величину ζ-потенциала нанокомпозитов хитозан–Ag определяли путем измерения электрофоретической подвижности частиц, а их средний гидродинамический диаметр – методом динамического рассеяния света (ДРС) на анализаторе Zetasizer Nano ZS (Malvern, Великобритания). Морфологию изучали методом просвечивающей электронной микроскопии (ПЭМ) на электронном микроскопе JEOL-LEM-1400 (Jeol Ltd., Япония). Для этого НЧ адсорбировали на подслое коллодия, нанесенного на медную сетку, и сушили на воздухе при комнатной температуре.
Антимикробная активность нанокомпозитов хитозан–Ag. В качестве тест-культур были выбраны штаммы Staphylococcus aureus (КМИЭВ В161), Salmonella dublin (КМИЭВ В152) и Escherichia coli (КМИЭВ В88), выращенные на мясопептонном агаре без антибиотиков.
Определение антибактериальной активности синтезированных нанокомпозитов проводили с использованием метода “колодцев” (метод диффузии в агар). В толще питательной агаровой среды Гивенталя–Ведьминой (АГВ), содержащей суточную культуру микроорганизмов в дозе 200 млн. клеток/мл, стерильно делали лунки диаметром 6 мм. В лунки вносили исследуемые нанокомпозиты и помещали в термостат при 37°С на 18–20 ч. Результаты оценивали по зоне задержки роста тест-культур вокруг лунки. В контрольные чашки Петри с АГВ засевали по 1 мл суспензий, содержавших по 200 млн. клеток 18-часовой культуры. Через 24 ч инкубирования при 37°С проводили учет роста. Далее проводили визуальную оценку наличия роста тест-штамма в опытных пробах в сопоставлении с ростом тест-штамма в положительном контроле (питательная среда с тест-штаммом без препарата) и измеряли диаметр зоны ингибирования.
Изучение острой токсичности. Острая токсичность нанокомпозита хитозан–Ag была изучена в эксперименте на животных (нелинейные самки и самцы белых крыс) при внутрижелудочном и внутрибрюшинном способах введения. Дозу нанокомпозита рассчитывали на единицу массы тела животного (мг/кг). Наблюдение за подопытными животными осуществляли в течение 14 сут после введения препарата: в первые 30 мин после введения, через 4 ч, затем ежедневно. Животных взвешивали до начала эксперимента и контролировали массу тела не реже раза в неделю. В ходе исследования острой токсичности регистрировали общее состояние животных, особенности их поведения, потребление корма и воды, характер симптомов интоксикации, наличие гибели животных и макроскопические изменения со стороны внутренних органов. В соответствии с требованиями ГОСТ 32644-2014 [18], а также принимая во внимание данные о низкой степени острой пероральной токсичности для животных хитозана [19], в целях гуманного обращения с животными эксперимент был проведен на трех животных (самки с исходной массой 160–180 г) с максимальной тестируемой дозой нанокомпозита – 5000 мг/кг (введение с помощью иглы-зонда). Класс опасности исследуемого нанокомпозита определяли на основании полученных результатов по Согласованной на глобальном уровне системе классификации опасности и маркировки химической продукции СГС (GHS) [20] и ГОСТ 12.1.007-76 [21].
Острая внутрибрюшинная токсичность изучена на белых крысах, которым вводили однократно внутрибрюшинно нанокомпозит с помощью стерильных одноразовых шприцев. Экспериментальные группы животных были сформированы рандомно в количестве 10 особей, состояли из животных обоего пола с исходной массой 180–220 г. Для тестирования выбрана максимальная доза – 1500 мг/кг. Животным контрольных групп в аналогичных условиях эксперимента вводили 0.9%-ный изотонический раствор натрия хлорида в эквивалентных количествах. Оценку результатов и классификацию нанокомпозитов проводили по ТКП 125-2008 (02040) [22].
Местно-раздражающее, ирритативное и кожно-резорбтивное действие. Целью изучения местно-раздражающего и кожно-резорбтивного действия являлись установление особенностей эпикутанного воздействия нанокомпозитов и оценка степени проявления кожно-раздражающих свойств при нанесении на кожу и слизистые оболочки глаз (ирритативное действие) лабораторных животных, а также кожно-резорбтивных свойств при однократных и повторных аппликациях нанокомпозитов на кожу лабораторным животным. На выстриженные участки кожи спины белых крыс (размером 3 × 2 см) наносили нанокомпозиты в дозе 0.5 мл с помощью окклюзионной марлевой повязки, время экспозиции – 4 ч. Предварительные испытания проводили с одним животным (белые крысы), подтверждающий тест на двух дополнительных особях крыс. Контролем служили симметрично расположенные на другой стороне спины животного “кожные окошки”, на которые наносили дистиллированную воду в эквивалентных дозах. Оценку функционального состояния кожи на опытном и контрольном участках кожи каждого животного проводили через 1, 24, 48 и 72 ч после аппликации и удаления нанокомпозитов с поверхности кожи по степени выраженности отека (нарастанию кожной складки, измеряемой микрометром типа МК-25) и эритемы (визуально). Интерпретацию и оценку результатов выполняли с учетом рекомендаций ГОСТ 32436-2013 [23].
Кожно-резорбтивное действие нанокомпозитов изучали на белых крысах “пробирочным методом”. Нанокомпозиты наносили эпикутанно на хвосты белых крыс в течение 20 сут (5 раз в неделю), ежедневная экспозиция – 4 ч. Контрольным животным наносили в эквивалентных объемах воду. О наличии резорбтивного действия судили по клинике отравления и гибели животных [24].
Местное раздражающее действие на слизистую глаз (ирритативное действие) изучали путем инстилляции 50–100 мкл нанокомпозитов хитозан–Ag в нижний конъюнктивальный свод правого глаза кролика-альбиноса (по три особи на каждый тестируемый нанокомпозит). Левый глаз служил контрольным, в него в той же дозе вносили дистиллированную воду. Визуальное наблюдение за состоянием слизистой оболочки и коньюктивы глаз проводили на протяжении суток с регистрацией признаков раздражения через 1 и 4 ч и далее ежесуточно в течение двух недель после воздействия. Оценку выраженности ирритативного действия проводили в баллах, классифицировали по Инструкции 1.1.11-12-35-2004 [24] и ГОСТ 32419-2013 [25] с учетом рекомендаций по клиническому наблюдению и классификации признаков раздражения глаз, изложенных в ГОСТ 34658-2020 [26].
Аллергенная активность. Изучение потенциальной аллергенной (сенсибилизирующей) способности нанокомпозитов, стабилизированных хитозаном, проводили экспрессным методом согласно Инструкции 1.1.11-12-35-2004 путем однократной внутрикожной сенсибилизации в тесте опухания лапы (ТОЛ) с дополнительной постановкой реакции специфического лизиса лейкоцитов (РСЛЛ) [24] и определением показателей общего анализа крови на автоматическом анализаторе крови Mythic 18 (Швейцария). В качестве разрешающей дозы использовали 0.35%-ный водный раствор нанокомпозитов, который не вызывал раздражения кожи.
Статистическая обработка результатов экспериментов по изучению токсичности нанокомпозитов. Количественные данные экспериментов представлены в виде медианы (Ме) и межквартильного интервала (Q1–Q3). Сравнение между группами выполнено непараметрическим методом с помощью U-критерия Манна–Уитни для независимых групп. Различия считали статистически значимыми при уровне p < 0.05.
Условия содержания животных при выполнении экспериментов соответствовали требованиям санитарных правил и норм 2.1.2.12-18-2006 “Устройство, оборудование и содержание экспериментально-биологических клиник (вивариев)”, утвержденных постановлением Главного государственного санитарного врача Республики Беларусь от 31 октября 2006 г. № 131. Перед проведением опытов лабораторные животные проходили карантин и акклиматизацию в условиях вивария в течение 14 дней. Проведение экспериментов и выведение лабораторных животных из опыта соответствовали принципам Европейской конвенции по защите позвоночных животных, используемых для экспериментов или в иных научных целях (Хельсинки, 1986 г.).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
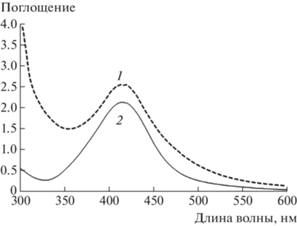
Физико-химические характеристики и антибактериальные свойства нанокомпозитов хитозан–Ag. После гидротермальной обработки реакционных смесей, содержащих хитозан и нитрат серебра, наблюдалось изменение их окраски с бесцветной до темно-коричневой, что свидетельствовало об образовании НЧ Ag. На спектрах поглощения синтезированных гидрозолей нанокомпозитов хитозан–Ag также имеется пик с максимумом поглощения при 415 нм, который соответствует пику поверхностного плазмонного резонанса НЧ Ag и подтверждает их формирование (рис. 1).
Как известно, величина ζ-потенциала является одним из важным параметров, характеризующих стабильность коллоидной системы. ζ-потенциал отражает разность потенциалов дисперсной среды и неподвижного слоя жидкости, окружающего частицу. Коллоидные растворы НЧ со значением ζ-потенциала (по модулю) свыше 18 мВ (по данным [27]) являются электрически стабилизированными. Согласно [27] размер НЧ и величина ζ-потенциала для антибактериальных композиций, содержащих НЧ металлов, связаны с проявлением бактерицидного эффекта. При сравнении размера НЧ, их ζ-потенциала и биоцидной активности был сделан вывод, что размер НЧ дисперсных систем в большинстве случаев находится в обратной корреляции с биоцидным эффектом в отношении тестируемых микроорганизмов, а величина ζ-потенциала напрямую обусловливает величину дезинфицирующего эффекта в антимикробных композициях [27].
В настоящей работе установлено, что синтезированные образцы заряжены положительно и величина их ζ-потенциала составляет 37.3 ± 0.2 и 43.2 ± 2.5 мВ в случае нанокомпозита 1 и 2 соответственно. Следовательно, синтезированные нанокомпозиты хитозан–Ag являются агрегационно-стабильными и их свойства при хранении будут оставаться неизменными, что является важным критерием возможности их практического применения. Средний гидродинамический диаметр составляет 340 и 250 нм для нанокомпозита 1 и 2 соответственно. Отметим, что согласно данным ДРС нанокомпозит 1 имеет мономодальное распределение частиц по размеру (рис. 2а), в то время как для нанокомпозита 2 характерно бимодальное распределение частиц (рис. 2б). В нанокомпозите 2 вклад в светорассеивание вносят две фракции: НЧ диаметром менее 40 нм и субмикронная фракция со средним диаметром ⁓100–300 нм (рис. 2). Оцененные значения индекса полидисперсности составляют 0.20 ± 0.04 и 0.40 ± 0.01 для нанокомпозита 1 и 2 соответственно.
Детальную информацию о форме и размерах НЧ позволяет получить ПЭМ. Так, согласно ПЭМ-анализу нанокомпозит 1 представляет собой монодисперсные НЧ диаметром 5–10 нм, собранные в сферические агрегаты, размер которых достигает ~150 нм (рис. 3а). С другой стороны, нанокомпозит 2 кардинально отличается от нанокомпозита 1 и представляет собой отдельные частицы со структурой “ядро (наночастица Ag0)–оболочка (хитозан)” (рис. 3б). Диаметр неорганического ядра в нанокомпозите 2 составляет 10–40 нм, а толщина хитозановой оболочки, которой оно покрыто, – 20–25 нм (рис. 3б). Данные ПЭМ согласуются с результатами ДРС и данными спектроскопического анализа: максимумы ППР для обоих образцов различаются незначительно, что указывает на сопоставимые размеры неорганического ядра Ag0. Бимодальное распределение частиц по размерам для нанокомпозита 2, оцененное методом ДРС, может быть связано с формированием ассоциатов из отдельных НЧ со структурой “ядро–оболочка”.
Результаты определения антибактериальной активности синтезированных нанокомпозитов в отношении выбранных тест-штаммов бактерий представлены в табл. 1. Установлено, что нанокомпозиты 1 и 2 проявляют активность в отношении как грамположительных, так и грамотрицательных бактерий: зоны ингибирования составляют 11–16 мм (табл. 1). При этом в отношении Staphylococcus aureus и Escherichia coli нанокомпозит 2 более активен по сравнению с нанокомпозитом 1. Согласно [28–30] антибактериальное действие НЧ Ag обусловлено несколькими процессами: прикреплением НЧ Ag к поверхности клеточной стенки и мембраны, проникновением НЧ внутрь клетки, генерацией активных форм кислорода и свободных радикалов, высвобождением катионов Ag+ из НЧ. Взаимодействие НЧ Ag с клеточной мембраной нарушает ее проницаемость и целостность, тем самым провоцируя гибель клетки. При этом более активны мелкие частицы, имеющие большую площадь поверхности, доступную для взаимодействия с клеточной мембраной, и высокую способность проникать внутрь бактерий. Так как стадия взаимодействия НЧ Ag с мембраной является важным этапом в реализации их антибактериальной активности, наличие на поверхности НЧ положительно заряженной стабилизирующей оболочки (например, хитозана) будет способствовать усилению их взаимодействия с отрицательно заряженной мембраной бактериальных клеток, тем самым усиливая их антимикробное действие. Таким образом, наблюдаемая выраженная антибактериальная активность синтезированных нанокомпозитов хитозан–Ag подтверждает эту гипотезу. Отметим, что в ряде исследований также показано, что наличие на поверхности НЧ Ag полимерной оболочки способно снижать их токсичность [13, 30, 31]. Положительное влияние модифицирующих НЧ оболочек природного происхождения может быть связано с повышением биосовместимости НЧ [32, 33]. В связи с этим провели экспериментальное изучение на лабораторных животных токсичности нанокомпозитов хитозан–Ag, проявляющих антибактериальные свойства, с учетом потенциальной возможности дальнейшего практического применения синтезированных нанокомпозитов.
Таблица 1.
Антибактериальная активность нанокомпозитов
| Зона ингибирования, мм | ||
|---|---|---|
| Нанокомпозит 1 | Нанокомпозит 2 | |
| Staphylococcus aureus | 13 | 16 |
| Salmonella dublin | 15 | 11 |
| Escherichia coli | 13 | 15 |
Экспериментальные результаты токсикологических исследований нанокомпозитов. Введение в желудок крыс нанокомпозитов пектин–Ag в максимальной дозе 5000 мг/кг не приводило к гибели подопытных животных. Тестируемые наноматериалы не оказывали отрицательного влияния на их общее состояние. Поведение, подвижность, пищевая и питьевая активность среди животных подопытных и контрольной групп на протяжении эксперимента не различались. В течение двух недель после введения наблюдали положительный прирост массы тела. По окончанию эксперимента органы умерщвленных животных при макроскопическом осмотре не имели патологических особенностей и не отличались от таковых у животных контрольной группы. Полученные результаты изучения острой внутрижелудочной токсичности позволяют сделать вывод о низкой степени опасности изученных нанокомпозитов хитозан–Ag, не требующих классификации и маркировки согласно требованиям СГС (GHS), как опасная химическая продукция по степени воздействия на организм человека при пероральном способе поступления [20]. По классификации ГОСТ 12.1.007-76 нанокомпозиты могут быть отнесены к веществам малоопасным (IV класс опасности) [21].
Тестирование нанокомпозитов при однократном внутрибрюшинном введении в дозе 1500 мг/кг не приводило к гибели и признакам интоксикации животных, что позволяет отнести изученные соединения по степени токсичности к относительно безвредным по ТКП 125-2008 (02040) [22].
По результатам изучения местно-раздражающего действия нанокомпозитов на кожу при однократных четырехчасовых аппликациях не выявлено видимых (клинических) признаков интоксикации животных и функциональных признаков раздражения кожи на протяжении всего периода наблюдений. Нанокомпозиты могут быть отнесены к химической продукции, не вызывающей повреждение/раздражение кожи и не подлежащей классификации в соответствии с критериями СГС (GHS) по данному виду опасности [20].
При однократном и 20-кратном погружении хвостов белых крыс в пробирки с нанокомпозитами, а также по окончанию эксперимента гибели и внешних (клинических) признаков интоксикации не установлено, что позволяет сделать вывод об отсутствии кожно-резорбтивного действия у изученных нанокомпозитов.
Инстилляция 50–100 мкл нанокомпозита 1 (содержание НЧ Ag – 0.19 мг/л) не приводила к функциональным изменениям со стороны глаз животных (гиперемия, слезотечение, хемоз и другие офтальмологические проявления), что свидетельствует об отсутствии способности нанокомпозита 1 оказывать ирритативное действие. В свою очередь, инстилляция 50–100 мкл нанокомпозита 2 в нижний конъюнктивальный свод глаза кроликов приводила к рефлекторному блефароспазму и слезотечению, умеренному отеку века, умеренной (диффузной) гиперемии коньюктивы глаза. Все перечисленные изменения были обратимы и восстанавливались в течение четырех суток наблюдения. Общая оценка выраженности ирритативного действия нанокомпозита 2 составила 4.5 балла, что соответствует 2 классу (умеренная степень раздражения) согласно Инструкции 1.1.11-12-35-2004 [24]. По критериям СГС (GHS) нанокомпозит 2 был отнесен к химическим веществам, обладающим потенциальной способностью вызывать обратимое раздражение глаз (класс опасности 2, подкласс 2А) [20].
Выявление сенсибилизирующего действия нанокомпозитов хитозан–Ag проводили лабораторными методами определения клеточно-опосредованного механизма формирования аллергии: провокационным ТОЛ и постановкой РСЛЛ [24]. Результаты ТОЛ и РСЛЛ, зафиксированные у лабораторных животных, отражены в табл. 2.
Таблица 2.
Показатели аллергизации животных, сенсибилизированных нанокомпозитами с хитозаном
| Показатель, ед. изм. | Группы сравнения (n = 8) | |||
|---|---|---|---|---|
| Контрольная | Опытная 1 | Опытная 2 | ||
| Толщина кожной складки, в 102 мм | Ме (Q1; Q3) |
0.161 (0.031–0.360) |
0.170 (0.063–0.460) |
0.229 (0.142–0.363)* |
| p | 0.037 | |||
| Н | 3/8 | 5/8 | 7/8 | |
| – в баллах | Ме (Q1; Q3) |
1.0 (0.00–2.00) |
2.5 (0.5–3.5) |
3.0* (1.0–4.0) |
| p | 0.17 | 0.026 | ||
| РСЛЛ, % | Ме (Q1; Q3) |
9.20 (5.61–12.38) |
9.34 (6.50–9.61) |
16.34 (6.50–19.65)* |
Эпикутанное тестирование животных продемонстрировало высокую аллергическую активность нанокомпозита с хитозаном в группе 2, в которой у животных наблюдалась наиболее высокая частота положительной кожной реакции на введение разрешающей дозы нанокомпозита, проявившейся увеличением в 1.4 раза относительных (p < 0.05) и в 3.0 раза абсолютных величин ТОЛ (p < 0.05). Выраженность кожной реакции у 87.5% животных опытной группы 2 составляла 1–4 балла, также отмечается возрастание показателя “процент лейколизиса” в 1.75 раза (p < 0.05) по сравнению с контролем.
У животных группы 1 показатели ТОЛ хоть и были выше, чем у контрольных животных, однако не являлись статистически значимыми. Значение показателя “процент лейколизиса” у животных опытной группы 1 практически не отличалось от уровня контрольных животных и не превышало 10%.
При изучении картины периферической крови у сенсибилизированных животных обращает на себя внимание увеличение в опытной группе 2 в 2.8 раза относительного содержания моноцитов (p < 0.05) на фоне общего гранулоцитоза, что также можно интерпретировать как неспецифический признак сенсибилизации, развития и формирования аллергической реакции (табл. 3).
Таблица 3.
Показатели общего анализа крови у сенсибилизированных животных
| Изучаемые показатели | Группы сравнения (n = 8) | ||
|---|---|---|---|
| Контроль | Группа 1 | Группа 2 | |
| Лейкоциты, 109/л | 15.85 (12.40–18.80) |
14.60 (12.80–16.10) |
14.10 (7.40–16.20) |
| Лимфоциты, % | 69.80 (66.60–74.50) |
69.65 (68.10–73.10) |
55.80 (48.60–61.00)* |
| Моноциты, % | 3.95 (3.40–4.40) |
3.70 (3.50–4.00) |
11.10 (9.50–12.60)* |
| Гранулоциты, % | 25.90 (21.00–29.00) |
26.35 (23.40–28.30) |
33.10 (26.40–39.30) |
| Эритроциты, 1012/л | 7.04 (5.98–8.56) |
8.57 (7.66–10.51) |
7.96 (7.33–8.76) |
| Гемоглобин, г/л | 16.40 (13.70–19.40) |
18.20 (15.40–21.80) |
17.20 (15.50–20.30) |
| Гематокрит, % | 40.00 (34.10–47.20) |
48.90 (44.70–56.10) |
42.60 (38.50–48.40) |
| Тромбоциты, 109/л | 595.00 (560.00–866.00) |
707.00 (387.00–727.00) |
806.00 (551.00–887.00) |
Таким образом, результаты ТОЛ свидетельствуют о том, что нанокомпозит, модифицированный хитозаном, с концентрацией НЧ Ag 1.9 мг/мл способен вызывать в организме лабораторных животных формирование аллергической реакции по механизму гиперчувствительности замедленного типа (IV тип аллергических реакций), а величина показателей ТОЛ и их статистическая значимость позволяют классифицировать данный нанокомпозит как вещество с выраженной сенсибилизирующей способностью (2 класс аллергенной активности) [24].
ЗАКЛЮЧЕНИЕ
Полученные методом “зеленой химии” нанокомпозиты, содержащие наночастицы Ag, модифицированные хитозаном, обладают высокой устойчивостью к агрегации (величина их ζ-потенциала – 37.3 ± 0.2 и 43.2 ± 2.5 мВ) и выраженными антимикробными свойствами в отношении Staphylococcus aureus, Salmonella dublin и Escherichia coli. Нанокомпозиты характеризются разной концентрацией НЧ Ag (1 – 0.19 мг/мл и 2 – 1.9 мг/мл) и имеют различное строение: нанокомпозит 1 представляет собой монодисперсные наночастицы, собранные в сферические агрегаты; нанокомпозит 2 – отдельные частицы со структурой “ядро (наночастица Ag0)–оболочка (хитозан)”.
Полученные результаты экспериментальных исследований острой токсичности, местно-раздражающих свойств и аллергенной (сенсибилизирующей) активности нанокомпозитов серебра с хитозаном и концентрацией НЧ Ag в коллоидных растворах, отличающейся на порядок, позволили установить следующие токсикологические параметры и оценить степень опасности нанокомпозитов:
– при остром внутрижелудочном введении нанокомпозиты являются малоопасными химическими веществами в соответствии с ГОСТ 12.1.007-76 (IV класс опасности) [21] и не подлежат классификации по критериям опасности СГС (GHS) [20];
– при остром внутрибрюшинном введении нанокомпозиты по степени токсичности характеризуются как относительно безвредные вещества (согласно ТКП 125-2008 (02040)) [22];
– могут быть отнесены к химической продукции, не вызывающей повреждение/раздражение кожи и не подлежащей классификации в соответствии с критериями СГС (GHS) [20] по данному виду опасности;
– не обладают кожно-резорбтивным действием.
Нанокомпозит с содержанием НЧ Ag 0.19 мг/л не оказывает ирритативного действия на слизистые оболочки лабораторных животных и обладает слабой аллергенной активностью, что не противоречит требованиям безопасности при оценке биологического действия НЧ и материалов, которые планируется использовать в качестве компонентов медицинских изделий и устройств (в частности, планируется практическое применение синтезированных нанокомпозитов для создания антимикробных покрытий на медицинских устройствах (стентах, стомах, дренажах, противоожоговых и ранозаживляющих повязках/сетках и т.д.).
Нанокомпозит, модифицированный хитозаном, с концентрацией НЧ Ag 1.9 мг/мл по критериям СГС (GHS) может быть отнесен к химическим веществам, обладающим потенциальной способностью вызывать обратимое раздражение глаз (класс опасности 2, подкласс 2А) [20], а также обладает выраженной сенсибилизирующей способностью (2 класс аллергенной активности) по классификации [24], реализующейся в виде формирования аллергической реакции по механизму гиперчувствительности замедленного типа (IV тип аллергических реакций).
Представленные данные о токсических свойствах и выполненная классификационная оценка опасности нанокомпозитов могут быть использованы для составления паспорта безопасности (Material Safety Data Sheet), который необходим в случае перехода от опытных разработок к промышленно-коммерческому производству. Изучение особенностей биологического действия, установление критических органов-мишеней при разных уровнях доз и времени экспозиции нанокомпозитов планируется продолжить в субхронических и хронических экспериментах.
Исследование выполнено в рамках ГПНИ “Конвергенция-2025” (задание 3.03.1 “Формирование тонкопленочных биосовместимых и биомиметических антимикробных композиционных материалов различного функционального назначения в соответствии с принципами “зеленой химии”).
Список литературы
Андрюков Б.Г. // Здоровье населения и среда обитания. 2021. № 5. С. 67. https://doi.org/10.35627/2219-5238/2021-338-5-67-77
Крутяков Ю.А., Кудринский А.А., Оленин А.Ю., Лисичкин Г.В. // Успехи химии. 2008. Т. 77. № 3. С. 242.
Букина Ю.А., Сергеева Е.А. // Вестник Казанского технологического университета. 2012. Т. 15. № 14. С. 170.
Крыжановская Е.В., Варламов В.П., Самуй-ленко А.Я. и др. // Сельскохозяйственная биология. 2008. Т. 43. № 6. С. 119.
Gil G., del Mónaco S., Cerrutti P., Galvagno M. // Biotechnol. Lett. 2004. V. 26. № 7. P. 569. https://doi.org/10.1023/B:BILE.0000021957.37426.9b
Варламов В.П., Ильина А.В., Шагдарова Б.Ц. и др. // Успехи биологической химии. 2020. Т. 60. С. 317.
Abioye A., Sanyaolu A., Dudzinska P. et al. // Pharm. Nanotechnol. 2020. V. 8. № 1. P. 33. https://doi.org/10.2174/2211738507666191021102256
Affes S., Maalej H., Aranaz I. et al. // Carbohydr. Polym. 2020. V. 236.https://doi.org/10.1016/j.carbpol.2020.116063
Wei D., Sun W., Qian W. et al. // Carbohydr. Res. 2009. V. 344. P. 2375. https://doi.org/10.1016/j.carres.2009.09.001
Tran H.V., Tran L.D., Ba C.T. et al. // Colloids Surf. A. 2010. V. 360. P. 32. https://doi.org/10.1016/j.colsurfa.2010.02.007
Kalaivani R., Maruthupandy M., Muneeswaran T. et al. // Front. Lab. Med. 2018. V. 2. P. 30. https://doi.org/10.1016/j.flm.2018.04.002
Kulikouskaya V., Hileuskaya K., Kraskouski A. et al. // SPE Polym. 2022. V. 3 (2). P. 77. https://doi.org/10.1002/pls2.10069
Asghar M.A., Yousuf R.I., Shoaib M.H., Asghar M.A. // Int. J. Biol. Macromol. 2020. V. 160. P. 934. https://doi.org/10.1016/j.ijbiomac.2020.05.197
Fernandes J.C., Borges M., Nascimento H. et al. // Int. J. Biol. Macromol. 2011. V. 49 (3). P. 433. https://doi.org/10.1016/j.ijbiomac.2011.05.032
Almada M., Burboa M.G., Robles E. et al. // Curr. Top. Med. Chem. 2014. V. 14 (6). P. 692. https://doi.org/10.2174/1568026614666140118214802
Ahmed T.A., Aljaeid B.M. // Drug Des. Devel. Ther. 2016. V. 10. P. 483. https://doi.org/10.2147/DDDT.S99651
Гилевская К.С., Машкин М.Е., Красковский А.Н. и др. // Журн. неорган. химии. 2021. Т. 66. № 8. С. 1017. https://doi.org/10.31857/S0044457X21080067
Методы испытания по воздействию химической продукции на организм человека. Острая пероральная токсичность – метод определения класса острой токсичности: ГОСТ 32644-2014. Введ. РБ 01.04.2017. Минск: Госстандарт, 2016. 15 с.
Жанзаков А.Е. // Ветеринарный врач. 2008. № 1. С. 20.
Согласованная на глобальном уровне система классификации опасности и маркировки химической продукции. https://unece.org/transport/standards/transport/dangerous-goods/ghs-rev9-2021
Вредные вещества. Классификация и общие требования безопасности: ГОСТ 12.1.007-76. Введ. 01.01.77. // Система стандартов безопасности труда. Ч. 1. Минск, 2008. С. 183.
Надлежащая лабораторная практика: ТКП 125-2008 (02040). Введ. 01.05.2008 // Сборник нормативных документов. Минск, 2011. 35 с.
Методы испытания по воздействию химической продукции на организм человека. Испытания по оценке острого раздражающего/разъедающего (коррозионного) действия на кожу: ГОСТ 32436-2013. Введ. РБ 01.08.2014. Минск: Госстандарт, 2016. 14 с.
Требования к постановке экспериментальных исследований для первичной токсикологической оценки и гигиенической регламентации веществ: инструкция 1.1.11-12-35-2004: утв. М-вом здравоохранения Респ. Беларусь 14.12.2004. Минск, 2004. 43 с.
Классификация опасности химической продукции. Общие требования: ГОСТ 32419-2013. Введ. РБ 01.11.2017. Минск: Госстандарт, 2017. 26 с.
Методы испытания по воздействию химической продукции на организм человека. Оценка раздражающего/разъедающего воздействия на глаза: ГОСТ 34658-2020. Введ. РБ 01.11.2021. Минск: Госстандарт, 2021. 22 с.
Гурин К.И., Погорельский И.П., Фролов Г.А. и др. // Дезинфекционное дело. 2019. № 3. С. 5. https://doi.org/10.35411/2076-457X-2019-3-5-15
Wahab Md A., Li L., Li H., Abdala A. // Nanomaterials. 2021. V. 11 (581). https://doi.org/10.3390/nano11030581
Dakal T.C., Kumar A., Majumdar R.S., Yadav V. // Front. Microbiol. 2016. V. 7. P. 1. https://doi.org/10.3389/fmicb.2016.01831
Roy A., Bulut O., Some S. et al. // RSC Adv. 2019. V. 9. P. 2673. https://doi.org/10.1039/c8ra08982e
Nguyen K.C., Seligy V.L., Massarsky A. et al. // J. Phys.: Conf. Ser. 2013. V. 429. 012025. https://doi.org/10.1088/1742-6596/429/1/012025
Nymark P., Catalán J., Suhonen S. et al. // Toxicology. 2013. V. 313. № 1. P. 38. https://doi.org/org/10.1016/j.tox.2012.09.014
Кирбик Б.С., Тихомирова С.В., Биткин И.А., Песня Д.С. // Туберкулез и болезни легких. 2015. № 4. С. 54. https://doi.org/10.21292/2075-1230-2015-0-4-54-57
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии