Российские нанотехнологии, 2023, T. 18, № 3, стр. 346-355
Оценка биобезопасности селенсодержащего нанокомпозита на основе полисахаридной матрицы крахмала
1 Иркутский институт химии им. А.Е. Фаворского СО РАН
Иркутск, Россия
* E-mail: mlesnichaya@mail.ru
Поступила в редакцию 08.12.2022
После доработки 27.01.2023
Принята к публикации 15.02.2023
Аннотация
Представлены результаты впервые проведенного исследования биологического действия нанокомпозита Крахмал–Se0НЧ на здоровые и Cms-инфицированные растения картофеля (Solаnum tuberоsum). Установлено, что добавление в среду растений водного раствора стабилизированных крахмалом наночастиц Se0 со средним размером 22 нм сопровождается отсутствием выраженного отклонения значений количественного содержания промежуточных и конечных продуктов процесса перекисного окисления липидов (диеновых конъюгатов и малонового диальдегида) в листьях от физиологически нормальных в контроле и поддержанием физиологического соотношения хлорофилл a/b на уровне 1:3, даже в условиях его предварительного нарушения совместно с незначительным (на 30%) повышением содержания общего хлорофилла (как в случае инфицированных растений). Полученные результаты свидетельствуют об отсутствии какого-либо негативного влияния нанокомпозита Крахмал–Se0НЧ на антиоксидантную систему и фонд хлорофилла в растительном организме, что подтверждает безопасность полученного нанокомпозита для растений картофеля.
ВВЕДЕНИЕ
Наблюдаемый всплеск интереса к использованию наночастиц селена (Se0НЧ) в агробиотехнологиях во всем мире обусловлен в первую очередь их значительным потенциалом в коррекции абиотических и биотических стрессов растений [1, 2]. Селен, являясь эссенциальным элементом, в низких концентрациях снижает количество свободных радикалов в растениях, усиленно продуцирующихся под действием ионов тяжелых металлов (Pb, Cd, As), избыточных концентраций ионов Na+ в почве, засухи, действии низких температур, органических или неорганических загрязнителей и других патогенов [3]. Подобное протективное действие селена способствует задержке увядания растений, повышению урожайности, увеличению питательной ценности, стимулированию дыхательной активности клеток и усилению метаболических процессов в растительном организме, а также защите растений от патогенов и неблагоприятных факторов среды [4].
Наибольшей биодоступностью среди всех известных форм селена обладают селенат- и селенит-ионы. Однако ввиду их высокой химической и биологической активности и очень узкого “окна” между низкой (при которых наблюдаются все его положительные перечисленные выше эффекты) и высокой концентрацией селена (с индукцией окислительного стресса и ингибированием ряда ферментных систем в клетках растительного организма) его использование в форме селенат- и селенит-анионов несет значительный риск постоянного превышения допустимых значений концентрации селена [5]. О чрезвычайно высокой химической и биологической активности селенат- и селенит-анионов свидетельствует наличие у них максимальной токсичности в ряду Se-содержащих соединений [5].
Наименее выраженная токсичность при сохранении всего профиля положительных биологических эффектов селена обнаружена для его нуль-валентной наноразмерной формы. Так, в [6–8] представлены результаты исследований по улучшению параметров роста растений, смягчению последствий абиотических стрессов (действие органических и неорганических загрязнителей, солевого стресса, дефицит влаги и др.) в условиях обработки их Se0НЧ.
При этом вследствие избытка поверхностной энергии наночастицы (НЧ) являются крайне нестабильными в нормальных условиях материалами и требуют обязательной пассивации поверхности молекулами-стабилизаторами, в частности водорастворимыми полисахаридами, обеспечивая тем самым сохранение наноразмерной дисперсности частиц, а также переведению их в водорастворимое состояние [9]. Водорастворимость (наряду с биологической активностью) является ключевым фактором возможности практического использования наноматериалов в агробиотехнологии и сельском хозяйстве. Среди потенциальных наностабилизирующих матриц особое место занимают природные полисахариды, в том числе коммерчески доступный водорастворимый полисахарид крахмал [10].
Ранее было установлено выраженное антимикробное действие стабилизированных арабиногалактаном НЧ селена в отношении бактериальных фитопатогенов, в частности Clavibacter michiganensis sepedonicus (Cms) [11, 12]. Данный штамм бактерий является возбудителем кольцевой гнили картофеля, поражающей до 70% всего урожая ежегодно [13]. Это значительно расширяет потенциал и области практического применения НЧ селена для комплексного оздоровления растений, в том числе стратегически важной культуры – картофеля. Вследствие чего оценка безопасности Se0НЧ в отношении самого растительного организма является необходимым условием их практического использования. Основным критерием данной оценки может являться исследование интенсивности свободнорадикальных процессов, развивающихся в растительном организме в качестве его первичной физиологической реакции в ответ на изменение условий существования (стресс).
Результатом любого стресса является усиление продукции активных форм кислорода (АФК), выполняющих функцию эндогенных сигнальных молекул в клетках, участвующих в развитии устойчивости к стрессору [14]. В то же время избыточная генерация АФК приводит к индукции процессов перекисного окисления липидов (ПОЛ) и деэтерификации жирных кислот. Эти процессы приводят к дестабилизации мембран и развитию патологии в условиях воздействия на организм образующего стресс фактора [15]. Первичными продуктами процесса ПОЛ являются диеновые конъюгаты (ДК) жирных кислот. Из полученных ДК после воздействия на них гидроксильных радикалов образуются гидропероксиды липидов. При этом продукты ПОЛ вызывают конформационные изменения фосфолипидов и фосфолипидного комплекса, что приводит к нарушению функций органоидов клетки, органов, а затем и всего растительного организма [16]. В местах присоединения перекисных радикалов к жирным кислотам они разрываются на фрагменты, края которых имеют высокореактивные альдегидные группы. Если разрыв произошел с двух сторон, образуется малоновый диальдегид (МДА), который подавляет активность многих ферментов, вступая в реакцию с SH- и CH3-группами белков. Таким образом, процессы ПОЛ играют существенную роль в регуляции обмена мембранных липидов, изменении физико-химических свойств и проницаемости биологических мембран в физиологических условиях.
Цель данной работы – оценка биобезопасности стабилизированных крахмалом Se0НЧ в отношении растений картофеля в условиях их физиологической нормы и инфицирования бактериальным фитопатогеном Cms.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы. Водорастворимый картофельный крахмал (Sigma-Aldrich), этанол (Реахим), селен в виде порошка (Вектон), гидрат гидразина (64%) (Реахим), ацетон (Реахим), гексан (Реахим), изопропанол (Реахим), тиобарбитуровая кислота (Вектон), ЭДТА (Sigma-Aldrich) и Тритон X-100 (Sigma-Aldrich) использовали без дополнительной очистки. Для расчета средневязкостной молекулярной массы крахмала по методике [17] использовали величину характеристической вязкости, определенную вискозиметрически в соответствии с протоколом, подробно описанным в [18]. Расчетное значение средневязкостной молекулярной массы используемого в работе крахмала составило 326 кДа.
Методы исследования. Микрофотографии Se0НЧ в полисахаридной матрице крахмала получали на просвечивающем электронном микроскопе (ПЭМ) “Leo 906Е”. Пробоподготовку образца для микроскопии осуществляли в соответствии с методикой, подробно описанной в [19]. Для измерения размера частиц использовали программу IPWin45. Распределение НЧ по размерам получали с помощью статистической обработки в ручном режиме не менее 7–10 микрофотографий разных полей анализируемой подложки для получения данных о размере 900–1000 частиц.
Элементный состав нанокомпозита определяли методом рентгеновского энергодисперсионного микроанализа на электронном сканирующем микроскопе Hitachi ТМ 3000, оснащенном SDD-детектором XFlash 430-4, и на CHNS-анализаторе Flash 2000 фирмы Thermo Scientific.
Спектры оптического поглощения 0.05%-ного водного раствора нанокомпозита регистрировали в интервале длин волн 190–1000 нм на спектрофотометре Perkin Elmer Lambda 35 в 1 см кварцевой кювете с использованием дистиллированной воды в качестве раствора сравнения.
Гидродинамические радиусы (Rh) стабилизированных крахмалом Se0НЧ и макромолекул исходного крахмала определяли методом динамического рассеяния света (ДРС) на корреляционном спектрометре Photocor Compасt-Z (источник света – термостабилизированный полупроводниковый лазер мощностью 20 мВт с длиной волны λ = 638 нм) под углом 90°. Анализ корреляционной функции осуществляли с помощью программы обработки данных ДРС Dynals. Величины Rh рассчитывали из значений коэффициентов диффузии (D) по уравнению Эйнштейна–Стокса: Rh = kT/6πη0D* (η0 – вязкость растворителя, k – постоянная Больцмана, T – температура). Дисперсность оценивали по стандартной методике с использованием распределения интенсивностей рассеяния в зависимости от значений Rh НЧ. Растворы для анализа готовили растворением в течение не менее семи часов 5 мг образца в 10 мл дистиллированной воды, предварительно отфильтрованной через шприцевой фильтр. Полученный раствор еще раз очищали фильтрованием через шприцевой фильтр (диаметр пор 0.22 мкм). Время каждого измерения составляло не менее 200 с. Измерение проводили в трехкратной повторности.
Электрофоретическую подвижность НЧ измеряли на спектрометре Photocor Compасt-Z с использованием протокола PALS (Phase analysis light scattering). На основании полученных значений скорости движения частиц в поле, рассчитанных из фазовой функции, определяли электрофоретическую подвижность частиц:
где ${v}$ – скорость движения заряженных частиц в электрическом поле с напряженностью E. Электрофоретическая подвижность μE = ${v}$/E была преобразована в ζ-потенциал (потенциал двойного электрического слоя на поверхности) по уравнению Смолуховского: μE = εε0ζ/ηs, где ε и ε0 – диэлектрическая проницаемость растворителя и вакуума соответственно. Каждое измерение проводили в трехкратной повторности, результаты усредняли.Синтез Se0НЧ в матрице крахмала. В трехгорлую колбу объемом 50 мл, оборудованную термометром и обратным холодильником, поместили 0.2 г порошка элементного селена, добавили 0.4 мл N2H4 · H2O и при постоянном перемешивании довели температуру реакционной среды до 80°С. Выдержали данную смесь в течение 30 мин при нагревании и интенсивном перемешивании в атмосфере аргона до полного растворения селена. Полученная смесь имела бордово-красный цвет и содержала ионы Se2–. Далее аликвоту (V = 120 мкл) реакционной среды, содержащей Se2-анионы, добавили к предварительно полученному водному раствору крахмала (3 г в 200 мл H2O) и перемешивали полученную смесь при комнатной температуре в течение 20 мин. Выделение целевого нанокомпозита и его очистку от примесей побочных продуктов реакции осуществляли осаждением в четырехкратный избыток этанола с последующим отделением образовавшегося осадка на фильтре Шотта, его многократной промывкой этанолом и высушиванием на воздухе. Содержание селена в полученном образце составило 2.34 мас. %. Выход – 72%. Найдено (Крахмал–Se0НЧ), %: C – 39.32, H – 5.83, Se – 2.34, O – 55.51.
Влияние нанокомпозита Крахмал–Se0НЧ (2.34% Se) на ПОЛ. Исследование влияния синтезированного нанокомпозита Крахмал–Se0НЧ (2.34% Se) на содержание основных продуктов ПОЛ в листьях здоровых и инфицированных Cms растений картофеля выполнено в условиях введения в жидкую среду роста растений 1 мл стерильных водных растворов опытных образцов (крахмал – 0.1 г/мл, нанокомпозит Крахмал–Se0НЧ (2.34% Se) – 0.045 г/мл, SeO2 – 0.007 г/мл (в пересчете на селен)), а также аликвоты стерильного раствора дистиллированной воды в контрольных группах. Продолжительность совместной экспозиции 12 ч.
Содержание диеновых конъюгатов в листьях растений. Определение содержания первичных продуктов ПОЛ, а именно диеновых конъюгатов, проводили по методике, подробно представленной в [20]. Кратко: 0.15 г листьев растений картофеля измельчали с 2 мл смеси (1 : 1) гексан–изопропанол. Объем доводили до 9 мл и выдерживали в течение 15 мин. Затем добавляли 1 мл дистиллированной воды для разделения фаз, снова перемешивали и давали разделиться в течение 30 мин. Затем 0.5 мл гексановой фракции осторожно отбирали сверху, помещали в кювету и добавляли 2.5 мл этанола. Измерения проводили на спектрофотометре UNICO 2802 (США) при длине волны 203 нм. Концентрацию ДК определяли по формуле
(1)
${{С}_{{{\text{ДК}}}}} = \left( {D \cdot \frac{l}{\varepsilon }} \right) \cdot \frac{V}{{1000}} \cdot m{\kern 1pt} ,$Содержание малонового диальдегида. Концентрацию МДА в листьях растений картофеля определяли посредством измерения оптической плотности окрашенного триметинового комплекса, образующегося в результате реакции между конечным продуктом процесса перекисного окисления липидов – МДА и тиобарбитуровой кислотой (ТБК) в области λ 532 нм. Спиртовой экстракт листьев для анализа готовили путем гомогенизации 0.15 г ткани листьев экспериментальных растений картофеля с 2 мл 50%-ного этанола. Полученный гомогенат центрифугировали в течение 15 мин при 5000 об./мин. Затем в пробирку с 0.5 мл экстракта последовательно добавляли 0.5 мл 1%-ного раствора Тритон X-100 в 50%-ном этаноле, 0.2 мл 0.6 М раствора HCl и 0.8 мл 0.06 М рабочего раствора TБК. Смесь нагревали на водяной бане в течение 15 мин. Охлаждение проводили при 15°C в течение 10 мин. После охлаждения добавляли 0.2 мл 0.005 М раствора этилендиаминтетрауксусной кислоты и 5 мл 96%-ного этанола для стабилизации окраски. Контролем служила пробирка, в которую были добавлены все растворы, кроме анализируемого образца. Концентрацию МДА (мкмоль г–1 ткани) как конечного продукта процесса ПОЛ рассчитывали по формуле
(2)
${{C}_{{{\text{МДА}}}}} = \frac{{\left( {D - {{D}_{0}}} \right) \cdot {{V}_{1}} \cdot {{V}_{3}}}}{{{{V}_{2}} \cdot {{\varepsilon }_{{532}}} \cdot m}},$Содержание хлорофилла в здоровых и Cms-инфицированных растениях картофеля, обработанных нанокомпозитом Крахмал–Se0НЧ (2.34% Se). Определение содержания хлорофиллов в опытных растениях проводили в соответствии с методикой, подробно описанной в [21]. Кратко: образец сырой ткани листьев гомогенизировали с 10 мл смеси петролейного эфира и ацетона с последующей экстракцией пигментов неразбавленным ацетоном. После объединения экстрактов смесь доводили до 25 мл путем добавления ацетона и измеряли оптическую плотность полученного раствора при 662 и 644 нм. Концентрацию хлорофилла в растворе рассчитывали с помощью уравнений
(3)
${{С}_{a}} = \left( {9.784 \cdot {{E}_{{662}}}} \right) - \left( {0.990 \cdot {{E}_{{644}}}} \right),$(4)
${{С}_{b}} = \left( {21.426 \cdot {{E}_{{644}}}} \right) - \left( {4.650 \cdot {{E}_{{662}}}} \right),$Расчет количества хлорофилла (отдельно хлорофилл a и b) на 1 г сырого веса проводили по формуле
где A – количество хлорофилла a и b, мг г–1, сырого веса; C – концентрация пигментов, мг л–1; V – объем экстракта, мл; a – вес в граммах.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез Se0НЧ выполнен в водном растворе крахмала в результате мягкого окисления селенид-анионов, предварительно сгенерированных посредством восстановления селена гидратом гидразина в инертной атмосфере согласно модифицированной методике, подробно представленной в [22]. В целом процесс протекает по двум реакциям
(6)
$2{\text{Se}}_{{{\text{bulk}}}}^{0} + {{{\text{N}}}_{{\text{2}}}}{{{\text{H}}}_{4}} \cdot {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to 2{{{\text{H}}}_{{\text{2}}}}{\text{Se}} + {{{\text{N}}}_{2}}{\kern 1pt} \uparrow + \;{{{\text{H}}}_{{\text{2}}}}{\text{O}},$(7)
${\text{2}}{{{\text{H}}}_{{\text{2}}}}{\text{Se}} + {{{\text{O}}}_{2}} \to 2{\text{S}}{{{\text{e}}}^{{\text{0}}}}{\kern 1pt} \downarrow + \;2{{{\text{H}}}_{{\text{2}}}}{\text{O}}.$На первом этапе происходят растворение порошка элементного селена и его восстановление до селеноводорода, который, обладая более высокой, чем сероводород, кислотностью (pKa 3.89), растворяется в воде и образует раствор селеноводородной кислоты, используемый в работе для синтеза НЧ селена (1). Синтез в атмосфере аргона предотвращает предварительное нежелательное окисление селенид-анионов и способствует снижению потерь прекурсора селена. Введение аликвоты полученной реакционной среды, содержащей селенид-анионы, в водный раствор крахмала приводит к их окислению до атомов селена Se0 молекулярным кислородом воздуха, пропускаемого через реакционную смесь (2). При этом единственными побочными продуктами данного синтеза на всех его этапах являются абсолютно экологичные молекулярный азот и вода. В результате коалесценции атомы селена образуют зародыши новой фазы, растущие и созревающие далее в Se0НЧ. Стабилизация поверхности сформировавшихся Se0НЧ и обеспечение их агрегативной устойчивости обусловливаются адсорбцией макромолекул крахмала на их поверхности, что приводит к возникновению защитной оболочки, обладающей механической прочностью и упругостью. Основным условием стабилизации является избыток макромолекул крахмала, необходимый для образования моно- или полислоя его макромолекул на поверхности Se0НЧ [23]. Реализация данного механизма обусловливает структурно-механический фактор устойчивости стабилизированных крахмалом Se0НЧ, полностью предотвращающий коагуляцию частиц.
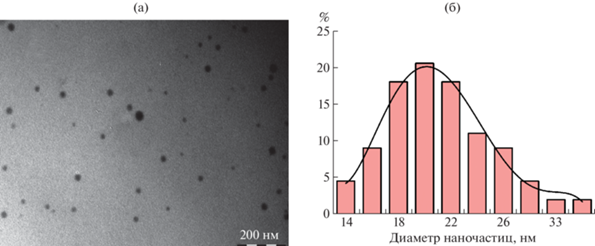
Согласно данным просвечивающей электронной микроскопии нанокомпозит Крахмал–Se0НЧ формируется в виде распределенных в полисахаридной матрице крахмала электроноконтрастных частиц с формой, приближенной к сферической (рис. 1а). Размер НЧ варьирует в интервале 14–37 нм (рис. 1б) со средним значением 22 нм.
Близкий к нормальному тип дисперсного распределения НЧ указывает на то, что в основе механизма их роста и созревания лежит последовательное присоединение атомов селена к поверхности растущей частицы, а не стохастическая агрегация сформированных НЧ [24]. Приближенность формы НЧ к сферической предположительно обусловлена стремлением к самопроизвольному снижению поверхностной энергии формирующихся частиц и отсутствием в реакционной среде условий для их анизотропного роста [25].
Спектр поглощения 0.05%-ного водного раствора нанокомпозита характеризуется монотонным подъемом из низкоэнергетической в высокоэнергетическую область спектра и наличием уширенного максимума в области 255 нм (рис. 2а), а также плато меньшей интенсивности в области ~520–540 нм. При этом максимум поглощения может быть обусловлен межполосным и основным электронными переходами в НЧ селена, в то время как плато в видимой области может быть обусловлено поверхностным плазмонным резонансом [26].
Рис. 2.
Спектр поглощения 0.05%-ного водного раствора стабилизированных крахмалом Se0НЧ(а), на вставке представлена спектральная зависимость коэффициента поглощения в координатах Tauc для данного композита; распределение интенсивности рассеяния света по значениям гидродинамических радиусов (Rh) в образцах исходного крахмала (б) и стабилизированных крахмалом Se0НЧ (в).
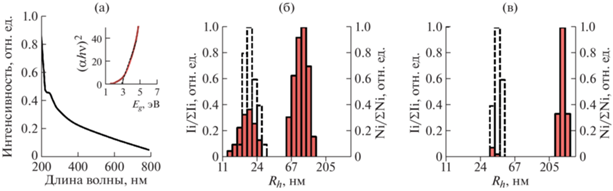
Оптическую ширину запрещенной зоны (Eg) стабилизированных крахмалом Se0НЧ определяли экстраполяцией к оси абсцисс линейного участка спектра поглощения данного нанокомпозита, представленного в координатах Tauc [27]. Установлено, что значение Eg для полученных Se0НЧ составило 3.0 эВ (рис. 2а, вставка), что намного превышает значение Eg для объемного образца аморфного селена (1.6–2.03). Подобное увеличение значения Eg, характерное для наноразмерного состояния материала по сравнению с его объемной (bulk) формой, обусловлено проявлением квантово-размерного эффекта – эффекта квантового удержания (quantum confinement effect), и хорошо соотносится с полученными в [28] данными для Se0НЧ, стабилизированных полисахаридной матрицей κ-каррагинана.
Исследование водных растворов стабилизированных крахмалом Se0НЧ методом ДРС позволило установить, что эти коллоиды характеризуются бимодальным типом распределения интенсивностей рассеяния с выраженным выделением двух фракций частиц (рис. 2б). Так, установлено, что в водном растворе исходного крахмала присутствуют две фракции частиц – быстрая со средним значением Rh 18 нм, вероятно, принадлежащая макромолекулам амилозы, вышедшим из гранул крахмала в процессе его пробоподготовки, и медленная с Rh 90 нм, принадлежащая агрегатам амилозы или амилопектина [29]. Присутствие в водном растворе крахмала достаточно крупных частиц со средним значением Rh 90 нм, предположительно, обусловлено агрегационными процессами между макромолекулами амилозы или амилопектина (крахмала) в растворе [30]. Насыщенность макромолекул полисахаридов гидроксильными группами способствует их вовлечению в образование водородных связей, а также их участию в ван-дер-ваальсовых взаимодействиях даже в хороших растворителях, что неизбежно приводит к образованию прочных ассоциатов и метастабильных агрегатов [31]. Переход к распределению по числу рассеивающих частиц сопровождается изменением его характера, а именно выделением только одной фракции частиц со средним значением Rh 18, вследствие преобладания данной фракции частиц в объеме анализируемого раствора по сравнению с крупноразмерными межмолекулярными ассоциатам и агрегатами, присутствующими в растворе в малом количестве. В водном растворе нанокомпозита Крахмал–Se0НЧ присутствуют также две фракции частиц, однако их средняя величина Rh значительно выше, чем у частиц в исходном крахмале – 28 и 260 нм для быстрой и медленной фракции соответственно (рис. 2в). Подобное увеличение среднего значения Rh частиц фракций, выделенных в нанокомпозите, вероятнее всего свидетельствует о формировании единой гибридной органо-неорганической системы типа ядро/оболочка – “Se0НЧ/полисахаридная матрица крахмала”, идентифицируемой как быстрая фракция с возможным участием полученных стабилизированных крахмалом НЧ в образовании ассоциатов и агрегатов (медленная фракция). По аналогии с исходным полисахаридом крахмалом переход к распределению по числу рассеивающих частиц сопровождается выделением только одной фракции частиц со средним значением Rh 30 нм, преобладающей в объеме анализируемого раствора. ζ-потенциал водного раствора стабилизированных крахмалом Se0НЧ составил –18 мВ в сравнении с –4 мВ для водного раствора крахмала. Значительный рост значения ζ-потенциала в нанокомпозите по сравнению с исходным крахмалом, предположительно, обусловлен формированием двойного электрического слоя на поверхности Se0НЧ, в частности присутствующими на их поверхности потенциалопределяющими ионами Se2–, сорбировавшимися из реакционной среды во время синтеза нанокомпозита. В целом полученная величина ζ-потенциала стабилизированных крахмалом Se0НЧ свидетельствует об их ограниченной устойчивости, вследствие чего дальнейшие эксперименты по определению биологического влияния полученного нанокомпозита Крахмал–Se0НЧ на растения проводили со свежеприготовленными водными растворами.
Результаты определения содержания ДК в листьях растений картофеля после выращивания на питательных средах с добавлением нанокомпозита Крахмал–Se0НЧ, крахмала и SeO2 для сравнения представлены на рис. 3а. Согласно полученным данным количество ДК в листьях здоровых растений составляло 0.152 мкМ г–1 (сухой вес) с небольшими (10–15%) отклонениями от этого значения в обе стороны. Такое содержание ДК в живом растении может быть обусловлено рядом естественных свободнорадикальных процессов, сопровождающих метаболизм любого организма. Инкубация экспериментальных растений в течение 12 ч со стерильными растворами SeO2 (для сравнения), крахмала и нанокомпозита Крахмал–Se0НЧ сопровождалась колебаниями количественного содержания ДК в листьях растений. Так, обработка здоровых растений раствором SeO2 приводила к повышению уровня ДК на 50% (до 0.225 мкМ г–1) по сравнению с контролем. Предположительно, это обусловлено взаимодействием ионов селена с мембранными белками клеток с последующей их инактивацией и запуском каскада реакций, включающих в себя передачу сигналов или ПОЛ, направленных на нейтрализацию стрессора (в данном случае избытка ионов селена), действующего на здоровый, нормально функционирующий растительный организм [32]. Тогда как добавление в среду роста растений стерильных растворов чистого крахмала или нанокомпозита Крахмал–Se0НЧ сопровождается незначительным повышением уровня ДК до 0.189 и 0.174 мкМ г–1 в их листьях. Однако наблюдаемые колебания уровня ДК в этом случае находятся практически в диапазоне ошибок уровня ДК контрольных растений. Это не позволяет в полной мере судить об их действии на растения картофеля.
Рис. 3.
Содержание продуктов перекисного окисления липидов: ДК (а) и МДА (б) в листьях здоровых и Cms-инфицированных растений картофеля после 12-часовой экспозиции с тестовыми растворами.
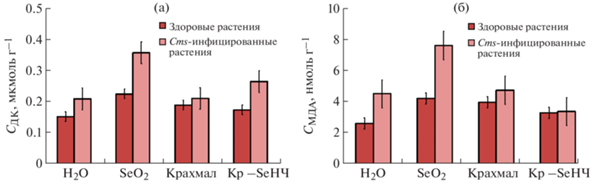
Аналогичный эксперимент, но с Cms-инфицированными растениями показал значительное повышение уровня ДК (до 0.209 мкМ г–1) в листьях картофеля контрольной группы. Вероятно, это обусловлено активацией естественных защитных механизмов растений, включающих в себя активную продукцию АФК для нейтрализации патогенных агентов (в данном случае бактерий Cms), и запуском каскада реакций ПОЛ.
Тенденция к повышению уровня ДК при обработке SeO2 в здоровых и зараженных растениях (0.357 мкМ г–1) свидетельствует об участии селена в инициации ряда сигнальных реакций, продуктами которых являются ДК. Высокая окислительная активность иона Se+4 может лежать в основе его взаимодействия с белковыми фрагментами клеточных стенок растений картофеля, вызывая замещение серы в сульфгидрильных группах белков и утрату ими функций, обеспечивающих целостность клеточной стенки [33]. В то же время столь высокая концентрация ДК в группе зараженных растений, обработанных SeO2, может быть обусловлена сочетанием реакции растительного организма на заражение Cms и избыток ионов селена. Добавление раствора крахмала в среду роста Cms-инфицированных растений, как и в случае здоровых, не сопровождалось повышением уровня ДК в листьях и сохраняло свое значение на уровне контрольной группы (0.211 мкМ г–1). Добавление в среду роста Cms-инфицированных растений нанокомпозита Крахмал–Se0НЧ сопровождается незначительным повышением уровня ДК до 0.265 мкМ г–1, вероятно, вследствие пролонгированного высвобождения с поверхности НЧ небольшого количества ионов Se4+ в процессе их совместной инкубации в среде роста растений, а также их взаимодействия с растительными клетками по типу ионов селена из SeO2, однако в гораздо меньшей концентрации. Отметим, что полученное значение содержания ДК в листьях Cms-инфицированных растений (0.265 мкМ г–1) в этом случае лишь незначительно превышает концентрацию ДК в контрольной группе (0.209 мкМ г–1), что также не позволяет в полной мере судить о достоверности выводов о влиянии нанокомпозита Крахмал–Se0НЧ на продукцию ДК растениями. В то же время ДК является промежуточным продуктом процесса ПОЛ, токсичность и реактогенность которого значительно ниже, чем конечного продукта этого процесса – МДА.
Средняя концентрация МДА в контрольной группе растений составила 2.6 и 4.5 нмоль г–1 для здоровых и инфицированных соответственно (рис. 3б). Повышенное значение концентрации МДА во втором случае было обусловлено активацией естественных процессов усиленной генерации АФК в клетках растений, направленных на нейтрализацию патогена (бактерий Cms). Введение SeO2 в среду роста здоровых растений картофеля сопровождается 1.65-кратным увеличением содержания МДА в листьях. Для инфицированных растений соблюдается та же тенденция, даже на фоне изначально большего количества МДА по сравнению со здоровыми растениями, вероятно, как и в случае с ДК, вследствие действия на растительный организм сразу нескольких повреждающих факторов (инфекция и избыток ионов селена). Внесение стерильного водного раствора крахмала в ростовую среду здоровых растений картофеля сопровождалось значительным (в 1.5 раза) увеличением концентрации МДА в листьях. Предположительно, это было вызвано кратковременной интенсификацией процессов ПОЛ в ответ на внесение полисахаридных молекул. В группе Cms-инфицированных растений, обработанных крахмалом, не наблюдалось каких-либо значимых отклонений величины содержания МДА (4.73 нмоль г–1) от контроля, что свидетельствует об отсутствии реакции со стороны Cms-инфицированного растительного организма, находящегося в стадии активной борьбы с бактериальными патогенами Cms, на введение слабопровоцирующего фактора (раствор крахмала).
Добавление нанокомпозита Крахмал–Se0НЧ в среду роста здоровых растений сопровождалось незначительным (в 1.3 раза) увеличением концентрации МДА по сравнению с контролем. Причиной данного повышения уровня МДА может являться, как и в случае с ДК, естественная реакция растительного организма на чужеродный агент, в качестве которого могут выступать ионы Se4+, медленно выделяющиеся с поверхности НЧ в процессе их совместной экспозиции. Тогда как введение нанокомпозита Крахмал–Se0НЧ в среду роста Cms-инфицированных растений сопровождалось снижением уровня МДА в их листьях до значений 3.36 нмоль г–1, что в 1.35 раза меньше, чем в контрольной группе. Медленно высвобождающиеся с поверхности НЧ ионы Se4+ могут ингибировать рост Cms вследствие наличия у Se0НЧ антимикробной активности в отношении данного бактериального фитопатогена, что было показано в [11, 12]. Замедление темпов роста бактерий Cms приводит к снижению микробной нагрузки на растительный организм с уменьшением продукции защитных и сигнальных свободнорадикальных продуктов, трансформирующихся в процессе своего метаболизма до наиболее агрессивного МДА.
В дополнение к описанному выше исследованию безопасности нанокомпозита Крахмал–Se0НЧ для растительного организма картофеля изучили влияние обработки растений нанокомпозитом, а также исходным крахмалом и SeO2 (для сравнения) на содержание хлорофилла в листьях. Установлено, что количество хлорофилла a и b в листьях здоровых растений составило 0.714 и 0.254 мг г–1 соответственно. Соотношение данных видов хлорофилла (1 : 2.8) было близко к физиологической норме (примерно 1 : 3). В листьях Cms-инфицированных растений содержание всех видов хлорофилла падает до общего значения 0.39 с отклонением соотношения хлорофилл a/b до 1 : 2.7. Причиной снижения общего количества хлорофилла в данном случае может являться разрушение пигмента, а именно хлорофилл-белкового комплекса протеолитическими ферментами бактерий Cms. Результатом работы протеаз Cms являются изменение структуры белковой стромы пластид и отделение хлорофилла от мембран [34]. Кроме того, уменьшение концентрации хлорофилла в растениях при их Cms-инфицировании может быть обусловлено значительным замедлением фотопревращения содержащегося в листьях протохлорофиллида в бесфитольное производное хлорофилла – хлорофиллид, т.е. происходит нарушение биосинтеза данного пигмента на его заключительном этапе [35].
Однократная обработка здоровых или Cms-инфицированных растений картофеля оксидом селена в конечной концентрации по селену 0.007 г/мл приводит к отклонению соотношения хлорофилла a/b от стандартного до 1 : 1.7 и 1 : 2.2 соответственно на фоне увеличения общего количества хлорофилла в обоих случаях. Предположительно, это обусловлено развитием компенсаторных метаболических процессов под влиянием избытка селена в среде роста растений, приводящих к увеличению общего количества хлорофилла (табл. 1). Это может привести к краткосрочному увеличению фотосинтетической способности, антиоксидантной активности и ускорению роста растений, что наблюдалось в [32, 36]. Увеличение доли хлорофилла b в общем фонде предположительно связано с окислением хлорофилла под действием АФК, генерируемых растительными клетками в ответ на изменение условий их жизни (в данном случае – внесение ионов Se+4) [37].
Таблица 1.
Содержание хлорофилла a и b и их соотношение в листьях здоровых и зараженных растений
| Контроль | SeO2 | Крахмал | Крахмал–Se0НЧ | |
|---|---|---|---|---|
| Здоровые растения | ||||
| Хлорофилл a, мг г–1 | 0.714 | 1.23 | 0.8 | 1.38 |
| Хлорофилл b, мг г–1 | 0.254 | 0.712 | 0.25 | 0.43 |
| Общий хлорофилл (a + b), мг г–1 | 0.968 | 1.942 | 1.05 | 1.81 |
| Хлорофилл a/b | 2.8 | 1.72 | 3.2 | 3.18 |
| Cms-инфицированные растения | ||||
| Хлорофилл a, мг г–1 | 0.256 | 0.354 | 0.295 | 0.339 |
| Хлорофилл b, мг г–1 | 0.093 | 0.158 | 0.101 | 0.117 |
| Общий хлорофилл (a + b), мг г –1 | 0.349 | 0.512 | 0.396 | 0.456 |
| Хлорофилл a/b | 2.72 | 2.2 | 2.9 | 2.9 |
Введение крахмала в среду роста здоровых или инфицированных растений характеризуется отсутствием значимых отличий полученных значений концентрации хлорофилла а, b, их общего количества и соотношения a/b от значений в соответствующих контрольных группах. Тогда как внесение нанокомпозита Крахмал–Se0НЧ характеризовалось преимущественным сохранением соотношения хлорофилл a/b на уровне 1 : 3, в том числе для инфицированных растений. Общее содержание хлорофилла в листьях инфицированных растений при этом было значительно (в 4 раза) снижено по сравнению со здоровыми растениями даже в условиях их обработки нанокомпозитом.
В группе Cms-инфицированных растений, инкубированных с нанокомпозитом Крахмал–Se0НЧ, можно отметить незначительное (на 30%) повышение содержания общего хлорофилла по сравнению с контрольной группой на фоне “выравнивания” соотношения хлорофилл а/b до контрольных значений. Отметим, что обработка растений стабилизированными крахмалом Se0НЧ характеризуется отсутствием какого-либо негативного влияния на содержание хлорофилла и соотношение его видов в листьях растений. Кроме того, такая обработка способствует сохранению хлорофилловых фондов на уровне контрольных интактных растений, что еще раз подтверждает безопасность полученного нанокомпозита для растений картофеля.
ЗАКЛЮЧЕНИЕ
Впервые осуществлен cинтез стабилизированных крахмалом Se0НЧ с использованием в качестве селенового прекурсора высокореакционноспособных селенид-анионов, предварительно сгенерированных восстановлением элементного селена гидратом гидразина. С использованием комплекса современных физических методов исследования установлено, что нанокомпозит Крахмал–Se0НЧ формируется в виде распределенных в полисахаридной матрице частиц размером 14–37 нм и формой, приближенной к сферической. Обнаружено, что в водном растворе полученного нанокомпозита Крахмал-Se0НЧ присутствуют две фракции частиц со средними значениями Rh 28 и 260 нм. Предположительно выделенные фракции могут соответствовать НЧ селена, поверхность которых покрыта слоем макромолекул крахмала (быстрая фракция) с формированием единой гибридной органо-неорганической системы типа ядро/оболочка – “Se0НЧ/полисахаридная матрица крахмала”, и агрегатам таких частиц (медленная фракция). В условиях in vivo обнаружено различие биологических действий нанокомпозита Крахмал–Se0НЧ на здоровый и Cms-инфицированный растительный организм. Так, добавление в среду роста здоровых растений картофеля водного раствора нанокомпозита Крахмал–Se0НЧ сопровождалось незначительным увеличением концентрации ДК и МДА по сравнению с контролем, вероятно, вследствие развития естественной реакции растительного организма на чужеродный агент, в качестве которого выступают ионы Se4+, медленно выделяющиеся с поверхности НЧ в процессе их совместной экспозиции. Тогда как введение нанокомпозита Крахмал–Se0НЧ в среду роста Cms-инфицированных растений сопровождалось незначительным повышением (в 1.26 раза) уровня ДК и 1.35-кратным снижением уровня МДА в их листьях, вследствие ингибирования роста Cms медленно высвобождающимися с поверхности НЧ ионами Se4+, благодаря наличию у Se0НЧ антимикробной активности в отношении данного бактериального фитопатогена. Кроме того, установлено, что внесение нанокомпозита Крахмал–Se0НЧ к здоровым и Cms-инфицированным растениям картофеля характеризовалось преимущественным сохранением и поддержанием физиологического соотношения хлорофилл a/b на уровне 1 : 3 даже в условиях его предварительного нарушения совместно с незначительным (на 30%) повышением содержания общего хлорофилла (как в случае инфицированных растений). Данные результаты свидетельствуют об отсутствии какого-либо негативного влияния полученного нанокомпозита Крахмал-Se0НЧ на антиоксидантную систему и фонд хлорофилла в растительном организме, что еще раз подтверждает безопасность нанокомпозита для растений картофеля.
Автор выражает благодарность А.И. Перфильевой и О.А. Ножкиной (сотрудникам СИФБР СО РАН) за предоставленные образцы здоровых и Cms-инфицированных растений картофеля.
В экспериментах использовали материалы и оборудование БАЦКП Иркутского института химии им. А.Е. Фаворского СО РАН.
Список литературы
El-Ramady H., Domokos-Szabolcsy E., Shalaby T. et al. // Selenium in Agriculture: Water, Air, Soil, Plants, Food, Animals and Nanoselenium. Springer, Cham. 2015. P. 217. https://doi.org/10.1007/978-3-319-11906-9_5
Girling C.A. // Agric. Ecosyst. Environ. 1984. V. 11. P. 37. https://doi.org/10.1016/0167-8809(84)90047-1
Gupta M., Gupta S. // Front Plant Sci. 2017. V. 11. P. 2074. https://doi.org/10.3389%2Ffpls.2016.02074
Hasanuzzaman M., Bhuyan M.H.M.B., Raza A. et al. // Plants (Basel). 2020. V. 4. P. 1711. https://doi.org/10.3390/plants9121711
Rahman M.M., Asiri A.M., Khan A. et al. Importance of Selenium in the Environment and Human Health [Internet]. London: IntechOpen, 2020. 94 p. https://doi.org/10.5772/intechopen.83202
Gudkov S.V., Shafeev G.A., Glinushkin A.P. et al. // ACS Omega. 2020. V. 5. P. 17767. https://doi.org/10.1021/acsomega.0c02448
Garza-Garcia J.J.O., Hernandez-Diaz J.A., Zamudio-Ojeda A. et al. // Biol Trace Elem Res. 2022. V. 200. P. 2528. https://doi.org/10.1007/s12011-021-02847-3
Bano I., Skalickova S., Sajjad H. et al. // Agronomy. 2021. V. 11. P. 2229. https://doi.org/10.3390/agronomy11112229
Pomogailo A.D., Dzhardimalieva G.I. Nanostructured Materials Preparation via Condensation Ways. Dordrecht: Springer, 2014. 460 p. https://doi.org/10.1007/978-90-481-2567-8
Osdaghi E., Van der Wolf J.M., Abachi H. et al. // Mol. Plant. Pathol. 2022. V. 23. P. 911. https://doi.org/10.1111/mpp.13191
Baharuddin A., Pabborong A., Kuswinanti T. et al. // IOP Conf. Ser.: Earth Environ. Sci. 2019. V. 355. P. 012081.
Hukkanen A., Karjalainen R., Nielsen S. et al. // J. Plant Dis. Prot. 2005. V. 112. P. 88.
Schneider B.J., Zhao J., Orser C.S. // FEMS Microbiol. Lett. 1993. V. 109. P. 207. https://doi.org/10.1111/j.1574-6968.1993.tb06169.x
Tripathy B.C., Oelmuller R. // Plant Signal. Behav. 2012. V. 7. P. 1621. https://doi.org/10.4161/psb.22455
Das K., Roychoudhury A. // Front. Environ. Sci. 2014. V. 2. https://doi.org/10.3389/fenvs.2014.00053
Smirnoff N., Arnaud D. // New Phytologist. 2019. V. 221. P. 1197. https://doi.org/10.1111/nph.15488
Dokic P., Dokic L., Dapcevic T. et al. // Prog. Colloid Polym. Sci. 2008. V. 135. P. 48.
Лесничая М.В., Александрова Г.П., Сухов Б.Г. и др. // Химия природных соединений. 2013. Т. 49. С. 347. https://doi.org/10.1007/s10600-013-0625-x
Лесничая М.В., Сухов Б.Г. // Российские нанотехнологии. 2021. Т. 16. С. 222. https://doi.org/10.1134/S1992722321020096
Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в биологических мембранах. М.: Наука, 1972. 252 с.
Филипцова Г.Г. Фотосинтез: методические рекомендации к лабораторным занятиям, задания для самостоятельной работы и контроля знаний студентов биологических факультетов. Минск: БГУ, 2017. 40 с.
Lesnichaya M., Gazizova A., Perfileva A. et al. // IET Nanobiotechnol. 2021. V. 15. P. 585. https://doi.org/10.1049/nbt2.12044
Лесничая М.В., Малышева С.Ф., Белогорлова Н.А. и др. // Изв. РАН. Сер. хим. 2019. Т. 68. С. 2245. https://doi.org/10.1007/s11172-019-2694-x
Оленин А.Ю., Лисичкин Г.В. // Успехи химии. 2011. Т. 80. С. 635. https://doi.org/10.1070/RC2011v080n07ABEH004201v
Nguyen T.K., Maclean N., Mahiddine S. // Chem. Rev. 2014. V. 114. P. 7610. https://doi.org/10.1021/cr400544s
Singh S.C., Mishra S.K., Srivastava R.K. et al. // J. Phys. Chem. 2010. V. 114. P. 17374. https://doi.org/10.1021/jp105037w
Зверева М.В., Жмурова А.В. // Журн. орган. химии. 2022. Т. 92. С. 1628. https://doi.org/10.1134/S1070363222100139
Lesnichaya M.V., Shendrik R., Sukhov B.G. // J. Lumin. 2019. V. 211. P. 305. https://doi.org/10.1016/j.jlumin.2019.03.056
Chakraborty S., Sahoo B., Teraoka I. et al. // Carbohydr. Polym. 2005. V. 60. P. 475. https://doi.org/10.1016/j.carbpol.2005.03.011
Casillo A., Fabozzi A., Russo Krauss I. et al. // Biomacromolecules. 2021. V. 12. P. 1445. https://doi.org/10.1021/acs.biomac.0c01659
Burchard W. Light Scattering from Polysaccharides as Soft Materials // Soft Matter Characterization. Eds. Borsali R., Pecora R. Dordrecht: Springer, 2008. https://doi.org/10.1007/978-1-4020-4465-6_9
Jiang C., Zu C., Lu D. et al. // Sci Rep. 2017. V. 7. P. 42039. https://doi.org/10.1038/srep42039
Lesnichaya M., Perfileva A., Nozhkina O. et al. // J. Trace Elem. Med. Biol. 2022. V. 69. P. 126904. https://doi.org/10.1016/j.jtemb.2021.126904
Padmaja K., Prasad D.D.K., Prasad A.R.K. // Phytochemistry. 1989. V. 28. P. 3321. https://doi.org/10.1016/0031-9422(89)80339-5
Лемеза Н.А., Гирилович И.С. // Вестн. Белорус. гос. ун-та им. В.И. Ленина. Сер. 2, Химия. Биология. География. 1991. Т. 2. С. 45. https://elib.bsu.by/handle/123456789/254761
Вихрева В.А., Балахнина Т.И., Гинс В.К. // Доклады Российской академии сельскохозяйственных наук. 2002. Т. 1. С. 8.
Zahedi S.M., Moharrami F., Sarikhani S. et al. // Sci. Rep. 2020. V. 10. P. 17672. https://doi.org/10.1038/s41598-020-74273-9
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии