Российские нанотехнологии, 2023, T. 18, № 6, стр. 737-749
Полимерная система “пэг–декстран” для выделения наноразмерных внеклеточных везикул
М. А. Слюсаренко 1, 2, Н. П. Евлампиева 1, *, О. С. Везо 1, А. В. Малек 2
1 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
2 Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова
Санкт-Петербург, Россия
* E-mail: n.yevlampieva@spbu.ru
Поступила в редакцию 29.12.2022
После доработки 27.04.2023
Принята к публикации 14.08.2023
Аннотация
Показано, что двухфазная полимерная система “полиэтиленгликоль–декстран” может с высокой эффективностью использоваться для выделения наноразмерных везикул из плазмы крови человека, и предложена соответствующая методика. Определены оптимальные параметры системы для этой цели: молекулярная масса полимеров, их весовое соотношение, рабочая температура; исследован механизм взаимодействия компонентов полимерной системы с компонентами плазмы. Установлено, что выделение везикул в заданном размерном диапазоне обусловлено выбором состава полимерной системы в области ниже ее бинодали и соблюдением определенного количественного соотношения гидродинамических объемов молекул декстрана и полиэтиленгликоля в плазме. Предлагаемая методика является недорогим и удобным способом концентрирования везикул для их последующего биохимического анализа.
ВВЕДЕНИЕ
Двухфазные системы на основе гидрофильных полимеров, таких как поливинилпирролидон, полиэтиленгликоль, полипропиленгликоль и их сополимеры, производные декстрана известны продолжительное время, но применяются они в основном только в лабораторных условиях. Наиболее часто двухфазную полимерную систему формируют либо добавлением низкомолекулярной соли к раствору высокомолекулярного соединения, либо из двух несовместимых в водной среде полимеров. Такие системы представляют интерес для выделения или разделения биообъектов: клеток и их органелл, энзимов, протеинов, пептидов, если они не разрушают и не денатурируют перечисленные объекты [1–4]. Успешным применение двухфазных систем считается тогда, когда удается сконцентрировать выделяемый объект в одной из фаз, либо на межфазной границе. Метод считается сугубо эмпирическим, требует экспериментального подбора параметров выбранной системы и определения условий ее эффективности по отношению к выделяемому объекту, что объясняет ограниченное использование двухфазных полимерных систем (ДПС) в аналитике и биотехнологиях. Изучение поведения ДПС и закономерностей их функционирования актуально в связи с большим количеством возможных применений. Отметим, что разделение смесей биообъектов с помощью ДПС, основанное на аффинных принципах, в рамках проведенного исследования не рассматривается.
Данная работа связана с изучением возможности выделения везикулярных компонент (везикул) плазмы крови с использованием ДПС. Везикулы – это мембранные образования, содержащиеся во всех биологических жидкостях организма. Они состоят из липидной оболочки с расположенными на ее поверхности наборами белков, состав которых зависит от продуцировавших их клеток, а также внутреннего наполнения, включающего в себя белки, липиды, нуклеиновые кислоты и другие соединения [5–7]. Интерес к везикулам существенно вырос в последние годы в связи с присуждением в 2013 г. Нобелевской премии по физиологии и медицине Д. Ротману, Р. Шекману и Т. Зюдофу за открытие системы везикулярного транспорта и в связи с доказательством высокой диагностической значимости этих объектов [6–8]. Размер везикул варьируется от микронных до нанометровых. Основная функция внеклеточных наноразмерных везикул (ВНВ) в живых организмах связана с осуществлением межклеточного обмена. Термин ВНВ принято использовать для везикул размером от 30 до 150 × 10–7 см. Диагностический потенциал ВНВ пока невозможно реализовать в полной мере из-за отсутствия достаточно простых и надежных методов выделения и анализа этих частиц. Несмотря на то что в последние годы был достигнут некоторый прогресс в решении проблемы выделения везикул, в частности с применением мембранных технологий [9, 10], до настоящего времени стандартом выделения ВНВ из плазмы крови считается двухэтапное ультрацентрифугирование при 110 000 g [11]. Поэтому поиск альтернативных методик выделения везикул из биологических жидкостей остается актуальным.
В данной работе в качестве “инструмента” для выделения ВНВ выбрана ДПС “полиэтиленгликоль–декстран” (“ПЭГ–декстран”), состоящая из биосовместимых, нетоксичных и коммерчески доступных полимеров. Для выделения ВНВ из плазмы крови данная ДПС не применялась. Можно найти примеры использования этой системы для целевого выделения различных биообъектов [1, 3, 12–14], но, к сожалению, общие критерии, на которые можно было бы опереться при выборе таких параметров ДПС, как молекулярная масса (ММ) полимеров или их количественное соотношение, не сформулированы. Кроме указанных параметров для практического применения ДПС требуется дополнительно подбирать температуру, рН среды, величину ионной силы, состав низкомолекулярных ионов [1–4].
Задачей работы помимо определения критериев применимости ДПС “ПЭГ–декстран” для выделения везикул определенных размеров из плазмы крови человека было исследование механизмов взаимодействия полимеров ДПС с компонентами плазмы в критических условиях близости к бинодали системы. Одной из задач также была количественная оценка эффективности выделения наноразмерных везикул плазмы с помощью ДПС “ПЭГ–декстран” для их последующего анализа. Работа имеет прямое отношение к разработке новых методов жидкостной биопсии c использованием везикул плазмы крови для раннего выявления и мониторинга онкологических заболеваний.
МАТЕРИАЛЫ И МЕТОДЫ
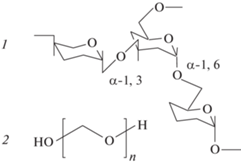
Для формирования ДПС использовали полимеры известных фирм-производителей (первая графа табл. 1), предназначенные для биомедицинского применения. Были приобретены шесть образцов ПЭГ и три образца декстрана в широком интервале ММ. Полимеры использовали без дополнительной очистки. Напомним, что ПЭГ – хорошо известный биосовместимый синтетический полимер (рис. 1), а декстран – полисахарид с вариативной степенью ветвления, зависящей от его происхождения.
Таблица 1.
Гидродинамические характеристики образцов декстрана и ПЭГ в ФСБ при 298 К: характеристическая вязкость [η], постоянная Хаггинса k', инкремент плотности Δρ/Δс, коэффициент поступательной диффузии D0, гидродинамический радиус Rh, молекулярная масса Mw, второй вириальный коэффициент А2 и гидродинамический инвариант А0
| Образец | [η] · 10–2, см3/г, (k´) | Δρ/Δс, г/см3 | D0 · 108, см2/с | Rh · 107, см | Mw · 10–3, г/моль | А2 · 104 моль ·мл/г2 | А0 · 1010 (СГС) |
|---|---|---|---|---|---|---|---|
| Декстран-1 (Loba Chemi) | 0.14 ± 0.01 (0.53) | 0.351 ± 0.007 | 66 ± 7 | 3.6 ± 0.4 | 19.4 ± 0.2 | 3.9 ± 0.4 | 2.7 ± 0.5 |
| Декстран-2 (Serva) | 0.36 ± 0.03 (0.55) | 0.364 ± 0.002 | 31 ± 5 | 8 ± 1 | 320 ± 10 | 2.0 ± 0.4 | 5.0 ± 0.8 |
| Декстран-3 (Sigma-Aldrich) | 0.48 ± 0.05 (0.46) | 0.403 ± 0.001 | 20 ± 2 | 11.9 ± 0.3 | 470 ± 10 | 1.7 ± 0.3 | 3.8 ± 0.4 |
| ПЭГ-1 (Serva) | 0.18 ± 0.01 (0.54) | 0.162 ± 0,002 | 104 ± 10 | 2.3 ± 0.4 | 4.9 ± 0.5 | 3.1 ± 0.3 | |
| ПЭГ-2 (Sigma-Aldrich) | 0.21 ± 0.01 (0.49) | 0.161 ± 0.001 | 91 ± 9 | 2.6 ± 0.3 | 6.6 ± 0.5 | 3.1 ± 0.3 | |
| ПЭГ-3 (Loba Chemi) | 0.28 ± 0.02 (0.46) | 0.161 ± 0.001 | 62 ± 6 | 3.8 ± 0.4 | 12 ± 1 | 30 ± 3 | 2.9 ± 0.3 |
| ПЭГ-4 (Loba Chemi) | 0.11 ± 0.01 (0.62) | 0.151 ± 0.002 | 112 ± 12 | 2.1 ± 0.2 | 9 ± 1 | 3.4 ± 0.4 | |
| ПЭГ-5 (Sigma) | 0.49 ± 0.04 (0.20) | 0.136 ± 0.004 | 57 ± 6 | 4.2 ± 0.2 | 17 ± 1 | 27 ± 2 | 3.6 ± 0.3 |
| ПЭГ-6 (Sigma) | 0.63 ± 0.01 (0.25) | 0.162 ± 0.002 | 41 ± 4 | 5.8 ± 0.1 | 26.2 ± 0.5 | 25 ± 4 | 3.2 ± 0.3 |
Для данной работы выбрали образцы декстрана, производимые одним и тем же типом бактерий Leuconostoc mesenteroides, с невысокой разветвленностью – 5%. Мономеры основной полисахаридной цепи декстрана соединены связью α-1,6, тогда как звенья боковых ветвей присоединены через связи α-1,3 (рис. 1). Тип гликозидной связи в боковых цепях декстрана может варьироваться.
В качестве основного растворителя в работе использовали фосфатно-солевой буфер (ФСБ) при значении рН 7.4.
Метод статического рассеяния света использовали для определения средневесовых молекулярных масс Мw полимерных образцов. Измерения интенсивности рассеянного света в растворах полимеров в ФСБ проводили согласно стандартной процедуре в интервале углов рассеяния 30°–140° на установке Photocor Complex (Россия) ресурсного центра СПбГУ “Центр диагностики функциональных материалов для медицины, фармакологии и наноэлектроники”. Источником света служил полупроводниковый лазер (25 мВТ) с длиной волны 445 нм, обработку данных проводили методом двойной экстраполяции по Зимму [15].
Плотности и показатели преломления растворов определяли на плотномере DMA 500 M CK (Anton Paar) и рефрактометре Abbemat WR/MW(Anton Paar) указанного выше ресурсного центра.
Для определения гидродинамических размеров Rh объектов в растворе использовали два метода: динамическое рассеяние света (ДРС) [16] и анализ траекторий наночастиц (АТН) [17].
Измерения ДРС проводили в соответствующем режиме спектрометра Photocor Complex. Лазер (25 мВт) с длиной волны 654 нм использовали как источник излучения. Интервал углов рассеяния изменяли от 40° до 140°, измерения проводили при температуре 298 К. Спектры времен релаксации, полученные при регистрации рассеянного света под разными углами, анализировали c помощью программы DYNALS [18]. Для определения коэффициента диффузии получали зависимость обратного времени релаксации 1/τ от квадрата волнового вектора q2 для четырех–пяти концентраций. Аппроксимировали каждую из полученных зависимостей линейной функцией. По данным аппроксимации из наклонов прямых получали коэффициенты диффузии D при каждой концентрации, а затем концентрационную зависимость D, которая при экстраполяции к с → 0 позволяла определить значения D0 = limc →0D (табл. 1). Типичные распределения частиц по размерам в растворах образцов ПЭГ и декстрана, полученные методом ДРС, показаны на рис. 2. Пример обработки данных ДРС приведен для одного из образцов ПЭГ на рис. 3, концентрационные зависимости коэффициентов поступательной диффузии D для образцов декстрана в ФСБ показаны на рис. 4.
Рис. 2.
Нормализованные распределения частиц по размерам в ФСБ для ПЭГ-6 при концентрации 1.495 × 10–2 г/см3 и угле рассеяния 80° (а) и для декстрана-2 при концентрации 0.05 × 10–2 г/см3 и угле рассеяния 90° (б), полученные методом ДРС.
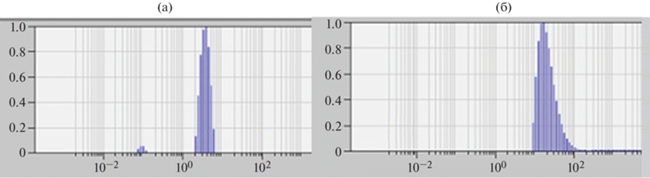
Рис. 3.
Зависимости обратных времен релаксации 1/τ флуктуаций концентрации частиц в растворе от квадрата вектора рассеяния (а) и соответствующая концентрационная зависимость коэффициентов диффузии D для ПЭГ-5 в ФСБ при 298 К (б). Измерения проводили при концентрациях с1 = 2.967, с2 = 1.992, с3 = 1.503, с4 = 0.991 и с5 = = 0.573 · 10–2 г/ см3. Времена релаксации определяли по положению максимумов распределений, распределения были мономодальными.
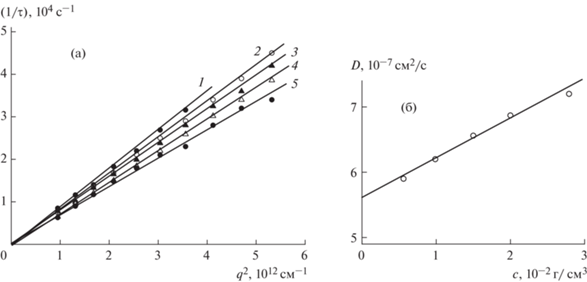
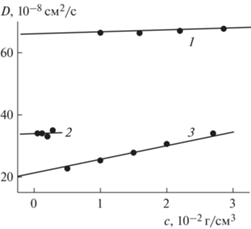
Рис. 4.
Концентрационные зависимости коэффициента диффузии D для образцов декстрана в ФСБ при 298 К, полученные методом ДРС. Номера прямых соответствуют номерам образцов декстрана в табл. 1.
Гидродинамические радиусы Rh макромолекул и частиц в исследованных растворах получали с использованием соотношения Стокса–Эйнштейна (1) и экспериментально определенных коэффициентов поступательной диффузии D0:
где k – постоянная Больцмана, η0 – вязкость растворителя, T – температура.Метод АТН относительно новый, в данной работе использовался для определения размера и концентрации выделенных ВНВ. Измерения проводили на анализаторе Nanosight NS300 (“Malvern”, США). Обработку спектров проводили в Nanosight NTA 3.2 Software. Проводили четыре–пять измерений для разных проб раствора одного и того же образца. Каждое измерение имело длительность 60 с, что соответствовало 1498 кадрам. Измерения были выполнены при 298 K. Метод АТН основан на фиксации смещений наночастиц за счет броуновского движения в реальном времени. Фиксация координат частиц во времени происходит при наблюдении смещения пятна дифракции света при попадании лазерного пучка на частицы. Из уравнения среднего смещения броуновской частицы (2) за выбранный интервал времени можно вычислить коэффициент диффузии:
где $r_{{xyz}}^{2}$– средний квадрат смещения броуновской частицы, $D~$– коэффициент диффузии, t – время наблюдения за частицей.Гидродинамический радиус частиц Rh, так же как в методе ДРС, вычисляли, используя соотношение (1).
Характеристическая вязкость [η] полимера в растворе является его важным гидродинамическим параметром, зависящим от свойств как полимера, так и растворителя:
(3)
$[\eta ] = \mathop {\lim }\limits_{c \to 0} \left( {\frac{{{{\eta }_{0}} - \eta }}{{{{\eta }_{0}}с}}} \right),$Величину [η] определяли экстраполяцией к с → 0 по методу Хаггинса:
где ηsp/c – приведенная вязкость, $k{\kern 1pt} '$ – константа Хаггинса [20].Для измерений использовали автоматизированный микровискозиметр Lovis 2000 M/ME на основе метода Гепплера. Прибор позволяет определять время качения шарика при разных углах наклона капилляра, заполненного раствором или растворителем. Измерения проводили при двух углах наклона капилляра вискозиметра 50° и 55°, время качения шарика фиксировали 5–6 раз, результат измерений усредняли для каждой из концентраций раствора. Величину ηsp/c вычисляли как (t – t0)/t0c, где t и t0 – время движения шарика в растворе и растворителе. Концентрационные зависимости ηsp/c для образцов ПЭГ показаны на рис. 5.
Рис. 5.
Концентрационная зависимость приведенной вязкости (ηsp/c) для образцов ПЭГ в фосфатно-солевом буферном растворителе при 298 К. Номера прямых соответствуют номерам образцов ПЭГ в табл. 1.
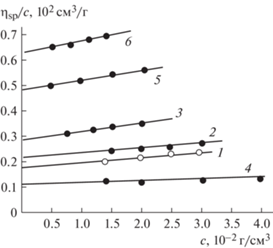
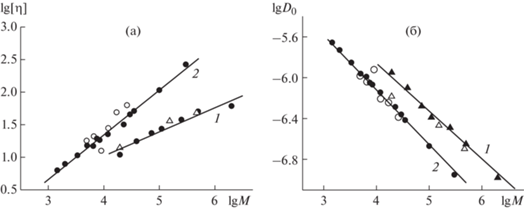
Рис. 6.
Молекулярно-массовые зависимости характеристической вязкости [η] (a) и коэффициента диффузии D0 (б) для образцов декстрана (1) и ПЭГ (2) в фосфатно-солевом буфере при 298 К; светлые точки – данная работа, темные – [21].
Денситометр DMA 5000M (Anton Paar, Австрия) применяли для определения плотности растворов полимеров.
Фазовые диаграммы получали в воде при 298 К, используя известные критические соотношения ПЭГ и декстрана близкой ММ при комнатной температуре [1, 2]. Это существенно сократило этап грубого подбора интервала концентраций для изучения фазового поведения систем ПЭГ–декстран. Далее к 1 см3 совместного раствора декстрана и ПЭГ в кювете для спектрофотометра СФ-56 при соотношении компонентов, близком к критическому, добавляли раствор ПЭГ известной концентрации, медленно вводя его дозатором по 0.2 см3 через 5 мин и измеряя величину оптического поглощения раствора на длине волны 300 нм. При разделении фаз наблюдали резкое снижение величины оптического поглощения раствора на 15–20% относительно предшествующего измерения. Положение точки на бинодали ДПС определяли, рассчитывая точное соотношение концентраций ПЭГ и декстрана с учетом введенного дополнительно раствора ПЭГ. Фазовые диаграммы, приведенные ниже, получали сглаживанием экспериментальной кривой, проведенной по восьми точкам.
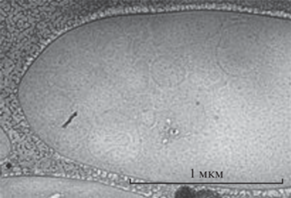
Метод криогенной просвечивающей электронной микроскопии (крио-ПЭМ) применяли для визуализации ВНВ, выделенных из плазмы. Медную сетку, покрытую углеродной пленкой (TEM-LC200CU25, Sigma-Aldrich, США), обрабатывали (15 с, O2/H2) на устройстве для гидрофильной очистки Jeol EM-39010. Суспензию ВНВ (4 мкл) наносили на сетку в климатической камере (относительная влажность 90%, температура 20°C). Избыточную суспензию удаляли с помощью фильтровальной бумаги, полученную пленку замораживали в жидком этане с помощью автоматического устройства быстрой заморозки образцов Leica EM GP. Изображения образцов получали при –170°C на крио-держателе Gatan 914 для крио-ПЭМ-визуализации на просвечивающем электронном микроскопе JEM-2100 (Jeol, Япония). Микрофотографии получали с помощью камеры Gatan Ultrascan 4000 при увеличении либо ×30 000, либо ×15 000.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Плазма крови млекопитающих – это многокомпонентная биологическая жидкость, содержащая помимо внеклеточных везикул протеины, нуклеиновые кислоты, липиды, витамины и другие составляющие. В этом отношении плазма представляет собой сложный объект для изучения механизма взаимодействия полимеров ДПС с разными по строению биологическими микро- и наночастицами, отличающимися по своим физическим и биохимическим свойствам. Данная работа в значительной степени базируется на физическом подходе, основанном на размерном критерии при изучении результата взаимодействия частиц в многокомпонентной среде. Такой подход позволил упростить рассмотрение процессов, происходящих при расслоении ДПС “ПЭГ–декстран” непосредственно в плазме крови.
Гидродинамические характеристики полимеров ДПС. Положение бинодали фазовой диаграммы двухфазных полимерных систем зависит от ММ каждого из ее компонентов. Сведения об этом имеются и для обсуждаемой ДПС [12–14], поэтому выбранные образцы ПЭГ и декстрана (табл. 1) были охарактеризованы методом статического рассеяния света с целью определения их средневесовой молекулярной массы Mw. Методы ДРС и вискозиметрии использовали для определения гидродинамических характеристик полимеров. Эти измерения проводили в ФСБ, который рассматривали как водную среду, подобную плазме, поскольку везикулы и белки сохраняют в ФСБ свою нативность. В табл. 1 приведены полученные характеристики полимеров в ФСБ, которые далее считали соответствующими тем же характеристикам в плазме.
Представленные в табл. 1 данные демонстрируют различие молекулярных свойств ПЭГ и декстрана в одном растворителе. ПЭГ – это линейный синтетический полимер, а декстран – полисахарид, имеющий слабо разветвленное строение (рис. 1). Различие в химической структуре и строении полимеров проявляется в конформационных и гидродинамических свойствах их молекул. Конформация ПЭГ – асимметричный статистический клубок, тогда как для разветвленных цепей декстрана пространственная форма молекул, очевидно, иная. Например, из табл. 1 видно, что гидродинамические радиусы Rh молекул ПЭГ и декстрана при близкой ММ сопоставимы (ПЭГ-5 с Мw = 17 × 103 г/моль и декстран-1 с Мw = 19.4 × 103 г/моль), но не их характеристическая вязкость [η], зависящая от формы молекул. Величина [η] для ПЭГ-5 сопоставима с таковой для декстрана-3 с существенно более высокой молекулярной массой Мw = 470 × 103 г/моль. Совокупность гидродинамических данных показывает, что в одном растворителе молекулы ПЭГ должны обладать существенно бóльшим исключенным объемом, чем молекулы декстрана. В частности, как видно из табл. 1, инкремент плотности Δρ/Δс для декстрана выше, чем для ПЭГ.
Образцы ПЭГ в табл. 1 представляют собой гомологический ряд, поскольку полученные для него степенные показатели молекулярно-массовых зависимостей для [η] и D хорошо соответствуют литературным данным (рис. 8).
Рис. 7.
Зависимость (M2/[η])1/3 от M(1–ε)/2 для образцов ПЭГ (а) и зависимость [η]М от M в логарифмическом масштабе для ПЭГ и декстрана (б); темные точки – данная работа, светлые – [21].
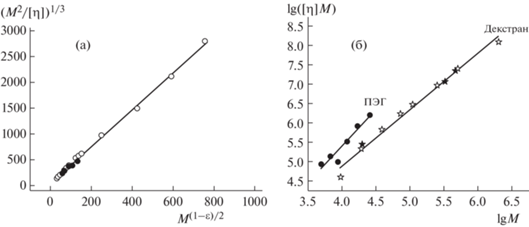
Рис. 8.
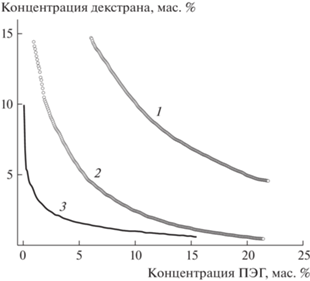
Фазовые диаграммы для трех ДПС разного состава в воде при 298 К: декстран-1: ПЭГ-1(1), декстран-1:ПЭГ-5 (2) и декстран-3:ПЭГ-5 (3).
Для декстрана как представителя класса разветвленных полиcахаридов бактериального синтеза о подобном сопоставлении можно говорить лишь условно, поскольку его молекулярные свойства, обусловленные возрастающей с ММ разветвленностью, отличаются от полимеров цепного строения. Это было продемонстрировано в классической работе В. Бурхарда на фракциях декстрана в интервале ММ от десятков тысяч до десятков миллионов [22]. Однако в ограниченной области ММ (20–500) × 103 г/моль при слабой степени разветвленности ~5% (как у изучаемых образцов) для декстрана допустима линейная аппроксимация молекулярно-массовых зависимостей [22, 23], поэтому с целью сопоставления свойств образцов декстрана c ранее опубликованными данными такая аппроксимация была сделана. Рисунки 6а и 6б демонстрируют близость [η] и D исследованных в работе образцов данным, опубликованным для ПЭГ и декстрана в ФСБ ранее [21]. В то же время из рис. 6 видно, что наклоны зависимостей для ПЭГ и декстрана различаются, т.е. в ФСБ при 298 К полимеры имеют существенно разные показатели степени в соотношениях типа Марка–Куна–Хаувинка (МКХ). Для примера приведем соотношения МКХ для вязкости из [21], где были исследованы более однородные гомологические серии ПЭГ и декстрана: [η] = (1.4 ± 0.2) 10–3 M0.45 ± 0.05 – декстран, [η] = (4.3 ± 0.4) 10–4 M0.67±0.07 – ПЭГ.
Как известно, в термодинамически идеальных условиях для полимера в растворе, когда внутримолекулярные взаимодействия и взаимодействие “полимер–растворитель” компенсируют друг друга (θ-условия, второй вириальный коэффициент A2 = 0), его конформация не возмущена объемными эффектами, то показатель степени аη в уравнении МКХ для вязкости должен быть равен 0.5 [24]. Классическая теория Флори–Хаггинса [24] также предсказывает, что А2 > 0 для растворов макромолекул в термодинамически хороших растворителях и А2 < 0 в плохих растворителях. При этом показатель степени в уравнении МКХ в термодинамически плохих условиях для полимера аη < 0.5, в хороших – аη > 0.5 [24].
Для декстрана в водных растворителях второй вириальный коэффициент А2 имеет положительные значения; сведения об этом можно найти как в научной периодике [21–24], так и в справочной литературе. Полученные в работе значения А2 для образцов декстрана в ФСБ (табл. 1) подтверждают это и вполне соответствуют данным [21]. В то же время существует значительное число экспериментальных работ, в которых показатель степени в соотношении МКХ для характеристической вязкости декстрана в водно-солевых растворителях меньше 0.5 [21–23], хотя такие растворители не являются для него термодинамически плохими. То есть декстран, даже будучи слабо разветвленным полимером, отличается по своим молекулярным свойствам от полимеров линейного строения, к которым относится ПЭГ. Для последнего А2> 0 и аη > > 0.5, т.е. ФСБ для ПЭГ однозначно термодинамически хороший растворитель. Таким образом, причиной несовместимости ПЭГ и декстрана в одном растворителе является и химическое строение, и разная архитектура их макромолекул.
Отметим, что величина А2 для рассматриваемых полимеров в ФСБ разная: значения А2 для ПЭГ примерно на порядок выше, чем для декстрана при близкой ММ (табл. 1). Этот факт может свидетельствовать о неидентичности термодинамических условий в ФСБ для ПЭГ и декстрана. Ведь согласно классическим термодинамическим теориям, чем ближе к нулю значение А2, тем предпочтительнее для полимера внутримолекулярные взаимодействия, а не взаимодействие с растворителем.
На рис. 7а приведено построение для оценки равновесной термодинамической жесткости (или длины статистического сегмента Куна А) цепей ПЭГ. Это построение, основанное на гидродинамической теории Грэя–Блюмфельда–Хирста [25, 29], позволяет определить величину А цепных макромолекул из наклона линейной зависимости (M2 [η])1/3 = f(M (1–ɛ)/2) к оси абсцисс и диаметр цепи d из величины отрезка, отсекаемого ею на оси ординат и пропорционального $\left( {\frac{A}{d}} \right)$:
(5)
$\begin{gathered} {{\left( {{{M}^{2}}\left[ \eta \right]} \right)}^{{1{\text{/}}3}}} = ~\left[ {\frac{3}{{\Phi _{0}^{{1{\text{/}}3}}\left( {1 - \varepsilon } \right)\left( {3 - \varepsilon } \right)}}} \right]\left( {\frac{{{{M}_{L}}^{{\frac{{1 + \varepsilon }}{2}}}}}{{{{A}^{{\frac{{1 - \varepsilon }}{2}}}}}}} \right){{M}^{{\frac{{1 - \varepsilon }}{2}}}} + \\ + ~\;\left( {\frac{{{{M}_{L}}{{P}_{0}}}}{{3{{\pi \Phi }}_{0}^{{1{\text{/}}3}}}}} \right)\left[ {\ln \left( {\frac{A}{d}} \right) - \frac{d}{{3A}} - {{\varphi }}\left( {{\varepsilon }} \right)} \right]. \\ \end{gathered} $Для ПЭГ в ФСБ из построения, приведенного на рис. 7а, получено значение длины сегмента Куна А = (2.0 ± 0.5) × 10–7 см и d = (0.2 ± 0.1) × 10–7 см; при этом были использованы следующие численные значения параметров, входящих в соотношение (5): ε = 0.113, $\Phi _{0}^{{}}$ = 2. 86 × 1023 моль–1, ${{P}_{0}}$= 5.11, ML =154 × 107 г/(моль×см). Количественная оценка равновесной жесткости цепи ПЭГ подтверждает, что это типично гибкоцепной полимер [29].
Среди полисахаридов декстран, для которого доминирующий тип связи циклических мономеров α-1,6 (рис. 1), тоже относится к гибким полимерам в отличие, например, от целлюлозы с характерной для нее β-1,4 гликозидной связью. Доказательству гибкости цепей декстрана посвящено значительное число публикаций в конце XX века [26–28]. Например, основываясь на данных метода двойного лучепреломления в потоке и полагая, что вклад в оптическую анизотропию раствора вносят в основном только независимо ориентирующиеся в потоке линейные участки цепей декстрана, в [28] получили оценку термодинамической жесткости для таких участков А = (1.5 ± ± 0.5) × 10–7 см. Невысокая равновесная жесткость декстрана и ПЭГ, несмотря на различие в химическом строении, предопределяет сильную зависимость конформации и размеров их молекул от термодинамических условий.
При обсуждении гидродинамических свойств полимеров в растворах принято оценивать величину гидродинамического инварианта А0 (6). Гидродинамический инвариант отражает взаимозависимость всех параметров макромолекул в растворе через их ММ и постоянство их средних размеров в явлениях поступательного и вращательного трения. Обычно оценкой численного значения А0 подтверждают комплементарность экспериментально полученных разными методами гидродинамических характеристик макромолекул [29]:
(6)
${{A}_{0}} = {{\left( {\frac{{M\left[ {{\eta }} \right]}}{{100}}} \right)}^{{1{\text{/}}3}}}\frac{{{{{{\eta }}}_{0}}{{D}_{0}}}}{T},$Если для ряда образцов ПЭГ среднее значение гидродинамического инварианта получилось равным (3.2 ± 0.3) × 10–10 г∙см2∙с–2∙град–1∙моль–1/3, что полностью соответствует значению А0 для гибкоцепных полимеров в термодинамически хороших растворителях [29, 30], то для исследованных образцов декстрана значения А0 различались большим разбросом (табл. 1), что может быть связано с несовпадением типа разветвленности и степени полидисперсности декстранов от разных производителей. Последнее отмечают многие исследователи полисахаридов бактериального происхождения, отдавая предпочтение использованию декстранов от одного производителя [21, 22]. В связи с этим констатируем, что архитектура и тип разветвленности декстрана, очевидно, отличаются от синтетических разветвленных полимеров как регулярных, так и нерегулярных, для которых наблюдают тенденцию к снижению величины А0 в сравнении с полимерами цепного строения [30–32].
Универсальным параметром для сопоставления макромолекул разной топологии является их гидродинамическая плотность. Для этого используется построение [η]М = f(М), поскольку величина произведения [η]M пропорциональна объему V, занимаемому макромолекулой в растворе (7) [33]. Наклон зависимости lg($\left[ \eta \right]M)$ от lgM будет обратно пропорционален средней гидродинамической плотности полимерных молекул (∼lg(1/ρ)):
(7)
$\left[ {{\eta }} \right]M = {{{{\Phi }}}_{0}}{{\left\langle {{{h}^{2}}} \right\rangle }^{{3{\text{/}}2}}}~\sim ~\,\,V,$Чем меньше величина наклона, тем выше плотность полимерного клубка для сравниваемых полимеров [33, 34]. Из рис. 7б видно, что для декстрана линейная аппроксимация экспериментальных данных имеет меньший наклон, чем для ПЭГ, т.е. декстран в сравнении с ПЭГ обладает более плотной внутримолекулярной упаковкой в одинаковых внешних условиях. Этот вывод полностью согласуются с приведенными в табл. 1 величинами инкремента плотности Δρ/Δc для декстрана и ПЭГ в ФСБ.
Полученные оценки Rh молекул ПЭГ и декстрана в ФСБ (табл. 1) использовали для изучения взаимодействия этих полимеров с компонентами плазмы.
Отметим, что исследование гидродинамических свойств, в том числе молекулярно-массовых зависимостей, позволяет выявить особенности, которые важны для понимания поведения несовместимой пары полимеров в одном растворителе. Для ПЭГ и декстрана помимо различия в топологии их молекул и взаимодействия “полимер–растворитель” такой особенностью является различие в гидродинамической плотности макромолекул, обусловленной их структурой и занимаемым ими объеме в растворе.
Формирование ДПС в плазме и ее оптимизация для выделения ВНВ. Как следует из табл. 1, образцы ПЭГ и декстран были выбраны в достаточно широком интервале изменения ММ. Примеры фазовых диаграмм для конкретных пар “ПЭГ–декстран” приведены на рис. 8.
Положение бинодали ДПС сильно зависело от температуры и ММ каждого из полимеров системы, тогда как ионная сила заметного влияния на фазовую диаграмму не оказывала. Четкое разделение на две фазы в совместном растворе ПЭГ и декстрана получали, когда концентрационная композиция ДПС соответствовала непосредственно бинодали или лежала выше нее.
Методика подбора наиболее оптимальных условий для выделения везикул со средним гидродинамическим радиусом Rh ~ 50 × 10–7 см из плазмы для каждой пары образцов полимеров, представленных в табл. 1, была следующей: выбирали две композиции ПЭГ–декстран немного выше бинодали, одну на бинодали и две ниже бинодали, опираясь на фазовые диаграммы, полученные в воде (рис. 8). Плазму перед добавлением в нее смеси сухих полимеров очищали от клеточного детрита, крупных везикул и белковых конгломератов путем поэтапного центрифугирования (300 g/10' – 1000g/10' – 2500 g/10'), которое традиционно проводится перед выделением ВНВ любым другим методом [5–7, 11]. Затем декстран и ПЭГ растворяли в плазме в течение одного часа при 277 К при периодическом перемешивании. Эффективность выделения ВНВ оценивали путем анализа распределения частиц по размерам в составе нижней фазы после однократного применения ДПС, поскольку именно в нижней фазе было установлено наличие везикул. Для каждой из систем, представленных в табл. 2, проводили анализ распределения частиц через час после добавления полимеров в плазму при нескольких концентрациях вблизи фазовой кривой. Распределения по размерам частиц в нижней фазе изучали методом АТН. Критерием служило сопоставление с унимодальным распределением ВНВ, которые выделяются из плазмы крови двойным ультрацентрифугированием при 110 000 g, поскольку такой способ – “стандарт” для выделения ВНВ из плазмы крови [11].
Таблица 2.
Состав исследованных ДПС
| ПЭГ-1 | ПЭГ-2 | ПЭГ-3 | ПЭГ-5 | ПЭГ-6 | |
|---|---|---|---|---|---|
| Декстран-1 | 1 (7.5:10)*, 2 (8:6), 3 (13:7.5), 4 (19:1), 5 (11.6:5) |
6 (15:3.4), 7 (10:4), 8 (8.5:5.6), 9 (3.5:7.6), 10 (3.5:10) |
11 (15:2.5),
12 (10:2.5),
13 (7.5:5),
14 (5:6), 15 (7:9) |
16 (12.5:1), 17 (12.5:2.2), 18 (6:5.5), 19 (2.5:7), 20 (2.7:10) |
21 (12.5:1.3),
22 (8.5:1.5),
23 (5.9:3.8),
24 (2.8:5), 25 (1.1:9) |
| Декстран-2 | 26 (12.5:1), 27 (15:2.5), 28 (7.5:4.5), 29 (3:5), 30 (3:8) |
31 (9:2), 32 (12.5:2.5), 33 (6:4), 34 (2.5:5.5), 35 (2.5:7) |
36 (10:1.6),
37 (12.5:2),
38 (5:4), 39 (2:5), 40 (1:8) |
41 (2:5), 42 (2:2.5), 43 (5:2.5), 44 (10:1), 45 (14:1.8) |
46 (12:0.9), 47 (7:0.8), 48 (4:2), 49 (0.8:2.8), 50 (0.8:5) |
| Декстран-3 | 51 (14:2), 52 (10:3), 53 (7.5:4.6), 54 (2.5:4.9), 55 (1.2:8) |
56 (2:6), 57 (4:4), 58 (2:4), 59 (4:2.5), 60 (14:2) |
61 (10:1.4),
62 (27.5:2.5),
63 (3.8:4.7),
64 (1:5), 65 (1:9) |
66 (3.5:1), 67 (3.5:3.5), 68 (1.5:5), 69 (7.5:2), 70 (1:3.5) |
71 (3:1.5), 72 (4.4:2), 73 (2:3), 74 (0.8:3.5), 75 (0.8:4.7) |
Было установлено, что ДПС, позволяющие получать фракцию частиц с размерными характеристиками, наиболее приближенными к “стандарту” (рис. 9), соответствуют массовым соотношениям ПЭГ:декстран, относящимся к области вблизи бинодали, но лежащей ниже нее. В таких условиях четкого разделения на две фазы в плазме не происходит: оба полимера, растворяясь в плазме при перемешивании и взаимодействуя с ее компонентами, перемещаются в верхнюю часть раствора (верхняя фаза), а тяжелые везикулы концентрируются в нижней фазе системы “плазма–ДПС” для высокомолекулярных образцов. Чем выше была ММ полимеров ДПС, тем при более низких их концентрациях происходило выделение ВНВ.
Рис. 9.
Распределения частиц по размерам в нижней фазе системы “плазма–ДПС” для ДПС с номерами 66 (1), 59 (2), 60 (3) (табл. 2) , полученные методом АТН, и для везикул, выделенных из плазмы ультрацентрифугированием при 110 000 g (4).
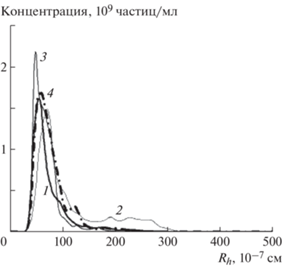
ДПС-66 (табл. 2), составленная из декстрана с Мw = 470 × 103 г/моль и ПЭГ с Мw = 19.4 × 103 г/моль при массовом процентном соотношении декстран:ПЭГ = 3.5:1 была отобрана как оптимальная. Основной причиной выделения ДПС-66 среди других было то, что она позволяла получать унимодальные распределения везикул, соответствующие “стандарту”, и высокие концентрации ВНВ нужных размеров, также близкие к “стандарту” и даже выше. Кроме того, в сравнении, например, с ДПС-60 (рис. 9) она требовала минимального количества полимеров для достижения цели. ДПС-66 использовали для анализа взаимодействия полимеров ДПС с компонентами плазы.
В процессе оптимизации ДПС выявили зависимость размера выделяемых везикул от соотношения гидродинамических объемов молекул полимеров ДПС. Значение гидродинамического объема оценивали как Vh = (4/3)$\pi R_{h}^{3}$. Для оптимальной системы ДПС-66 и близких к ней по качеству систем для выделения ВНВ со средним гидродинамическим радиусом Rh ~ 50 × 10–7 см отношение (Vhдек/VhПЭГ) = 24 ± 4. Характерной особенностью ДПС при таком соотношении гидродинамических объемов молекул декстрана и ПЭГ было то, что получаемые распределения частиц в нижней фазе системы “ДПС–плазма” соответствовали унимодальным фракциям частиц аналогично тому, как это показано на рис. 9 для ДПС-66.
Механизм взаимодействия ДПС с компонентами плазмы исследовали с помощью модельных систем методом ДРС в растворах в ФСБ. В качестве модельного белка плазмы был взят альбумин, так как доля альбуминов от общего числа белков в плазме составляет 60%, т.е. альбумин – типичный белок плазмы крови. Использовали бычий сывороточный альбумин (БСА). Схема проведения эксперимента следующая: смешивали заранее приготовленные растворы ПЭГ 4.6% и БСА 10.4% в ФСБ и фиксировали распределения частиц как результат их взаимодействия. Это исследование показывает возрастание доли частиц с размером, превышающим молекулярный размер БСА и ПЭГ при повышении концентрации ПЭГ в совместном растворе, и однозначно свидетельствует о комплексообразовании между компонентами (рис. 10). Наличие подобного комплексообразования между ПЭГ и белками хорошо известно [35, 36]. Декстран в отличие от ПЭГ не проявил склонности к комплексообразованию с БСА.
Рис. 10.
Нормированные распределения частиц по размерам в растворе модельной системы “ПЭГ-5–БСА” при последовательном увеличении концентрации полимера 0.46 (а), 1.38 (б), 2.3 мас. %(в) и постоянной концентрации альбумина (БСА) 5.2 мас. %.

Изучение взаимодействия ПЭГ с ВНВ (рис. 11а), а также декстрана с ВНВ (рис. 11б) по аналогичной модельной схеме показало отсутствие комплексообразования между ВНВ и полимерами, о чем свидетельствовало сохранение размеров частиц в совместном растворе.
Рис. 11.
Распределения частиц по размерам в растворах исходных компонентов и их смесей в ФСБ при 298 К: а – смесь ПЭГ-5 и ВНВ, б – смесь декстрана-3 и ВНВ. Распределения получены при угле рассеяния 90°.
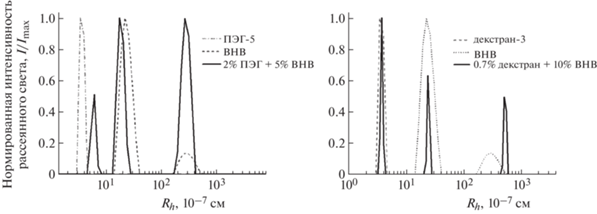
Таким образом, на модельных системах установлена инертность полимеров используемой ДПС к ВНВ и показано отсутствие взаимодействия между декстраном и белками плазмы, а также наличие комплексообразования между белками плазмы и ПЭГ. Этот результат позволил прийти к общему выводу о возможности использования ДПС “ПЭГ–декстран” для эффективного выделения внеклеточных везикул со средним гидродинамическим радиусом Rh = 50 × 10–7 см. Наличие везикул в нижней фазе системы “плазма–ДПС” было подтверждено методом крио-ПЭМ (рис. 12).
ЗАКЛЮЧЕНИЕ
Предложен надежный и относительно недорогой метод выделения внеклеточных нановезикул из плазмы крови с использованием двойной полимерной системы “ПЭГ–декстран”. Высокая концентрация выделяемых этим методом ВНВ обусловлена разделением компонентов плазмы за счет использования неравновесных условий близости к бинодали ДПС, инертностью везикул к обоим полимерам, а также эффективным связыванием белковых компонентов плазмы только с одним из полимеров ДПС – ПЭГ. Оптимальной для выделения ВНВ оказалась ДПС, состоящая из декстрана-3 с ММ 470 × 103 г/моль и ПЭГ-5 с ММ 17 × 103 г/моль (табл. 1) при их массовом процентном соотношении 3.5:1. При такой концентрации полимеров состав данной ДПС относится к области, лежащей ниже бинодали eе фазовой диаграммы. Средний гидродинамический радиус Rh выделяемых с использованием данной ДПС нановезикул составляет 50 × 10–7 см. Это частицы гораздо более крупного размера, чем молекулы ПЭГ и декстрана (табл. 1). Увеличением содержания декстрана в составе оптимальной ДПС можно смещать максимум распределения в сторону уменьшения средних размеров ВНВ аналогично тому, как это показано на рис. 11. Однако определяющее влияние на средний размер и ширину распределения выделяемых ВНВ, как показал эксперимент, оказывает соотношение гидродинамических объемов молекул декстрана и ПЭГ в плазме, а значит, молекулярная масса полимеров. Двукратное применение оптимальной ДПС для выделения везикул из 1 см3 плазмы позволяет добиться практически полного отсутствия белков в нижней фазе системы “плазма–ДПС” и содержания в ней ВНВ ~2 × 1011 частиц/мл (по данным АТН). Такую концентрацию можно считать высокой в сравнении со стандартом выделения ВНВ методом двойного ультрацентрифугирования при 110 000 g, в процессе которого часть везикул теряется из-за разрушения их липидных оболочек [11]. Количества ВНВ, которое можно выделить с помощью ДПС “ПЭГ–декстран” из 1 см3 плазмы, достаточно для дальнейшего анализа состава их поверхностных белков, что было продемонстрировано в [37].
М.А. Слюсаренко выражает благодарность сотруднице НМИЦ онкологии им. Петрова Е.Л. Зейдиной за рекомендации и полезные советы.
Работа выполнена при поддержке “Центра развития молекулярных и клеточных технологий”, где были получены микрофотографии методом крио-ПЭМ, и “Центра диагностики функциональных материалов для медицины, фармакологии и наноэлектроники”, на оборудовании которого были выполнены исследования методами статического, динамического рассеяния света и денситометрии, Санкт-Петербургского государственного университета.
Список литературы
Albertsson P.A. // Biochem. Pharmacol. 1961. V. 5. P. 351. https://doi.org/10.1016/0006-2952(61)90028-4
Platis D., Labrou N.E. // Biotechnol. J. 2009. V. 4 (9). P. 1320. https://doi.org/10.1002/biot.200800359
Andrews B.A., Huang R.B., Asenjo J.A. // Bioseparation. 1995. V. 5 (2). P. 105. PMID: 7772946
Asenjo J.A., Andrews B.A. // J. Chromatogr. A. 2012. V. 1238. P. 1.https://doi.org/10.1016/j.chroma.2012.03.049
Yáñez-Mó M., Siljander P.R.-M., Andreu Z. et al. // J. Extracell. Vesicles. 2015. V. 4. P. 27066. https://doi.org/10.3402/jev.v4.27066
Doyle L.M., Wang M.Z. // Cells. 2019. V. 8 (7) P. 727. https://doi.org/10.3390/cells8070727
Bebelman M.P., Smit M.J., Pegtel D.M. et al. // Pharmacol. Ther. 2018. V. 188. P. 1. https://doi.org/10.1016/j.pharmthera.2018.02.013
Abels E.R., Breakefield X.O. // Cell. Mol. Neurobiol. 2016. V. 36 (3). P. 301. https://doi.org/10.1007/s10571-016-0366-z
Chernyshev V.S., Chuprov-Netochin R.N., Tsydenzhapova E. et al. // J. Extracell. Vesicles. 2022. V. 11 (8). e12256. https://doi.org/10.1002/jev2.12256
Visan K.S., Lobb R.J., Ham S. et al. // J. Extracell. Vesicles. 2022. V. 11 (8). e12266. https://doi.org/10.1002/jev2.12266
Yang D., Zhang W., Zhang H. et al. // Theranostics. 2020 V. 10 (8). P. 3684. https://doi.org/10.7150/thno.41580
Johansson H.O., Persson J., Tjerneld F. // Biotechnol. Bioeng. 1999. V. 66 (4). P. 247.https://doi.org/10.1002/(SICI)1097-0290(1999)66:4<247: :AID-BIT6>3.0.CO;2-5
Andrews B.A., Schmidt A.S., Asenjo J.A. // Biotechnol. Bioeng. 2005. V. 90 (3). P. 380. https://doi.org/10.1002/bit.20495
Jadhav S.B., Singhal R.S. // Carbohydrate Polymers. 2012. V. 90 (4). P. 1811. https://doi.org/10.1016/j.carbpol.2012.07.078
Schärtl W. Light scattering from polymer solutions and nanoparticle dispersions. Berlin-Heidelberg: Springer, 2007. 191 p. https://doi.org/10.1007/978-3-540-71951-9
Chu B. Laser Light Scattering: Basic Principles and Practice, 2nd Ed. New York: Academic Press, 1991. 343 p.
Fedosov I.V., Nefedov I.S., Khlebtsov B.N. et al. // Opt. Spectrosc. 2009. V. 107. Art. 846.https://doi.org/10.1134/S0030400X09120030
DYNALS software. https://www.photocor.ru/products/dynals
Nanosight NTA 3.2 Software. https://www.malvernpanalytical.com/en/assets/NanoSight-NTA32-SUN-Software
Kulicke W.M., Clasen C. Viscosimetry of Polymers and Polyelectrolytes. Springer Laboratory Series. Berlin, Heidelberg: Springer, 2004. 120 p.https://doi.org/10.1007/978-3-662-10796-6_9
Armstrong J.K., Wenby R.B., Meiselman H.J. et al. // Biophys. J. 2004. V. 87 (6). P. 4259. https://doi.org/10.1529/biophysj.104.047746
Burchard W. // Adv. Colloid Interface Sci. 1996. V. 64. P. 45.https://doi.org/10.1016/0001-8686(95)00274-X
de Belder A.N. Dextran - handbook: Physical-chemical properties. Uppsala: Amersham Biosciences, 2003. 64 p. https://www.dextran.com/
Seiffert S. Physical Chemistry of Polymers: A Conceptual Introduction, Berlin; Boston: De Gruyter, 2020. 215p.https://doi.org/10.1515/9783110672817
Gray H.B., Bloomfield V.A., Hearst J.E. // J. Chem. Phys. 1967. V. 46 (4). P. 1493.https://doi.org/10.1063/1.1840879
Huber A. // J. Appl. Polym. Sci. Appl. Polym. Symp. 1991. V. 48. P. 95. https://doi.org/10.1002/APP.1991.070480009
Pavlov G.M., Korneeva E.V., Yevlampieva N.P. // Intern. J. Biol. Macromol. 1994. V. 16 (6). P. 318. https://doi.org/10.1016/0141-8130(94)90063-9
Pavlov G.M., Grishchenko A.E., Rjumtsev E.I., Yevlampieva N.P. // Carbohydrate Polymers 1999. V. 38 P. 267. https://doi.org/10.1016/S0144-8617(98)00101-5
Цветков В.Н. Жесткоцепные полимерные молекулы. Л.: Наука, 1986, 378 с.
Grube M., Cinar G., Schubert U.S., Nischang I. // Polymers. 2020. V. 12. 277. https://doi.org/10.3390/polym12020277
Shpyrkov A.A., Tarasenko I.I. Pankova G.A. et al. // Polym. Sci. A. 2009. V. 51 (3). P. 250. https://doi.org/10.1134/S0965545X09030031
Pavlov G.M., Koreeva E.V., Harding S.E. et al. // Carbohydrate Polymers. 1999. V. 38 (4). P. 195.
Pavlov G.M. // Eur. Phys. J. E. 2007. V. 22. P. 171. https://doi.org/10.1140/epje/e2007-00025-x
Pavlov G.M., Okatova O.V., Gubarev A.S. et al. // Polym. Sci. A. 2015. V. 57 (3). P. 115. https://doi.org/10.1134/S0965545X15020133
Bekale L., Agudelo D., Tajmir-Riahi H.A. // Colloids and Surfaces B: Biointerfaces. 2015. V. 130. P. 141.https://doi.org/10.1016/j.colsurfb.2015.03.045
Ragi C., Sedaghat-Herati M.R., Ouameur A.A. et al. // Biopolymers. 2005. V. 78 (5). P. 231. https://doi.org/10.1002/bip.20281
Slyusarenko M., Shalaev S., Valitova A. et al. // Biosensors. 2022. V. 12 (1). 23. https://doi.org/10.3390/bios12010023
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии