Нефтехимия, 2020, T. 60, № 3, стр. 401-409
Влияние криогенных условий измельчения молибденита на активность массивных сульфидных катализаторов гидроочистки
Е. В. Микубаева 1, А. С. Акимов 1, С. П. Журавков 2, Н. В. Сизова 1, А. В. Восмериков 1, И. П. Просвирин 3, В. И. Зайковский 3, М. А. Уймин 4, В. В. Майков 4, К. Н. Лисовая 1, Т. А. Федущак 1, *
1 Институт химии нефти СО РАН
634055 Томск, Россия
2 Национальный исследовательский Томский политехнический университет
634050 Томск, Россия
3 Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, Россия
4 Институт физики металлов им. М.Н. Михеева УрО РАН
620108 Екатеринбург, Россия
* E-mail: taina@ipc.tsc.ru
Поступила в редакцию 14.10.2019
После доработки 16.11.2019
Принята к публикации 18.11.2019
Аннотация
Впервые выполнено измельчение молибденита в криогенных условиях в среде аргона, исследованы физико-химические свойства образцов, их каталитическая активность в модельных реакциях гидродесульфирования дибензотиофена, компонентов дизельной фракции, а также инициирующая способность в реакции окисления изопропилбензола. Обнаружена их высокая каталитическая способность.
В области гидроочистки нефтяных топливных фракций все более востребованы массивные сульфидные катализаторы. Это катализаторы без носителя. Для них возможно свободное варьирование концентрацией активного компонента. Такого рода системы приобретают все большую значимость в связи с утяжелением нефтяного сырья и возникающими ограничениями на использование каталитических систем с активным компонентом, нанесенным на пористый носитель.
Массивные катализаторы можно получать твердофазным способом при механохимическом воздействии мелющих тел на смесь порошков Ni (40 мкм), W (44 мкм), Мо (74 мкм), Al (44 мкм). Номинальный состав композита соответствует соотношению (Ni50Mo25W25)50Al50 мол. % [1].
Ni–W–Mo-оксидные каталитические прекурсоры можно получать механохимической активацией солей предшественников, таких как Ni-гидроксикарбонат nNi(OH)2 · mNiCO3, парамолибдат аммония (NH4)6Mo7O24 · 4H2O, метавольфрамат аммония (NH4)6H2W12O40. Выделяющаяся кристаллизационная вода участвует в реакции, облегчая ее протекание [2].
Некоторые исследователи отдают предпочтение высокотемпературному разложению тетратиомолибдата аммония (NH4)2MoS4. Для полученного MoS2 необходима дополнительная стадия механического измельчения в среде органических растворителей [3]. Этот метод не требует выполнения стадии активирования с использованием токсичного сероводорода, по сравнению с вышеупомянутыми подходами [1, 2]. Для таких катализаторов на примере модельных реакций гидрирования, изомеризации алкенов и обмена дейтерия было установлено наличие корреляции между активностью MoS2 и степенью дефектности наноразмерных пластинчатых кристаллов молибдендисульфида, объединенных в пакеты [3].
Остается интересным прямой твердофазный способ получения массивных сульфидных каталитических систем в одну стадию, посредством механического измельчения очищенного молибденита (коммерческий продукт). Приготовление катализатора осуществляется в планетарных мельницах при высоких значениях ускорений мелющих тел (300–500 м/с2) в среде органических растворителей, например, бутанола [4]. Образующиеся MoS2-нанокристаллиты характеризуются площадью удельной поверхности 81 м2/г, высокой дефектностью и каталитической активностью в модельной реакции гидрогенолиза дибензотиофена (ДБТ) и гидродесульфирования нативного нефтяного сырья. Недостатком является зауглероживание катализатора уже после первого цикла его использования.
Молибдендисульфид является представителем дихалькогенидов переходных металлов слоистой структуры. Для исследователей представляет определенный интерес задействовать его межслоевое пространство посредством интеркаляции реактантами. Ранее измельчение молибденита было осуществлено в вертикальной вибрационной мельнице в инертной газовой среде в присутствии микроколичеств полярных и неполярных жидкостей, причем, при малых значениях ускорений (~5 м/с2) мелющих тел [5]. В использованных условиях сдвиговые деформации преобладали над ударными. Методом термического анализа, совмещенного с микрокалориметрией и масс-спектральной регистрацией летучих продуктов, было обнаружено, что эвакуация воды и метанола из полученных нанокристаллитных образцов происходит при температурах на 100–120°С выше их температур кипения. Причина обусловлена интеркаляцией растворителей в межслоевое пространство кристаллитов. При этом метанол-содержащий образец характеризовался высоким уровнем гидродесульфирующей способности в модельной реакции. Однако, несмотря на то, что его размерным прекурсором был молибденит (крупнодисперсный MoS2), для СН3ОН-содержащего MoS2-катализатора неожиданно потребовалась дополнительная стадия его активирования с привлечением сероводорода, как и для традиционных солевых или оксидных предшественников [1, 2].
Публикаций, посвященных специфике измельчения в крио-условиях, не так много [6]. Ранее была показана эффективность сочетания механохимической активации (МА) и низких температур (80 К) на примере измельчения гематита [7], когда процесс крио-измельчения реализуется в высокоскоростных дезинтеграторах-активаторах.
Предметом данного исследования являлось получение массивных сульфидных катализаторов механоактивацией молибденита в криогенных условиях в среде аргона, а также исследование их структурных особенностей, физико-химических свойств поверхности и каталитической активности.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Крио-катализаторы были приготовлены механическим измельчением крупнодисперсного коммерческого порошка дисульфида молибдена MoS2 (ДМИ-7) в течение 7 ч в вертикальной вибрационной мельнице в криогенных условиях (77 К) в среде аргона. Физико-химические характеристики крио-образцов были изучены методами рентгенофазового анализа (РФА; дифрактометр D8-Discovery, Bruker, Germany), рентгеновской фотоэлектронной спектроскопии (РФЭС, фотоэлектронный спектрометр SPECS с использованием AlKα-излучения), седиментационного анализа (СА; дисковая центрифуга DC24000, CPS Instruments, USA), просвечивающей электронной микроскопии (ПЭМ, JEM-2010, JEOL Ltd., Япония), температурно-программированного восстановления (ТПВ, хемосорбционный анализатор “Хемосорб”, НЕОСИБ, Россия).
Активность крио-катализаторов оценивали в модельной реакции гидродесульфирования дибензотиофена и гидрогенолиза компонентов смесевой дизельной фракции (ДФ; 90% прямогонной ДФ + 10% ДФ стадии каткрекинга; содержание серы 2.08%; плотность 0.8574 г/см3; суммарное содержание моно-, ди-, три- и полиароматических соединений составило 49.9%). Эксперименты по испытанию каталитической активности проводили с использованием автоклава Autoclave Engineers Bolted Closure (США), объем реактора 100 мл, объем гексадекана в нем 80 мл, давление 3.0–3.4 МПа, температура 280–340°С. Вес образца катализатора составлял 0.64 г, дибензотиофена 0.17 г (мольное отношение катализатор : ДБТ = 1 : 0.23), в пересчете на содержание серы Sисх = 500 ppm. Предварительное активирование катализатора проводили в среде водорода или cмеси водорода с сероводородом (9 : 1) при давлении 3.4 МПа и температуре 340°C. Анализ гидрогенизатов на содержание остаточной серы (Sост) выполнен методом рентгенофлуоресцентного анализа (Спектроскан SW-D3).
Эксперименты на цикличное использование катализатора (1–3 цикла) выполнены без извлечения каталитического образца из реактора, но с добавлением новой порции раствора ДБТ в гексадекане (Sисх = 500 ppm). Химический состав гидродесульфуризатов определен методом хромато-масс-спектрометрии (магнитный хромато-масс-спектрометр DFS, ThermoScientific, Германия).
Химическое тестирование поверхности крио-MoS2-катализатора на наличие активных центров инициирующей природы выполняли с использованием модельной реакции окисления изопропилбензола (микрокалориметр МКДП-2, Россия). В качестве инициатора сравнения использовали азобисизобутиронитрил (АИБН).
Изложение и обсуждение экспериментальных результатов выполнено при сопоставлении данных для двух образцов: крио-образца крио-МoS2 и метанол-содержащего образца МoS2 + + 100СH3OH(8), полученного при допировании 100 мкл метанола в пространство мельницы при времени МА 8 ч.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Известное повышение хрупкости механически измельчаемых в криогенных условиях веществ и материалов позволяет превращать твердые тела в высокодисперсные порошки. Сведения о получении порошковых катализаторов из молибденита в среде аргона при 77 К в литературных источниках отсутствуют.
На рис. 1 приведены седиментационные кривые для образца крио-МoS2, полученного при измельчении в аргоне при 77 К, а также для метанол-содержащего катализатора (образцы № 4 и № 3; табл. 1). Последний был получен нами ранее и описан в работе [5]. Как и следовало ожидать, в отличие от образца с метанольным допантом, крио-катализатор характеризуется более высокой дисперсностью, что согласуется с литературными данными [7]. Седиментационное распределение его частиц соответствует наноразмерным фракциям 14–21 и 21–60 нм в количествах 37 и 63% соответственно. Для метанолсодержащего катализатора, МoS2 + 100СH3OH(8) характерна асимметричная куполообразная седиментационная кривая с максимумом распределения частиц 139 нм. Фракция с размером частиц до 139 нм присутствует в количестве 21%. При этом 79% этого порошка приходится на частицы с дисперсностью сравнительно широкого размерного диапазона: от 139 до 1000 нм.
Рис. 1.
Седиментационные кривые: (a) крио-МoS2; (б) метанолсодержащий катализатор МoS2 + 100СH3OH(8).

Таблица 1.
Структурные параметры катализаторов
| № п/п | Катализаторы | Дисперсность L, нм (ОКР) | Межплоскостное расстояние, D002, Å | Микронапряжение, Δd/d × 103 | c/a |
|---|---|---|---|---|---|
| 1 | *МoS2 ДМИ-7 | 50 | 6.15 | 2.1 | 3.888 |
| 2 | **МoS2(8) | 12 | 6.20 | 8.8 | 3.954 |
| 3 | МoS2 + 100СH3OH(8) | 25 | 6.19 | 2.3 | 3.912 |
| 4 | Крио-МoS2 | 32 | 6.16 | 2.1 | 3.903 |
Результаты обработки профилей дифракционных рефлексов, полученных методом РФА, приведены в табл. 1.
Как следует из данных табл. 1, после механообработки молибденита (МoS2; образец № 1; табл. 1; время МА = 8 ч), для образца № 2 наблюдается повышение дисперсности в 4.2 раза (L; табл. 1), некоторое возрастание межплоскостных расстояний (D002; от 6.15 до 6.20 Å) и четырехкратное усиление микронапряжений в кристаллитах (Δd/d × 103 = 8.8).
По сравнению с исходным молибденитом и образцом МoS2(8) структурные изменения для других катализаторов (МoS2+100СH3OH(8), крио-МoS2) незначительны. Двукратное возрастание дисперсности установлено для образца МoS2 + 100СH3OH(8), но еще меньшее для катализатора крио-МoS2 (в 1.6 раза). Межплоскостные расстояния для образца крио-МoS2 мало отличаются от исходного молибденита и нанокристаллов МoS2 +100СH3OH(8) в ряду значений 6.16, 6.15 и 6.19 Å соответственно. Результаты дифракционного анализа для образца крио-МoS2 согласуются с выводами авторов работы [5] относительно “бездефектных” порошков, получаемых в условиях крио-измельчения.
В соответствии с электронными микрофотографиями, приведенными на рис. 2, кристаллиты крио-МoS2 сохраняют слоистую структуру и представляют собой совокупность частиц размерами свыше 100 нм (рис. 2б). При этом сами частицы состоят из наноразмерных пластинок с базальными гранями 10–100 нм (рис. 2а). Крио-образец отличается от образца сравнения № 3 (табл. 1) более высоким уровнем разупорядоченности единичных пластинчатых кристаллов в пачечных структурах.
Рис. 2.
Электронные микрофотографии для образца крио-МoS2 с размером граней 10–100 нм (а) и свыше 100 нм (б).

На рис. 3 приведены рентгеновские фотоэлектронные спектры регионов S2s + Mo3d и S2p образцов крио-МoS2. В спектре региона Mo3d образца крио-МoS2 (рис. 3а) значение энергии связи основного пика молибдена (Mo3d5/2) составляет 229.3 эВ. Такое значение энергии связи характерно для молибдена в сульфидном окружении, в частности в соединении MoS2 [8, 9], в данном случае формальное состояние молибдена Mo4+. Со стороны бóльших значений энергии связи (~236 эВ) в спектре региона Mo3d наблюдается плечо, которое свидетельствует, что часть молибдена находится в окисленном состоянии. Плечо со стороны меньших значений энергии связи (226.6 эВ) принадлежит сере (уровень S2s). Соотношение оксидной и сульфидной форм молибдена приведено в табл. 2.
Таблица 2.
Соотношение атомных концентраций элементов в образцах крио-МoS2 и МoS2 + 100СH3OH(8) в соответствии с результатами РФЭС
| Образец | S/Mo | ${{{\text{SO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{SO}}_{4}^{{2 - }}} {{{{\text{S}}}^{{2 - }}}}}} \right. \kern-0em} {{{{\text{S}}}^{{2 - }}}}}$ | Mo6+/Mo4+ |
|---|---|---|---|
| Крио-MoS2 | 2.1 | 0.17 | 0.20 |
| МоS2 + 100СН3ОН(8) | 2.1 | 0.61 | 0.69 |
В спектре региона S2p для крио-образца наблюдается интенсивный пик со значением энергии связи 162.4 эВ (рис. 3б), что характерно для сульфидов (сера находится в состоянии S2–). Кроме того, присутствует еще один, достаточно интенсивный пик со стороны бóльших значений энергии связи (169.2 эВ). Это значение характерно для серы, связанной с кислородом, например, в виде сульфат-ионов (${\text{SO}}_{4}^{{ - 2}}$) или S–О-мостиковых структур [10]. Соотношение сульфатной и сульфидной форм серы (${{{\text{SO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{SO}}_{4}^{{2 - }}} {{{{\text{S}}}^{{2 - }}}}}} \right. \kern-0em} {{{{\text{S}}}^{{2 - }}}}}$) для данного образца соответствует 0.17 (табл. 2).
Для метанол-содержащего катализатора, в отличие от образца крио-МoS2, в спектре региона Mo3d (рис. 4а) наблюдается также небольшой пик с энергией связи 231.4 эВ, характерный для Мо5+, а в спектре региона S2p (рис. 4б) – малоинтенсивный пик со значением энергии связи 163.2 эВ, соответствующий сере в состоянии ${\text{S}}_{2}^{{2 - }}$ [5].
Рис. 4.
Фотоэлектронные спектры регионов S2s + Mo3d (а) и S2p (б) для метанол-содержащего образца [5].

Согласно данным, приведенным в табл. 2, для “метанольного” образца МoS2 + 100СH3OH(8) соотношение сульфатной и сульфидной форм серы (${{{\text{SO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{SO}}_{4}^{{2 - }}} {{{{\text{S}}}^{{2 - }}}}}} \right. \kern-0em} {{{{\text{S}}}^{{2 - }}}}}$) на поверхности в 3.6 раз больше, чем для крио-образца. Для окисленных состояний молибдена (Mo6+/Mo4+) характерна аналогичная тенденция (выше в 3.5 раз). При этом различия в условиях измельчения молибденита в обоих случаях не отражаются на величине соотношения S/Mo : 2.1.
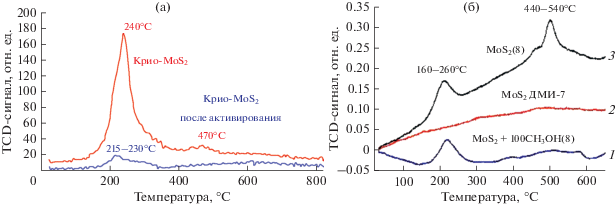
На рис. 5 приведены спектры ТПВ исследуемых образцов. В соответствии с данными, приведенными на рис. 4, их восстановление (катализаторы №№ 1–4, табл. 1), за исключением молибденита (образец № 1, табл. 1; кривая 2, рис. 5б), происходит в две стадии: при 240°С и в области 470–500°С (восстановление МоО3) [11]. В соответствии с литературными данными [12], в низкотемпературной области (до 260°С) при восстановлении водородом образуются координационно ненасыщенные центры, которые являются “активными центрами катализаторов гидроочистки”. После активирования крио-образца посредством выдерживания его в атмосфере водорода в ТПВ-спектре, вместо изначально интенсивного пика при 240°С, регистрируется слабо выраженный широкий пик (рис. 5а).
Рис. 5.
Термопрограммированное восстановление образцов крио-MoS2(7) (а) и образцов, полученных в инертной среде аргона (б).
В табл. 3 представлены результаты тестирования катализаторов в модельной реакции гидродесульфирования ДБТ. Из представленных в табл. 3 данных, следует, что в отличие от метанол-содержащего катализатора МоS2 + 100СН3ОН(8) образец крио-MoS2 не требует активирования в среде сероводорода. Достаточно его выдерживание в среде водорода, т.к. остаточная сера в соответствующем гидрогенизате не обнаруживается. В то же время для “метанольного” катализатора гидродесульфирование в аналогичных условиях не протекает на должном уровне (Sост = 150 ppm).
Таблица 3.
Результаты тестирования катализаторов в модельной реакции гидродесульфирования дибензотиофена (340°С, 3.4 МПа)
| Катализатор | Среда активирования | Sост, ppm | *Состав продуктов реакции, мас. % | |||
|---|---|---|---|---|---|---|
| БФ | ЦГБ | ТГДБТ | БЦГ | |||
| MoS2(8) | Н2 + Н2S | 105 | 54.0 | 45.0 | 1.0 | Нет |
| МоS2 + 100СН3ОН(8) | Н2 | 150 | – | – | – | – |
| Н2 + Н2S | 3 | 43.0 | 57.0 | Нет | Нет | |
| Крио-MoS2 | Н2 | 0 | 60.95 | 35.25 | Нет | 3.80 |
| Н2 + Н2S | 20 | – | – | – | – | |
Хорошо известно, что соотношение БФ и ЦГБ в продуктах реакции позволяет судить о маршрутах протекания реакции гидродесульфирования ДБТ (рис. 6). Известно, что БФ образуется в результате крекинга C–S-связи в ДБТ, а ЦГБ – при гидрировании ДБТ или бифенила [1]. Следовательно, оба исследованных катализатора обладают и крекирующей и гидрирующей активностью. Однако, содержание в продуктах реакции некоторого количества БЦГ (3.80%) позволяет предположить пролонгированный вклад гидрирующей способности катализатора крио-MoS2 по сравнению с образцом МоS2 + 100СН3ОН(8).
Как следует из данных табл. 3 и 4, крио-катализатор способен не только эффективно катализировать реакцию гидродесульфирования ДБТ в стандартных условиях модельной реакции – 340°С, 3.4 МПа, причем без использования сероводорода на стадии активирования, но и сохранять способность к полному десульфированию ДБТ в условиях пониженного давления (на 0.4 МПа) и температуры (на 40°С), а также цикличного использования катализатора в 3-х реакционных циклах.
В процессе гидрогенизации разбавленной гексадеканом ДФ (Sисх = 500 ppm) для крио-катализатора, активированного в среде водорода, обнаружена бóльшая гидродесульфирующая способность (Sост = 15 ppm) по сравнению с метанолсодержащим образцом (Sост = 62 ppm, активирование в среде Н2 + Н2S). Этот результат представляет интерес, так как получен на смесевой ДФ с высоким содержанием ароматических углеводородов (до 49%) и при минимальном избытке по водороду 4 : 1 (из литературных источников это соотношение составляет 200–1200 : 1).
Хорошо известно, что многие наноразмерные металлы или их оксиды инициируют радикальные реакции окисления органических соединений [13]. Проведено химическое тестирование поверхности образца крио-MoS2 на наличие активных центров инициирующей природы с привлечением модельной реакции окисления изопропилбензола (ИПБ), которая протекает в присутствии кислорода и стандартного инициатора азобисизобутиронитрила (АИБН) по радикальному механизму. Как следует из данных, приведенных на рис. 7 и в табл. 5, образец крио-MoS2 обладает сравнительно высокой инициирующей способностью.
Таблица 5.
Максимальное тепловыделение и скорость окисления в присутствии АИБН и катализатора крио-MoS2
| Количество Крио-MoS2, мг |
Количество АИБН, мг | Тепловыделение Wмакс × 103, Дж/с |
Скорость окисления wокисл × 106, мол/л с |
|---|---|---|---|
| 2.3 | – | 4.39 | 19.79 |
| – | 2.3 | 1.81 | 8.15 |
Значение максимального тепловыделения (Qмакс) для катализатора крио-MoS2 оказалось в 2.5 раза выше (Wмакс =4.39 × 10–3 Дж/с; табл. 5), чем в присутствии традиционного инициатора радикальных реакций – АИБН (Qмакс = 1.81 × 10–3 Дж/с; табл. 5). Скорость окисления кумола для крио-катализатора (wокисл = 19.79 × 10–6 мол/л с; табл. 5) также в 2.4 раза превышает значение, соответствующее АИБН (wокисл = 8.15 × 10–6 мол/л с).
Приведенные результаты свидетельствуют о присутствии на поверхности образца крио-MoS2 центров, способных активировать молекулу кислорода для последующего генерирования органических радикалов в реакции.
ЗАКЛЮЧЕНИЕ
Впервые показано, что измельчение молибденита в аргоне (77 К) приводит к получению порошков с высокой дисперсностью (<20 нм), характеризующихся низкодефектной структурой. Найдено, что по сравнению с образцом МоS2 + + 100СН3ОН(8), на поверхности крио-нанокристаллитов S–O- и Мо–О-содержащие структуры присутствуют в незначительном количестве. Обнаружено, что катализатор крио-MoS2 обладает способностью полного (Sост = 0 ppm) гидродесульфирования ДБТ в модельной реакции и эффективного гидрообессеривания компонентов ДФ (Sост = 15 ppm). Причем, для активирования крио-катализатора достаточно его выдержать в атмосфере Н2, сульфидирующий агент не требуется. Установлено, что образец крио-MoS2 сохраняет свою активность при снижении стандартной температуры гидродесульфирования ДБТ на 40°C (до 300°C) при одновременном уменьшении давления в реакторе на 0.4 МПа. Каталитическая активность крио-образца сохраняется на первоначальном уровне после трех циклов его использования. Показано, что реакция гидрогенолиза ДБТ протекает по крекирующему и гидрирующему маршрутам. Обнаружено, что катализатор крио-MoS2 способен эффективно инициировать модельную реакцию окисления изопропилбензола.
Список литературы
Huirache-Acuna R., Flores Z.M.I., Albiter M.A., Estrada-Guel I., Ornelas C., Paraguay-Delgado F., Rico J.L., Bejar-Gomez L., Alonso-Nunez G., Martinez-Sanchez R. // AZojomo. 2006. V. 2.
Дуплякин В.К., Лихолобов В.А., Бакланова О.Н., Чиркова О.А., Лавренов А.В., Белый А.С. Патент РФ № 2346742 // Б.И. 2009. № 5.
Polyakov M., Indris S., Schwamborn S., Mazheika A., Poisot M., Kienle L., Bensch W., Muhler M., Grünert W. // J. Catalysis. 2008. № 260. P. 236.
Masato K., Kunio U., Yasunori K., Fumikazu I. // Applied Catalysis A: General. 2004. № 276. P. 241.
Feduschak T., Akimov A., Morozov M., Uymin M., Zaikovskii V., Prosvirin I., Vosmerikov A., Zhuravkov S., Vlasov V., Kogan V. // Comptes Rendus Chimie. 2016. № 19. P. 1315.
Третьяков Ю.Д., Олейников Н.Н., Можаев А.П. Основы криохимической технологии. М.: Высшая школа, 1987. С. 15.
Степанов Е.Г., Котельников Г.Р. // Известия вузов. Химия и химическая технология. 2003. Т. 46. № 9. С. 26.
Yun J.-M., Noh Y.-J., Yeo J.-S., Go Y.-J., Na S.-I., Jeong H.-G., Kim J., Lee S., Kim S.-S., Koo H.Y., Kim T.-W., Kim D.-Y. // J. Materials Chemistry C. 2013. № 1. P. 3777.
Gao D., Si M., Li J., Zhang J., Zhang Z., Yang Z., Xue D. // Nanoscale Research Letters. 2013. № 8. P. 129.
Zhuang S.-X., Yamazak M., Omata K. Takahashi Y., Yamada M. // Applied Catalysis B: Environmental. 2001. № 31. P. 133.
Liu F., Xua S., Chi Y., Xue D. // Catalysis Communications. 2011. № 12. P. 521.
Afanasiev P. // Applied Catalysis A: General. 2006. № 303. P. 110.
Федущак Т.А., Сизова Н.В., Величкина Л.М. // Журн. физической химии. 2009. Т. 83. № 8. С. 1.
Дополнительные материалы отсутствуют.





