Нейрохимия, 2019, T. 36, № 1, стр. 65-70
Метаболизм серотонина и норадреналина в мозге крыс при моделировании комбинированного действия ионизирующих излучений и гипогравитации в наземном эксперименте
В. С. Кохан 1, В. С. Кудрин 1, 2, А. С. Штемберг 1
1 ФГБУН Государственный научный центр РФ Институт медико-биологических проблем РАН
Москва, Россия
2 ФГБУН Научно-исследовательский институт фармакологии им. В.В. Закусова
Москва, Россия
Поступила в редакцию 26.03.2018
После доработки 31.05.2018
Принята к публикации 07.05.2018
Аннотация
Нарушение операторской деятельности космонавтов под действием факторов космического полета является основным лимитирующим фактором межпланетных полетов. Выход за пределы геомагнитного поля чреват существенным повышением радиационной нагрузки. Гипогравитация – еще один фактор космического полета, который оказывает существенное влияние на функции ЦНС. Ранее было установлено, что воздействие ионизирующего излучения и гипогравитации может оказывать разнонаправленные эффекты в отношении функций ЦНС, а при комбинированном воздействии – нейтрализовывать эффекты друг друга. В настоящей работе мы изучили эффекты гипогравитации (в модели антиортостатического вывешивания) и облучения (γ-кванты и 12С+6) на метаболизм серотонина и норадреналина в критических для реализации стресс-индуцированного ответа морфологических структурах мозга аутбредных крыс Long Evans. Комбинированное действие факторов реализовалось в доминировании радиационного фактора, которое заключалось в усилении норадренергической нейромедиаторной передачи в префронтальной коре, а также в ослаблении серотонинергической нейромедиаторной передачи в пределах префронтальной коры и миндалевидного тела. В гипоталамусе изменений отмечено не было. Таким образом, мы не обнаружили характерных для стресс-индуцированного ответа изменений в серотонинергической и норадренергической нейромедиаторной передачи.
ВВЕДЕНИЕ
Перспектива пилотируемых дальних космических миссий и освоение человеком космоса актуализировала исследования, направленные на изучение влияния факторов космического полета (ФКП) на ЦНС. Нарушение операторской деятельности космонавтов под действием ФКП является основным лимитирующим фактором дальних космических миссий [1]. ФКП принято разделять на ионизирующие излучения и нерадиационные факторы: гипо- и гипер-гравитация, гипомагнитное поле, изменение состава газовой среды, изоляция и другие. Выход за пределы геомагнитного поля чреват существенным ростом радиационной нагрузки. При этом, наибольшую опасность несут галактические космические лучи, представленные тяжелыми заряженными частицами (ТЗЧ) высоких энергий [2].
Известно, что первичные эффекты действия ионизирующих излучений на биологические ткани носят стохастический характер. В первую очередь это генотоксический эффект (одно- и двухцепочечные разрывы ДНК, нарушение структуры хроматина, таутомеризация канонических уотсон-криковских пар оснований), свободнорадикальные реакции и оксидантный стресс, изменение химического состава биомолекул вследствие ядерных взаимодействий при столкновении с ТЗЧ и другие [1, 3]. Эффекты гипогравитации более предсказуемы и заключается в перераспределении жидкости в теле, повышении внутричерепного давления, поражении функций вестибулярного аппарата, снижении афферентного потока от костно-мышечного аппарата [1]. Действие гипогравитации носит стрессогенный характер [4].
Ряд работ был посвящен изучению изменений в моноаминергических нейромедиаторных системах мозга под действием как отдельных ФКП, так и их комбинации. Было показано, что комбинированное облучение γ-квантами и 1H+ приводит к немедленному угнетению серотонинергической нейромедиаторной передачи [5]. Примечательно, что по мере роста линейной передачи энергии (ЛПЭ) частиц, эффекты в отношении моноаминергической системы нарастают. Так, облучение 1H+ в пике Брэгга приводит к угнетению норадренергической и серотонинергической нейромедиаторных систем [6]; облучение 12C6+ (1 Гр, 500 МэВ) приводит к значительному усилению этих эффектов [7]. При этом, наиболее чувствительной к ионизирующему излучению морфологической структурой в ряду гиппокампа, стриатума, прилежащего ядра и префронтальной коры, является последняя.
Напротив, антиортостатическое вывешивание (в качестве модели гипогравитации, АнОВ) приводит к активации серотонинергической системы в гипоталамусе, стриатуме и гиппокампе [8, 9], свидетельствуя о стрессогенной природе данного фактора [1].
Наиболее интересные эффекты наблюдаются при комбинированном действии ионизирующего излучения и АнОВ. Существует не так много работ, посвященных исследованию комбинированного влияния ФКП, с которыми можно ознакомиться в обзорных работах [1, 10]. Известно, что ТЗЧ с различным значением Z в комбинации приводят к потенцированию эффектов друг друга [11]. Комбинированное облучение γ-квантами и 1H+ крыс, подвергнутых длительному АнОВ, приводит к немедленной нормализации активности серотонинергической системы, активированной под действием только лишь АнОВ [8, 9]. При этом, отложенные эффекты комбинированного действия в отношении моноаминергической системы ранее не изучались. Известно, что длительное воздействие АнОВ (21 день) и γ-квантов (122 кэВ, 40 мГр) приводит к увеличению содержания биомаркеров окислительного стресса, что увеличивает вероятность повреждения нервной ткани. Примечательно, что этот эффект значительно менее выражен, нежели при воздействии только лишь АнОВ [12].
Целью настоящей работы было исследовать влияние комбинации облучения (γ-кванты и 12С6+) и АнОВ на серотонинергическую и норадренергическую систему в морфологических структурах мозга крысы, критических для реализации стресс-индуцированного ответа ЦНС, в динамике: немедленно после завершения воздействия факторов и спустя 30 дней.
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные. В работе использовали самцов аутбредных крыс линии Long Evans возрастом 2 мес. и массой 160–180 г. Животные имели свободный доступ к еде и воде, и содержались в стандартных условиях вивария при температуре 19–22°С, 55% влажности и световом дне продолжительностью 12 ч.
Для проведения эксперимента были сформированы 2 группы репрезентативных животных: виварийный контроль (K, 13 крыс) и группа, подвергнутая комбинированному действию ионизирующего излучения и антиортостатического вывешивания (RS, 20 крыс).
Антиортостатическое вывешивание. В качестве модели гипогравитации была использована методика антиортостатического вывешивания (фактор S). Животные были подвешены за хвост через специальный бестравматичный захват под углом 30°–40° к горизонтальной поверхности таким образом, чтобы задние конечности не касались дна клетки. Специальное устройство подвеса обеспечивало свободное передвижение животных по клетке, не препятствуя доступу к пище и воде. Крысы располагались в клетках индивидуально. Клетки формировали собой многоярусный стенд, находящийся напротив источника γ-квантов в пределах равномерного потока ионизирующего излучения (±10%). Контрольные животные располагались в той же комнате, но с обратной стороны источника, таким образом, находясь вне зоны облучения. Продолжительность воздействия фактора S составляла 12 сут.
Воздействие ионизирующего излучения. Облучение γ-квантами (661.7 кэВ) было осуществлено с помощью установки GOBO-60 (ГНЦ РФ ИМБП – РАН, г. Химки), содержащей 137Cs-источник с сертифицированной активностью 72 г-экв. Ra.
В ходе однократного суточного сеанса на 6 день эксперимента животные были облучены в поглощенной дозе 3 Гр, находясь непосредственно в стендах для вывешивания. На 12 день от начала эксперимента крысы были сняты со стенда для вывешивания, и голова животных была подвергнута равномерному однократному облучению ионами 12С6+ (450 МэВ) в поглощенной дозе 1.5 Гр (ФГБУ ГНЦ ИФВЭ, г. Протвино). Комбинированное облучение было обозначено как фактор R.
Забор биологического материала. Часть животных из экспериментальной и контрольной групп были умерщвлены через 1 сут, а оставшиеся животные – на 30 сут от завершения моделирования воздействия факторов. Животные были декапитированы, после чего избранные морфологические структуры мозга были препарированы на термоэлектрической охлаждающей поверхности (+2°С) и немедленно заморожены в жидком азоте до момента анализа.
Высокоэффективная жидкостная хроматография. Избранные морфологические структуры, а именно: префронтальную кору (PFC), миндалину (AMY) и гипоталамус (HYP) гомогенизировали при +4°C в стеклянном гомогенизаторе с тефлоновым пестиком. В качестве среды гомогенизации и выделения использовали 0.1 М НСlО4 с добавлением внутреннего стандарта – 3,4-диоксибензиламина – вещества катехоламиновой природы, но не встречающегося в нативной ткани, в концентрации 0.5 нмоль/мл. Образцы гомогенизировали в 20-кратном объеме среды выделения. Пробы центрифугировали при +4°C, 10 000 g, в течение 15 мин. Супернатант использовался в дальнейшем для определения моноаминов и их метаболитов.
Концентрацию моноаминов и их метаболитов определяли с помощью метода высокоэффективной жидкостной хроматографии (ион-парная хроматография) с электрохимической детекцией на хроматографе LC_304T (BAS, США) с инжектором Rheodyne 7125, петля для нанесения образцов – 20 мкл. Изучаемые вещества разделяли на обращеннофазной колонке ReproSil-Pur, ODS-3,4 × 100 мм, 3 мкм (Dr.Majsch GMBH, Германия). Использовали насос PM-80 (BAS, США), скорость элюции подвижной фазы 1 мл/мин при давлении 200 атм. Мобильная фаза – 0.1 M цитратно-фосфатный буфер, содержащий 1.1 ммоль октансульфоновой кислоты, 0.1 ммоль ЭДТА и 9% ацетонитрила (pН 3.0). Измерение проводили с помощью электрохимического детектора LC-4B (BAS, США) на стеклоугольном электроде (+0.85 В) против электрода сравнения Ag/AgCl. Регистрацию образцов проводили с применением аппаратно-программного комплекса Мультихром 1.5 (Амперсенд, Россия).
Для калибровки хроматографа использовали смеси рабочих стандартов определяемых веществ в концентрации 500 пмоль/мл. Величины концентрации моноаминов в опытных образцах рассчитывали методом “внутреннего стандарта”, исходя из отношений площади пиков в стандартной смеси и в образце.
Определяли содержание норадреналина (NA), серотонина (5-HT) и его метаболита – 5-гидроксииндолуксусной кислоты (5-HIAA). После интегрирования площади пиков, абсолютную концентрацию рассчитывали в нмоль на 1 г исследуемой ткани.
Статистическая обработка результатов. Стандартную обработку данных осуществляли с помощью программы Statistica 10 (StatSoft Inc., США). Данные были подвергнуты двухфакторному дисперсионному анализу. Дальнейшему анализу подвергали только те данные, для которых было выявлено статистически значимое факторное влияние (p < 0.05). Апостериорный анализ проводили с помощью критерия Дункана.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Статистически значимое влияние комбинированного действия факторов R и S было отмечено в отношении 5-HIAA (F = 10.5; p = 0.003) и NA (F = 6.3; p = 0.02) в PFC (рис. 1а).
Рис. 1.
Содержание нейромедиаторов и их метаболитов. Данные представлены как среднее + SEM. а – Содержание норадреналина (NA), серотонина (5-HT) и его метаболита 5-оксииндолуксусной кислоты (5-HIAA) в префронтальной коре (PFC), миндалине (AMY) и гипоталамусе (HYP). б – Значение соотношения 5-HIAA/5-HT в PFC, AMY и HYP. K – контрольная группа крыс, RS – группа крыс, подвергнутая воздействию радиационного и гипогравитационного факторов; цифровой индекс (30) указывает на группы животных, исследуемые на 30 день от завершения действия факторов. Звездочкой (*) отмечены статистически значимые отличия внутри временных интервалов тестирования, p < < 0.05 (апостериорный тест Дункана). Квадратами (◼) отмечены статистически значимые отличия между одноименными группами на разных временных интервалах тестирования, p < 0.05 (апостериорный тест Дункана). Точное значение уровня значимости смотрите в тексте.
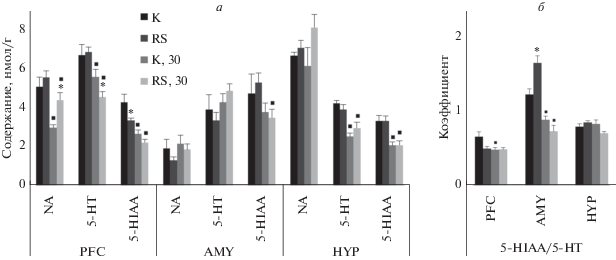
Статистически значимый временной эффект был отмечен в отношении 5-HIAA (F = 7.3; p = 0.01), NA (F = 18.8; p = 0.0002), 5-HT (F = 24.8; p = = 0.00003) в PFC; 5-HIAA (F = 6; p = 0.02) и соотношения 5-HIAA/5-HT (F = 55.5; p = 0) в AMG; 5-HIAA (F = 25.2; p = 0.00002) и 5-HT (F = 22.8; p = 0.00005) в HYP (рис. 1а, 1б).
Статистически значимое взаимодействие временного эффекта и факторов воздействия было зарегистрировано в отношении 5-HIAA (F = 5.6; p = 0.03) в PFC; соотношения 5-HIAA/5-HT (F = = 11.8; p = 0.002) в AMG; 5-HIAA (F = 7.7; p = = 0.009) в HYP (рис. 1а, 1б).
В PFC были отмечены следующие нейрохимические сдвиги: содержание NA в группе RS-30 было больше на 48% (p = 0.01) в сравнении с группой K-30, при этом в группах K-30 и RS-30 содержание NA синхронно снижалось на 42% (p = 0.007) и 20% (p = 0.04) соответственно в сравнении с группой K и RS соответственно; содержание 5-HIAA в группе RS было меньше на 32% (p = 0.004) в сравнении с группой K, при этом в группе K-30 и RS-30 содержание 5-HIAA синхронно снижалось на 39% (p = 0.00007) и 34% (p = = 0.001) в сравнении с группами K и RS соответственно; содержание 5-HT в группе RS-30 было меньше на 19% (p = 0.04) в сравнении с группой K-30, при этом в группе K-30 и RS-30 содержание 5-HT синхронно снижалось на 17% (p = 0.03) и 34% (p = 0.0001) в сравнении с группами K и RS соответственно; значение соотношения 5-HIAA/5-HT в группе RS было меньше на 24% (p = 0.003) в сравнении с группой K, при этом значение соотношения 5-HIAA/5-HT снижалось только в группе K-30 – на 27% (p = 0.002) в сравнении с группой K.
В AMG были отмечены следующие нейрохимические сдвиги: содержание 5-HIAA в группе RS-30 было меньше на 33% (p = 0.04) в сравнении с группой RS; значение соотношения 5-HIAA/5-HT в группе RS было больше на 36% (p = 0.001) в сравнении с группой K, при этом значение соотношение 5-HIAA/5-HT в группах K-30 и RS-30 синхронно снижалось на 28% (p = 0.008) и 56% (p = 0.00005) в сравнении с группой K и RS соответственно.
В HYP были отмечены следующие нейрохимические сдвиги: в группах K-30 и RS-30 содержание 5-HIAA синхронно снижалось на 38% (p = = 0.002) и 37% (p = 0.002) в сравнении с группами K и RS соответственно; содержание 5-HT в группе K-30 и RS-30 синхронно снижалось на 41% (p = 0.0004) и 34% (p = 0.03) в сравнении с группами K и RS соответственно.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Центральным звеном ответа на стресс является активация гипоталамо-гипофизарно-адренокортикальной (HPA) оси [13]. При этом, основными проводниками стресса выступают такие нейромедиаторы как NA и 5-HT [14]. Настоящая работа была сосредоточена на изучении метаболизма 5-HT и NA в критических для стресс-индуцированного ответа морфологических структурах мозга: AMY, HYP и PFC.
Базируясь на том факте, что увеличение концентрации метаболитов в ткани ex vivo и/или увеличение соотношения метаболит/нейромедиатор отражают усиление нейромедиаторной передачи in vivo [15, 16], мы постулируем о немедленной активации 5-HT-эргической нейромедиаторной передачи в AMY. В то же время, на 30 день от воздействия ТЗЧ наблюдается нивелирование данного эффекта. AMY является одной из основных структур обработки эмоциональной информации, ее гиперактивность обнаруживается при тревожных расстройствах и депрессии [17]. В свете того, что 5-HT иннервация AMY является необходимым и достаточным условием активации HPA оси и реализации стресс-индуцированного ответа ЦНС [18–21], мы наблюдаем свидетельства немедленной активации стресс-индуцированного ответа. Стоит отметить, что центральное ядро AMY особенно чувствительно к таким факторам как потеря крови и изменение кровяного давления [22], что хорошо согласуется с литературными данными о влиянии S-фактора на внутричерепное давление [1]. Таким образом, это типичный ответ, характерный для воздействия S-фактора и отмеченный в ряде ранних работ [8, 9]. Примечательно, что на 30 день исследования мы обнаруживаем нормализацию 5-HT метаболизма в AMY.
В PFC, напротив, мы наблюдаем немедленное и стойкое (до 30 дней) угнетение 5-HT нейромедиаторной передачи, характерное для воздействия R-фактора [6–8]. Мы отмечаем изменения того же характера, но более ярко выраженные, что, вероятно, связано с возрастающим значения ЛПЭ более тяжелых ядер 12С6+. Учитывая тот факт, что 5-HT действует преимущественно ингибирующее в пределах кортикальных нейросетей [23], угнетение метаболизма 5-HT может быть звеном нейрохимических процессов, обеспечивающих феномен растормаживания ЦНС [1] под действием умеренных доз ионизирующего излучения.
Поздняя активация NA-эргической нейромедиации в PFC требует особого обсуждения. PFC вовлечена в реализацию сложных форм поведения, среди которых: обучение на чужих ошибках, виртуальный перебор вариантов при неочевидном и/или сложном выборе или научение методом проб и ошибок, более характерное для грызунов [24, 25]. Источником исключительно плотной NA-эргической иннервации PFC являются проекции нейронов голубого пятна (LC) [26]. Как известно, нейроактивность LC также ответственна за усиление тревожного поведения путем модуляции активности AMY (активации) и PFC (угнетение). Под влиянием стресса нейроактивность PFC подавляется, передавая управление теменной ассоциативной коре и подкорковым структурам, реализующим привычное поведение [27], что выполняется посредством резкого усиления NA иннервации [28]. Напротив, есть данные, указывающие на то, что умеренное усиление NA-иннервации PFC приводит к улучшению научения по типу проб и ошибок при неочевидном выборе [29]. Более того, умеренная активация некоторых NA-эргических путей LC улучшает внимание и повышает его селективность, тем самым устраняя влияние отвлекающих стимулов [30]. В свете этого, мы расцениваем активацию NA-эргической нейромедиации в пределах PFC как реализацию тонкой настройки кортикальных нейросетей для оптимальной активности, что находит подтверждение в ряде работ [31]. Данное предположение находит свое подтверждение также в литературных данных, указывающих на нейтральное или положительной влияние действия комбинированных ионизирующих излучений как единственного фактора или в комбинации с S-фактором на пространственное обучение и рабочую память крыс [1, 6, 8].
Наконец, в HYP наблюдалось лишь синхронное возрастное снижение 5-HT-эргической нейромедиаторной передачи. Таким образом [32, 33], мы не наблюдаем достаточных и необходимых условий активации HPA оси.
ЗАКЛЮЧЕНИЕ
Комбинированное действие S и R факторов приводит к их антагонистическому взаимодействию в отношении 5-HT нейромедиаторной передачи в PFC и AMY. В результате мы наблюдаем подавление метаболизма 5-HT, что свидетельствует о доминировании R фактора. Опираясь на литературные данные, можно говорить о том, что характер антагонистического взаимодействия (от нейтрализации эффектов друг друга до доминирования R фактора) является дозо- и ЛПЭ-зависимым.
Стойкое угнетение метаболизма 5-НT и активации NA-эргической нейромедиаторной передачи в PFС под влиянием комбинации R- и S-факторов, по-видимому, происходит в той степени, при которой инициируются адаптивные изменения активности кортикальных нейросетей для их оптимального функционирования, что реализуется в улучшении показателей обучения в ряде поведенческих тестов, показанное в ранних работах. Мы считаем эти изменения результатом реализации адаптивных/компенсаторных механизмов в нервной ткани под действием комбинированных ФКП.
Список литературы
Kokhan V.S., Matveeva M.I., Mukhametov A., Shtemberg A.S. // Neurosci. Biobehav. Rev. 2016. V. 71. P. 621–632.
Cucinotta F.A., Kim M.H., Chappell L.J., Huff J.L. // PLoS One. 2013. V. 8. № 10. P. e74988.
Godbeer A.D., Al-Khalili J.S., Stevenson P.D. // Phys. Chem. 2015. V. 17. № 19. P. 13034–13044.
Porte Y., Morel J.L. // Front. Behav. Neurosci. 2012. V. 6. P. 64.
Штемберг А.С., Базян А.С., Лебедева-Георгиевская К.Б., Матвеева М.И., Кудрин В.С., Наркевич В.Б., Клодт П.М., Кохан В.С. // Авиакосм. и экол. медицина. 2013. V. 47. № 6. P. 54–60.
Штемберг А.С., Кохан В.С., Кудрин В.С., Матвеева М.И., Лебедева-Георгиевская К.Б., Тимошенко Г.Н., Молоканов А.Г., Красавин Е.А., Наркевич В.Б., Клодт П.М., Базян А.С. // Нейрохимия. 2015. V. 32. № 1. P. 78–85.
Матвеева М.И., Штемберг А.С., Тимошенко Г.H., Красавин Е.А., Наркевич В.Б., Клодт П.М., Кудрин В.С., Базян А.С. // Нейрохимия. 2013. V. 30. № 4. P. 343–348.
Kokhan V.S., Matveeva M.I., Bazyan A.S., Kudrin V.S., Mukhametov A., Shtemberg A.S. // Behav. Brain. Res. 2017. V. 320. P. 473–483.
Штемберг А.С., Лебедева-Георгиевская К.Б., Матвеева М.И., Кудрин В.С., Наркевич В.Б., Клодт П.М., Базян А.С. // Изв. РАН Сер. биол. 2014. № 2. P. 168–176.
Cortese F., Klokov D., Osipov A., Stefaniak J., Moskalev A., Schastnaya J., Cantor C., Aliper A., Mamoshina P., Ushakov I., Sapetsky A., Vanhaelen Q., Alchinova I., Karganov M., Kovalchuk O., Wilkins R., Shtemberg A., Moreels M., Baatout S., Izumchenko E., de Magalhães J., Artemov A., Costes S., Beheshti A., Mao X., Pecaut M., Kaminskiy D., Ozerov I., Scheibye-Knudsen M., Zhavoronkov A. // Oncotarget. 2018. № 9. P. 14692–14722.
Raber J., Allen A.R., Sharma S., Allen B., Rosi S., Olsen R.H., Davis M.J., Eiwaz M., Fike J.R., Nelson G.A. // Radiat. Res. 2016. V. 185. № 1. P. 20–30.
Mao X.W., Nishiyama N.C., Pecaut M.J., Campbell-Beachler M., Gifford P., Haynes K.E., Becronis C., Gridley D.S. // Radiat. Res. 2016. V. 185. № 6. P. 647–657.
O'Connor T.M., O’Halloran D.J., Shanahan F. // QJM. 2000. V. 93. № 6. P. 323–333.
Konstandi M., Johnson E., Lang M.A., Malamas M., Marselos M. // Pharmacol. Res. 2000. V. 41. № 3. P. 341–346.
Shannon N.J., Gunnet J.W., Moore K.E. // J. Neurochem. 1986. V. 47. № 3. P. 958–965.
Thorre K., Chaouloff F., Sarre S., Meeusen R., Ebinger G., Michotte Y. // Brain Res. 1997. V. 772. № 1–2. P. 209–216.
Rauch S.L., Shin L.M., Wright C.I. // Ann. N.-Y. Acad. Sci. 2003. V. 985. №. P. 389–410.
Akmaev I.G., Kalimullina L.B., Sharipova L.A. // Neurosci. Behav. Physiol. 2004. V. 34. № 6. P. 603–610.
Pitkanen A., Savander V., LeDoux J.E. // Trends Neurosci. 1997. V. 20. № 11. P. 517–523.
Feldman S., Weidenfeld J. // Brain Res. Bull. 1998. V. 45. № 4. P. 389–393.
Bocchio M., McHugh S.B., Bannerman D.M., Sharp T., Capogna M. // Front. Neural. Circuits. 2016. V. 10. P. 24.
Saha S. // Clin Exp Pharmacol Physiol. 2005. V. 32. № 5–6. P. 450–456.
Puig M.V., Watakabe A., Ushimaru M., Yamamori T., Kawaguchi Y. // J. Neurosci. 2010. V. 30. № 6. P. 2211–2222.
Churchwell J.C., Morris A.M., Heurtelou N.M., Kesner R.P. // Behav. Neurosci. 2009. V. 123. № 6. P. 1185–1196.
Floresco S.B., Ghods-Sharifi S. // Cereb. Cortex. 2007. V. 17. № 2. P. 251–260.
Morilak D.A., Barrera G., Echevarria D.J., Garcia A.S., Hernandez A., Ma S., Petre C.O. // Prog. Neuropsychopharmacol. Biol. Psychiatry. 2005. V. 29. № 8. P. 1214–1224.
Arnsten A.F., Goldman-Rakic P.S. // Arch. Gen. Psychiatry. 1998. V. 55. № 4. P. 362–368.
Arnsten A.F. // CNS Drugs. 2009. V. 23 Suppl 1. P. 33–41.
Amemiya S., Kubota N., Umeyama N., Nishijima T., Kita I. // Behav. Brain Res. 2016. V. 297. P. 104–111.
Berridge C.W., Waterhouse B.D. // Brain Res. Rev. 2003. V. 42. № 1. P. 33–84.
Atzori M., Cuevas-Olguin R., Esquivel-Rendon E., Garcia-Oscos F., Salgado-Delgado R.C., Saderi N., Miranda-Morales M., Trevino M., Pineda J.C., Salgado H. // Front. Synaptic Neurosci. 2016. V. 8. P. 25.
Herman J.P., McKlveen J.M., Ghosal S., Kopp B., Wulsin A., Makinson R., Scheimann J., Myers B. // Compr. Physiol. 2016. V. 6. № 2. P. 603–621.
Mo B., Feng N., Renner K., Forster G. // Brain Res. Bull. 2008. V. 76. № 5. P. 493–498.
Дополнительные материалы отсутствуют.


