Нейрохимия, 2019, T. 36, № 2, стр. 164-169
Влияние метотрексата на пул низкомолекулярных серосодержащих соединений в головном мозге крыс
Я. И. Новогродская 1, М. Н. Курбат 1, Е. М. Дорошенко 1
1 УО “Гродненский государственный медицинский университет”
Гродно, Беларусь
Поступила в редакцию 13.07.2018
После доработки 01.11.2018
Принята к публикации 12.11.2018
Аннотация
Однократное введение метотрексата в дозе 0.1 мг/кг на 24 ч и 7 сут характеризуется дисбалансом пула низкомолекулярных серосодержащих соединений, выраженность которого уменьшается в ряду гипоталамус > средний мозг > большие полушария > стриатум > мозжечок. Через 24 ч в больших полушариях крыс снижается реметилирование гомоцистеина, в стриатуме активируется транссульфурирование, в среднем мозге тормозится синтез таурина, в гипоталамусе увеличивается синтез гомоцистеиновой кислоты и таурина, а в мозжечке активируется оксидазный путь превращений цистеина и гомоцистеина, ингибируется транссульфурирование и биосинтез таурина. Через 7 сут после однократного воздействия метотрексата общей тенденцией является торможение реакций окисления, активация транссульфурирования и декарбоксилирования в синтезе таурина.
ВВЕДЕНИЕ
Выбор препаратов для химиотерапии опухолей ЦНС и поражений ЦНС при лимфопролиферативных заболеваниях обусловлен их активностью и способностью проникать через гематоэнцефалический барьер, так как не все потенциальные противоопухолевые средства способны проникать через него, что влияет на эффективность терапии и целесообразность ее назначения [1, 2]. Первым эффективным препаратом для лечения злокачественных новообразований, обладающим способностью проникать в ткани мозга, стал классический антиметаболит фолиевой кислоты – метотрексат (MTX) [3]. Метотрексат отличается от фолиевой кислоты карбоксильной группой вместо аминогруппы в 4-м положении птеридиновой молекулы и наличием метильной группы в 10-м положении 4‑аминобензойной кислоты [4]. Поступая в клетку, метотрексат превращается в метотрексатные полиглутаматы путём последовательного присоединения остатков глутаминовой кислоты при помощи фолилполиглутаматсинтетазы [5]. Гамма-глутамилгидролаза удаляет остатки глутаминовой кислоты с полиглутаматов и MTX выходит из клеток [6]. Метотрексат и/или метотрексатные полиглутаматы, конкурентно ингибируя дигидрофосфатредуктазу, нарушают синтез тетрагидрофолиевой кислоты [7]. Недостаток тетрагидрофолатов угнетает синтез пуринов и тимидина, превращение гомоцистеина в метионин и метаболизм длинноцепочечных жирных кислот в ткани головного мозга. Имеются данные об ингибировании метотрексатом не только дигидрофосфатредуктазы, но и β-глицинамид рибонуклеотид-трансформилазы, 5'-амино-4'-имидазолкарбоксамид-рибонуклеотид-трансформилазы, тимидилатсинтазы, которые также участвуют в синтезе ДНК и РНК [8, 9, с. 39].
Известно, что MTX имеет высокую степень ионизации при физиологических значениях рН, что препятствует его проникновению в ЦНС в высоких концентрациях, а неповрежденный ГЭБ может ограничивать проникновение метотрексата в мозг и опухоль при лечении первичных опухолей [3] при помощи транспортеров. Так, транспортеры MRP4/ABCC4, BCRP/ABCG2 имеют сродство к нуклеозидным аналогам [10, 11], к числу которых относятся противоопухолевые средства, в том числе и метотрексат. В то же время ГЭБ не только ограничивает, но и обеспечивает транспорт веществ в мозг. Проникать относительно беспрепятственно через него могут липофильные соединения, а с участием переносчиков и транспортных систем – и гидрофильные молекулы [12, 13], к которым относятся аминокислоты и их производные. Благодаря системам транспорта мозг способен поддерживать относительно постоянные уровни свободных аминокислот и родственных им соединений, независимо от их концентрации в крови [14].
С другой стороны, метотрексат через фолатзависимые механизмы может вмешиваться в метаболические превращения свободных аминокислот, вызывая метаболический дисбаланс в соответствующей ткани, который может приводить к повреждению клеток головного мозга, стенок сосудов, мембран клеток головного мозга, структуры ДНК, нарушению внутриутробного развития структур головного мозга и т.д. [15]. Искусственный дефицит коферментных форм фолатов, вызванный метотрексатом, позволит оценить функциональную значимость фолатных механизмов в поддержании постоянства уровней свободных аминокислот и их производных в мозге крыс.
Целью исследования стал анализ пула низкомолекулярных серосодержащих соединений в функционально и метаболически различных отделах головного мозга крыс после введения метотрексата.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперимент был выполнен на 24 белых крысах-самцах гетерогенной популяции массой 220–240 г, содержавшихся на обычном рационе вивария со свободным доступом к воде. Животные были разделены на 3 группы (по 8 животных в группе): 1-й (контрольная группа), животным внутрибрюшинно вводили изотонический раствор (0.9% раствор NaCl), 2-й и 3-й (опытные группы) – метотрексат (РУП “Белмедпрепараты”) в дозе 0.1 мг/кг [16] однократно. Забой животных проводили через 24 ч и 7 сут. За 12 ч до декапитации животные были лишены пищи с сохранением свободного доступа к воде. Проведение эксперимента соответствовало правилам и нормам биоэтического обращения с подопытными животными и одобрено комитетом по биомедицинской этике учреждения образования “Гродненский государственный медицинский университет”.
После декапитации на холоде быстро извлекали головной мозг и выделяли отделы (большие полушария, стриатум, средний мозг, гипоталамус, мозжечок). Для осаждения белков образцы тканей гомогенизировали в 10 объемах 0.2 М раствора хлорной кислоты, содержащем 0.2 мМ норвалина, 1 мкМ ванилиновой кислоты, 50 мг/л ЭДТА, 50 мг/л метабисульфита натрия. Пробы центрифугировали (Biofuge Primo R+) при 4°С в течение 15 мин при 16 000 g. Затем супернатант немедленно отбирали и хранили до исследования при –18°С. Концентрации цистеиновой кислоты (CA), цистеинсульфиновой кислоты (CSA), глутатиона (GSH), серина (Ser), глицина (Gly), гипотаурина (HpTau), таурина (Tau), метионина (Met), цистатионина (Ctn), гомоцистеиновой кислоты (HCA) определяли в полученных хлорнокислых экстрактах методом обращенно-фазной ВЭЖХ с предколоночной дериватизацией о-фталевым альдегидом и 3-меркаптопропионовой кислотой и детектированием по флуоресценции (338/455 нм). Предколоночную дериватизацию проводили непосредственно перед вводом проб в хроматограф путем смешивания пробы с 5-кратным объемом 0.4% о-фталевого альдегида и 0.3% 3-меркаптопропионовой кислоты в 0.4 М Na-боратном буфере, pH 9.4, затем пробы нейтрализовали 0.2 М раствором HClO4 до слабокислой среды и немедленно вводили в колонку. Подвижная фаза: 0.1 М Na-ацетатный буфер, pH 6.15, содержащий 20 мг/л ЭДТА (A); ацетонитрил/вода 7/3 (об./об.) (B), метанол/вода 7/3 (об./об.) (С), 0.1 М Na-ацетатный буфер, pH 5.55, содержащий 20 мг/л ЭДТА (D). Градиентное элюирование от 2 до 100% В с изменением соотношения B/C и A/D в ходе анализа, за 69 мин; скорость потока 0.2 мл/мин, температура колонки 35°С [17].
Хроматограммы обрабатывали с помощью программы Agilent ChemStation В.04.02 по методу внутреннего стандарта. Для калибровки системы использовали смесь аминокислот Aldrich (США), содержащую по 500 нмоль/мл каждого соединения. Смесь стандартов обрабатывали так же, как пробы тканей.
Статистическую обработку данных проводили с помощью программы Statistica 10.0 (серийный номер AXAR207F394425FA-Q) с применением t‑критерия Стьюдента для независимых выборок после контроля нормальности с помощью критерия Колмогорова–Смирнова с поправкой Лиллифорса, а также однофакторного дисперсионного анализа (ANOVA) с поправкой на множественные сравнения по критерию Тьюки. При отклонении распределения от нормального достоверность различий между группами проверяли медианным тестом Манна–Уитни. Для анализа взаимосвязи признаков применяли корреляционный анализ (коэффициенты корреляции по Пирсону). Во всех процедурах статистического анализа критический уровень значимости р принимали равным 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В больших полушариях интактных животных выявлены положительные связи между уровнями Met-HCA (r = 0.83, p < 0.05), Met-Ser (r = 0.77, p < < 0.05), Met-Gly (r = 0.87, p < 0.05), Gly-Tau (r = = 0.91, p < 0.05), Ser-Gly (r = 0.87, p < 0.05), Ser-HpTau (r = 0.81, p < 0.05), Ser-Tau (r = 0.92, p < 0.05), HpTau-Tau (r = 0.82, p < 0.05), которые указывают на то, что синтез таурина происходит преимущественно по пути окисления гипотаурина, а не цистеинсульфината.
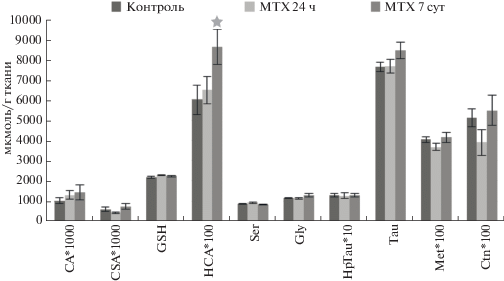
Метотрексат в дозе 0.1 мг/кг через 24 ч в больших полушариях крыс приводил к снижению уровня метионина, нарушая, вероятно, процесс реметилирования гомоцистеина в метионин, но не транссульфурирование. В пользу этого предположения говорит положительная корреляция между уровнями Ctn-CSA (r = 0.80, p < 0.05), Ser-Gly (r = 0.90, p < 0.05), Gly-Tau (r = 0.76, p < 0.05).
Через 7 сут наблюдалась тенденция к повышению уровня цистатионина, что, возможно, говорит о высокой активности цистатионин-β-синтазы, но при этом уровни остальных исследованных аминокислот снижались, что указывает на вероятное ингибирование γ-цистатионазы (рис. 1). Положительная корреляция между уровнями CSA-CA (r = 0.92, p < 0.05) указывала на активный синтез таурина из цистеинсульфината через его окисление в цистеат, а не декарбоксилирование в гипотаурин.
Рис. 1.
Уровни НСС в больших полушариях крыс (среднее ± ср. ошибка среднего). Примечание: * p < 0.05 при сравнении с контрольной группой.
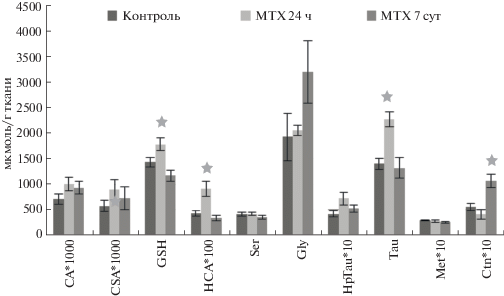
Метотрексат в стриатуме крыс приводил к незначительному дисбалансу уровней серосодержащих аминокислот (рис. 2). Так, через 24 ч после его введения не отмечено статистически значимых изменений уровней серосодержащих аминокислот и их метаболитов. Тесная положительная корреляционная связь между уровнями Ser-Gly (r = 0.98, p < 0.05) указывала на возможную активацию транссульфурирования. В контрольной группе такая связь отсутствовала, но наблюдалась положительная корреляция между уровнями Met и Tau (r = 0.79, p < 0.05).
Через 7 сут после введения метотрексата наблюдалось статистически достоверное повышение уровня гомоцистеиновой кислоты, что может быть связано с окислением гомоцистеина и может сопровождаться торможением транссульфурирования гомоцистеина и синтеза цистатионина. Корреляционный анализ выявил следующие достоверные положительные связи в данном отделе ЦНС: СА-СSA (r = 0.76, p < 0.05), СА-Tau (r = = 0.96, p < 0.05), СSA-Tau (r = 0.78, p < 0.05), СА-Gly (r = 0.91, p < 0.05), СSA-Gly (r = 0.86, p < 0.05), которые указывали на активное восстановление процесса декарбоксилирования цистеиновой и цистеинсульфиновой кислот по пути биосинтеза таурина.
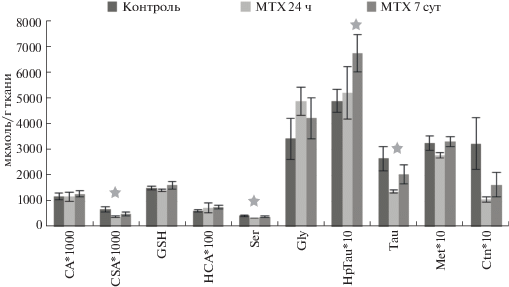
В среднем мозге воздействие метотрексата также приводило к метаболическому дисбалансу исследуемых соединений. Через 24 ч после введения метотрексата наблюдалось снижение уровней CSA, Ser, Tau, что указывает на угнетение декарбоксилирования цистеинсульфиновой кислоты и, вероятно, нарушение синтеза таурина. Через 7 сут наблюдалось статистически достоверное повышение уровня НpTau (рис. 3). При этом уровень таурина не снижался, что, вероятно, связано со снижением активности гипотауриндегидрогеназы и ингибированием синтеза таурина.
Корреляционный анализ показал, что в контрольной группе все определяемые непосредственно метаболически связанные друг с другом соединения не коррелировали между собой. Через 24 ч после введения метотрексата наблюдалась положительная корреляция между уровнями Ser-Ctn (r = 0.83, p < 0.05), которая указывала на блокировку цистатион-β-синтазы, т.е. на ингибирование транссульфурирования на уровне первой реакции, Ctn-Tau (r = 0.89, p < 0.05), свидетельствующая о том, что синтез таурина стал зависимым от достаточности серина как предшественника. Через 7 сут после введения метотрексата прослеживалась отрицательная корреляционная связь между Gly-Ser (r = –0,97, p < 0.05). Глицин, не превращаясь в серин, может являться фактором, ограничивающим синтез таурина.
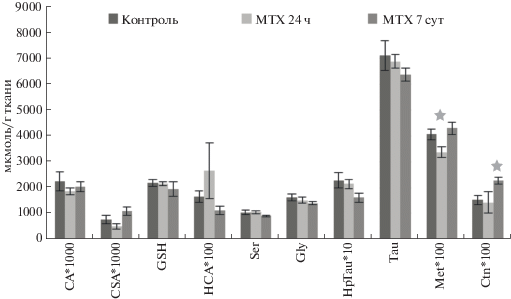
В гипоталамусе крыс через 24 ч после введения MTX достоверно повышались уровни HCA, Tau и GSH. Повышение уровней гомоцистеиновой кислоты и глутатиона, вероятно, указывают на окислительный стресс и активацию антиоксидантной функции. Положительная корреляция в гипоталамусе контрольной группы крыс наблюдалась между уровнями СA-HCA (r = 0.76, p < < 0.05), Ser-Tau (r = 0.84, p < 0.05). Через 24 ч после введения MTX выявлены отрицательные корреляции между уровнями Ser-Ctn (r = –0.89, p < 0.05), Gly-Tau (r = –0,80, p < 0.05), Ctn-Tau (r = –0,93, p < 0.05) и положительные корреляции между уровнями Gly-Ctn (r = 0.76, p < 0.05), Ser-Tau (r = = 0.88, p < 0.05), Met-Tau (r = 0.76, p < 0.05), которые подтверждают предположение об активной наработке таурина только в результате катаболизма метионина.
Через 7 сут наблюдалось статистически достоверное повышение уровня цистатионина по сравнению с контролем, что может быть обусловлено высокой активностью цистатионин-β-синтазы и относительным блоком на уровне γ-цистатионазы (рис. 4). Положительные корреляционные связи между уровнями Ser-CA (r = 0.88, p < 0.05), CA-Tau (r = 0.79, p < 0.05), Ser-Tau (r = 0.81, p < < 0.05), Ser-Met (r = 0.80, p < 0.05), Gly-Ctn (r = 0.86, p < 0.05) и отрицательная корреляционная связь между уровнями Gly-Tau (r = –0.73, p < 0.05) подтверждали активное протекание транссульфурирования. Таурин синтезировался в мозге преимущественно в результате окисления цистеина до цистеинсульфиновой кислоты, которая декарбоксилировалась с образованием гипотаурина с последующим окислением его до таурина.
Содержание низкомолекулярных серосодержащих и родственных соединений в мозжечке через 24 ч и 7 сут после введения MTX достоверно не изменялось. Корреляционный анализ выявил положительные связи между уровнями HCA-CA (r = 0.72, p < 0.05), Ser-CSA (r = 0.77, p < 0.05), которые указывали на активацию оксидазного пути превращений цистеина и гомоцистеина, так как наработка цистеата и гомоцистеата осуществляется в однотипных реакциях из, соответственно, цистеина и гомоцистеина уже через 24 ч.
Через 7 сут после введения метотрексата наблюдалась положительная корреляция между уровнями Ser-Ctn (r = 0.94, p < 0.05), которая указывала на активное восстановление процесса транссульфурирования гомоцистеина и биосинтеза таурина, который, вероятно, был заторможен через 24 ч после введения MTX.
В контрольной группе крыс корреляционный анализ выявил отрицательные связи между уровнями Ser-Gly (r = –0.85, p < 0.05), Gly-Tau (r = –0.91, p < 0.05), Gly-Met (r = –0.79, p < 0.05). Это может означать весьма активное протекание в мозжечке взаимопревращений глицина и серина, которые сопровождались активным транссульфурированием с участием серина и активным использованием другого продукта этой реакции – метилен-ТГФК, используемого для реметилирования гомоцистеина в метионин. На эти процессы указывала положительная корреляция между уровнями Ser-Tau (r = 0.91, p < 0.05), Ctn-Tau (r = 0.74, p < 0.05), Met-Ctn (r = 0.82, p < 0.05).
ВЫВОДЫ
1. Однократное введение метотрексата характеризуется нарушениями формирования пула низкомолекулярных серосодержащих соединений в регионах головного мозга крыс. Выраженность дисбаланса концентраций отдельных НСС уменьшается в ряду гипоталамус > средний мозг > > большие полушария > стриатум > мозжечок.
2. Направленность и степень выраженности изменения нейрохимических процессов метаболизма НСС зависит от метаболической активности исследуемых регионов ЦНС:
– в больших полушариях крыс при 24-часовом воздействии метотрексата имеет место снижение реметилирования гомоцистеина в метионин, а через 7 сут – изменение предпочтительного пути синтеза таурина.
– в стриатуме крыс через 24 ч активируется процесс транссульфурирования, а через 7 сут – декарбоксилирования CSA и CA.
– в среднем мозге через 24 ч тормозится синтез таурина путем снижения интенсивности транссульфурирования. В более позднем сроке наблюдается торможение окисления гипотаурина.
– в гипоталамусе крыc через 24 ч увеличивается синтез гомоцистеиновой кислоты и таурина через активное окисление гомоцистеина и гипотаурина, а через 7 сут повышается активность транссульфурирования.
– в мозжечке крыс через 24 ч после введения метотрексата активируется оксидазный путь превращений цистеина и гомоцистеина и ингибируется транссульфурирование и биосинтез таурина, восстановление активности которых происходит к 7 сут эксперимента.
Список литературы
Переводчикова Н.И. // М.: Практическая медицина, 2018. 688 с.
Раевский О.А. // Биомедицинская химия. 2014. Т. 60. №. 2. С. 161–181.
Миненко С.В. // Онкогематология. 2011. Т. 3. С. 50–56.
Cronstein B.N. // Pharmacol Rev. 2005. V. 57. P. 163–172.
Mikkelsen Torben S. // Pharmacogenet. Genomics. 2011. V. 21. № 10. P. 679–686.
Lima A. // Int. J. Mol. Sci. 2015. V. 16. P. 13760–13780.
Корман Д.Б. Основы противоопухолевой химиотерапии. М.: Практическая медицина, 2006. 503 с.
Hagner N., Cancer M. // Cancer Manag. Res. 2010. V. 2. P. 293–301.
Бачериков В.А. // Вісник ОНУ. Хімія. 2013. Т. 18. № 3. С. 38–52.
Polly J.W. // Drug. Metab. Disposit. 2009. V. 37. P. 439–442.
Sane R. // Drug Metab. Dispos. 2014. V. 42. № 4. P. 537–540.
Angelov L. // J. Clin. Oncol. 2009. V. 27. № 21. P. 3503–3509.
Alavijeh M.S. // NeuroRx. 2005. V. 2. P. 554–571.
Курбат М.Н., Лелевич В.В. // Нейрохимия. 2009. Т. 26. № 1. С. 29–34.
Широков Е.А., Леонова С.Ф. // Клин. мед. (Москва). 2006. Т. 84. № 12. С. 39–42.
Пронько П.С., Хомич Т.И., Сатановская В.И., Лис Р.Е., Наумов А.В. // Фундаментальные науки – медицине: материалы Междунар. науч. конф. 17 мая 2013 г. Минск: Беларус. навука, 2013. Ч. 2. С. 166–170.
Дорошенко Е.М., Снежицкий В.А., Лелевич В.В. // Журнал Гродненского государственного медицинского университета. 2017. Т. 15. № 5. С. 552.
Дополнительные материалы отсутствуют.