Нейрохимия, 2019, T. 36, № 3, стр. 254-264
Нейробиологические эффекты комбинированного воздействия антиортостатического вывешивания и ионизирующих излучений различного качества
К. Б. Лебедева-Георгиевская 1, В. С. Кохан 1, А. К. Шуртакова 1, А. А. Перевезенцев 1, В. С. Кудрин 1, 3, А. С. Штемберг 1, А. С. Базян 1, 2
1 ФГБУН Государственный научный центр РФ Институт медико-биологических проблем РАН
Москва, Россия
2 ФГБУН Научно-исследовательский институт фармакологии им. В.В. Закусова РАН
Москва, Россия
3 ФГБУН Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
Поступила в редакцию 08.05.2018
После доработки 12.12.2018
Принята к публикации 17.12.2018
Аннотация
Целью настоящего исследования являлось изучение нейробиологических эффектов при моделировании некоторых факторов межпланетного полета: гипогравитации, моделируемой в наземном эксперименте с помощью общепринятой методики гравитационной разгрузки – 7-суточного антиортостатического вывешивания (АнОВ), синхронного с ней длительного гамма облучения и высокоэнергетических протонов. Исследовали поведение животных в ряде тестов: “открытого поля”, приподнятого крестообразного лабиринта, условного рефлекса пассивного избегания, водного теста Морриса, а также обмен моноаминов в ключевых структурах мозга. Наиболее интересным и парадоксальным результатом нашего исследования является то, что в ряде случаев наблюдается нивелирование эффектов при комбинированном действии облучения и микрогравитации, проявляющееся как в поведении, так и в нейрохимических изменениях во всех пяти исследованных структурах мозга, несмотря на то, что эти структуры играют различную роль в реализации поведения. При этом изолированное воздействие как облучения, так и АнОВ вызывали значительные изменения.
В дальних космических экспедициях, связанных с выходом за пределы магнитосферы Земли, одним из основных лимитирующих возможность осуществления таких экспедиций факторов становится радиационный, который, в сочетании с другими факторами, основным из которых является гипогравитация, может привести к нарушениям функций ЦНС, лежащих в основе операторской деятельности космонавтов. Это, в свою очередь, представляет реальную опасность для выполнения ими полетного задания и самой их жизни. При этом, в отличие от отдаленных последствий воздействия радиации (канцерогенез, катарактогенез, цитогенетические нарушения, сокращение продолжительности жизни и др.), эргономический риск, обусловленный возможными нарушениями операторской деятельности космонавтов, связан с угрозой их жизни непосредственно в процессе полета. Основную опасность представляют галактические космические лучи (ГКЛ), состоящие из протонов и тяжелых ионов чрезвычайно высоких энергий (до 1020 МэВ). Защититься от таких высокоэнергетических излучений в условиях космического корабля чрезвычайно сложно.
Кроме того, полученные данные представляют интерес применительно к проблемам протонной терапии опухолей головного мозга.
В настоящее время получено достаточно экспериментальных данных, свидетельствующих о существенных нарушениях функций ЦНС на всех уровнях ее организации, вызываемых воздействием тяжелых ионов. Так, при облучении ионами 56Fe в дозах 0.1–2 Гр с энергией порядка 1 ГЭВ/нуклон зарегистрировано снижение калий-зависимого освобождения ДА в стриатуме, заметное снижение активности глутаматергической системы в гиппокампе, снижение двигательной активности и мышечной силы, пространственной ориентации и памяти, нарушение когнитивных функций мозга, а также усугубление наблюдающихся нарушений с возрастом [1–4].
Данных о воздействии протонов на функции ЦНС сравнительно немного. Облучение крыс протонами в дозах менее 3 Гр индуцировало нарушения условнорефлекторной вкусовой аверсии в течение 3 дней [5], а в дозах 3–4 Гр приводило к возникновению кратковременного дефицита исследовательской активности в “открытом поле”, возрастанию числа реакций замирания при звуковом сигнале (испуг) и нарушениям координации движений на ротороде у мышей [6]. Авторы полагают, что нарушения были опосредованы радиационным повреждением ДА функций гиппокампа, мозжечка и, возможно, переднего мозга. Высокоэнергетические протоны в пике Брэгга, в дозах 1–2 Гр, нарушают поведение в Т-образном лабиринте. Это воздействие вызывает снижение концентрации катехоламинов в префронтальной коре и в полосатом теле [7].
Нейробиологические эффекты комбинированного действия ионизирующих излучений (ИИ) и гипогравитации (ГГ) на ЦНС являются одной из важнейших и, в то же время, наименее исследованных проблем в космической биологии и медицине. Показано, что при комбинированном воздействии ИИ и ГГ могут значительно модулировать эффекты друг друга [8]. В последних исследованиях были получены первые свидетельства того, что комбинация этих факторов может приводить не только к аддитивным или синергическим, но и к антагонистическим эффектам [9–11], что также связано с изменениями эффективности моноаминергических систем в некоторых ключевых структурах головного мозга [12–15].
В наших предыдущих исследованиях, посвященных изучению нейробиологических эффектов ионизирующих излучений и микрогравитации в общепринятой наземной модели антиортостатического вывешивания (АнОВ) было показано, что наиболее существенные нарушения наблюдались при 30-суточном воздействии [8], в то время как в 14-суточном эксперименте они в значительной степени нивелировались [9]. По нашему предположению, это связано с разными стадиями общего адаптационного синдрома, на которые приходились эти воздействия.
Таким образом, нейробиологические эффекты комбинированного действия изучаемых факторов при разных сроках облучения существенно различались. В связи с этим целью настоящего исследования было изучить данные эффекты в начальной стадии адаптации к АнОВ – при 7-суточном воздействии.
МАТЕРИАЛЫ И МЕТОДЫ
Животные
Эксперименты проводились на 80 самцах крыс линии Вистар (60 крыс для поведенческих экспериментов, 20 крыс для нейрохимических экспериментов) c начальной массой 250–300 г. Животные были размещены в виварии по пять животных в клетке при естественных условиях освещения с продолжительностью светового дня приблизительно 8 ч, со свободным доступом к воде и пище и разделены на четыре экспериментальные группы: интактный (виварный) контроль, АнОВ, облучение в суммарной дозе 3 Гр и АнОВ + облучение (по 15 крыс в каждой поведенческой группе и по 5 крыс в каждой группе для нейрохимических исследований).
Этическое одобрение проведенных исследований
Все процедуры, проводимые в исследованиях с участием животных, соответствовали этическим нормам утвержденными биоэтическими комиссиями Федерального государственного бюджетного учреждения науки Государственного научного центра РФ – Института медико-биологических проблем РАН, Федерального государственного бюджетного учреждения науки Института высшей нервной деятельности и нейрофизиологии РАН и Федерального государственного бюджетного учреждения науки Научно-исследовательского института фармакологии им. В.В. Закусова РАН, Москва, на основании декларации Хельсинкского комитета 1964 года и ее более поздними поправками с сопоставимыми этическими стандартами.
Экспериментальные воздействия
При создании АнОВ использовали индивидуальные секции из оргстекла размером 42 × 42 × 40 см, скомпонованные в два стеллажа по 15 секций каждый. Животных вывешивали за основание хвоста под углом 30°. При этом крыс крепили с помощью специальных карабинов, надевающихся на металлический стержень, таким образом, чтобы они могли свободно перемещаться в пределах клетки. Таким образом, создавался антиортостаз, вызывающий перераспределение жидкостей в организме, и снималась статическая нагрузка с задних конечностей, что воспроизводит эффекты, характерные для состояния невесомости. Данная методика – принятая экспериментальная наземная модель невесомости для мелких лабораторных животных [7–9].
Стеллажи с вывешенными животными были размещены в облучательской: стеллаж с крысами, подвергавшимися комбинированному воздействию АнОВ и γ-излучения – в зоне облучения на расстоянии 3.3 м от источника излучения, таким образом, чтобы облучение всех крыс, находящихся в поле облучения, было равномерным; стеллаж с крысами, подвергавшимися воздействию только АнОВ, – в том же помещении облучения, но вне зоны облучения. Крысы, подвергавшиеся только облучению, были размещены на стеллаже, находящемся в поле облучения, в домашних клетках.
Был проведен суточный сеанс облучения; суммарная доза составила 1.5 Гр. После снятия с вывешивания было проведено облучение крыс протонами на установке “Фазотрон” в Объединенном институте ядерных исследований (Дубна). Доза облучения составила 1.5 Гр, энергия протонов 170 МэВ. Задачей исследования было изучение нейробиологических эффектов комбинированного воздействия двух видов излучения, моделирующих эффекты ГКЛ, поэтому крысы подвергались облучению обеими видами ионизирующих излучений. Животных исследовали на 2 сутки после облучения. Крысы были разделены на 2 группы: с одной из них проводили поведенческие исследования, которые продолжались в течение недели после экспериментальных воздействий; животные второй группы были декапитированы на вторые сутки после облучения протонами, у них были выделены соответствующие структуры мозга и проведены нейрохимические исследования.
Поведенческие исследования
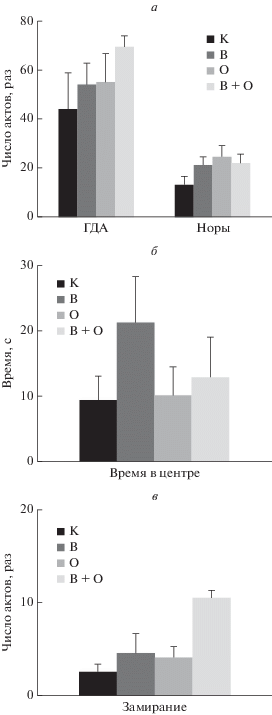
Открытое поле. Для оценки двигательной и ориентировочно-исследовательской активности крыс тестировали в “открытом поле” (ОП). ОП представляло собой круг диаметром 1 м, расчерченный на сектора с отверстием в центе каждого. Время тестирования составляло 5 мин. Данные регистрировали раздельно за первые и вторые 2.5 мин для оценки процесса угашения двигательной и ориентировочно-исследовательской активности. Регистрировали латентный период выхода крысы из центра ОП, горизонтальную (по числу пересеченных линий), вертикальную (ориентировочную) двигательную активность, исследовательскую активность (по числу заглядываний в отверстия), число выходов в центр ОП, число реакций “замирания” (freezing), число груминговых реакций и дефекаций.
Выработка УРПИ основана на врожденном стремлении мышей и крыс к ограниченному замкнутому пространству и избеганию освещенных участков (норковый рефлекс). В эксперименте использовали камеру из непрозрачного пластика, с перегородкой с прямоугольным отверстием на уровне пола 6 × 6 см, разделяющей камеру на два отсека, и с электрифицированным полом для каждого отсека. Один из отсеков размером 23 × 16 × × 16 см закрыт съемной светонепроницаемой крышкой; второй отсек размером 23 × 16 × 45 см не имеет крышки и освещен лампой. Освещенность по центру затемненного отсека составляла 12 лк, освещенного – 150 лк. Животное помещали в центр освещенного отсека хвостом к отверстию в перегородке и регистрировали время перехода в затемненный отсек всеми четырьмя лапами – латентное время. Немедленно после этого на пол затемненного отсека подавали однополярные импульсы тока 0.3 мА частотой 100 Гц, до тех пор, пока животное не перейдет обратно в освещенный отсек, но не более 3 с, после чего животное переносили в домашнюю клетку. Тест повторяли через 24 ч и спустя 1 нед., но лишь для тех групп животных, которые показали достоверное обучение спустя 24 ч после эксперимента. Фиксировали латентное время перехода в затемненный отсек, пол при этом не активировали.
В тесте Морриса использовали бассейн голубого цвета диаметром 150 см и высотой стенок 40 см, глубина наполнения составляла 21 см. В геометрический центр одного из четырех секторов бассейна помещали круглую платформу из прозрачного оргстекла диаметром 10 см, скрытую под поверхностью воды на глубине 1 см, и, таким образом, невидимую для животного на голубом фоне; воду не подкрашивали. Платформа оставалась на одном и том же месте на протяжении всего эксперимента. Крысу помещали в воду в произвольном месте бассейна и давали свободно плавать в течение 60 с, что составляло одну пробу; в одной пробе всех тестируемых крыс запускали с одного и того же места. В случае нахождения крысой платформы ранее этого срока фиксировали время нахождения платформы и предоставляли животному в течение 20 с пребывать на платформе для ориентирования. После этого крысу снимали с платформы и запускали снова в бассейн с другого произвольного места; таким образом, 2 пробы формировали одну сессию. В день проводили 2 сессии с перерывом 4 часа. В случае не нахождения платформы животное подманивали к платформе, постукивая по ее поверхности пальцем, или же помогали достичь платформы, направляя крысу рукой; в этом случае фиксировали время нахождения платформы, равное 60 с. Тест проводили в течение 6 дней. На седьмой день проводили однократную пробу без установки платформы, в течение одной пробы (60 с), фиксировали время пребывания крыс в секторе, в котором платформа располагалась ранее.
Приподнятый крестообразный лабиринт имел длину отсеков, равную 50 см с шириной аллеи 10 см, высота стенок огороженных отсеков составляла 40 см. Освещенность в центре огороженных отсеков составляла 12 лк, неогороженных – 60 лк. Крысу помещали в угол огороженного отсека лабиринта (одного и того же для всех тестируемых животных) и фиксировали следующие параметры: латентное время выхода в неогороженный участок, количество таких выходов и общее время пребывания в неогороженном участке лабиринта.
Статистическая обработка результатов
Стандартную статистическую обработку данных проводили с помощью статистического пакета Statistica 8 (“StatSoftInc.”, США). Было показано, что полученные данные имеют нормальное распределение, что дает основание использовать параметрические методы сравнения. Гомогенность первичного пула животных анализировали с помощью t – критерия Стьюдента для одной выборки. В случае p < 0.05 принимали гипотезу о принадлежности выборки генеральной совокупности. Для сравнения значения признака внутри одной группы использовали t – критерий Стьюдента для зависимых выборок. В случае p < 0.05 принимали гипотезу о значимом влиянии эффекта на изучаемый признак. Для сравнения значения признака в различных группах использовали тест ANOVA и апостериорный тест при наличии статистических различий в ANOVA. Статистически значимым результатом считали величину p < или = 0.05. Величину p от 0.05 до 0.099 считали тенденцией изменений.
Нейрохимические исследования
Для нейрохимических исследований были отобраны 5 контрольных крыс и по 5 животных из каждой экспериментальной группы: АнОВ; облучение; комбинированное воздействие (АнОВ + облучение). Животных декапитировали через 7 сут. после экспериментальных воздействий. Выделяли следующие структуры мозга: префронтальную кору, прилежащее ядро (nucleus accumbens), гипоталамус, гиппокамп, стриатум, которые взвешивали и замораживали в жидком азоте. Выделенные структуры гомогенизировали при +4°C в стеклянном гомогенизаторе с тефлоновым пестиком (0.2 мм) при скорости вращения пестика 3000 об./мин. В качестве среды гомогенизации и выделения использовали 0.1 Н НСlО4 с добавлением внутреннего стандарта ДОБА (3,4-диоксибензиламин) – вещества катехоламиновой природы, но не встречающегося в нативной ткани, в концентрации 0.5 нмоль/мл. Прилежащее ядро гомогенизировали в 40-кратном объеме, остальные структуры мозга – в 20-кратных объемах среды выделения. Пробы центрифугировали при +4°C, 10 000 g, в течение 15 мин. Супернатант использовался в дальнейшем для определения моноаминов и их метаболитов.
Концентрацию моноаминов и их метаболитов определяли с помощью метода высокоэффективной жидкостной хроматографии (ионпарная хроматография) с электрохимической детекцией на хроматографе LC–304T (BAS, WestLafayette, США) с инжектором Rheodyne 7125, петля для нанесения образцов – 20 мкл. Изучаемые вещества разделяли на обращеннофазной колонке ReproSil-Pur, ODS-3, 4 × 100 мм, 3 мкм (Dr.Majsch GMBH, “Элсико”, Москва). Насос PM-80 (BAS, США), скорость элюции подвижной фазы 1.0 мл/мин при давлении 200 атм. Мобильная фаза – 0.1 M цитратно-фосфатный буфер, содержащий 1.1 мM октансульфоновой кислоты, 0.1 мM ЭДТА и 9% ацетонитрила (pН 3.0). Скорость протока 1 мл/мин. Измерение проводили с помощью электрохимического детектора LC-4B (BAS, США) на стеклоугольном электроде (+0.85 V) против электрода сравнения Ag/AgCl. Регистрацию образцов проводили с применением аппаратно-программного комплекса МУЛЬТИХРОМ 1.5 (АМПЕРСЕНД).
Для калибровки хроматографа использовали смеси рабочих стандартов определяемых веществ в концентрации 500 пмоль/мл. Величины концентрации моноаминов в опытных образцах рассчитывали методом “внутреннего стандарта”, исходя из отношений площади пиков в стандартной смеси и в образце. Определяли содержание норадреналина (НА), дофамина (ДА) и его метаболитов – 3,4-диоксифенилуксусной кислоты (ДОФУК), гомованилиновой кислоты (ГВК), 3-метокситирамина (3-МТ), серотонина (5-окситриптамина, 5-ОТ) и его метаболита – 5– гидроксииндолуксусной кислоты (5-ОИУК).
Результаты нейрохимических исследований выражали в виде средних величин ± стандартная ошибка среднего. Полученные результаты анализировали односторонней ANOVA; и posthoc тест Дункана. Статистически значимым результатом считали величину p < или = 0.05. Величину p от 0.05 до 0.099 считали тенденцией изменений.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Открытое поле
Существенных различий в компонентах активного поведения в тесте “открытого поля” не было обнаружено. Наблюдалась даже некоторая слабо выраженная тенденция к увеличению двигательной и исследовательской активности у крыс экспериментальных групп (рис. 1). Наблюдалось увеличение времени, проведенного крысами, подвергнутыми АнОВ, в центре “открытого поля”; в то же время было зарегистрировано существенное возрастание такого показателя пассивно-оборонительного поведения и тревожности как число реакций замирания у животных той же группы.
Приподнятый крестообразный лабиринт
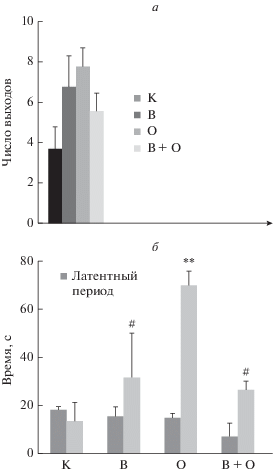
Наиболее существенным результатом тестирования крыс в приподнятом крестообразном лабиринте явилось статистически значимое увеличение суммарного времени, проведенного в открытом участке лабиринта, у облученных крыс: как по отношению к контролю – на 416.8% (p < 0.01), так и по отношению к другим экспериментальным группам – на 284% и 321% сравнительно с группами АнОВ + облучение иАнОВ соответственно (p < 0.05). У животных групп АнОВ и АнОВ + облучение этот показатель возрос на 134.2 и 95.7% соответственно. Значения латентного периода выхода из центральной площадки лабиринта были низкими у крыс всех экспериментальных групп, причем наиболее резкое снижение наблюдалось у животных, подвергнутых комбинированному воздействию факторов (снижение на 14, 18 и 60% в группах АнОВ, облучение и АнОВ + облучение соответственно), однако различия были недостоверны. Среднее количество выходов в открытый участок лабиринта недостоверно возрастало в ряду АнОВ + облучение, АнОВ и облучение на 50.5, 83, 110% соответственно (рис. 2).
УРПИ
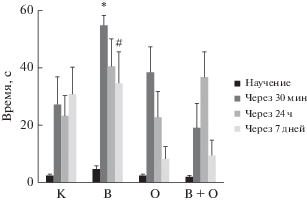
Крысы, подвергнутые АнОВ, продемонстрировали хорошее сохранение долговременной памяти при тестировании через все использованные в эксперименте промежутки времени: время пребывания в светлом отсеке камеры было больше на 101% относительно контроля (p < 0.05) и на 131% относительно показателей крыс группы АнОВ + облучение (p < 0.01), хотя с увеличением интервалов времени с момента выработки рефлекса наблюдалась тенденция к его сокращению. В группах облучение и АнОВ + облучение зафиксирована четкая тенденция к снижению времени пребывания в светлом отсеке камеры при тестировании через 7 сут, хотя различия были недостоверны (рис. 3).
Водный лабиринт Морриса
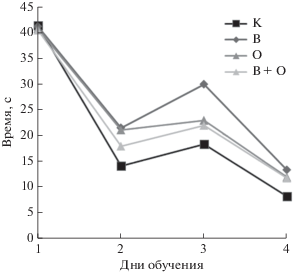
При тестировании в водном лабиринте Морриса значимых различий обнаружено не было. Все крысы как контрольной, так и экспериментальных групп успешно обучились нахождению платформы, хотя обучение животных экспериментальных групп по сравнению с контролем происходило несколько медленнее, причем наихудшие результаты показали крысы, подвергнутые АнОВ (рис. 4).
Нейрохимические исследования
Исследование концентрации моноаминов и их метаболитов в префронтальной коре (табл. 1) показало, что показатели крыс контрольной группы и группы АнОВ + облучение достоверно не различаются. При этом облучение вызывает статистически значимое снижение концентрации 3-МТ, метаболита ДА, значимое снижение концентрации серотонина 5-ОТ и тенденцию к снижению концентрации 5-ОИУК, метаболита серотонина, по отношению к контрольным животным. При сравнении показателей облученных животных с таковыми животных, подвергнутых комбинированному воздействию, выявлена только тенденция к уменьшению концентрации ДА.
Таблица 1.
Концентрация моноаминов и их метаболитов (нмоль/г ткани) в префронтальной коре мозга крыс
| № | Группа | НА | ДОФУК | ДА | ГВК | 3-МТ | 5-ОИУК | 5-ОТ |
|---|---|---|---|---|---|---|---|---|
| 1 | Контр. | 1.91 ± 0.06 | 0.23 ± 0.01 | 0.42 ± 0.03 | 0.30 ± 0.04 | 0.05 ± 0.02 | 1.26 ± 0.06 | 2.90 ± 0.07 |
| 2 | АнОВ | 1.20 ± 0.05 | 0.20 ± 0.01 | 0.52 ± 0.03 | 0.29 ± 0.01 | 0.08 ± 0.02 | 1.24 ± 0.08 | 2.76 ± 0.07 |
| р = 1 vs 2 | 0.596 | 0.201 | 0.820 | 0.747 | 0.379 | 0.884 | 0.220 | |
| 3 | Обл. | 1.93 ± 0.09 | 0.24 ± 0.02 | 0.45 ± 0.02 | 0.39 ± 0.05 | 0.13 ± 0.01 | 1.07 ± 0.05 | 2.62 ± 0.06 |
| р = 1 vs 3 | 0.878 | 0.623 | 0.581 | 0.265 | 0.013 | 0.070 | 0.026 | |
| р = 2 vs 3 | 0.821 | 0.130 | 0.088 | 0.113 | 0.102 | 0.152 | 0.216 | |
| 4 | Выв. | 1.87 ± 0.09 | 0.18 ± 0.01 | 0.48 ± 0.08 | 0.27 ± 0.08 | 0.05 ± 0.02 | 0.94 ± 0.07 | 2.54 ± 0.13 |
| р = 4 vs 1 | 0.731 | 0.050 | 0.584 | 0.735 | 0.853 | 0.014 | 0.050 | |
| р = 4 vs 2 | 0.469 | 0.401 | 0.645 | 0.832 | 0.297 | 0.033 | 0.201 | |
| р = 4 vs 3 | 0.68 | 0.042 | 0.74 | 0.23 | 0.009 | 0.205 | 0.618 |
При вывешивании значимо снижается концентрация ДОФУК, метаболита ДА, по сравнению с контрольными и облученными крысами. По сравнению с облученными крысами была снижена также концентрация 3-МТ, метаболита ДА. У вывешенных крыс уменьшена концентрация метаболита серотонина 5-ОИУК по сравнению как с контрольной группой, так и с группой комбинированного воздействия. У вывешенных крыс концентрация серотонина значимо уменьшена по сравнению с контрольной группой.
В прилежащем ядре (табл. 2) не наблюдалось значимых различий между контрольной группой, группой крыс, подвергнутых комбинированному воздействию, и группой облученных животных. Вместе с тем, АнОВ вызывало значительные изменения, заключающиеся в следующем. Концентрации метаболитов ДА, ДОФУК и ГВК, были значительно снижены по сравнению с контролем, группами животных, подвергнутых комбинированному воздействию и облучению. Концентрация ДА у крыс этой группы была значимо снижена по сравнению с облученными крысами,а при сравнении с контрольной и группой крыс АнОВ + облучение была выявлена значительная тенденция к снижению концентрации ДА. Концентрация третьего метаболита ДА, 3‑МТ была значимо снижена по сравнению с группой АнОВ + облучение, а по сравнению с контрольной группой животных выявлена тенденция к уменьшению его концентрации.
Таблица 2.
Концентрация моноаминов и их метаболитов (нмоль/г ткани) в прилежащем ядре мозга крыс
| № | Группа | НА | ДОФУК | ДА | ГВК | 3-МТ | 5-ОИУК | 5-ОТ |
|---|---|---|---|---|---|---|---|---|
| 1 | Контр. | 3.63 ± 0.55 | 8.94 ± 0.7 | 52.34 ± 4.64 | 5.75 ± 0.44 | 0.63 ± 0.13 | 3.76 ± 0.12 | 4.52 ± 0.13 |
| 2 | АнОВ | 4.37 ± 0.64 | 8.34 ± 0.40 | 49.12 ± 3.36 | 6.47 ± 0.58 | 0.55 ± 0.08 | 4.39 ± 0.45 | 4.82 ± 0.59 |
| р = 1 vs 2 | 0.465 | 0.559 | 0.649 | 0.401 | 0.682 | 0.234 | 0.648 | |
| 3 | Обл. | 3.36 ± 0.60 | 7.50 ± 0.33 | 46.88 ± 2.07 | 5.42 ± 0.27 | 0.52 ± 0.11 | 3.45 ± 0.12 | 4.45 ± 0.39 |
| р = 1 vs 3 | 0.779 | 0.135 | 0.464 | 0.585 | 0.585 | 0.129 | 0.886 | |
| р = 2 vs 3 | 0.350 | 0.189 | 0.620 | 0.165 | 0.855 | 0.091 | 0.653 | |
| 4 | Выв. | 3.57 ± 0.73 | 5.60 ± 0.27 | 39.59 ± 1.86 | 3.94 ± 0.16 | 0.30 ± 0.03 | 2.86 ± 0.14 | 3.91 ± 0.12 |
| р = 4 vs 1 | 0.957 | 0.040 | 0.052 | 0.009 | 0.064 | 0.002 | 0.016 | |
| р = 4 vs 2 | 0.506 | 0.001 | 0.055 | 0.047 | 0.028 | 0.017 | 0.189 | |
| р = 4 vs 3 | 0.850 | 0.004 | 0.047 | 0.003 | 0.130 | 0.020 | 0.271 |
У вывешенных крыс была значимо снижена концентрация метаболита серотонина 5-ОИУК по сравнению со всеми тремя исследованными группами крыс, а концентрация серотонина в прилежащем ядре вывешенных крыс была статистически значимо уменьшена только по сравнению с контрольными крысами.
В дорзальном стриатуме (табл. 3) изменения были менее выражены, чем в вентральном стриатуме (табл. 2, прилежащее ядро). Изменения в основном касаются НА системы. Выявлено значимое увеличение концентрации НА у облученных и вывешенных крыс по сравнению с контрольной группой. Обнаружена тенденция к снижению концентрации ДОФУК, метаболита ДА, по отношению к контрольной группе крыс.
Таблица 3.
Концентрация моноаминов и их метаболитов (нмоль/г ткани) в стриатуме мозга крыс
| № | Группа | НА | ДОФУК | ДА | ГВК | 3-МТ | 5-ОИУК | 5-ОТ |
|---|---|---|---|---|---|---|---|---|
| 1 | Контр. | 0.73 ± 0.03 | 5.78 ± 0.36 | 60.18 ± 3.92 | 5.23 ± 0.35 | 1.14 ± 0.27 | 4.04 ± 0.21 | 3.31 ± 0.06 |
| 2 | АнОВ | 1.21 ± 0.32 | 5.43 ± 0.42 | 56.34 ± 2.61 | 5.18 ± 0.48 | 0.73 ± 0.10 | 4.46 ± 0.31 | 3.41 ± 0.21 |
| р = 1 vs 2 | 0.213 | 0.584 | 0.487 | 0.956 | 0.240 | 0.354 | 0.679 | |
| 3 | Обл. | 1.04 ± 0.04 | 5.08 ± 0.24 | 56.14 ± 1.99 | 5.27 ± 0.26 | 0.97 ± 0.09 | 4.08 ± 0.22 | 3.49 ± 0.13 |
| р = 1 vs 3 | 0.003 | 0.182 | 0.434 | 0.931 | 0.614 | 0.923 | 0.272 | |
| р = 2 vs 3 | 0.632 | 0.530 | 0.957 | 0.897 | 0.155 | 0.399 | 0.766 | |
| 4 | Выв. | 1.01 ± 0.05 | 4.94 ± 0.13 | 58.37 ± 1.45 | 4.98 ± 0.12 | 1.08 ± 0.25 | 3.99 ± 0.27 | 3.12 ± 0.14 |
| р = 4 vs 1 | 0.002 | 0.085 | 0.708 | 0.573 | 0.893 | 0.888 | 0.301 | |
| р = 4 vs 2 | 0.582 | 0.349 | 0.560 | 0.718 | 0.283 | 0.338 | 0.332 | |
| р = 4 vs 3 | 0.684 | 0.673 | 0.440 | 0.404 | 0.726 | 0.824 | 0.119 |
В гипоталамусе (табл. 4) облучение вызывает значительное повышение концентрации ДОФУК, ДА, ГВК, 5-ОИУК и 5-ОТ по сравнению с контрольной группой. При сравнении с группой комбинированного воздействия облучение вызывает повышение концентрации ДА, ГВК и тенденцию к повышению концентраций ДОФУК, 5-ОИУК и 5‑ОТ. При вывешивании наблюдалась тенденция к повышению концентрации ДОФУК, ДА, 5-ОИУК и 5-ОТ по отношению к контролю и ярко выраженная тенденция к повышению концентрации ДА по отношению к группе комбинированного воздействия.
Таблица 4.
Концентрация моноаминов и их метаболитов (нмоль/г ткани) в гипоталамусе мозга крыс
| № | Группа | НА | ДОФУК | ДА | ГВК | 3-МТ | 5-ОИУК | 5-ОТ |
|---|---|---|---|---|---|---|---|---|
| 1 | Контр. | 8.04 ± 1.63 | 0.19 ± 0.04 | 1.73 ± 0.35 | 0.18 ± 0.03 | 0.07 ± 0.03 | 2.35 ± 0.31 | 5.34 ± 0.48 |
| 2 | АнОВ | 9.81 ± 0.80 | 0.23 ± 0.03 | 1.79 ± 0.10 | 0.18 ± 0.03 | 0.01 ± 0.006 | 2.9 ± 0.32 | 5.97 ± 0.49 |
| р = 1 vs 2 | 0.409 | 0.542 | 0.896 | 0.879 | 0.173 | 0.293 | 0.433 | |
| 3 | Обл. | 10.84 ± 0.53 | 0.33 ± 0.03 | 2.91 ± 0.25 | 0.30 ± 0.03 | 0.07 ± 0.05 | 3.86 ± 0.28 | 7.59 ± 0.44 |
| р = 1 vs 3 | 0.183 | 0.028 | 0.041 | 0.023 | 0.9850 | 0.012 | 0.015 | |
| р = 2 vs 3 | 0.385 | 0.070 | 0.006 | 0.030 | 0.344 | 0.079 | 0.059 | |
| 4 | Выв. | 13.30 ± 2.65 | 0.37 ± 0.07 | 3.31 ± 0.59 | 0.29 ± 0.06 | 0.08 ± 0.04 | 4.23 ± 0.67 | 8.86 ± 1.32 |
| р = 4 vs 1 | 0.169 | 0.080 | 0.075 | 0.132 | 0.844 | 0.052 | 0.056 | |
| р = 4 vs 2 | 0.292 | 0.141 | 0.053 | 0.165 | 0.169 | 0.149 | 0.105 | |
| р = 4 vs 3 | 0.440 | 0.657 | 0.601 | 0.900 | 0.857 | 0.664 | 0.439 |
В гиппокампе (табл. 5) обнаружены снижение концентрации 5-ОИУК, метаболита серотонина, у вывешенных крыс по отношению к группе комбинированного воздействия, выраженная тенденция к снижению концентрации НА у облученных крыс по отношению к группе комбинированного воздействия, а также выраженная тенденция к снижению концентрации 5-ОИУК, метаболита серотонина, по отношению к группам комбинированного воздействия и облучения.
Таблица 5.
Концентрация моноаминов и их метаболитов (нмоль/г ткани) в гиппокампе мозга крыс
| № | Группа | НА | ДОФУК | ДА | ГВК | 3-МТ | 5-ОИУК | 5-ОТ |
|---|---|---|---|---|---|---|---|---|
| 1 | Контр. | 2.57 ± 0.09 | 0.13 ± 0.01 | 0.17 ± 0.04 | 0.15 ± 0.04 | 0.06 ± 0.02 | 2.83 ± 0.1 | 3.07 ± 0.11 |
| 2 | АнОВ | 2.79 ± 0.17 | 0.14 ± 0.01 | 0.20 ± 0.03 | 0.11 ± 0.01 | 0.03 ± 0.01 | 3.30 ± 0.2 | 3.27 ± 0.07 |
| р = 1 vs 2 | 0.360 | 0.442 | 0.566 | 0.364 | 0.229 | 0.102 | 0.187 | |
| 3 | Обл. | 2.33 ± 0.07 | 0.16 ± 0.01 | 0.15 ± 0.02 | 0.09 ± 0.02 | 0.04 ± 0.01 | 2.90 ± 0.14 | 3.11 ± 0.15 |
| р = 1 vs 3 | 0.103 | 0.121 | 0.817 | 0.237 | 0.386 | 0.707 | 0.822 | |
| р = 2 vs 3 | 0.060 | 0.308 | 0.272 | 0.463 | 0.618 | 0.195 | 0.436 | |
| 4 | Выв. | 2.37 ± 0.15 | 0.17 ± 0.02 | 0.26 ± 0.08 | 0.16 ± 0.05 | 0.09 ± 0.03 | 2.52 ± 0.09 | 3.01 ± 0.15 |
| р = 4 vs 1 | 0.339 | 0.136 | 0.385 | 0.880 | 0.560 | 0.072 | 0.827 | |
| р = 4 vs 2 | 0.143 | 0.261 | 0.543 | 0.410 | 0.152 | 0.015 | 0.208 | |
| р = 4 vs 3 | 0.809 | 0.536 | 0.294 | 0.29 | 0.224 | 0.074 | 0.702 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Как было показано в наших предыдущих экспериментах [9, 16–18], основные компоненты двигательной и ориентировочно-исследовательской активности у животных экспериментальных групп после воздействия АнОВ достаточно быстро восстанавливаются, о чем свидетельствует отсутствие достоверных различий с контролем по всем показателям активного поведения крыс при тестировании их в “открытом поле”. Из результатов этих же экспериментов был сделан общий вывод о том, что АнОВ является наиболее значимым фактором из всех используемых, оказывающим влияние на поведение крыс, о чем свидетельствуют остаточные явления повышенной тревожности у животных этой группы. Это подтверждает и более медленное обучение этих крыс в водном тесте Морриса. Эти данные согласуются с результатами, полученными при изучении поведения крыс в “открытом поле” после облучения протонами, когда значимые изменения были обнаружены только при облучении в самой большой дозе (4 Гр) [7]. Однако результаты экспериментов с облучением протонами низкой энергии взрослых самцов крыс инбредных линий Fischer 344 и Lewis в дозах 25 и 100 сГр выявили выраженное нарушение когнитивных функций, таких как устойчивость внимания и уровень работоспособности ЦНС [19, 20]. У крыс Fischer 344 обнаружены более высокие уровни тирозин – гидроксилазы и транспортеров дофамина в лобной коре. Таким образом, центральные дофаминергические механизмы непосредственно связаны как с реализацией когнитивных функций, так и с радиационными нарушениями этих функций. Хорошо известно, что концентрация КА в структурах мезолимбической ДА системы контролирует эмоционально-мотивационное поведение, внимание, пространственное обучение и память [21]. Облучение протонами головного мозга мышей приводило к изменению экспрессии генов в гиппокампе и секреции нейротрофинов [22], а также к функциональным нарушениям мРНК [23]. Гамма-облучение в низких дозах вызывает изменения в экспрессии генов, регулирующих ионные каналы и синаптическую пластичность [24]. В наших экспериментах также было получено достоверное ухудшение дискриминантного обучения в Т-образном лабиринте после облучения головы крыс протонами с энергией 170 МэВ в пике Брэгга в дозах 1 и 2 Гр [7].
В то же время результаты исследования поведения крыс в приподнятом крестообразном лабиринте, являющемся общепринятым тестом на тревожность, выявили снижение тревожности животных экспериментальных групп по всем показателям. Наибольшее увеличение времени, проведенного в открытом участке лабиринта, а также частоты выходов в открытый участок у облученных крыс, вероятно, можно объяснить широко известным возбуждающим эффектом облучения в небольших дозах [18].
Отдельного обсуждения заслуживает влияние облучения на процессы консолидации памяти. Так, через 30 мин и 24 ч эффект не отличается от контрольного, однако при тестировании долговременной памяти наблюдается заметное снижение воспроизведения памятного следа у крыс обеих групп, подвергшихся облучению. Возможно негативное влияние облучения на хранение памятного следа. Ряд работ говорит о том, что облучение вызывает нарушения в процессах нейрогенеза и синаптогенеза [20, 25].
Интересно проанализировать особенности поведения животных при изучаемых воздействиях в сопоставлении с результатами предыдущих экспериментов с разной продолжительностью АнОВ. С этой точки зрения результаты данного эксперимента занимают промежуточное положение между результатами экспериментов с использованием 30-суточного [8] и 14-суточного АнОВ [9]. Наиболее существенные нейробиологические эффекты были получены при комбинированном воздействии 30-суточного АнОВ и ионизирующих излучений, в частности, угнетение активных компонентов поведения в “открытом поле”, повышение тревожности и достоверное нарушение долговременной памяти при воздействии АнОВ и АнОВ + облучение. При 14-суточном воздействии подобных нарушений не наблюдалось, напротив, происходило снижение тревожности по всем показателям. В данном же эксперименте мы видим тенденцию к снижению долговременной памяти в тех же экспериментальных группах и достаточно противоречивую картину показателей тревожности и пассивно-оборонительного поведения. Возможно, это можно объяснить тем, что в экспериментах различной продолжительности основные воздействия приходились на разные стадии общего адаптационного синдрома (ОАС): стадию истощения при 30-суточном АнОВ, стадию резистентности при 14-суточном АнОВ и стадию тревоги в данном эксперименте.
Полученные результаты нейрохимических исследований показывают, что изменение концентрации моноаминов и их метаболитов, а именно, достоверное их снижение по сравнению с виварийным контролем, наблюдается при изолированном воздействии облучения и АнОВ. Это можно интерпретировать как отрицательное влияние данных воздействий на метаболизм моноаминов и, соответственно, на поведение. При этом влияние этих факторов на метаболизм моноаминов проявляется более интенсивно, чем на поведение. Это связано с тем, что нейрохимические процессы более чувствительны к воздействиям физических факторов, чем поведение, в связи с тем, что поведение является интегративным показателем более высокого уровня, чем нейрохимические показатели, и предполагает значительно более широкие возможности компенсации нарушенных функций.
Снижение активности ДА и СТ систем в прилежащем ядре у крыс группы АнОВ кажется особенно интересным, поскольку в нашем предыдущем исследовании такого снижения не наблюдается. Таким образом, 7-дневное АнОВ сказывается на концентрации катехоламинов сильнее, чем 14‑дневное. Это может быть связанно с более выраженным стрессогенным эффектом краткосрочного АнОВ [26], что подтверждает наше предположение о стадии тревоги ОАС, на которую пришлось экспериментальное воздействие. Тот факт, что изменения в дофаминергической и серотонинергической системах в гипоталамусе и прилежащем ядре носят разнонаправленный характер, хотя они имеют одинаковый источник данных медиаторов [27, 28], может быть связан с собственным метаболизмом моноаминов в гипоталамусе [28]. Другим объяснением данного факта может быть различный характер метаболизма моноаминов в префронтальной коре и в прилежащем ядре [29].
Примечателен тот факт, что в предыдущем нашем исследовании [18] изменения концентрации моноаминов в префронтальной коре были более выражены для ДА системы. В данном же эксперименте наиболее значимые изменения в префронтальной коре коснулись серотонина в группе облученных крыс. Здесь мы также наблюдаем разнонаправленный эффект факторов АнОВ и облучения при комбинированном воздействии. Таким образом, при более длительном вывешивании наблюдается более высокая чувствительность префронтальной коры к экспериментальным воздействиям.
Наиболее интересным и парадоксальным результатом нашего исследования является то, что в ряде случаев наблюдается нивелирование эффектов при комбинированном действии облучения и АнОВ, проявляющееся как в поведении, так и в нейрохимических изменениях во всех пяти исследованных структурах мозга, несмотря на то, что эти структуры играют различную роль в реализации поведения. Подобный эффект был обнаружен в отношении апоптоза в коре мозга при исследовании комбинированного воздействия АнОВ и гамма-облучения [10].
Список литературы
Rabin B.M., Joseph J.A., Shukitt-Hale B. // Adv. Space Res. 2003. V. 31. № 1. P. 127–33.
Rabin B.M., Joseph J.A., Shukitt-Hale B. // Radiat. Res. 2005. V. 164. № 4. Pt. 2. P. 552–555.
Machida M., Lonart G., Britten R.A. // Radiat. Res. 2010 V. 174. № 5. P. 618–623.
Britten R.A., Davis L.K., Johnson A.M., Keeney S., Siegel A., Sanford L.D., Singletary S.J., Lonart G. // Radiat. Res. 2012. V. 77. № 2. P. 146–151.
Rabin B.M., Hunt W.A., Joseph J.A., Dalton T.K., Kandasamy S.B. // Radiat. Res. 1991. V. 128. № 2. P. 216–221.
Pecaut M.J., Haerich P., Zuccarelli C.N., Smith A.L., Zendejas E.D., Nelson G.A. // Cogn. Affect Behav. Neurosci. 2002. V. 2. № 4. P. 329–340.
Штемберг А.С., Кохан В.С., Кудрин В.С., Матвеева М.И., Лебедева-Георгиевская К.Б., Тимошенко Г.Н., Молоканов А.Г., Красавин Е.А., Наркевич В.Б., Клодт П.М., Базян А.С. // Нейрохимия, 2015. Т. 32. № 1. С. 78–85.
Штемберг А.С., Лебедева-Георгиевская К.Б., Матвеева М.И., Кудрин В.С., Наркевич В.Б., Клодт П.М., Базян А.С. // Известия РАН. Серия Биологическая. 2014. № 2. С. 168–175.
Kokhan V.S., Matveeva M.I., Bazyan A.S., Kudrin V.S., Mukhametov A., Shtemberg A.S. // Behav. Brain. Res. 2017. 320. P. 473–483.
Mao X.W., Nishiyama N.C., Pecaut M.J., Campbell-Beachler M., Gifford P., Haynes K.E., Becronis C., Gridley D.S. // Radiat. Res. 2016. V. 185. № 6. 647–657
Pani G., Verslegers M., Quintens R., Samari N., de Saint-Georges L., van Ostveldt P., Baatout S., Benotmane M.A. // PLoS One. 2016. V. 11. № 5. e0155260. https://doi.org/10.1371/journal.pone
Базян А.С. // XVIII Международная научно-техническая конференция “Нейроинформатика – 16”: Лекции по нейроинформатике. М.: НИЯУ МИФИ, 2016. С. 147–170. 224 с.
Базян А.С. // Успехи физиол. наук. 2016. Т. 47. № 1. С. 17–29.
Базян А.С. // Успехи физиол. наук. 2016. Т. 47. № 3. С. 15–33.
Базян А.С., Рогаль А.В. // Успехи физиол. наук, 2015. Т. 46. № 1. С. 3–21.
Штемберг А.С., Базян А.С., Лебедева-Георгиевская К.Б., Матвеева М.И., Кудрин В.С., Кохан В.С. // Авиакосм. и экол. мед. 2013. Т. 47. № 6. С. 54–60.
Штемберг А.С. // Авиакосм. и экол. мед. 1997. Т. 31. № 2. С. 38–43.
Штемберг А.С. // Авиакосм. и экол. мед. 2005. Т. 39. № 4. С. 50–52.
Raber J., Allen A.R., Rosi S., Sharma S., Dayger C., Davis M.J., Fike J.R. // Behav. Brain. Res. 2013. V. 246. P. 69–75.
Davis C.M., De Cicco-Skinner K.L., Hienz R.D. // PLoS One. 2015. V. 10. № 12. e0144556.
Luo H., Li Y., Liu Z., Cao L., Zhang Z., Wang Y., Zhang X., Liu Z., Shi X. // Neural Regen. Res. 2016. V. 11. № 9. P. 1480–1486.
Chang, P.Y., Doppalapudi, R., Bakke, J., Wang A., Menda S., Davis Z. // Radiat. Environ. Biophys. 2010. V. 49. № 3. P. 379–388.
Khan S.Y., Tariq M.A., Perrott J.P., Brumbaugh C.D., Kim H.J., Shabbir M.I., Ramesh G.T., Pourmand N. // Mol. Cell. Biochem. V. 382. Issue 1–2. P. 225–235.
Lowe X., Wyrobek A. // Current Genomics. 2012. V. 13. № 6. P. 489–497.
Tseng B.P., Lan M.L., Tran K.K., Acharya M.M., Giedzinski E., Limoli C.L. // Redox. Biology. 2013. V. 19. № 1. P. 153–162.
Mahar I., Bambico F.R., Mechawar N., Nobrega J.N. // Neurosci. Biobehav. Rev. 2014. 38. P. 173–192.
Van Bockstaele E.J., Biswas A., Pickel V.M. // Brain Res. 1993. V. 624. № 1–2. P. 188–198.
de Wardener H.E. // Physiol. Rev. 2001. V. 81. № 4. P. 1599–1658.
Belujon P., Patton M.H., Grace A.A. // Cerebral Cortex 2014. V. 24. № 4. P. 968–977.
Дополнительные материалы отсутствуют.
Инструменты
Нейрохимия