Нейрохимия, 2019, T. 36, № 3, стр. 246-253
Влияние ионизирующего излучения на креатин-креатинкиназную систему мозга крыс и противолучевое действие креатина
М. С. Петросян 1, Л. С. Нерсесова 1, Н. А. Адамян 1, М. Г. Газарянц 1, Ж. И. Акопян 1
1 Институт молекулярной биологии НАН РА
Ереван, Армения
Поступила в редакцию 24.08.2018
После доработки 06.11.2018
Принята к публикации 12.11.2018
Аннотация
Креатинкиназа (КК) со своими субстратами креатином (Кр) и креатинфосфатом (КФ) образует Кр–КФ–КК-азную систему, которая наряду с буферной и транспортной ролями в энергетическом обмене клетки, выполняет и функцию поддержки стабильности митохондриальных мембран, что в совокупности обусловливает нейропротекторную роль Кр. Учитывая антиапоптотические и антиоксидантные свойства Кр, а также тот факт, что в основе радиационного поражения лежит механизм оксидативного стресса, мы исследовали: 1) влияние ионизирующего излучения на динамику пострадиационных изменений активности КК и содержания Кр в мозгу беспородных крыс после их облучения в сублетальной дозе 4.5 Гр в присутствии и отсутствие Кр; 2) противолучевую эффективность Кр в отношении Кр–КК системы мозга и выживаемости крыс после их облучения в дозе ЛД70/30, равной 6.3 Гр. Полученные данные показали высокую степень радиочувствительности и адаптабельности Кр–КК системы мозга, а также значительную противолучевую эффективность Кр как в отношении Кр–КК системы мозга, так и выживаемости крыс. Радиозащитный эффект Кр, рассчитанный с использованием статистической модели выживаемости Каплана–Мейера составил для группы, получавшей раствор Кр в 0.9% глюкозе, по отношению к контрольной группе, получавшей вместо Кр воду – 38.6%, а по отношению к контрольной группе, получавшей 0.9% раствор глюкозы – 30.3%. Для группы, получавшей водный раствор Кр, эффект оказался меньшим – 20.5% в сравнении с соответствующей ей контрольной группой, что, очевидно, связано со сравнительно худшей усвояемостью клеткой Кр из водного раствора.
ВВЕДЕНИЕ
Kреатинкиназа (НФ 2.7.3.2.), катализируя обратимый перенос фосфорильного остатка с АТФ на креатин (Кр), играет ключевую роль в энергетическом гомеостазе клеток с высокими энергетическими потребностями, и, в частности, клеток мозга. Вместе со своими субстратами Кр и креатин-фосфатом (КФ) креатинкиназа (КК) образует Кр–КФ–КК-азную систему, которая, как показали исследования последних лет [1–3], выполняет не только буферную и транспортную роли в энергетическом обмене клетки, но и ряд других функций, среди которых особое место занимает функция поддержки стабильности митохондриальных мембран, связанная с протекторной ролью Кр. В мозгу димерная цитоплазматическая КК присутствует как в цитоплазме, так и в таких субклеточных структурах, как например эндоплазматический ретикулум и плазматическая мембрана нейронов, а также в мембранах, богатых ацетилхолиновыми рецепторами [1]. Доказано, что ВВ-КК участвует в сохранении кальциевого гомеостаза, процессинге нейротрансмиттеров, а также аксональном и дендритном транспорте [4]. Октамерная мозговая митохондриальная КК в составе протеолипидного комплекса может прямо трансфосфорилировать Кр внутримитохондриально продуцируемым АТФ-ом в КФ, который затем транспортируется в цитоплазму в качестве запасного макроэрга. Кроме того, митохондриальная КК оказывает стабилизирующее и протекторное действие на открытие митохондриальных временных проницаемых пор, а следовательно, влияет на процессы апоптоза и некроза [1]. Основную часть необходимого Кр организм человека получает через пищу, а оставшаяся часть синтезируется в самом организме. Кр из кровотока легко проходит через гемато-энцефалический барьер с помощью специального Nа-зависимого транспортного белка-переносчика, после чего активно извлекается из экстрацеллюлярной жидкости мозга нейронами и олигодендроцитами, а астроциты, лишенные транспортного белка, способны синтезировать Кр сами [1, 3].
Ионизирующее излучение (ИИ) оказывает на клетки как прямое действие, вызывая разрывы химических связей в макромолекулах, в том числе и ферментных белках, так и опосредованное, обусловленное образованием свободных радикалов, которые агрессивно взаимодействуют с макромолекулами [5]. В результате этого имеют место изменения, как в уровнях активности, так и в биосинтезе ферментов, что служит основанием для использования анализа активности ферментов для оценки влияния ионизирующего излучения и изучения эффективности различных радиопротекторов [6–8]. Ранее нами было исследовано влияние рентгеновского излучения на активность ряда ключевых ферментов клеточного метаболизма, в том числе и КК, в различных органах и сыворотке крови; наиболее радиочувствительным ферментом оказалась КК [9]. Необходимо отметить, что до недавнего времени в центре внимания исследователей была мышечная КК. Интерес к мозговой КК усилился в последнее десятилетие в связи с обнаружением ее роли в патогенезе нейродегенеративных заболеваний и процессов старения, в основе которых лежит окислительный стресс, а также протекторного действия Кр на эти процессы. Оказалось, что Кр способствует заметной нейропротекции в экспериментальных моделях животных при амиотрофическом боковом склерозе, болезни Хантингтона, паркинсонизме, травматических повреждениях мозга и спинного мозга, церебральной ишемии [10–13]. Как показали многочисленные исследования с применением различных методических подходов протекторное действие Кр обусловлено, в основном, его антиапоптотическими и антиоксидантными свойствами. Учитывая то, что в основе этиопатогенеза радиационного поражения также находится окислительный стресс, в данной работе мы исследовали влияние ионизирующего излучения на Кр–КК-ую систему мозга крыс и противолучевое действие Кр.
МЕТОДЫ ИССЛЕДОВАНИЯ
В двух сериях опытов использовано 60 и 72 белых беспородных крыс-самцов, соответственно, весом 180–210 г, которые содержались в стандартных условиях, в том числе на стандартном рационе питания. Общее однократное облучение крыс проводили в изолированном помещении, предназначенном для подобных опытов, на рентгеновской установке “РУМ-17” (напряжение 200 киловольт, сила тока 20 мА, Cu–Al фильтр; кожно-фокусное расстояние 50 см, мощность дозы облучения 1.78 Гр/мин).
В первой серии опытов животные, которые подвергались облучению в дозе 4.5 Гр, были разделены на 1 опытную и 2 контрольные группы по 15 особей в каждой: опытной группе за 2 недели до и 2 недели после облучения давали per os в дозе 1 г/кг веса животного креатин, растворенный в 0.9% растворе глюкозы, а 2 контрольным группам 0.9% раствор глюкозы и воду, соответственно. Кроме того, в качестве исходного контроля была использована равноценная по числу крыс группа интактных животных. Пострадиационные эффекты исследовались в 1-ые, 7-ые, 15-ые сутки после лучевого воздействия путем отбора на каждый срок из опытных и контрольных групп по 5 крыс.
Во второй серии опытов, посвященной исследованию выживаемости крыс после облучения их в дозе ЛД70/30, равной 6.3 Гр, в присутствии и отсутствие креатина, животные были разделены на 6 групп, по 12 особей в каждой. Крысам первой и второй опытных групп per os в дозе 1 г/кг веса животного давали креатин, растворенный в 0.9% растворе глюкозы и в воде, соответственно; двум облучаемым контрольным группам – 0.9% раствор глюкозы и воду, соответственно. Кроме того, в качестве контроля были использованы 2 группы интактных животных, получавшие и не получавшие раствор креатина в 0.9% глюкозе, соответственно. Противолучевые свойства радиопротектора оценивали по выживаемости животных в течение 30 сут после облучения согласно статистическому методу Каплан–Майер программы SPSS 16 [14].
В экстрактах мозга и сыворотке крови крыс, выживших в опытных группах через 30 дней после облучения, а также в указанных выше контрольных группах были определены уровни активности КК и содержание Кр.
Для определения активности КК и содержания креатина в мозге и сыворотке крови проводили декапитацию животных после эфирного наркоза. Кровь собирали в пробирки без антикоагулянта, после ее свертывании центрифугировали в рефрижераторной центрифуге при 800 g в течение 20 мин и полученную сыворотку крови использовали в тот же день для определения ферментной активности. Мозг отмывали от крови охлажденным физиологическим раствором и гомогенизировали в экстрагирующем буферном растворе с pH 7.2 (0.1 моль/л трис-HCl, 5 ммоль/л дитиотреитола (ДТТ) и 1 ммоль/л этилендиаминтетраацетата (ЭДТА)). Экстракты полученные после центрифугирования гомогенатов при 23 000 g в течение 30 мин, использовали для определения ферментной активности. КК-ную активность определяли спектрофотометрически по накоплению продукта реакции креатина [15]. Ферментную активность выражали в мкмоль/г влажной ткани в мин для ткани мозга и мкмоль/л мин для сыворотки крови.
Содержание креатина в мкг/г влажного веса мозга и в мкг/мл сыворотки определяли спекрофотометрически согласно методу Эннора и Розенберга [16].
Использованные реагенты: креатин моногидрат, креатинфосфат динатриевая соль (тетрагидрат), АДФ натриевая соль, 1-нафтол, диацетил (2.3 бутандиол), дитиотрейтол, ЭДТА фирмы Sigma Aldrich (Германия), а также 40% глюкоза (ОАО Ереванская ХФФ).
Для наглядного изображения рассчитанные средние и их стандартные отклонения для уровней активности КК и содержания Кр на графиках выражены в % по отношению к контрольному уровню, которым служили соответствующие данные, полученные для интактных животных (результаты 3 независимых экспериментов).
Для статистической обработки данных использован пакет SPSS (Statistical Package for Social Science). Характер распределения полученных данных определен методом Колмогорова-Смирнова. Сравнительный анализ проведен с использованием непараметрического теста Манна–Уитни. Различия считались достоверными при р < 0.05. Корреляционный анализ проведен с использованием непараметрического теста Спирмена.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Как известно, биохимическим критерием радиационного повреждения ферментов является утрата присущей им активности. Окончательное проявление биологического поражения ферментных молекул in vivo может растягиваться на дни [5]. Ранее, при исследовании влияния сублетальных доз рентгеновского облучения на активность ряда ферментов, в том числе КК, в различных органах и сыворотке крови крыс, нами было показано, что: 1) облучение вызывает колебательные изменения уровня КК-ой активности во времени, которые в ряде случаев имеют бифазный характер; 2) КК является одним из наиболее радиочувствительных и адаптабельных ферментов [9]. Учитывая это, а также нейропротекторные свойства Кр, представляло интерес исследовать влияние рентгеновского излучения на динамику пострадиационных изменений уровней КК-активности и содержания Кр в мозге и сыворотке крыс в присутствии и отсутствие природного адаптогена Кр.
На рис. 1 представлены данные по динамике изменений активности КК (А) и содержания креатина (Б) в в мозге и сыворотке крови крыс после общего облучения их в дозе 4.5 Гр и влиянию креатиновой биодобавки на эти изменения. Как следует из этих данных в первые пострадиационные сутки в мозге крыс контрольных групп 2 и 3, получавших воду и раствор глюкозы, имеет место статистически достоверное падение активности КК (на 40–50%), тогда как в опытной группе крыс, получавших Кр в растворе глюкозы, активность фермента падает только на 20% (рис. 1,А, а,1)). Одновременно с этим в указанных контрольных группах наблюдается повышение содержания эндогенного Кр в мозге (почти на 30%), которое, однако, статистически недостоверно. Повышенное же содержание Кр в мозге крыс опытной группы 1 (на 27%), очевидно, связано с обогащением организма этих животных креатиновой добавкой (рис. 1,Б,а,1), поскольку корреляционный анализ не выявил возможную взаимосвязь между этим повышением и указанным выше падением уровня активности мозговой КК этих животных (r1 = 0.017, p = 0.983). В связи с этим следует отметить, что согласно литературным данным содержание креатина и его производных может повышаться в клетке вплоть до 30% при длительном использовании креатина в качестве эргогенического средства [17]. Наблюдаемые в 1-ые пострадиационные сутки небольшие колебания в уровнях активности КК и в содержании Кр в сыворотке крови животных всех 3 групп статистически недостоверны (рис. 1А и Б, а).
Рис. 1.
Динамика изменений уровней активности КК (А, в %) и содержания креатина (Б, в %) в мозге и сыворотке крови крыс после общего облучения их в дозе 4.5 Гр в присутствии и отсутствие креатина. n = 5 для каждой группы животных: 1 – опытная, получавшая креатин в дозе 1 г/кг веса в 0.9% растворе глюкозы; 2 и 3 – контрольные, получавшие, соответственно воду и 0.9% раствор глюкозы. Пострадиационные сроки: (а) 1-ые, (б) 7-ые, (в) 15-ые сутки. Пунктирная линия – контрольный уровень (интактные крысы), принятый за 100%. * Отличие от контроля достоверно при р < < 0.05–0.001.
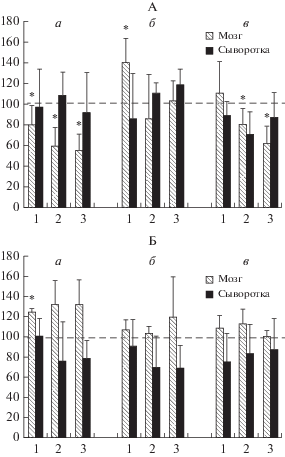
На 7-ые пострадиационные сутки в опытной группе животных отмеченное в первые сутки падение активности мозговой КК сменяется статистически достоверным повышением активности фермента, которое носит скорее всего компенсаторный характер, а к 15 суткам отмечается стабилизация КК-ой активности на контрольном уровне как в мозге, так и в сыворотке крови. Содержание Кр в мозге этих крыс в указанные сутки держится на уровне контроля. В контрольных группах 2 и 3 в эти же сроки обнаруживается тенденция к восстановлению уровня активности мозговой КК до контрольного уровня, которая, однако, на 15-ые пострадиационные сутки сменяется новым достоверным падением уровня активности фермента (на 20–40%), по-видимому, из-за исчерпания нативных адаптационных возможностей Кр–КК-системы мозга этих животных. В то же время уровни содержании Кр в мозге и сыворотке крови крыс этих групп в указанные сроки колеблются вокруг контрольного уровня. Итак, из приведенных данных следует, что Кр оказывает достоверное противолучевое действие на Кр–КК-ую систему мозга, обеспечивая таким образом адаптацию энергетического обмена ткани к лучевому воздействию.
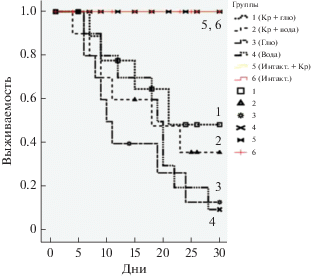
Противолучевое действие Кр было оценено также с использованием, общепринятой в такого рода исследованиях, модели выживаемости крыс при их общем облучении в дозе 6.3 Гр равной ЛД70/30. Учитывая данные литературы о повышении усвоения креатина, поступившего в организм per os, в присутствии сахаров [18], в опытных группах мы использовали раствор Кр как в воде, так и в 0.9% глюкозе. Предварительные опыты показали, что: 1) наиболее эффективная доза креатиновой добавки составляет 1 г/кг веса крысы, 2) используемый нами препарат не токсичен, 3) наиболее эффективный способ введения – за 2 недели до и 2 недели после облучения, 4) повышение содержания Кр в мозге опытных животных прямо пропорционально зависит от получаемой дозы, что свидетельствует о проницаемости гематоэнцефалического барьера для используемого нами Кр. На рис. 2 изображены кривые выживаемости крыс в контрольных и опытных группах, подвергнутых общему облучению в дозе ЛД70/30 = 6.3 Гр при применении креатина в дозе 1 г/кг веса за 2 недели до и 2 недели после облучения. Сравнительный анализ этих данных показывает, что гибель животных в опытной группе 1, получавших Кр в растворе глюкозы, начинается с 7-ого дня после облучения, тогда как в контрольных группах 3 и 4 это имеет место на 2 дня раньше, что свидетельствует о большей резистентности первых к воздействию ИИ; более того, в контрольных группах гибель животных продолжается до 25–28 дня, тогда как в опытной группе 1 гибель их прекращается уже на 21-й день после облучения и это при том, что уже с 16 дня после облучения физическое состояние крыс в этой группе в целом значительно лучше, чем в контрольных. И, наконец, смертность животных в контрольной группе 4, где из 12-и крыс выжили только 3, значительно превышает смертность крыс в опытной группе 1, в которой из 12-и животных выжили 8. Несколько более скромный противолучевой эффект обнаруживается в опытной группе 2, получавшей водный раствор Кр: гибель крыс в данном случае начинается с 6 дня и заканчивается на 23 день; число выживших из 12 крыс составляет 6 в противовес соответствующей контрольной группе 4, в которой, как было указано выше, из 12 крыс выжили только 3. Радиозащитный эффект Кр, рассчитанный с использованием статистической модели выживаемости Каплана–Мейера, составил для группы 1 по отношению к контрольной группе 4 – 38.6%, а по отношению к контрольной группе 3 – 30.3%. Как и следовало ожидать, учитывая сравнительно худшую усвояемость организмом Кр из водного раствора [18], противолучевая эффективность Кр для опытной группы 2 несколько меньше: в сравнении с соответствующей ей контрольной группой 4 радиозащитный эффект для нее составляет 20.5%. Таким образом, данная серия опытов однозначно свидетельствует о противолучевой эффективности Кр, оказавшегося способным повышать резистентность и адаптабельность организма к ИИ.
Рис. 2.
Кривые выживаемости крыс, подвергнутых общему облучению в дозе ЛД50/30 = 6.3 Гр при применении креатина в дозе 1 г/кг веса за 2 недели до и 2 недели после облучения. Опытные группы 1 и 2 – (креатин + 0.9% глюкоза) и (креатин + вода), соответственно; контрольные группы 3 и 4 – 0.9% глюкоза и вода, соответственно; 5 группа – интактные крысы, получавшие креатин + 0.9% глюкоза; 6 группа – интактные крысы. n = 12 для каждой группы.
Для оценки адаптационных свойств мозговой Кр–КК системы крыс, выживших через 30 дней после облучения как в опытных, так и в контрольных группах, были определены изменения в уровнях активности КК и содержания Кр в их мозге и сыворотке крови. Как следует из рис. 3 в опытных группах 1 и 2, получавших Кр в растворе глюкозы и водный раствор Кр, соответствнно, в мозге крыс как активность, так и содержание креатина почти не отличаются от контрольного уровня, что свидетельствует о полном восстановлении физического состояния крыс до нормы благодаря противолучевой эффективности Кр и значительным адаптационным возможностям Кр–КК системы. Таким образом эти данные полностью соответствует приведенным выше данным по выживаемости. Однако, в сыворотке крови этих животных обнаруживаются повышенный уровень активности КК и равноценное повышение содержания Кр. Можно предположить, что в этот период продолжается выведение через кровь из органов и тканей излишков Кр, полученного в опыте в качестве протектора.
Рис. 3.
Активность КК (а, в %) и содержание креатина (б, в %) в мозге и сыворотке крыс при применении креатина в дозе 1 г/кг веса крыс за 2 недели до и 2 недели после облучения на 30-ые сутки после общего облучения их в дозе 6.3 Гр. n = 5 для каждой группы крыс, за исключением группы 3. 1 – Опытная, получавшая креатин в дозе 1 г/кг веса в растворе глюкозы; 2 – опытная, получавшая креатин растворенный в воде в дозе 1 г/кг веса; 3 – контрольная облученная группа (n = 3), получавшая воду; 4 – интактная группа животных, получавшая креатин растворенный в воде. Пунктирная линия – контрольный уровень (интактные крысы), принятый за 100%. * и ** – Отличие от контроля достоверно при р < 0.05–0.001 соответственно.
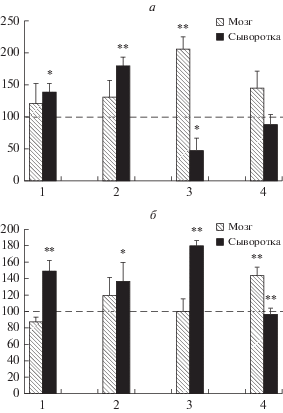
Особый интерес представляют данные относительно контрольных облученных крыс (группа 3), получавших вместо раствора Кр воду, в которой через 30 дней после облучения из 12 животных выжило 3 крысы. У этих выживших животных определяется с высокой степенью достоверности повышенный уровень активности мозговой КК (более чем в 2 раза по сравнению с интактными крысами) при нормальном уровне содержания Кр в нем, что однозначно свидетельствует о том, что в повышенной природной резистентности этих животных к воздействию ИО принимает участие мозговая Кр–КК система. При этом в сыворотке крови этих животных уровень активности КК достоверно вдвое меньше контрольного уровня, а содержание Кр вдвое выше при высокой степени взаимосвязи изменений этих парметров (r3 = 0.865, p3 = 0.05). В качестве объяснения можно сделать следующее предположение: компенсаторное повышение уровня активности КК в ходе адаптации энергетического обмена клетки к воздействию ИИ в мозге, а также, вполне вероятно, в других органах, требует дополнительного синтеза эндогенного Кр, который, как известно, осуществляется в печени, почках и селезенке, а транспортируется в другие органы и ткани через кровь [13], что и имеет результатом повышение содержания Кр в сыворотке и, известное для КК, субстратное ингибирование ее активности высокими концентрациями Кр [19]. Данные, полученные относительно контрольной группы 4, интактные животные которой получали водный раствор Кр, показывают, что и в отсутствие сахаров в мозге имеет место накопление Кр (почти в 1.5 раза выше контрольного уровня).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Как известно, ионизирующее излучение, индуцирует в клетках образование свободных радикалов кислорода, которые вызывают изменения в антиоксидантной системе, ведущие к оксидативному стрессу и, как следствие, к повреждению компонентов клеток, таких как ферменты, ДНК, липиды. Эффект оксидативного стресса зависит от силы его выраженности. Клетки могут вернуться в исходное состояние при небольших нарушениях, тогда как более выраженный оксидативный стресс вызывает клеточную смерть. Известно, что биохимическим критерием повреждения ферментов является утрата присущей им активности, что служит основанием для использования анализа активности ферментов для оценки влияния ионизирующего излучения и изучения эффективности различных радиопротекторов [5]. КК проявляет высокую чувствительность к окислительному стрессу как на посттранскрипционном, так и на генном уровнях [3, 20, 21]. Она вовлечена в немедленную ответную реакцию клетки на воздействие стресса, приводящего ее к энергетическому истощению. В связи с этим этот фермент, а также уровни отношений КФ/АТФ и КФ/Кр принято рассматривать как показатель энергетического статуса клетки [1, 3]. Как было отмечено выше, основанием для интереса к исследованию противолучевой активности Кр послужило обнаружение его протекторной роли при нейродегенеративных заболеваниях, старении и действии стрессорных факторов, как например, ультрафиолетовое излучение [22], в основе патофизиологии которых лежат аналогичные молекулярные механизмы окислительного стресса [1, 3, 13]. На основании многочисленных исследований с применением различных методических подходов обсуждаются следующие, не исключающие друг друга, механизмы протекторного действия Кр: 1) механизм поддержания энергетического гомеостаза, который помогает в стрессовых ситуациях сохранять в клетке высокие значения АТФ/АДФ и КФ/АТФ отношений; 2) механизм поддержания Са2+ гомеостаза; 3) механизм его антиапоптотического действия, который обусловлен совместным участием Кр и митохондриальной КК в процессе ингибирования открытия митохондриальных проницаемых пор, являющегося ранним тригером апоптоза; 4) механизм антиоксидантного действия благодаря совместному индуцирующему действию Кр и F1-АТФ-азы на эффективность связи дыхательной цепи и производства АТФ, в результате чего продуцируется значительно меньше высокоактивных кислородных радикалов [1, 22–24]. Таким образом, можно утверждать, что Кр–КФ–КК система улучшает сопротивляемость клеток стрессу, делая их менее восприимчивыми к повреждению. Перечисленные факты и полученные нами данные позволят обсудить влияние ИИ на Кр–КК-ую систему и противолучевые свойства природного адаптогена Кр.
Анализ пострадиационных изменений уровней активности мозговой КК под действием сублетальной дозы ИИ, равной 4.5 Гр, в присутствии и отстуствии Кр (рис. 1) показал:
1) эти изменения во времени разнонаправлены и носят колебательный характер, что, по-видимому, связано с включением в разные пострадиационные сроки разных механизмов адаптации; при этом следует отметить, что пострадиационные колебательные изменения уровней активности, а также изоферментных спектров и кинетических параметров показаны для многих ферментов и, в целом, характерны для пострадиационных биологических эффектов [6, 7, 9, 25];
2) высокую радиочувствительность КК, уровень активности которой в контрольных группах 2 и 3, не получавших Кр, уже в первые сутки падает на 40–50%, в связи с чем следует отметить показанную для КК инактивацию свободными радикалами, обусловленную присутсвием в активном центре фермента легко модифицируемых SН-групп [21, 26]; далее, несмотря на последующую тенденцию к повышению, активность КК в этих группах к конечному сроку наблюдения вновь падает, по-видимому, в результате исчерпания нативного адаптационного потенциала мозговой Кр–КК системы;
3) Кр-ая добавка оказывает защитное действие на Кр–КК систему (опытная группа 1), уменьшая повреждающее действие радиации в первые пострадиационные сутки и стимулируя адаптационные свойства Кр–КК системы в последующие сроки, обеспечивая, таким образом, полное восстановление энергетического метаболизма мозга к конечному сроку исследования;
4) 0.9% раствор глюкозы не обладает противолучевой активностью в отношении Кр–КК системы (контрольная группа 3) и в этом смысле как растворитель Кр не влияет на радиопротекторные данные, полученные относительно Кр.
Известно, что резистентность организмов к воздействию экстремальных факторов, в основе которых окислительный стресс, определяется в значительной степени эффективностью регуляторных механизмов поддержания энергетики клетки [27]. Необходимо отметить, что динамика отмеченных выше изменений Кр–КК-ой системы в присутствии и отсутствие Кр, как биологической добавки, направленной на поддержание энергетического обмена ткани мозга, в значительной мере совпадает с исследованной нами динамикой выживаемости крыс. Как показал сравнительный анализ данных, полученных с использованием модели выживаемости крыс после облучения их в дозе ЛД70/30 = 6.3 Гр (рис. 2), гибель животных в опытных группах, получавших Кр, начинается на 2 дня позже и заканчивается на 5–7 дней раньше, чем в контрольных группах, не получавших Кр, что свидетельствует о значительном повышении резистентности крыс, обогащенных Кр-ом, к воздействию облучения. При этом уже с 13-ого пострадиационного дня смертность животных в этих группах резко падает (1 и 2 случая в группах 1 и 2 соответственно), что совпадает со стабилизацией уровней активности КК и содержания Кр в мозге к 15 пострадиационному дню в первой серии экспериментов. Что касается радиозащитного эффекта Кр, рассчитанного с использованием статистической модели выживаемости Каплана–Мейера, то он составил для группы 1, получавшей раствор Кр в 0.9% глюкозе, по отношению к контрольной группе, получавшей вместо Кр воду – 38.6%, а по отношению к контрольной группе, получавшей 0.9% раствор глюкозы – 30.3%. Как и следовало ожидать, радиозащитный эффект водного раствора Кр, учитывая его сравнительно худшую усвояемость клеткой, оказался несколько меньшим – 20.5% в сравнении с соответствующей ей контрольной группой. Таким образом, данная серия опытов однозначно свидетельствует о противолучевой эффективности Кр, оказавшегося способным повышать резистентность и адаптабельность организма к ионизирующему облучению.
О значительных нативных адаптационных свойствах КК и об участии Кр–КК-ой системы в процессе выживания свидетельствуют и данные об активности КК и содержании Кр в мозге крыс, выживших в контрольной группе животных через 30 дней после облучения в дозе 6.3 Гр. Особый интерес представляют данные относительно контрольных облученных крыс (рис. 3, группа 3), получавших вместо раствора Кр воду, в которой через 30 дней после облучения из 12 животных выжило 3 крысы. У этих животных определяется с высокой степенью достоверности повышенный уровень активности мозговой КК (более чем в 2 раза по сравнению с интактными крысами) при нормальном уровне содержания Кр в нем, что однозначно свидетельствует о том, что в повышенной природной резистентности этих животных к воздействию ИО принимает участие мозговая Кр–КК система. Можно предположить, что к этому пострадиационному сроку включаются механизмы долговременной адаптации, связанные с дополнительным биосинтезом ферментного белка. В связи с этим значительный интерес представляют и данные о достоверном двуккратном повышении содержания Кр в сыворотке крови этих животных, которое корреляционно связано (r3 = 0.865, p3 = 0.05) с равноценным падением активности сывороточной КК. В качестве объяснения этого явления можно сделать следующее предположение: компенсаторное повышение уровня активности КК в ходе адаптации энергетического обмена клетки к воздействию ИИ в мозге, а также в других органах, требует дополнительного синтеза эндогенного Кр, который, как известно, осуществляется в печени, почках и селезенке, а транспортируется в остальные органы и ткани через кровь [13], что и по-видимиму, приводит к повышению содержания Кр в сыворотке и, известному для КК субстратному ингибированию ее активности высоким содержанием Кр [19]. Данные, полученные относительно контрольной группы интактных животных, получавших водный раствор Кр, показывают, что и в отсутствие сахаров в мозге имеет место накопление Кр (почти в 1.5 раза выше контрольного уровня), что и обусловливает пусть меньший по сравнению с эффектом Кр в растворе глюкозы, но все же существенный, радиозащитный эффект водного раствора Кр.
ВЫВОДЫ
1. Динамика пострадиационных изменений уровней активности мозговой КК, индуцированных общим рентгеновским облучением крыс в сублетальной дозе 4.5 Гр, в присутствии и отсутствие Кр имеет колебательный характер и указывает на высокую радиочувствительность и значительную адаптабельность фермента; в то же время уровень содержания Кр в мозге этих животных остается в пределах контрольного уровня.
2. Одновременно с этим, указанная динамика пострадиационных изменений свидетельствует о противолучевой эффективности Кр по отношению к Кр–КК системе мозга.
3. Радиозащитные эффекты раствора Кр в 0.9% глюкозе и воде, рассчитанные согласно статистической модели выживаемости Каплана–Мейера, после облучения крыс в дозе ЛД70/30 = 6.3 Гр равны 30.3 и 20.5% соответственно.
4. Кр–КК система мозга крыс обладает определенными нативными адаптационными свойствами к действию ИИ, которые значительно возрастают в присутствии Кр в качестве биодобавки.
Список литературы
Wallimann T., Tokarska-Schlattner M., Schlattner U. // Amino Acids. 2011. V. 40. P. 1271–1296.
Schlattner U., Tokarska-Schlattner M., Wallimann T. // Biochim. Biophys. Acta. 2006. V. 1762. P. 164–180.
Нерсесова Л.С. // Журн. эволюц. биохим. и физиол. 2011. Т. 47. № 2. С. 120–127.
Ames A. // Brain Res. Rev. 2000. V. 34. P. 42–68.
Куценко С.А. // Военная токсикология, радиобиология и медицинская защита. М.: Фолиант, 2004. С. 108.
Catravas G.N., McHale C.G. // J. Neurochem. 1975. V. 24. № 4. P. 673–667.
Бурлаковa Е.Б., Конрадов А.А., Мальцевa Е.Л. // Хим. физика. 2003. Т. 22. № 2. С. 21–40.
Somayaji Y., Vidya V., Vishakh R, Shetty J., Peter A.J., Kumari S. // Cogent Biology. 2016. V. 2. № 1. P. 1–14.
Нерсесова Л.C., Газарянц М.Г., Мкртчян З.C., Меликсетян Г.О., Погосян Л.Г., Погосян С.А., Погосян Л.Л., Каралова Е.М., Аветисян А.С., Аброян Л.О., Каралян З.А., Акопян Ж.И. // Радиац. биология. Радиоэкология. 2013. Т. 53. № 1. С. 55–62.
Pastula D.M., Moore D.H., Bedlack R.S. // Cochrane Database Syst. Rev. 2012. P. 1–26.
Brewer G.J., Wallimann T. // J. Neurochem. 2000. V. 74. P. 1968–1978.
Adcock K.H., Nedelcu J., Loenneker T., Wallimann T., Wagner B.P. // Dev. Neurosci. 2002. V. 24. P. 382–388.
Salomons G.S., Wyss M. // Subcell. Biochem. 2007. V. 46. № 17. P. 351.
Goel M.K., Khanna P., Kishore J. // Send to Int. J. Ayurveda Res. 2010. V. 1. № 4. P. 274–278.
Петрова Т.А., Лызлова С.Н. // Вестн. ЛГУ. 1985. № 24. С. 88–90.
Ennor A. H., Rosenberg H. // Biochem. J. 1954. V. 57. P. 295.
Dobgenski V., Santos M.G.d., Kreider R. // J. Nutri. Health May. 2016. V. 2. № 1. P. 1–5.
Costallat B.L., Miglioli L., Silva P., Novo N.F., João L.G. // Rev. Bras. Med. Esporte. 2007. V. 13. № 1. P. 18–21.
Lyslova S.N., Stefanov V.E. // Phosphagenkinases. 1991. Boston.
Malone J., Ullrich R. // Radiat. Res. 2007. V. 167. № 2. P. 176–184.
Aksenov M., Aksenova M., Butterfield D.A., Markesbery W.R. // J. Neurochem. 2000. V. 74. P. 2520–2527.
Lenz H., Schmidt M. Welge V., Schlattner U., Wallimann T., Elsässer H.-P., Wittern K.-P., Wenck H., Stäb F., Blatt T. // J. Invest. Dermatol., 2005. V. 124. P. 443–452.
Kay L., Nicolay K., Wieringa B., Saks V., Wallimann T. // J. Biol. Chem. 2000. V. 275. P. 6937–6944.
Meyer L.E., Machado L.B., Santiago A.P., da-Silva W.S., De Felice F.G., Holub O., Oliveira M.F., Galina A. // J. Biol. Chem. 2006. V. 281. P. 37361–37371.
Нерсесова Л.С., Петросян М.С., Газарянц М.Г., Мкртчян З.С., Меликсетян Г.О., Погосян Л.Г., Акопян Ж.И. // Радиац. биология. Радиоэкология. 2014. Т. 54. № 5. С. 522–530.
Koufen P., Stark G. // Biochim. Biophys. Acta. 2000. V. 1501. № 1. P. 44–50.
Хочачка П., Сомеро Дж. // Биохимическая адаптация. М.: Мир, 1988. 568 с.
Дополнительные материалы отсутствуют.


