Нейрохимия, 2019, T. 36, № 4, стр. 308-314
Экспрессия нейротрофического фактора 3 в гиппокампе неонатальных крыс при введении дексаметазона
В. В. Булыгина 1, Т. С. Калинина 1, 2, Д. А. Ланшаков 1, 2, Н. Н. Дыгало 1, 2
1 Федеральное государственное бюджетное научное учреждение “Федеральный исследовательский центр
Институт цитологии и генетики Сибирского отделения Российской академии наук”
Новосибирск, Россия
2 Новосибирский государственный университет
Новосибирск, Россия
Поступила в редакцию 23.11.2018
После доработки 25.03.2019
Принята к публикации 03.04.2019
Аннотация
Повышенный уровень глюкокортикоидов в перинатальном периоде онтогенеза способен провоцировать в дальнейшем развитие нейропатологии, в механизмы которой может быть вовлечен апоптоз клеток мозга, вызванный нарушениями экспрессии нейротрофинов, наименее изученным из которых является нейротрофический фактор 3 (NT3). С целью прояснения этого вопроса, в работе исследовали влияние глюкокортикоида дексаметазона (DEX) на уровни мРНК NT3 и ключевой протеазы апоптоза каспазы-3, а также белков незрелой (proNT3) и зрелой (matNT3) форм исследуемого нейротрофина в гиппокампе 3–4-дневных крысят через 6 или 24 ч после введения DEX. Через 6 ч, но не 24 ч, DEX повышал уровни мРНК NT3 в целом гиппокампе, а также содержание белков proNT3 и matNT3 в полях СА1–3 и зубчатой извилине структуры. При этом формировалось временное преобладание экспрессии апоптогенной proNT3 над matNT3, не сопроводавшееся, однако, повышением уровня мРНК каспазы-3.
ВВЕДЕНИЕ
Глюкокортикоидная терапия при развитии респираторного дистресс-синдрома новорожденных широко используется в медицинской практике [1]. Однако перинатальное применение глюкокортикоидов может провоцировать развитие нейропатологий [2, 3], механизмы возникновения которых во многом остаются неясными. Широкий спектр генов, экспрессия которых способна меняться под влиянием глюкокортикоидов, включает гены белков апоптозного каскада [4] и регуляторов нейропластичности, среди которых и нейротрофический фактор 3 (NT3) [5, 6].
Нейротрофические факторы играют важную роль в процессе формирования головного мозга в онтогенезе [7]. При этом незрелые формы белков нейротрофинов могут избегать внутриклеточного процессинга и секретироваться из нейронов с самостоятельными сигнальными функциями [8]. В частности, пронейротрофины, благодаря высокой аффинности к рецепторам p75NTR, активируют программируемую гибель клеток [9]. Нейроны неонатального гиппокампа могут подвергаться повреждающему воздействию избытка глюкокортикоидных гормонов, поскольку в этой структуре уже в перинатальном периоде достаточно высока экспрессия глюкокортикоидных рецепторов [10]. Ранее нами [11] в гиппокампе неонатальных крысят через 24 часа после введения дексаметазона было обнаружено повышение уровня proBDNF. Это повышение сопровождалось увеличением в структуре количества клеток, экспрессирующих активную каспазу-3, что может отражать вклад данного пронейротрофина в индукцию проапоптозных механизмов. Вместе с тем неясно, влияет ли неонатальное повышение глюкокортикоидов на экспрессию другого нейротрофического фактора – нейротрофического фактора 3, как его незрелой (proNT3), так и зрелой (matNT3) форм. С целью прояснения этого вопроса в работе был проведен анализ экспрессии NT3 и соотношения proNT3/matNT3 в гипокампе крысят после воздействия дексаметазоном на третий день их жизни.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проводили на крысах линии Вистар. Крыс содержали в условиях свободного доступа к воде и корму в виварии ИЦиГ СО РАН и использовали в опытах согласно правилам гуманного обращения с экспериментальными животными, утвержденными Комиссией по биоэтике ИЦиГ СО РАН в соответствии с Директивой Европейского Парламента и Совета ЕС 2010/63/EU от 22 сентября 2010 г. и “Правилам проведения работ с использованием экспериментальных животных” (приказ Минздрава СССР № 755 от 12 августа 1977 г.). Беременных самок за 3–4 дня до родов рассаживали в индивидуальные клетки. День родов считали первыми сутками жизни. Крысятам на 3-й день жизни подкожно вводили дексаметазон (DEX) (KRKA, Словения, 0.2 мг/кг в объеме 20 мкл) либо физиологический раствор (физ. раствор). Доза гормона в настоящем исследовании эквивалентентна 12 мг дексаметазона в день для человека весом 60 кг, что имитирует клиническую дозу для беременной женщины (0.2 мг/ кг) [12] и соответствует дозе, применяемой нами ранее [13]. Образцы гиппокампа собирали через 6–24 ч после введения дексаметазона. Временные точки определяли, исходя из предыдущих данных [11, 14] и данных литературы [15, 16], ориентируясь на выявленные в этих работах изменения экспрессии ключевых нейротрофических факторов в гиппокампе в ответ на введение глюкокортикоидов. Суммарную РНК выделяли, применяя одностадийный гуанидин-изотиоцианатный метод, как описано ранее [14]. Для получения кДНК брали 3 мкг суммарной РНК и ревертазу MuLV (“СибЭнзим”, Россия) и инкубировали в условиях стандартной методики (90 мин при 42°С). Количественный анализ содержания мРНК генов NT3 и каспазы-3 относительно мРНК actb проводили методом ОТ-ПЦР в реальном времени с использованием наборов TaqMan® Gene Expression Assays на амплификаторе ABI VIIA™ 7 (“Applied Biosystems”, США), и рассчитывали по методу ∆∆Сt. Для этого метода брали по 5–6 крысят каждой группы. Белки proNT3 и matNT3 определяли методом иммуногистохимии [17] по отдельности на разных срезах с использованием флуоресцентно меченных вторичных антител. После глубокого холодового наркоза крысят транскардиально перфузировали 0.02 М фосфатным буфером (PBS) и 4% раствором параформальдегида в 0.02 М PBS. Использовали специфичные к незрелому нейротрофическому фактору proNT3 первичные кроличьи антитела (AB15564 Merck Millipore) и специфичные к зрелому нейротрофическому фактору-3 matNT3 первичные кроличьи антитела (AB1532P Merck Millipore) в разведении 1 : 200. Далее срезы инкубировали со вторичными антителами осла против IgG кролика с флуоресцентной меткой (Alexa-568, Invitrogen) в разведении 1 : 350. Уровень pro-NT3 и mat-NT3 оценивали на коронарных срезах мозга по величине оптической плотности клеток на цифровых фотографиях (увеличение ×200) на 4–5 полях зрения от 4–5 животных каждой группы. Цифровые фотографии срезов гиппокампа были получены на лазерном сканирующем микроскопе LSM-780. Данные по относительной оптической плотности флуоресцентного сигнала были обработаны с помощью программного обеспечения ZEN (2011, SP2). Применяли двухфакторный дисперсионный анализ (ANOVA) (пакет программ STATISTICA (ver. 6.0; StatSoft, Inc., 2001), факторами которого являлись DEX и время после его введения, с последующим Post-Hoc анализом межгрупповых различий по критерию Фишера LSD, различия с р < 0.05 считали достоверными.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Уровни обеих форм NT3, выявляемых иммуногистохимически (рис. 1), повышались во всех полях неонатального гиппокампа через 6 ч после введения DEX. Результаты двухфакторного дисперсионного анализа денситометрии препаратов, подобных изображенным на рис. 1 и их количественных оценок, усредненно представленных на рис. 2, свидетельствуют о достоверном влиянии фактора DEX на уровень иммуногистохимически выявляемого proNT3 (рис. 1а и 2а; F1,13 = от 15.72 в зубчатой извилине до 42.24 в СА3; Post-Hoc сравнения групп с предварительными за 6 ч инъекциями DEX и животных, получавших физ. раствор от p < 0.00005 в зубчатой извилине до p < 0.000001 в СА3). Вместе с тем, через сутки после введения DEX достоверных различий по уровню proNT3 между животными, получавшими гормон, и конт-рольной группой уже не обнаруживалось во всех полях гиппокампа (Post-Hoc анализ от р = 0.38 в СА2 до р = 0.91 в СА1). Выявлено достоверное влияние фактора времени после введения DEX (F1,13 = от 17.64 в зубчатой извилине до 45.04 в СА3) и взаимодействия факторов DEX и времени после его введения (F1,13 = от 17.64 в зубчатой извилине до 45.04 в СА3) на содержание проформы NT3 в гиппокампе.
Рис. 1.
Репрезентативные микрофотографии панорамм гиппокампа через 6 часов после введения дексаметазона: а – proNT3, б – matNT3. Вторичные антитела мечены Alexa 568, флуоресцентный сигнал преобразован в негатив и соответствует черному цвету.
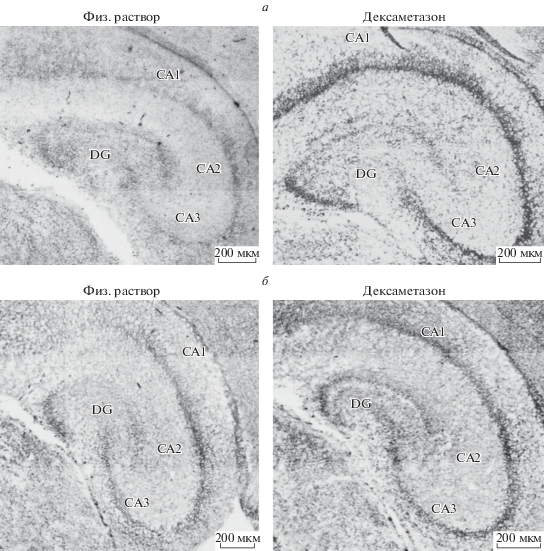
Рис. 2.
Уровень proNT3 (а) и matNT3 (б) в областях гиппокампа неонатальных крысят через 6 часов после введения дексаметазона. *р < 0.05; ***р < 0.001 по сравнению с введением физ. раствора.
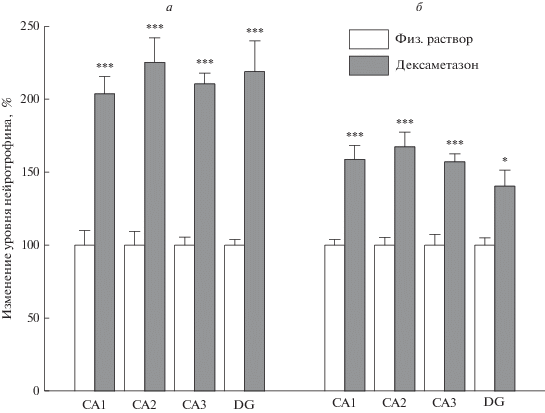
Повышение уровня белка proNT3 через 6 ч пос-ле введения глюкокортикоида сопровождалось и увеличением содержания зрелой формы matNT3 во всех полях гиппокампа, что отражает достоверное влияние фактора DEX (рис. 1б, 2б, F1,13 = от 5.88 СА1 до 7.7 в СА2, F1,12 = 7.21 в СА3, за исключением зубчатой извилины F1,13 = 0.74) и Post-Hoc сравнения групп с предварительными за 6 ч инъекциями DEX и животных, получавших физ. раствор от p < 0.015 в зубчатой извилине до p < < 0.0008 в СА3. Через 24 ч после гормонального воздействия различия по уровню matNT3 между группой с введением дексаметазона и контрольной с введением физ. раствора по Post-Hoc анализу нивелировались (от р = 0.16 в зубчатой извилине до р = 0.48 в СА3). Также показано достоверное влияние фактора времени после введения DEX (F1,13 = от 9.24 в зубчатой извилине до 18.44 в СА2) и взаимодействия факторов DEX и времени после его введения (F1,13 = от 9.24 в зубчатой извилине до 18.44 в СА2) на уровень зрелого белка NT3 в гиппокампе.
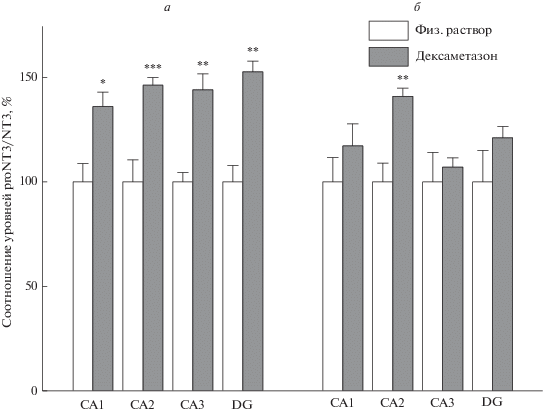
Оценка соотношения уровня незрелой формы нейротрофического фактора-3 proNT3 к содержанию зрелого белка этого нейротрофа matNT3 в гиппокампе 3-х дневных крысят выявила достоверное влияние фактора DEX во всем гиппокампе (рис. 3а) (F1,12 = 7.62 в СА1, F1,12 = 34.93 в СА2, F1,13 = 9.55 в СА3, F1,13 = 12.92 в зубчатой извилине), и рост этого показателя именно через 6 часов после инъекции глюкокортикоида во всех исследованных областях (Post-Hoc сравнение по Фишеру групп с введением дексаметазона или физ. раствора через 6 часов от p < 0.02 в СА1 до p < 0.0009 в СА2). Через сутки после введения дексаметазона значимых изменений в соотношениях незрелой и зрелой форм этого нейротрофина уже не наблюдалось в большинстве исследованных областей гиппокампа: СА1 p = 0.23, СА3 p = 0.56, зубчатая извилина p = 0.18, лишь в области СА2 повышенное соотношение незрелой к зрелой форме NT3 проявлялось и через 24 ч (p < 0.0008) (Post-Hoc анализ 24 часовых групп, рис. 3б). Влияние фактора времени после введения DEX и взаимодействия факторов DEX и времени после его введения недостоверно для этого показателя во всех полях гиппокампа, за исключением области СА3 (F1,13 = 4.98).
Рис. 3.
Отношение уровней proNT3 к matNT3 в областях гиппокампа неонатальных крысят через 6 (а) или 24 ч (б) после введения им дексаметазона. *р < 0.05; **р < 0.01; ***р < 0.001 по сравнению с введением физ. раствора.
Уровень мРНК NT3 в гиппокампе достоверно увеличился через 6 ч после введения дексаметазона и оставался несколько повышенным и через 24 ч после гормонального воздействия (эффект – DEX F1,19 = 26.96; p < 0.00001, Post-Hoc сравнения группы дексаметазона с введением физ. раствора 6 ч р < 0.0001; с введением физ. раствора 24 ч р < < 0.05) (табл. 1).
Таблица 1.
Уровень мРНК NT3 и каспазы-3 в гиппокампе 3-дневных крысят после введения дексаметазона
| Группа | Время после воздействия, ч | Физ. раствор | Дексаметазон |
|---|---|---|---|
| NT3 | 6 | 1.00 ± 0.06 | 1.53 ± 0.12*** |
| 24 | 0.95 ± 0.07 | 1.25 ± 0.12* | |
| Каспаза-3 | 6 | 1.06 ± 0.18 | 1.00 ± 0.12 |
| 24 | 1.12 ± 0.12 | 1.06 ± 0.08 |
В этих опытах уровень мРНК каспазы-3 в гиппокампе оставался неизменным как через 6 ч, так и через 24 ч после инъекции глюкокортикоида (табл. 1). Как собственно DEX, так и время после его введения, а также и взаимодействие этих факторов не оказывали существенного влияния на уровень мРНК ключевой протеазы апоптоза.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В гиппокампе глюкокортикоидные рецепторы экспрессируются на высоком уровне уже в перинатальном периоде [10], и поэтому его клетки высокочувствительны к этим гормонам. Так повышение уровня мРНК c-fos, маркера нейрональной активности [18], наблюдалось у 3-х дневных крысят в полях СА1 и СА3 гиппокампа уже через час после введения дексаметазона [14]. Ранее не было выявлено значимых признаков усиления процесса апоптотической гибели клеток в отделах неонатального головного мозга в первые часы после введения небольших, применяемых в клинике и аналогичных использованной в нашей работе, доз глюкокортикоидов [13]. Однако даже одна инъекция подобной дозы дексаметазона приводила к поведенческим нарушениям у неонатальных крысят [19]. Механизмы патологических эффектов глюкортикоидов на неонатальный головной мозг не ясны, и могут затрагивать в том числе и модификацию нейротрофических процессов, которая проявляется как в первые часы после инъекции дексаметазона, так и через сутки после воздействия [11], что определило выбор временных интервалов после введения дексаметазона в текущем эксперименте.
В данной работе обнаружено, что введение дексаметазона уже в первые часы приводит к значимому увеличению в гиппокампе экспрессии NT3 как на уровне мРНК, так и на уровнях проформы и зрелой формы нейротрофина. Эти факты согласуются с важной и неоднозначной, очевидно из-за особенностей экспериментов, ролью глюкокортикоидных гормонов в регуляции нейротрофических процессов в головном мозге, установленной, прежде всего, на примере мозгового нейротрофического фактора BDNF [20, 21]. Так, у взрослых животных после введения дексаметазона или стресса, повышающего уровень глюкокортикоидов в крови, в гиппокампе наблюдали как снижение экспрессии BDNF [22, 23], так, и напротив, повышение, уровня этого нейротрофина [24, 25], а после хронического стресса, отмечалось также и повышение уровня мРНК NT3 в этой структуре мозга [5]. Глюкокортикоиды влияют на экспрессию BDNF, как путем связывания активированного гормоном его рецептора с регуляторными участками гена bdnf [26], так и через эпигенетические механизмы – ацетилирование гистонов [27]. В настоящее время какие-либо сведения о возможных механизмах регуляции экспрессии NT3 глюкокортикоидами в литературе не обнаружены, и эта проблема нуждается в исследовании.
При стимуляции экспрессии нейротрофина дексаметазоном формировалось преобладание proNT3 над matNT3. Баланс незрелых и зрелых форм нейротрофинов важен, поскольку пронейротрофины способны индуцировать апоптоз даже в присутствии трофической поддержки жизнеспособности клеток зрелыми формами факторов [28]. Проапоптозную функцию в формирующемся мозге, по-видимому, способен выполнять и предшественник нейротрофического фактора 3 – proNT3. Это показано на культуре нервных клеток in vitro [29], а также in vivo [30]. Однако, в данном эксперименте, несмотря на преобладание в первые часы после гормонального воздействия proNT3 над matNT3 во всем гиппокампе, признаков значимой модификации процесса апотоза как по уровню мРНК каспазы-3 в данной работе, так и по числу активной каспаза-3-позитивных клеток исследованных ранее [11], в этом отделе мозга через 6 часов после введения дексаметазона не обнаружено. Через сутки после воздействия существенных эффектов глюкокортикоида на уровни matNT3 или proNT3 и их соотношение в большинстве областей гиппокампа уже не наблюдалось, за исключением зоны СА2, где уровень proNT3 превышал таковой matNT3.
Следует отметить, что повышение уровня matNT3 стимулирует образование возбуждающих синапсов глутаматергической системы [31], что в свою очередь способно индуцировать эксайтотоксическую гибель клеток [14]. Однако эксайтотоксический фактор, также как и особенности экспрессии proNT3/matNT3 в первые часы после введения дексаметазона, судя по нашим результатам определения уровня мРНК ключевой исполнительной протеазы программируемой гибели клеток – каспазы 3, и ранее полученных данных неизменности числа активной каспаза-3 экспрессирующих клеток в гиппокампе [11], по-видимому, не оказывают заметного влияния на апоп-тоз клеток гиппокампа неонатального мозга. Это может быть, по-крайней мере частично, обусловлено параллельной активацией гормоном антиапоптозных процессов. Действительно, через 6 ч после введения дексаметазона у 3-дневных крысят наблюдялось повышение уровней антиапоптозного белка Bcl-xL и его мРНК в гиппокампе [10] и в стволе головного мозга [32].
ЗАКЛЮЧЕНИЕ
В работе впервые обнаружена способность глюкокортикоидов индуировать экспрессию нейротрофического фактора 3 в гиппокампе неонатальных крысят. При этом формировалось временное преобладание proNT3 над matNT3, которое однако, судя по уровню мРНК каспазы-3, и предыдущим данным по отсутствию роста числа клеток, экспрессирующих активную каспазу-3 не сопровождалось значимой модификацией протекания апоптоза в этой структуре головного мозга.
Список литературы
Kreider M.L., Aldridge J.E., Cousins M.M., Oliver C.A., Seidler F.J., Slotkin T.A. // Neuropsychopharmacology. 2005. V. 30. P. 1841–1855.
Murphy V.E., Smith R., Giles W.B., Clifton V.L. // Endocr. Rev. 2006. V. 27. P. 141–169.
Waffarn F., Davis E.P. // Am. J. Obstet. Gynecol. 2012. V. 207. P. 446–454.
Duksal F., Kilic I., Tufan A.C., Akdogan I. // Brain Res. 2009. V. 1250. P. 75–80.
Smith M.A., Makino S., Altemus M., Michelson D., Hong S.K., Kvetnansky R., Post R.M. // Proceedings of the National Academy of Sciences of the United States of America. 1995. V. 92. P. 8788–8792.
Roskoden T., Otten U., Schwegler H. // Exp. Brain Res. 2004. V. 154. P. 183–191
Roth T., Sweatt J. // Horm. Behav. 2011. V. 59. P. 315–320.
Yang J., Harte-Hargrove L.C., Siao C.J., Marinic T., Clarke R., Ma Q., Jing D., Lafrancois J.J., Bath K.G., Mark W., Ballon D., Lee F.S., Scharfman H.E., Hempstead B.L. // Cell Rep. 2014. V. 7. P. 796–806.
Hempstead B. // Handb. Exp. Pharmacol. 2014.V. 220. P. 17–32.
van Eekelen J.A., Bohn M.C., de Kloet E.R. // Dev. Brain Res. 1991. V. 61. P. 33–43.
Bulygina V.V., Kalinina T.S., Lanshakov D.A., Dygalo N.N. // European Neuropsychopharmacology. 2017. V. 27 (S4). P. S609.
Miracle X., Di Renzo G.C., Stark A., Fanaroff A., Xavier Carbonell-Estrany X., Saling E. // J. Perinat. Med. 2008. V. 36. № 3. P. 191–196.
Menshanov P.N., Bannova A.V., Bulygina V.V., Dygalo N.N. // Physiol. Res. 2013. V. 62. P. 205–213.
Lanshakov D.A., Sukhareva E.V., Kalinina T.S., Dygalo N.N. // Neurobiol. Dis. 2016. V. 91. P. 1–9.
Lindholm D., Castren E., Hengerer B., Zafra F., Berninger B., Thoenen H. // Eur. J. Neurosci. 1992. V. 4. № 5. P. 404–410.
Suri D., Vaidya V.A. // Neuroscience. 2013. V. 239. P. 196–213.
Lanshakov D.A., Bulygina V.V., Romanova I.V., Dygalo N.N. // Bull. Exp. Biol. Med. 2009. V. 147. № 5. P. 635–638.
Kovács K.J. // Neurochem. Int. 1998.V. 33. P. 287–297.
Menshanov P.N., Bannova A.V., Dygalo N.N. // Behav. Brain Res. 2014. V. 271. P. 43–50.
Jeanneteau F., Chao M.V. // Neuroscience. 2013. V. 239. P. 173–195.
Numakawa T., Odaka H., Adachi N. // Int. J. Mol. Sci. 2017. V. 18. № 11. P. e2312. doi:10.3390/ijms18112312
Vellucci S.V., Parrott R.F., Mimmack M.L. // Res. Vet. Sci. 2001. V. 70. P. 157–162.
Murakami S., Imbe H., Morikawa Y., Kubo C., Senba E. // Neurosci. Res. 2005. V. 53. P. 129–139.
Marmigère F., Givalois L., Rage F., Arancibia S., Tapia-Arancibia L. // Hippocampus. 2003. V. 13. P. 646–655.
Li X.H., Liu N.B., Zhang M.H., Zhou Y.L., Liao J.W., Liu X.Q., Chen H.W. // Chin. Med. J. (Engl.). 2007. V. 120. P. 669–674.
Chen H., Lombès M., Le Menuet D. // Mol. Brain. 2017. V. 10. № 1. P. 12. https://doi.org/10.1186/s13041-017-0295-x
Fuchikami M., Morinobu S., Kurata A., Yamamoto S., Yamawaki S. // Int. J. Neuropsychopharmacol. 2009. V. 12. P. 73–82.
Volosin M., Trotter C., Cragnolini A., Kenchappa R.S., Light M., Hempstead B.L., Carter B.D., Friedman W.J. // J. Neurosci. 2008. V. 28. P. 9870–9879.
Yano H. Torkin R., Martin L.A., Chao M.V., Teng K.K. // J. Neurosci. 2009. V. 29. P. 14790–14802.
Zanin E.A., Abercrombie E., Friedman W.J. // eLife. 2016. V. 5. P. e16654. https://doi.org/10.7554/eLife.16654
Ammendrup-Johnsen, Naito Y., Craig A.M., Takahashi H. // J. Neurosci. 2015. V. 35. P. 12425–12431.
Shishkina G.T., Kalinina T.S., Bulygina V.V., Lanshakov D.A., Babluk E.V., Dygalo N.N. // PLoS One. 2015. V. 10. № 12. P. e0143978. https://doi.org/10.1371/journal.pone.0143978
Дополнительные материалы отсутствуют.


