Нейрохимия, 2019, T. 36, № 4, стр. 315-326
Влияние нейропатической боли на состояние глиальных клеток и гиппокампальный нейрогенез у старых животных
А. А. Тыртышная 1, 2, И. В. Манжуло 1, 2, С. П. Коновалова 2, А. А. Заглядкина 2, А. А. Старинец 2
1 Федеральное государственное бюджетное учреждение науки “Национальный научный центр морской биологии
им. А.В. Жирмунского” Дальневосточного отделения Российской академии наук
Владивосток, Россия
2 Дальневосточный федеральный университет
Владивосток, Россия
Поступила в редакцию 17.09.2018
После доработки 19.12.2018
Принята к публикации 14.01.2019
Аннотация
Исследование направлено на изучение влияние хронической нейропатической боли на состояние микроглии и нейрогенез в гиппокампе у старых мышей. Индукция нейропатической боли проводилась путем наложения трех свободных лигатур на седалищный нерв правой задней конечности животных. Тестирование поведения показало наличие нарушений рабочей памяти и локомоторной активности у животных с нейропатической болью как через неделю, таки через 3 недели после операции. Поведенческие нарушения сопровождались снижением гиппокампального нейрогенеза, а также увеличением экспрессии микроглиальных маркеров Iba-1 и CD86 в гиппокампе животных с перевязанным седалищным нервом. Кроме того, индукция нейропатической боли привела к изменению экспрессии астроглиальных маркеров S100β и GFAP в гиппокампе. Полученные данные свидетельствуют о том, что поведенческие изменения при нейропатической боли сопровождаются изменением активности микроглии и астроглии, что приводит к нарушению нейрогенеза и снижению когнитивных функций.
ВВЕДЕНИЕ
Международная ассоциация боли определяет нейропатическую боль как “неприятный сенсорный и эмоциональный опыт, связанный с фактическим или потенциальным повреждением тканей” [1]. Нейропатическая боль может быть связана с различными заболеваниями или травмами, воздействующими на сенсорную систему с помощью различных механизмов.
Механизмы развития нейропатической боли сложны и не до конца понятны. Восприятие боли и передача болевого импульса осуществляется ноцицептивной системой, которая включает в себя нервные волокна и проводящие пути, расположенные в спинном мозге, а также ряд супраспинальных центров. Выделяют ряд структур головного мозга, принимающих участие в передаче и обработке болевого сигнала, среди которых ретикулярная формация продолговатого мозга, ядра таламуса, а также структуры лимбической системы, в том числе, гипоталамус, миндалевидное тело и гиппокамп [2].
Гиппокамп является основной структурой, обеспечивающей пространственную и кратковременную память, а также играющей важную роль в механизмах формирования эмоций. Эта область мозга связана с восприятием хронической боли, в частности, ее аффективно-мотивационного компонента [3]. Сенсорная информация, поступающая из периферических структур в миндалину, обрабатывается и передается в центральные ядра, расположенные в нескольких отделах головного мозга, в том числе, в гиппокамп [4]. Исследования показывают, что хроническая боль может вызывать как сенсорные нарушения, так и различные функциональные расстройства (тревога, амнезия, бессонница и депрессия) [3]. При этом, непосредственно повреждающий фактор и когнитивно-поведенческие последствия нейропатической боли могут иметь совершенно разные временные рамки [5]. Это указывает на сложность центральных процессов, ответственных за когнитивные последствия боли. Изучение изменений нейрональной и глиальной пластичности гиппокампа, наблюдаемых в результате болевого воздействия, имеет важное значение для понимания механизмов развития когнитивных и эмоциональных последствий нейропатической боли.
Как правило, нейропатическая боль характеризуется широким спектром симптомов и клинических проявлений, связанных как с уменьшением чувствительности, так и с ее усилением [6, 7]. Симптоматика нейропатического болевого синдрома во многом зависит от типа боли, пола [8], возраста человека [9] и ряда других факторов. Влияние возраста на боль, а также ее когнитивные и эмоциональные последствия можно объяснить морфологическими изменениями в нейронах и глиальных клетках. Такие возрастные особенности обычно связаны с измененной нейротрансмиссией, а также чувствительностью рецепторов, участвующих в восприятии и модуляции боли. Кроме того, немаловажную роль играют изменения в электрофизиологических параметрах нейронов, таких как длительность возбуждающих постсинаптических потенциалов, синаптическая задержка и амплитуда тормозных постсинаптических потенциалов. Изменения в этих параметрах, в первую очередь, связаны с возрастным изменением числа возбуждающих и ингибирующих синапсов на нейронах [9].
Актуальность изучения данной патологии у старых животных объясняется тем, что значительная часть населения, страдающего нейропатической болью, относится к старшей возрастной группе [10]. В нашем предыдущем исследовании мы занимались изучением влияния нейропатической боли на состояние микроглии и нейрогенез в гиппокампе у молодых мышей [11]. Исследование было направлено на выяснение механизмов поведенческих изменений, характерных для животных с нейропатической болью, а также на фармакологическую коррекцию данных изменений. Настоящее исследование направлено на изучение влияния нейропатической боли на состояние микроглии, нейрогенез в гиппокампе и болевое поведение у старых животных.
МЕТОДЫ ИССЛЕДОВАНИЯ
Характеристика экспериментального материала. Эксперимент проводился на 28 мышах-самцах линии С57Bl/6 в возрасте 18 мес. Животных размещали по 4 в клетке со свободным доступом к пище и воде и содержали при постоянной температуре (23 ± 2°C) и влажности (55 ± 15%) с 12-часовым циклом “день/ночь”. Все экспериментальные манипуляции с животными одобрены комиссией по биомедицинской этике “Национального научного центра морской биологии” ДВО РАН. Нейропатическую боль индуцировали с использованием модели хронического констрикционного повреждения (chronic constriction injury, CCI) седалищного нерва [12]. Животных анестезировали с помощью смеси препаратов золетил (Вирбак, Франция) и ксилазин (Алфасан Интернэшнл БВ, Нидерланды) в отношении 1 : 4; 0.2 мл смеси/кг веса, внутрибрюшинно. Для моделирования нейропатического болевого синдрома на седалищный нерв правой задней конечности накладывали три лигатуры ближе к трифуркации с расстоянием 1 мм между лигатурами (пролен, ETHICON, США). Лигатуры слегка затягивали до появления небольшого подергивания конечности. Все экспериментальные животные были разделены на 2 группы:
– группа “ЛО” – ложнооперированные животные (14 животных);
– группа “CCI” – животные с констрикционным повреждением седалищного нерва (14 животных);
Половину мышей вывели из эксперимента на 7 день после операции, вторую половину – на 21 день. В течение 3 дней перед выведением животных из эксперимента им вводили раствор 5-бромдезоксиуридина (BrdU, Sigma-Aldrich, США) в концентрации 100 мг/кг внутрибрюшинно.
Поведенческие исследования. Поведенческие тесты проводили через 1 и 3 нед. после операции перед выведением мышей из эксперимента. Определение тепловой аллодинии проводили еженедельно. Все тесты проводили в течение светового дня с 7 утра до 7 вечера. Перед тестированием каждого животного аппараты тщательно очищали 10% этанолом для минимизации обонятельных сигналов. Для того, чтобы адаптировать животных и избежать стресса, связанного с новой средой, животных помещали в испытательный аппарат на 10 мин в течение 3 дней, предшествующих дню тестирования. В день тестирования мышей оставляли в домашних клетках в экспериментальной комнате в течение 2 ч перед началом поведенческих исследований.
Термическая аллодиния. Термическую аллодинию измеряли с использованием теста с холодной пластиной (Cold/Hot Plate Analgesia Meter No.05044 Columbus Instruments, США) [13]. Испытание проводили в камере с акриловыми стенками толщиной 30 см на металлической пластине 30 × 30 см. Температуру холодной пластины поддерживали на уровне при +4°С. Время тестирования составляло 60 с. Мышей помещали на холодную пластину и регистрировали момент первого подъема поврежденной задней лапы.
Оценка спонтанной локомоторной активности. Спонтанную локомоторную активность оценивали, помещая мышь в центр круглой арены из оргстекла (60 см в диаметре, высота стенок – 40 см) на 5 мин. Яркость освещения арены составляла 500 люкс. Площадь арены была разделена на 37 квадратов. Поведение мыши регистрировалось видеокамерой, расположенной над аппаратом в течение 5 мин. При анализе видеозаписей регистрировалось количество квадратов, пересеченных животным.
Определение рабочей памяти в тесте спонтанного чередования рукавов в Y-образном лабиринте. Рабочую память экспериментальных животных изучали в тесте спонтанного чередования рукавов в Y-образном лабиринте. Y-образный лабиринт представлял собой устройство, сделанное из оргстекла, с тремя одинаковыми рукавами, длина которых составляла 30 см, ширина – 10 см. Высота стенок лабиринта составляла 20 см. В начале тестирования мышь помещали в центр лабиринта и оставляли на 5 мин. Производилась видеозапись и фиксировалось количество и последовательность входов в рукава лабиринта с целью вычисления коэффициента спонтанного чередования рукавов [14]. Критерием входа в рукав лабиринта считалось положение мыши, когда все 4 лапы находились внутри рукава. Для вычисления коэффициента спонтанного чередования рукавов использовалась следующая формула:
Ks – коэффициент спонтанного чередования рукавов, R – количество последовательных перемещений в три неповторяющихся рукава лабиринта, A – общее количество возможных альтернаций.
Иммуногистохимические исследования. Экстракция гиппокампа для последующего иммуногистохимического исследования проводился на 7-й и 21-й день после операции. Мышей анестезировали передозировкой смеси препаратов золетил и ксилазин, введенной внутрибрюшинно, и транскардиально перфузировали 100 мл холодного физраствора (~4°C), pH 7.2. Извлеченный головной мозг делили на 2 полушария. Правое полушарие помещали в 4% параформальдегид (забуференный до pH 7.2) на 12 ч. Гиппокамп из левого полушария экстрагировали и замораживали при –70°C для дальнейших исследований. Спустя 12 ч материал тщательно промывали фосфатным буферным раствором (pH 7.2) и погружали на 48 ч в 30% раствор сахарозы (Sigma Aldrich). После этого материал помещали на 24 часа в среду для криостата Neg-50 (Thermo Scientific) и производили изготовление свободноплавающих сагиттальных срезов толщиной 30 мкм с помощью криостат-микротома (НМ525, Thermo Scientific). Для иммуногистохимической характеристики экспрессии глиальных маркеров использовали метод иммунопероксидазной реакции. Использованный в работе иммуногистохимический метод состоит из следующих этапов: (1) Прединкубация в растворе, блокирующем эндогенную пероксидазную активность (0.3% раствор H2O2); (2) Прединкубация в растворе, блокирующем неспецифическое связывание антител (5% обезжиренное молоко в PBS); (3) Инкубирование срезов в растворе первичных антител (4°С, 24 ч); (4) Инкубирование срезов с раствором вторичных антител, меченных пероксидазой хрена: PI-1000 (anti-rabbit); PI-2000 (anti-mouse), 1 : 100 (Vector Laboratories, США); (5) Для проведения иммунопероксидазной реакции использовали хромоген ImmPACT™ DAB Peroxidase Substrate (SK-4105, Vector Laboratories, США); (6) Окрашенные срезы тщательно отмывали 0.1 М фосфатным буфером (pH 7.4), обезвоживали и заключали в среду VectaMount Permanent Mounting Medium (H-5000, Vector laboratories) по стандартной методике. В работе использованы первичные поликлональные кроличьи антитела против Iba-1 (ab107159, Abcam, США, 1 : 500), CD86 (ab53004, Abcam, США, 1 : 200), GFAP (Abcam ab7260, США, 1 : 1000) и S100β (ab52642, Abcam, США, 1 : 200).
Для иммуногистохимического выявления BrdU-меченых клеток в субгранулярном слое зубчатой извилины гиппокампа использовались первичные антитела к BrdU (ab1893, Abcam, США, 1 : 200) и вторичные флуоресцентные антитела (A-11015, ThermoFisher scientific, США, 1 : 200).
От каждого животного было взято для анализа по 3 среза, что составило 21 срез для каждой группы. Изображения были получены на микроскопе Zeiss AxioScope A1, оснащенном видеокамерой AxioCam 503 и программным обеспечением AxioVision (Zeiss). Съемка каждого оптического среза производилась c использованием следующих параметров: увеличение окуляра –10×, увеличение объектива – 10×, значение экспозиции камеры – 2 мс для иммунопероксидазной окраски и 11.2 мс для флуоресцентной окраски. Для каждого среза отдельно производилась съемка CA1-области и зубчатой извилины. Подсчеты каждой области производились на основании 21 снимка. Изображения обрабатывались и анализировались с использованием программного обеспечения ImageJ (NIH, США). Обработка каждой микрофотографии включала в себя следующие этапы: преобразование в черно-белый вариант (8-битное изображение); вычитание фона (rolling ball radius = 50); усиление контрастности (+30 единиц); бинаризация. Порог бинаризации, позволяющий селективно выделить необходимые для подсчета элементы, подбирался индивидуально для каждого маркера. Выбранное значение использовалось для подсчета во всех группах. Для измерения площади окрашивания маркера производилось выделение необходимой области и вычисление процентной доли окрашенной площади. Кроме того, в первичную обработку входила калибровка изображения — перевод пикселей в квадратные микрометры. При подсчете BrdU-иммунопозитивных клеток на мм3 использовали формулу: d = (106 × n)/(Sl), где n – количество клеток; S – площадь субгранулярной зоны (мкм2); l – толщина среза, 106 – коэффициент преобразования мкм2 в мм2. Подсчет BrdU-позитивных клеток проводился строго в субгранулярном слое зубчатой извилины гиппокампа. Для статистической обработки проводилось усреднение значений, полученных для каждого отдельного среза.
Твердофазный иммуноферментный анализ. Для количественного определения содержания цитокинов ФНО-α и ИЛ-10 в гиппокампе использовали твердофазный иммуноферментный анализ (ИФА). Для исследования использовали гиппокамп, ранее извлеченный из левого полушария и замороженный при температуре –70°C. В исследовании были использованы наборы для иммуноферментного выявления ФНО-α (ab100747, Abcam, США) и ИЛ-10 (ab100697, Abcam, США) мыши в соответствии с рекомендациями производителя. Ткань гиппокампа гомогенизировали с использованием раствора (100 мМ Трис, рН 7.4, 150 мМ NaCl, 1 мМ EGTA, 1 мМ ЭДТА, 1% Triton X-100, 0.5% дезоксихолата натрия) с коктейлем ингибиторов протеаз (cОмплет, Sigma-Aldrich, США) в концентрации 1 мг/мл. Концентрацию белка определяли с использованием набора BCA (Pierce, Rockford, IL). Оптическую плотность измеряли с помощью планшетного спектрофотометра iMark (Bio-Rad) при длине волны 450 нм.
Статистическая обработка результатов. Для статистического анализа и обработки результатов исследования рассчитывали средние арифметические величины ($\bar {x}$) и среднеквадратичные отклонения (σ) средних величин. Все параметры были проверены на нормальность распределений с использованием теста Колмогорова–Смирнова. Оценку достоверности различий результатов экспериментальных наблюдений проводили с использованием t-критерия Стьюдента. Уровень значимости считали достоверным при p < 0.05. Статистический анализ проводили с использованием программного обеспечения Microsoft Excel (США).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Изменение поведенческой активности при нейропатической боли. С целью подтверждения наличия нейропатического болевого синдрома проводилась количественная оценка холодовой аллодинии с использованием прибора “горячая/холодная пластина”. Животных помещали в аппарат и фиксировали момент подъема поврежденной конечности. Тестирование показало, что термическая аллодиния у животных, подвергнутых перевязке седалищного нерва, остается на одном уровне с 14 по 28 день после операции. У ложнооперированных животных подъема конечности в течение 60 с тестирования не наблюдалось.
Достоверное снижение локомоторной активности наблюдается лишь на 3 неделе после перевязки седалищного нерва (101.28 ± 12.32 vs. 51.28 ± ± 9.79, p < 0.01). Кроме того, наблюдалось снижение коэффициента спонтанного чередования рукавов в Y-лабиринте как на 1 так и на 3 нед. после операции, что свидетельствует о нарушении рабочей пространственной памяти у животных с нейропатической болью (71.64 ± 3.18 vs. 58.42 ± 3.15 – 1 нед. и 73.71 ± 3.36 vs. 61.28 ± 3.49 – 3 нед., p < 0.05) (рис. 1).
Рис. 1.
Поведение животных при нейропатической боли. (a) Динамика развития холодовой аллодинии: момент подъема поврежденной конечности над холодной пластиной (+4°C) при наблюдении в течение 1 мин. x ± σ, n = 7 на группу; (б) Спонтанная локомоторная активность в тесте “открытое поле”, x ± σ, n = 7 (животных в группе), *p < 0.05. (в) Рабочая память в Y-лабиринте. x ± σ, n = 7 на группу, *p < 0.05, **p < 0.01.
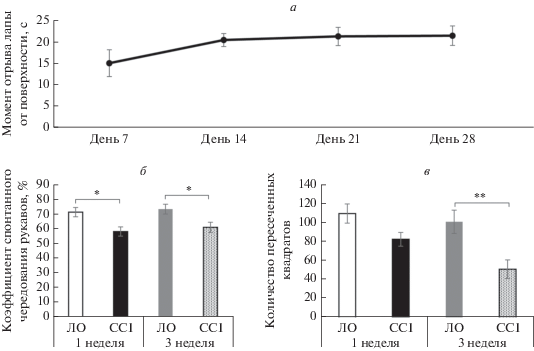
Изменение состояния микро- и астроглии у животных с нейропатической болью. На данном этапе проводилось изучение экспрессии маркеров микро- и астроглии в гиппокампе животных путем определения площади окрашивания в CA1-регионе гиппокампа и зубчатой извилине.
При определении экспрессии маркера общего пула микроглии Iba-1 было выявлено повышение площади окрашивания как через неделю, так и через 3 недели после операции. При этом, через неделю после операции повышение наблюдалось в слоях регионов Stratum oriens (p < 0.05) и Stratum radiatum (p < 0.05), через 3 недели – в Stratum lacunosum-moleculare CA1-региона (p < 0.001) и Stratum moleculare зубчатой извилины (p < 0.05) (рис. 2).
Рис. 2.
Влияние хронического констрикционного повреждения на активность микроглии в гиппокампе. (а) Примеры изображений CA1 области гиппокампа, полученных при иммуногистохимической окраске на маркер микроглии Iba-1. (б) Примеры изображений зубчатой извилины гиппокампа, полученных при иммуногистохимической окраске на маркер микроглии Iba-1. (в) Процент площади, покрываемой Iba1-иммунопозитивным окрашиванием в CA1-области гиппокампа и зубчатой извилине через 1 и 3 недели после операции, x ± σ, n = 21 (изображений для группы), *p < 0.05; (г) Процент площади, покрываемой Iba1-иммунопозитивным окрашиванием в отдельных слоях CA1-области гиппокампа и зубчатой извилины через 1 и 3 недели после операции, x ± σ, n = 21 (изображений для группы), *p < 0.05; ***p < < 0.001. Масштабный отрезок – 200 мкм. So – Stratum Oriens, Sr – Stratum Radiatum, Slm – Stratum lacunosum moleculare, Sm – Stratum Moleculare.

Исследование экспрессии CD86 показало, что повышение данного маркера в слое Stratum lacunosum-moleculare региона CA1 наблюдается в течение всего периода исследования (p < 0.05). При этом на 1 неделе достоверное повышение экспрессии CD86 наблюдается в слое Stratum radiatum (p < 0.05) (рис. 3).
Рис. 3.
Влияние хронического констрикционного повреждения на активность микроглии в гиппокампе. (а) Примеры изображений, полученных при иммуногистохимической окраске CA1 области гиппокампа на маркер микроглии CD86. (б) Процент площади, покрываемой CD86-иммунопозитивным окрашиванием в CA1-области гиппокампа и зубчатой извилине через 1 и 3 недели после операции, x ± σ, n = 21 (изображений для группы), *p < 0.05. (в) Процент площади, покрываемой CD86-иммунопозитивным окрашиванием в отдельных слоях CA1-области гиппокампа и зубчатой извилины через 1 и 3 недели после операции, x ± σ, n = 21 (изображений для группы), *p < 0.05. Масштабный отрезок – 200 мкм. So – Stratum Oriens, Sr – Stratum Radiatum, Slm – Stratum lacunosum moleculare, Sm – Stratum Moleculare.
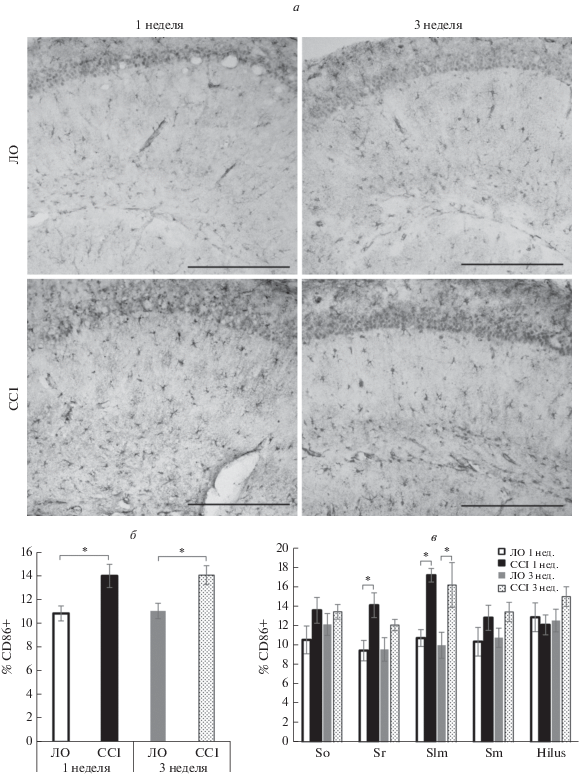
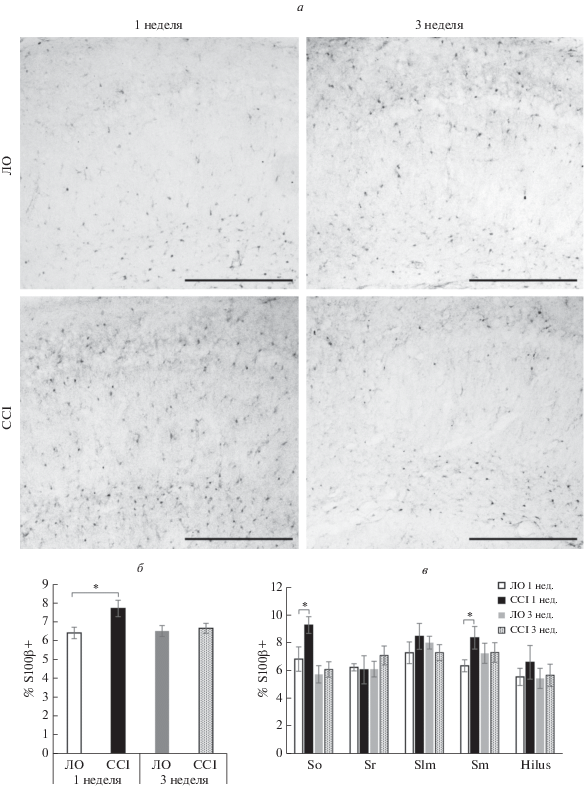
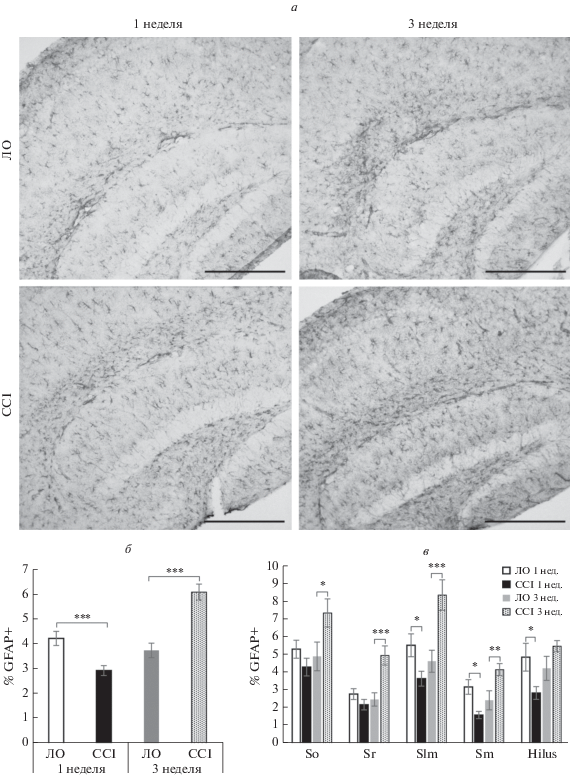
Нейропатический болевой синдром сопровождался и изменением площади иммуногистохимического окрашивания астроцитарных маркеров: GFAP (белок цитоскелета) и S100β (цитоплазматический белок). Через неделю после операции наблюдалось достоверное снижение площади окрашивания GFAP (p < 0.001), в то время как через 3 нед. после перевязки седалищного нерва наблюдалось увеличение данного показателя в 1.6 раза (p < 0.001). Главным образом, снижение площади окрашивания через неделю после операции наблюдалось в слоях Hilus (p < 0.05) и Stratum moleculare (p < 0.05) зубчатой извилины и слоях Stratum lacunosum-moleculare (p < 0.05) CA1-региона. На 3 неделе достоверное увеличение площади окрашивания наблюдалось в регионах Stratum radiatum (p < 0.001), Stratum lacunosum-moleculare (p < 0.001) и Stratum moleculare (p < 0.01) (рис. 4).
Рис. 4.
Влияние хронического констрикционного повреждения на активность астроглии в гиппокампе. (а) Примеры изображений, полученных при иммуногистохимической окраске CA1 области гиппокампа на маркер астроглии S100β. (б) Процент площади, покрываемой S100β-иммунопозитивным окрашиванием в CA1-области гиппокампа и зубчатой извилине через 1 и 3 недели после операции, x ± σ, n = 21 (изображений для группы), *p < 0.05. (в) Процент площади, покрываемой S100β-иммунопозитивным окрашиванием в отдельных слоях в CA1-области гиппокампа и зубчатой извилины через 1 и 3 недели после операции, x ± σ, n = 21 (изображений для группы), *p < 0.05. Масштабный отрезок – 200 мкм. So – Stratum Oriens, Sr – Stratum Radiatum, Slm – Stratum lacunosum moleculare, Sm – Stratum Moleculare.
В то же время повышение экспрессия белка S100β было зафиксировано лишь через неделю после перевязки седалищного нерва, в частности, достоверное увеличение площади окрашивания наблюдалось в регионе Stratum oriens (p < 0.05) и Stratum moleculare (p < 0.05) (рис. 5).
Рис. 5.
Влияние хронического констрикционного повреждения на активность астроглии в гиппокампе. (а) Примеры изображений, полученных при иммуногистохимической окраске CA1 области гиппокампа на маркер астроглии GFAP. (б) Процент площади, покрываемой GFAP-иммунопозитивным окрашиванием в CA1-области гиппокампа и зубчатой извилине через 1 и 3 недели после операции, x ± σ, n = 21 (изображений для группы), *p < 0.001. (в) Процент площади, покрываемой GFAP-иммунопозитивным окрашиванием в отдельных слоях CA1-области гиппокампа и зубчатой извилины через 1 и 3 недели после операции, x ± σ, n = 21 (изображений для группы), *p < 0.05, **p < 0.01, ***p < < 0.001. Масштабный отрезок – 200 мкм. So – Stratum Oriens, Sr – Stratum Radiatum, Slm – Stratum lacunosum moleculare, Sm – Stratum Moleculare.
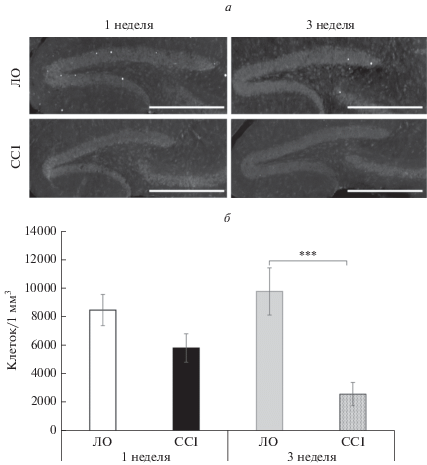
Изменение уровня нейрогенеза у животных с нейропатической болью. На данном этапе проводилось изучение интенсивности нейрогенеза в гиппокампе у животных с нейропатической болью и ложнооперированных животных. Иммуногистохимическое выявление BrdU в субгранулярной зоне зубчатой извилины гиппокампа показало снижение пролиферативной активности в 2.5 раза через 3 нед. после перевязки седалищного нерва (9799.56 ± ± 1650.87 vs. 2609.78 ± 813.37, p < 0.001). Через неделю после операции достоверных различий с группой ложнооперированных животных не наблюдалось (рис. 6).
Рис. 6.
Влияние хронического констрикционного повреждения на пролиферативную активность в субгранулярной зоне зубчатой извилины гиппокампа. (а) Примеры изображений, полученных при иммуногистохимическом выявлении BrdU. (б) Количество иммунопозитивных клеток на 1 мм3 субгранулярной зоны зубчатой извилины гиппокампа, ***p < 0.001. Масштабный отрезок – 200 мкм.
Экспрессия цитокинов в гиппокампе. Определение экспрессии провоспалительного цитокина ФНО-α в гиппокампе показало достоверное повышение концентрации данного маркера как через неделю, так и через 3 недели после операции (наблюдается повышение концентрации со 132 до 272 на 1 неделе и со 149 до 376 на 3 неделе). Однако, повышение концентрации противовоспалительного маркера ИЛ-10 в тканях гиппокампа наблюдалось лишь на 3 неделе после операции (215.37 ± ± 6.59 vs. 250.00 ± 8.01, p < 0.05) (рис. 7).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Нейропатический болевой синдром, возникающей вследствие нарушений в работе периферической нервной системы, часто становится причиной развития патологических процессов центральной нервной системы. Хронические ноцицептивные сигналы, возникающие в периферических тканях, могут привести к реорганизации корковых структур и заднего мозга, а также к нарушению пластичности нейронов в соматосенсорных и моторных системах [15, 16]. Данная работа посвящена исследованию изменений, происходящих в гиппокампе при периферически индуцированной хронической нейропатической боли.
Известно, что гиппокампальный нейрогенез у взрослых животных участвует в процессах обучения и формировании памяти [17]. Различные нарушения процессов нейрогенеза могут стать причиной развития депрессии [18], повышенной тревожности [19], стресса [20] и формирования контекстуального условно-рефлекторного страха [21]. В качестве объекта исследования нами были выбраны старые животные со сниженной интенсивностью нейрогенеза [22], что позволило получить более отчетливую картину гистохимических и поведенческих изменений, наблюдаемых вследствие перевязки седалищного нерва. Существенное снижение локомоторной активности и нарушения рабочей памяти сопровождались снижением нейрогенеза в субгранулярном слое зубчатой извилины гиппокампа как через неделю, так и через три недели после операции. При этом, в нашем предыдущем исследовании на молодых животных [11] существенных изменений нейрогенеза не наблюдалось спустя 2 недели после операции, что свидетельствует о возрастном усилении активности деструктивных процессов, вызванных повреждением периферической нервной системы. Как известно, стресс, в том числе вызванный хронической болью, может оказывать влияние на интенсивность нейрогенеза [23], однако механизмы этого процесса до сих пор не до конца поняты. Мы предполагаем, что одним из факторов, вызывающих нарушения нейрогенеза в гиппокампе при нейропатической боли, является изменение состояния микроглии, в частности, ее активация и изменение динамики поляризации. Известно, что факторы, продуцируемые микроглиоцитами провоспалительного (М1) фенотипа, препятствуют нормальному протеканию процессов нейрогенеза [24, 25]. Эти факторы способствуют развитию долговременного неврологического дефицита и, в конечном итоге, приводят к нарушению высшей нервной деятельности [26]. Продукция провоспалительных цитокинов, таких как ИЛ-1β [27] или ФНО-α [28] способна ингибировать взрослый нейрогенез. Напротив, активация провоспалительной микроглии (М2-фенотип) индуцирует нейрогенез [29, 30].
При исследовании состояния микроглии в гиппокампе мы обнаружили повышение экспрессии маркера провоспалительной микроглии CD86, при этом, уровень экспрессии данного маркера оставался стабильным на протяжении всего периода наблюдения. Максимальная экспрессия CD86 наблюдается в слоях Stratum radiatum и Stratum lacunosum-moleculare, что, вероятно, связано с наличием в данных слоях аксонов, идущих от 3 слоя нейронов энторинальной коры. Данный кортико-гиппокампальный вход наряду с перфорантным путем традиционно считается одним из основных путей поступления болевой информации в гиппокамп [3]. Подобная картина наблюдается и в отношении экспрессии маркера общего пула микроглии Iba-1. Однако повышение данного маркера наблюдается, главным образом, в слоях Stratum oriens, Stratum radiatum, Stratum lacunosum-moleculare и Stratum moleculare. При этом, повышение в слое Stratum moleculare, вероятно, связано с участием перфорантного пути в передаче болевой информации. Данный путь представляет собой проекции аксонов, берущих начало на нейронах 2 слоя энторинальной коры и оканчивающихся на дендритах зубчатой извилины гиппокампа. Повышение активности Iba-1 в слое Stratum oriens CA1-региона может быть связано с наличием эфферентных волокон, несущих информацию в другие корковые и подкорковые структуры. Увеличение доли микроглии провоспалительного фенотипа подтверждается и результатами иммуноферментного анализа, показавшего повышение концентрации провоспалительного цитокина ФНО-α в тканях гиппокампа на протяжении всего периода наблюдения. При этом, увеличение экспрессии противовоспалительного цитокина ИЛ-10 наблюдалось лишь спустя 3 недели после операции, что может свидетельствовать о наличии хронического процесса нейровоспаления в гиппокампе и позднем наступлении фазы разрешения нейровоспалительного процесса.
Иммуногистохимическое выявление глиального фибриллярного кислого белка – маркера астроглии продемонстрировало снижение его экспрессии через неделю после операции, однако через 3 недели было зафиксировано существенное повышение GFAP-иммунореактивности. Как известно, астроциты активно участвуют в обработке информации в головном мозге, секретируя, транспортируя и поглощая нейромедиаторы (глутамат, гамма-аминомасляную кислоту и аденозинтрифосфат), а также формируя трехсторонние синапсы [31]. Кроме того, астроглия выполняет и ряд других функций, определяющих функциональную активность нейронов и регулирующих процессы нейрогенеза, среди которых структурная и метаболическая поддержка, формирование гематоэнцефалического барьера [32], регуляция концентрации ионов в межклеточном пространстве [33], участие в процессах миелинизации [34] и поддержании долгосрочной потенциации [35]. Уменьшение количества астроцитов в гиппокампе характерно для ряда патологических процессов, в частности, травматического повреждения головного мозга [36], ишемии [37], депрессии [38] и т.д. В данных исследованиях снижение плотности астроцитов сопровождалось нейродегенерацией, нарушением нейрогенеза, долговременной потенциации и когнитивных функций. Продемонстрированное нами снижение GFAP-иммунореактивности наблюдалось, главным образом, в хилусе зубчатой извилины, что, вероятно, связано с расположением афферентных волокон, несущих болевую информацию из энторинальной коры. Повышение GFAP-иммунореактивности через 3 недели после операции может быть связано с наличием хронического стресса, что согласуется с предыдущими исследованиями [39]. Однако, механизмы изменения экспрессии астроцитарных маркеров и морфологических характеристик астроцитов при различных патологических состояниях не вполне ясны. Возможно, изменение морфологии и числа астроцитов связано с экспрессией на их поверхности рецепторов к про- и противовоспалительным цитокинам, активно вырабатываемым микроглиальными клетками уже на начальных стадиях развития патологического процесса [40]. При анализе экспрессии астроцитарного маркера S100β было выявлено повышение площади иммуногистохимического окрашивания через неделю после операции, главным образом, в слоях Stratum oriens и Stratum moleculare. Учитывая, что белок S100β является маркером “зрелых” астроцитов, в отличие от GFAP, который маркирует всю популяцию астроцитов [41], в данных слоях, вероятно, происходит снижение пролиферативной активности астроцитов с последующим уменьшение доли новообразованных клеток. Как известно, S100β является цитоплазматическим маркером, способным диффундировать в межклеточное пространство, что может объяснять отсутствие повышения площади иммуногистохимического окрашивания на 3 неделе при повышении площади окрашивания GFAP. Вероятно, выработка S100β происходила в течение короткого временного отрезка и к третей послеоперационной неделе выработанный белок успел диффундировать во внеклеточное пространство.
Полученные данные свидетельствуют о том, что изменения в поведении, вызванные нейропатической болью, сопровождаются активацией астроглии и микроглии с увеличением доли микроглиоцитов провоспалительного фенотипа. Это явление сопровождается снижением интенсивности гиппокампального нейрогенеза у подопытных животных, что, вероятно, является следствием выработки провоспалительных цитокинов активированными глиоцитами. Продуцируемые факторы оказывают влияние не процессы нейрогенеза как путем регуляции пролиферации и дифференцировки нейрональных клеток-предшественников, так и путем регуляции количества новообразованных нейронов посредством фагоцитоза [42]. В то же время, глиальная активация в отдельных слоях CA1-региона и зубчатой извилины гиппокампа является следствием их участия в передаче болевой информации из энторинальной коры. Это подтверждается существенным увеличением доли активированной глии в слоях Stratum lacunosum-moleculare и Stratum moleculare, где расположены окончания аксонов, идущих из II и III слоев энторинальной коры.
ЗАКЛЮЧЕНИЕ
Полученные нами данные позволяют объяснить поведенческие изменения, наблюдаемые при нейропатической боли у экспериментальных животных. Результаты иллюстрируют важность нейроглиальных взаимодействий в реализации когнитивных функций и объясняют поведенческие изменения, сопровождающие болевой синдром.
Список литературы
Merskey H., Bogduk N. // Pain Terms: A Current List with Definitions and Notes on Usage: Classification of Chronic Pain. 1994. 2nd ed. Seattle: IASP Task Force on Taxonomy.
Finnerup N.B., Sindrup S.H., Jensen T.S. // Fundamental & Clinical Pharmacology. 2007. V. 21. № 2. P. 129–136.
Liu M.G., Chen J. // Neurosci. Bull. 2009. V. 25. № 5. P. 237.
McEwen B.S. // Ann. N.Y. Acad. Sci. 2001. V. 933. № 1. P. 265–277.
Dimitrov E.L., Tsuda M.C., Cameron H.A., Usdin T.B. // J. Neurosci. 2014. V. 34. № 37. P. 12304–12312.
Baron R., Binder A., Wasner G. // The Lancet Neurology. 2010. V. 9. № 8. P. 807–819.
Maier C., Baron R., Tölle T.R., Binder A., Birbaumer N., Birklein F., Gierthmühlen J., Flor H., Geber C., Huge V., Krumova E.K. // Pain. 2010. V. 150. № 3. P. 439–450.
Fillingim R.B., King C.D., Ribeiro-Dasilva M.C., Rahim-Williams B., Riley J.L. // J. Pain. 2009. V. 10. № 5. P. 447–485.
Leite-Almeida H., Almeida-Torres L., Mesquita A.R., Pertovaara A., Sousa N., Cerqueira J.J., Almeida A. // Pain. 2009. V. 144. № 1–2. P. 57–65.
Jones M.R., Ehrhardt K.P., Ripoll J.G., Sharma B., Padnos I.W., Kaye R.J., Kaye A.D. // Curr. Pain Headache Rep. 2016. V. 20. № 4. P. 23.
Tyrtyshnaia A.A., Manzhulo I.V., Sultanov R.M., Ermolenko E.V. // Acta Histochem. 2017. V. 119. № 8. P. 812–821.
Bennett G.J., Xie Y.K. // Pain. V. 198833. № 1. P. 87–107.
Allen J.W., Yaksh T.L. // Pain Research: Methods and Protocols. 2004. P. 11–23.
Knowles J.K., Simmons D.A., Nguyen T.V.V., Vander Griend L., Xie Y., Zhang H., Yang T., Pollak J., Chang T., Arancio O., Buckwalter M.S. // Neurobiol. Aging. 2013. V. 34. № 8. P. 2052–2063.
Rusanescu G., Mao J. // J. Cell. Mol. Med. 2017. V. 21. № 2. P. 299–314.
Seifert F., Maihöfner C. // Curr. Opin. Anesthesiol. 2011. V. 24. № 5. P. 515–523.
Deng W., Aimone J.B., Gage F.H. // Nat. Rev. Neurosci. 2010. V. 11. № 5. P. 339.
Sahay A., Hen R. // Nat. Neurosci. 2007. V. 10. № 9. P. 1110.
Revest J.M., Dupret D., Koehl M., Funk-Reiter C., Grosjean N., Piazza P.V., Abrous D.N. // Mol. Psychiatry. 2009. V. 14. № 10. P. 959.
Dranovsky A., Hen R. // Biol. Psychiatry. 2006. V. 59. № 12. P. 1136–1143.
Saxe M.D., Battaglia F., Wang J.W., Malleret G., David D.J., Monckton J.E., Garcia A.D.R. Sofroniew M.V., Kandel E.R., Santarelli L., Hen R. // Proc. Natl. Acad. Sci. U. S. A. 2006. V. 103. № 46. P. 17501–17506.
Van Praag H., Shubert T., Zhao C., Gage F.H. // J. Neurosci. 2005. V. 25. № 38. P. 8680–8685.
Egeland M., Zunszain P.A., Pariante C.M. // Nat. Rev. Neurosci. 2015. V. 16. № 4. P. 189.
Ekdahl C.T., Claasen J.H., Bonde S., Kokaia Z., Lindvall O. // Proc. Natl. Acad. Sci. U. S. A. 2003. V. 100. № 23. P. 13632–13637.
Butovsky O., Kunis G., Koronyo-Hamaoui M., Schwartz M. // Eur. J. Neurosci. 2007. V. 26. № 2. P. 413–416.
Roughton K. et al. // Dev. Neurosci. 2013. V. 35. № 5. P. 406–415.
Kuzumaki N., Ikegami D., Imai S., Narita M., Tamura R., Yajima M., Suzuki A., Miyashita K., Niikura K., Takeshima H., Ando T. // Synapse. 2010. V. 64. № 9. P. 721–728.
Montgomery S.L., Bowers W.J. // J. Neuroimmune Pharmacol. 2012. V. 7. № 1. P. 42–59.
Butovsky O., Ziv Y., Schwartz A., Landa G., Talpalar A.E., Pluchino S., Martino G., Schwartz M. // Mol. Cell. Neurosci. 2006. V. 31. № 1. P. 149–160.
Nikolakopoulou A.M., Dutta R., Chen Z., Miller R.H., Trapp B.D. // Proc. Natl. Acad. Sci. U. S. A. 2013. V. 110. № 21. P. 8714–8719.
Perea G., Navarrete M., Araque A. // Trends in Neurosci. 2009. V. 32. № 8. P. 421–431.
Figley C.R., Stroman, P.W. // Eur. J. Neurosci. 2011. V. 33. № 4. P. 577–588.
Gabriel S., Njunting M., Pomper J.K., Merschhemke M., Sanabria E.R., Eilers A., Kivi A., Zeller M., Meencke H.J., Cavalheiro E.A., Heinemann U., Lehmann T.N. // J. Neurosci. 2004. V. 24. № 46. P. 10416–10430.
Ishibashi T., Dakin K.A., Stevens B., Lee P.R., Kozlov S.V., Stewart C.L., Fields R.D. // Neuron. 2006. V. 49. № 6. P. 823–832.
Han X., Chen M., Wang F., Windrem M., Wang S., Shanz S., Xu Q., Oberheim N. A., Bekar L. // Cell Stem Cell. 2013. V. 12. № 3. P. 342–353.
Zhao X., Ahram A., Berman R.F., Muizelaar J.P., Lyeth B.G. // Glia. 2003. V. 44. № 2. P. 140–152.
Ouyang Y.B., Voloboueva L.A., Xu L.J., Giffard R.G. // J. Neurosci. 2007. V. 27. № 16. P. 4253–4260.
Gosselin R.D., Gibney S., O’Malley D., Dinan T.G., Cryan J.F. // Neurosci. 2009. V. 159. № 2. P. 915–925.
Bridges N., Slais K., Syková E. // Acta Neurobiol. Exp. 2008. V. 68. № 2. P. 131.
Farina C., Aloisi F., Meinl E. // Trends in Immunol. 2007. V. 28. № 3. P. 138–145.
Raponi E., Agenes F., Delphin C., Assard N., Baudier J., Legraverend C., Deloulme J.C. // Glia. 2007. V. 55. № 2. P. 165–177.
Sato K. // Glia. 2015. V. 63. № 8. P. 1394–1405.
Дополнительные материалы отсутствуют.



