Нейрохимия, 2019, T. 36, № 4, стр. 292-301
Синтез дофамина недофаминергическими нейронами тубероинфундибулярной системы у крыс в онтогенезе
Т. С. Пронина 1, Л. К. Дильмухаметова 1, А. И. Куртова 1, М. В. Угрюмов 1, 2
1 Федеральное государственное бюджетное учреждение науки
Институт биологии развития им. Н.К. Кольцова РАН
Москва, Россия
2 Национальный исследовательский университет “Высшая школа экономики”
Москва, Россия
Поступила в редакцию 03.12.2018
После доработки 18.12.2018
Принята к публикации 28.12.2018
Аннотация
В начале 2000-х годов было показано, что дофамин синтезируется не только дофаминергическими нейронами, обладающими необходимым набором ферментов – тирозингидроксилазой и декарбоксилазой ароматических L-аминокислот (ДАА), но и совместно недофаминергическими (моноферментными) нейронами, содержащими по одному из ферментов. При этом L-диоксифенилаланин (L-ДОФА), синтезируемый в нейронах, содержащих тирозингидроксилазу, переносится в нейроны, содержащие ДАА, где синтезируется дофамин. Доказательством кооперативного синтеза дофамина в наших предыдущих исследованиях явилось снижение общего синтеза дофамина при инкубации суспензии нейронов тубероинфундибулярной системы (ТИС) плодов или срезов ТИС взрослых крыс в присутствии нейтральной аминокислоты – конкурентного ингибитора мембранного переносчика L-ДОФА. В данной работе примененный ранее методический подход был усовершенствован за счет использования только срезов ТИС и 2-амино-2-норборнанкарбоновой кислоты – синтетического неметаболизируемого ингибитора мембранного переносчика L-ДОФА. Это позволило подтвердить наличие кооперативного синтеза дофамина в ТИС у плодов и взрослых крыс и получить дополнительное доказательство этого синтеза в виде увеличения межклеточного содержания L-ДОФА при ингибировании его мембранного переносчика. Кроме того, использование усовершенствованного метода позволило впервые количественно охарактеризовать синтез дофамина недофаминергическими нейронами и сравнить его у плодов и взрослых крыс. Показано, что доля кооперативного синтеза дофамина от общего синтеза дофамина моноферментными и дофаминергическими нейронами в ТИС у плодов крыс в 1.8 раза больше, чем у взрослых животных. С точки зрения функциональной роли дофамина, продуцируемого моноферментными нейронами, особый интерес представляют данные, указывающие на шестикратное увеличение синтеза дофамина моноферментными нейронами ТИС у крыс с конца пренатального периода до взрослого состояния. Таким образом, в онтогенезе доля синтеза дофамина недофаминергическими моноферментными нейронами по отношению к общему синтезу дофамина значительно снижается, а абсолютное значение кооперативного синтеза дофамина многократно возрастает.
ВВЕДЕНИЕ
Дофамин (ДА) – один из наиболее широко распространенных в нервной системе нейротрансмиттеров, участвующий в регуляции важнейших функций организма – репродуктивной, двигательной, когнитивной и др. [1–3]. Участие в регуляции той или иной функции определяется локализацией нейронов, продуцирующих ДА, в нервной системе. Так, ДА-продуцирующие нейроны, расположенные в нигростриатной системе мозга, являются ключевым звеном регуляции двигательной функции, а нейроны, локализованные в тубероинфундибулярной системе (ТИС) гипоталамуса – в регуляции репродуктивной функции [1].
До начала 2000-х годов господствовало представление о том, что ДА синтезируется только в так называемых ДА-ергических нейронах, содержащих оба необходимых для этого фермента – тирозингидроксилазу (ТГ) и декарбоксилазу ароматических L-аминокислот (ДАА). ТГ обеспечивает превращение L-тирозина в L-диоксифенилаланин (L-ДОФА), а ДАА – обеспечивает дальнейшее превращение L-ДОФА в ДА [4]. Однако с начала 2000-х накапливаются доказательства того, что ДА может синтезироваться не только в ДА-ергических нейронах, но и в так называемых моноферментных нейронах, содержащих только по одному из ферментов – ТГ или ДАА. При этом было показано, что L-ДОФА, синтезируемый в ТГ-содержащих нейронах, после поступления в межклеточную среду захватывается нейронами, содержащими только ДАА, в которых и происходит окончательный синтез ДА [5].
Первые доказательства кооперативного синтеза ДА недофаминергическими нейронами были получены при изучении ТИС у крыс в конце пренатального периода [6], когда в этой системе содержатся только моноферментные нейроны [7]. Следует уточнить, что тела нейронов ТИС расположены в аркуатном ядре, а их аксоны проецируются в срединное возвышение гипоталамуса, где ДА выделяется в гипофизарную портальную систему циркуляции, оказывая ингибирующее влияние на секрецию пролактина лактотрофами гипофиза [1]. В последующих работах было показано, что, несмотря на то, что после рождения в ТИС появляются ДА-ергические нейроны, и их число c возрастом постепенно увеличивается [7], кооперативный синтез ДА происходит и у взрослых животных [8].
Доказательства наличия кооперативного синтеза в ТИС у плодов и взрослых крыс были получены при использовании принципиально одного и того же оригинального методического подхода ex vivo (in vitro). Это метод основан на оценке синтеза ДА в ТИС при ее инкубации в присутствии конкурентного ингибитора мембранного переносчика больших нейтральных L-аминокислот и L-ДОФА. При наличии кооперативного синтеза ДА моноферментными нейронами даже в присутствии ДА-ергических нейронов ингибирование мембранного переносчика L-ДОФА приводит к снижению общего синтеза ДА в ТИС [5].
Несмотря на корректность полученных ранее данных о кооперативном синтезе ДА в ТИС у плодов и у взрослых крыс и интерпретации этих данных [6, 8], использованный ранее методический подход может быть существенно усовершенствован на основе новых знаний и появления новых методических возможностей. Исходя из этого, целью данной работы явилась ревизия полученных ранее данных о синтезе ДА недофаминергическими нейронами ТИС на новом методическом уровне и количественная оценка уровня кооперативного синтеза ДА на различных этапах индивидуального развития. Задачами данного исследования являются: (1) количественная оценка кооперативного синтеза ДА недофаминергическими нейронами ТИС у крыс в конце пренатального периода; (2) количественная оценка кооперативного синтеза ДА недофаминергическими нейронами ТИС у взрослых крыс; (3) количественная оценка соотношения кооперативного синтеза ДА в ТИС у плодов и взрослых крыс.
МАТЕРИАЛЫ И МЕТОДЫ
Животные, эксперименты. Работу проводили на самцах крыс линии Вистар на 60-й постнатальный день (П60) и на плодах на 21-й эмбриональный день (Э21). Животных содержали в стандартных условиях вивария при свободном доступе к пище и воде и 12-часовом режиме день–ночь. Все манипуляции с животными были проведены в соответствии с национальными и международными требованиями и правилами, утвержденными комитетом по охране животных ФГБУН Института биологии развития им. Н.К. Кольцова РАН.
Крыс на П60 (n = 20) и на Э21 (n = 114) под наркозом изофлураном декапитировали, и затем выделяли мозг. Далее на вибратоме (Vibratome 1000 plus Sectioning system, Германия) в буфере Кребса-Рингера (мМ: NaCl 120, KCl 4.8, CaCl2 2, MgSO4 1.3, NaHCO3 25, d-глюкоза 10, HEPES 20, аскорбиновая кислота 0.1, pH 7.4, 4°C) приготавливали срезы мозга толщиной 300 мкм на уровне ТИС и черной субстанции. Далее ТИС и черную субстанцию вырезали из фронтальных срезов мозга, полученных у крыс на П60 в соответствии с атласом Paxinos and Watson [9] и на Э21 в соответствии с атласом Ashwell and Paxinos [10].
На П60 от мозга первой группы животных (n = = 12) брали по 3 фронтальных среза (координаты от 2.2 до 3.1 мм каудальнее брегмы), после чего под контролем бинокулярной лупы при 4°C вырезали левые и правые половинки ТИС.
На П60 от мозга второй группы животных (n = 8) брали по 3 фронтальных среза (координаты от 4.6 до 5.5 мм каудальнее брегмы), после чего под контролем бинокулярной лупы при 4°C вырезали левые и правые половинки черной субстанции.
На Э21 от мозга плодов третьей группы животных (n = 72) брали по 1 фронтальному срезу, после чего под контролем бинокулярной лупы при 4°C вырезали обе половинки ТИС.
На Э21 от мозга плодов четвертой группы животных (n = 42) брали по 2 фронтальных среза, после чего под контролем бинокулярной лупы при 4°C вырезали левые и правые половинки черной субстанции.
Инкубация срезов ex vivo. В термостатируемые (37°С) проточные камеры объемом 400 мкл отдельно помещали выделенные левые или правые половинки ТИС или черной субстанции от каждого животного из первой и второй групп на П60, а также по обе половинки ТИС от 6 плодов или все половинки черной субстанции от 3 плодов из третьей и четвертой групп животных на Э21. Срезы мозга на П60 инкубировали в буфере Кребса-Рингера в течение 40 мин, а на Э21 – 20 мин, при скорости потока раствора через камеру 100 мкл/мин (рис. 1).
Рис. 1.
Схема эксперимента. АНК, 2-амино-2-норборнанкарбоновая кислота; АНК–, отсутствие в среде, АНК+, содержание в среде в концентрации 0.5 мМ; КРБ, Кребс-Рингер буфер.
После периода стабилизации в половину исследуемых камер поступал буфер Кребса-Рингера, содержащий 0.5 мМ 2-амино-2-норборнанкарбоновой кислоты (АНК) (Сигма, США) – синтетический неметаболизируемый конкурентный ингибитор мембранного переносчика больших нейтральных аминокислот и L-ДОФА, а в оставшиеся камеры – буфер Кребса-Рингера без АНК. Затем срезы инкубировали в течение 1 ч и собирали инкубационную среду, оттекавшую из камер. После окончания инкубации срезы замораживали в жидком азоте. В собранную среду добавляли по 100 мкл 1 М HClO4 и по 2 пмоль/мл 3,4-дигидроксибензиламина (ДГБА) в качестве внутреннего стандарта для высокоэффективной жидкостной хроматографии с электрохимической детекцией. После этого инкубационную среду замораживали и вместе с замороженными срезами хранили при –70°C до определения ДА и L-ДОФА.
Высокоэффективная жидкостная хроматография с электрохимической детекцией. Концентрацию и содержание ДА и L-ДОФА определяли в срезах ТИС и черной субстанции, полученных от крыс на Э21 и П60, а также в инкубационной среде методом высокоэффективной жидкостной хроматографии с электрохимической детекцией. Ткань гомогенизировали с помощью ультразвукового гомогенизатора. Срезы ТИС на Э21 и П60 гомогенизировали в 50 мкл 0.1 M HClO4 с 125 пмоль/мл ДГБА. Срезы черной субстанции на Э21 гомогенизировали в 50 мкл 0.1 М HClO4 с 25 пмоль/мл ДГБА, а на П60 – в 100 мкл 0.1 М HClO4 с 50 пмоль/мл ДГБА. Полученные гомогенаты центрифугировали 20 минут при 20000 g при 4°C и собирали супернатант. Определение ДА и L-ДОФА проводили на обращенно-фазовой колонке (100 × 4 mm ReproSil-Pur C18, 3 μm) (Dr. Maisch, Германия). Подвижной фазой служил 0.1 М цитратно-фосфатный буфер, содержащий 0.25 мМ октансульфоната натрия, 0.1 М ЭДТА и 9% ацетонитрила (pH 2.5). Потенциал веществ выходящих из колонки определяли с помощью электрохимического детектора DECADE II (Antec Leyden, Нидерланды) (+0.8 B, чувствительность детектора 2 нА). Регистрацию и обработку данных проводили с помощью программы LabSolutions Analysis Data System (Shimadzu, Япония). Во всех пробах ткани определяли содержание общего белка с помощью набора “BCA Protein Assay Kit” в соответствии с инструкцией производителя (The Thermo Scientific Pierce, США).
Статистика. Статистический анализ данных выполняли с использованием GraphPad Prism 6.0 (GraphPad Software, США). Нормальность данных проверяли с помощью критерия Шапиро-Вилка. Для статистического сравнения выбранных групп использовали t-тест Стьюдента для параметрических данных и U-тест Манна-Уитни для непараметрических данных. Данные представлены как среднее ± стандартная ошибка среднего (SEM). Значение p < 0.05 считалось статистически значимым.
Уровень синтеза ДА недофаминергическими нейронами ТИС на животное рассчитывали как:
СдаТанк– – содержание ДА в срезах после инкубации без добавления АНК, усредненное на массу белка ТИС от одного животного,
СдаСанк– – содержание ДА в инкубационной среде после инкубации без добавления АНК, усредненное на массу белка ТИС от одного животного,
СдаТанк+ – содержание ДА в срезах после инкубации с добавлением АНК, усредненное на массу белка ТИС от одного животного,
СдаСанк+ – содержание ДА в инкубационной среде после инкубации с добавлением АНК, усредненное на массу белка ТИС от одного животного,
N – число структур (левая или правая – 0.5 структуры, левая и правая – 1 структура) от одного животного, взятых в каждую инкубационную камеру,
n – число животных, от которых были взяты образцы ткани в каждую инкубационную камеру.
Доля синтеза ДА моноферментными нейронами по отношению к общему синтезу ДА в ТИС рассчитывали как:
СдаТанк– – содержание ДА в срезах после инкубации без добавления АНК, усредненное на массу белка ТИС от одного животного,
СдаСанк– – содержание ДА в инкубационной среде после инкубации без добавления АНК, усредненное на массу белка ТИС от одного животного,
СдаТанк+ – содержание ДА в срезах после инкубации с добавлением АНК, усредненное на массу белка ТИС от одного животного,
СдаСанк+ – содержание ДА в инкубационной среде после инкубации с добавлением АНК, усредненное на массу белка ТИС от одного животного.
Концентрация ДА, синтезированного недофаминергическими нейронами ТИС на содержание белка в ТИС:
СдаТанк– – содержание ДА в срезах после инкубации без добавления АНК, усредненное на массу белка ТИС от одного животного,
СдаСанк– – содержание ДА в инкубационной среде после инкубации без добавления АНК, усредненное на массу белка ТИС от одного животного,
СдаТанк+ – содержание ДА в срезах после инкубации с добавлением АНК, усредненное на массу белка ТИС от одного животного,
СдаСанк+ – содержание ДА в инкубационной среде после инкубации с добавлением АНК, усредненное на массу белка ТИС от одного животного,
m – масса белка ТИС от одного животного.
РЕЗУЛЬТАТЫ
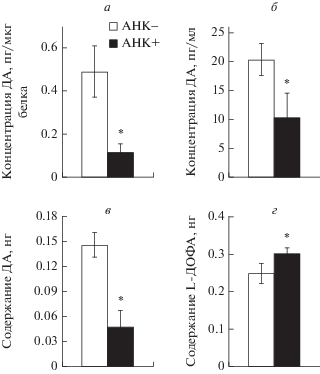
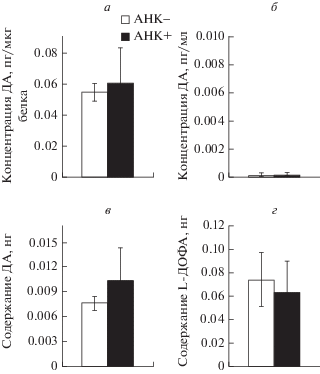
Содержание ДА и L-ДОФА в срезах медиобазального гипоталамуса и в инкубационной среде после инкубации с АНК и без АНК. У крыс на Э21 концентрация ДА в срезах ТИС после инкубации с АНК (0.11 ± 0.046 пг/мкг белка) была на 77.2% меньше, чем в срезах ТИС после инкубации без АНК (0.49 ± 0.117 пг/мкг белка) (рис. 2а). Концентрация ДА в инкубационной среде после инкубации срезов с АНК (10.3 ± 4.4 пг/мл) была на 50% меньше, чем в инкубационной среде после инкубации срезов без АНК (20.4 ± 2.9 пг/мл) (рис. 2б). При этом общее содержание ДА в инкубационной среде и ткани снижалось на 68% после инкубации с АНК (0.046 ± 0.02 нг) по сравнению с инкубацией без нее (0.145 ± 0.014 нг) (рис. 2в). На Э21 содержание L-ДОФА в инкубационной среде увеличивалось на 21.4% после инкубации срезов ТИС с АНК (0.301 ± 0.017 нг) по сравнению с инкубацией без нее (0.248 ± 0.027 нг) (рис. 2г).
Рис. 2.
Концентрация дофамина (ДА) в срезах (а) и инкубационной среде (б), суммарное содержание ДА срезах и инкубационной среде (в) и содержание L-диоксифенилаланина (L-ДОФА) в инкубационной среде (г) после инкубации срезов ТИС в буфере Кребса-Рингера с добавлением 2-амино-2-норборнанкарбоновой кислоты (АНК+) или в буфере Кребса-Рингера без 2-амино-2-норборнанкарбоновой кислоты (АНК–) на 21-й эмбриональный день (группы: число инкубаций постоянного количества срезов с АНК или без нее – 6). *р < 0.05, при сравнении между группами после инкубации с АНК (АНК+) и без нее (АНК–).
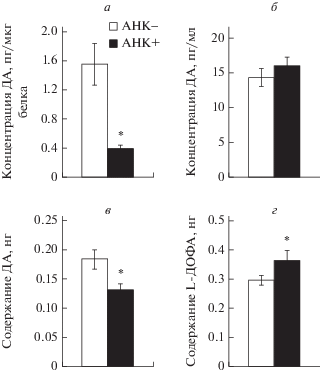
На П60 концентрация ДА в срезах ТИС после инкубации с АНК (0.38 ± 0.056 пг/мкг белка) была на 75.5% меньше, чем в срезах ТИС после инкубации без АНК (1.56 ± 0.289 пг/мкг белка) (рис. 3а). Концентрация ДА в инкубационной среде после инкубации срезов с АНК (16 ± 1.3 пг/мл) не менялась по сравнению с концентрацией ДА в инкубационной среде после инкубации срезов без АНК (14.4 ± 1.3 пг/мл) (рис. 3б). При этом общее содержание ДА в инкубационной среде и ткани снижалось на 29.6% после инкубации с АНК (0.131 ± 0.01 нг) по сравнению с инкубацией без нее (0.184 ± 0.017 нг) (рис. 3в). На П60 содержание L-ДОФА в инкубационной среде увеличивалось на 23% после инкубации срезов ТИС с АНК (0.365 ± 0.033 нг) по сравнению с инкубацией без нее (0.297 ± 0.017 нг) (рис. 3г).
Рис. 3.
Концентрация дофамина (ДА) в срезах (а) и инкубационной среде (б), суммарное содержание ДА срезах и инкубационной среде (в) и содержание L-диоксифенилаланина (L-ДОФА) в инкубационной среде (г) после инкубации срезов ТИС в буфере Кребса-Рингера с добавлением 2-амино-2-норборнанкарбоновой кислоты (АНК+) и без добавления 2‑амино-2-норборнанкарбоновой кислоты (АНК–) на 60-й постнатальный день (группы: число инкубаций постоянного количества срезов с АНК или без нее – 12 ). *р < 0.05, при сравнении между группами после инкубации с АНК (АНК+) и без нее (АНК–).
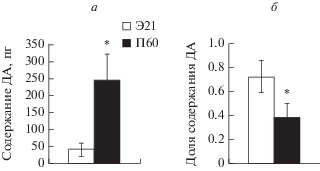
Синтез ДА недофаминергическими моноферментными нейронами на ТИС от одного животного увеличивается с Э21 (38.96 ± 19.8 пг) по П60 (244.5 ± 78.5 пг) в 6 раз (рис. 4а). При этом доля синтеза ДА недофаминергическими моноферментными нейронами в общем синтезе ДА на Э21 составляла 72% и снижалась к П60 до 39%, т.е. в 1.8 раза (рис. 4б).
Рис. 4.
Содержание дофамина (ДА), синтезированного моноферментными не дофаминергическими нейронами в срезах тубероинфундибуляроной системы в течение 1 ч (а) и доля дофамина, синтезированного моноферментными недофаминергическими нейронами (б) от общего синтеза дофамина на 21-й эмбриональный день (Э21) и 60-й постнатальный (П60) день (группы: число инкубаций постоянного количества срезов на Э21 – 6 и на П60 – 12), *р < 0.05, при сравнении между группами на Э21 и П60.
Содержание ДА и L-ДОФА в срезах черной субстанции и в инкубационной среде после инкубации с АНК и без АНК. На Э21 концентрация ДА в срезах черной субстанции после инкубации с АНК (0.06 ± 0.02 пг/мкг белка) не менялась по сравнению с концентрацией ДА в срезах после инкубации без АНК (0.054 ± 0.006 пг/мкг белка) (рис. 5а). Концентрация ДА в инкубационной среде после инкубации срезов с АНК или без АНК не определялась (была ниже разрешающей способности метода) (рис. 5б). Общее содержание ДА в инкубационной среде и в срезах не изменялось после инкубации с АНК (0.01 ± 0.004 нг) по сравнению с инкубацией без АНК (0.008 ± 0.0008 нг) (рис. 5в). На Э21 содержание L-ДОФА в инкубационной среде так же не менялось после инкубации срезов черной субстанции с АНК (0.063 ± 0.027 нг) по сравнению с инкубацией без нее (0.074 ± 0.023 нг) (рис. 5г).
Рис. 5.
Концентрация дофамина (ДА) в срезах (а) и инкубационной среде (б), суммарное содержание ДА срезах и инкубационной среде (в) и содержание L-диоксифенилаланина (L-ДОФА) в инкубационной среде (г) после инкубации срезов черной субстанции в буфере Кребса-Рингера с добавлением 2-амино-2-норборнанкарбоновой кислоты (АНК+) и без добавления 2-амино-2-норборнанкарбоновой кислоты (АНК–) на 21-й эмбриональный день (группы: число инкубаций постоянного количества срезов с АНК или без нее – 7 ). *р < 0.05, при сравнении между группами после инкубации с АНК (АНК+) и без нее (АНК–).
На П60 концентрация ДА в срезах черной субстанции после инкубации с АНК (0.86 ± ± 0.078 пг/мкг белка) не менялась по сравнению с концентрацией ДА в срезах после инкубации без АНК (0.77 ± 0.11 пг/мкг белка) (рис. 6а). Концентрация ДА в инкубационной среде после инкубации срезов с АНК (15.2 ± 2.6 пг/мл) не менялась по сравнению с концентрацией ДА в инкубационной среде после инкубации срезов без АНК (10.6 ± 3.4 пг/мл) (рис. 6б). Общее содержание ДА в инкубационной среде и в срезах не изменялось после инкубации с АНК (0.317 ± 0.036 нг) по сравнению с инкубацией без нее (0.26 ± 0.042 нг) (рис. 6в).
Рис. 6.
Концентрация дофамина (ДА) в срезах (а) и инкубационной среде (б), суммарное содержание ДА срезах и инкубационной среде (в) и содержание L-диоксифенилаланина (L-ДОФА) в инкубационной среде (г) после инкубации срезов черной субстанции в буфере Кребса-Рингера с добавлением 2-амино-2-норборнанкарбоновой кислоты (АНК+) и без добавления 2-амино-2-норборнанкарбоновой кислоты (АНК–) на 60-й постнатальный день (группы: число инкубаций постоянного количества срезов с АНК или без нее – 8). * р < 0.05, при сравнении между группами после инкубации с АНК (АНК+) и без нее (АНК–).
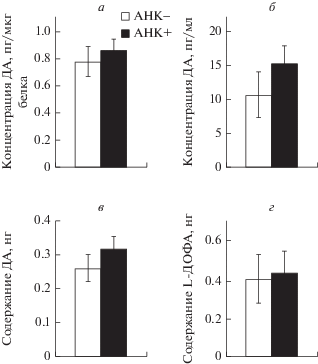
На П60 содержание L-ДОФА в инкубационной среде так же не менялось после инкубации срезов черной субстанции с АНК (0.431 ± 0.11 нг) по сравнению с инкубацией без нее (0.402 ± 0.13 нг) (рис. 6г).
ОБСУЖДЕНИЕ
Появление в конце 80-х годов иммуногистохимического метода выявления одновременно двух внутриклеточных антигенов, позволило показать, что в мозге, наряду с нейронами, содержащими оба фермента синтеза ДА – ТГ и ДАА, имеются нейроны, обладающие только одним из ферментов [11–14]. Несмотря на последующие многочисленные попытки понять функциональное значение этих нейронов, это не удавалось сделать до тех пор, пока не была найдена область мозга – ТИС, в которой у плодов крыс в конце пренатального периода содержатся практически только моноферментные нейроны [7]. Одновременно были получены косвенные доказательства синтеза ДА в этой области мозга, несмотря на отсутствие ДА-ергических нейронов в этот период онтогенеза. К ним относится высокое содержание ДА в культуре клеток эмбриональной ТИС и становление у крыс в конце пренатального периода характерного для взрослых животных дофаминового ингибиторного контроля секреции гипофизарного пролактина [15, 16].
Синтез ДА недофаминергическими нейронами тубероинфундибулярной системы у крыс в конце пренатального периода. Получение прямого доказательства синтеза ДА недофаминергическими моноферментными нейронами стало возможным только после разработки принципиально нового методического подхода ex vivo [5]. Этот подход позволил оценить и сравнить уровень синтеза ДА при инкубации нейронов ТИС в буфере Кребса-Рингера и после инкубации в буфере Кребса-Рингера в присутствии конкурентного ингибитора мембранного переносчика L-ДОФА и, следовательно, при ингибировании кооперативного синтеза ДА. В качестве показателя уровня синтеза ДА использовали общее содержание ДА в нейронах и в среде после инкубации в течение часа. Так, было показано, что при инкубации суспензии нейронов ТИС плодов крыс в буфере Кребса-Рингера в присутствии L-тирозина в качестве конкурентного ингибитора мембранного переносчика L-ДОФА, синтез ДА был значительно ниже, чем при инкубации без добавления L‑тирозина. В контроле оценивали синтез ДА в суспензии однородной популяции ДА-ергических нейронов в черной субстанции. В отличие от нейронов ТИС, инкубация нейронов ЧС с L-тирозином сопровождалась увеличением синтеза ДА, поскольку L-тирозин является субстратом синтеза ДА в этих нейронах [6].
Несмотря на то, что приведенные выше доказательства кооперативного синтеза ДА моноферментными нейронами не вызывают сомнения, они не позволили количественно оценить уровень кооперативного синтеза ДА в ТИС у крыс в конце пренатального периода, по крайней мере, по трем причинам. Во-первых, кооперативный синтез оценивали только во фракции тел нейронов ТИС, хотя наиболее интенсивный синтез ДА происходит в терминалах аксонов в срединном возвышении. Во-вторых, L-тирозин, который, хотя и является ингибитором мембранного переносчика L-ДОФА, способен включаться в метаболизм ДА. И, наконец, из известных в настоящее время конкурентных ингибиторов, L-тирозин обладает не самой высокой аффиностью к мембранному переносчику L-ДОФА [17]. Это означает, что L-тирозин не в состоянии полностью заингибировать кооперативный синтез ДА, а следовательно в экспериментах с его использованием нельзя количественно оценить уровень кооперативного синтеза ДА.
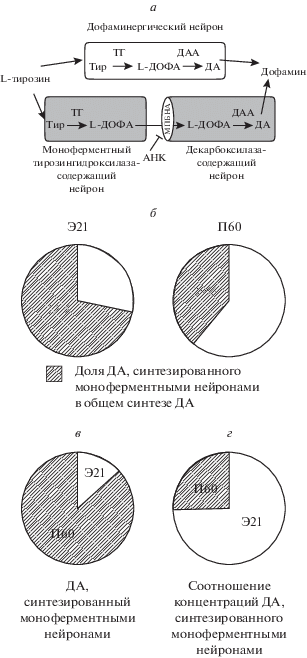
Исходя из выше изложенных критических замечаний, при проведении данной работы были внесены соответствующие изменения в схему экспериментов, позволившие дать не только качественную, но и количественную оценку кооперативного синтеза ДА недофаминергическими нейронами. Во-первых, кооперативный синтез ДА оценивали у плодов крыс на Э21 в вибратомных срезах ТИС, включающих не только тела нейронов, локализованных в аркуатном ядре, но и в терминалях аксонов, проецирующихся в срединное возвышение. Во-вторых, в качестве конкурентного ингибитора мембранного переносчика L-ДОФА использовали синтетический ингибитор АНК (рис. 7а), не включающийся в нейрональный метаболизм и обладающую наиболее высокой аффиностью по сравнению с другими конкурентными ингибиторами мембранного переносчика больших нейтральных аминокислот [17–19].
Рис. 7.
Схема синтеза дофамина (ДА) дофаминергическими нейронами и нейронами, содержащими только тирозингидроксилазу (ТГ) и только декарбоксилазу ароматических L-аминокислот (ДАА) (а); схематическое изображение синтеза дофамина моноферментными нейронами в тубероинфундибулярной системе у крыс на 21-й эмбриональный день (Э21) и 60-й постнатальный день (П60): (б) вклад моноферментных нейронов в общий синтез дофамина, (в) соотношения величин абсолютного синтеза дофамина моноферментными нейронами и (г) соотношения концентраций дофамина, синтезированного моноферментными нейронами. АНК, 2-амино-2-норборнанкарбоновая кислота; L-ДОФА, L-диоксифенилаланин; МПБНА, мембранный переносчик больших нейтральных L-аминокислот; Тир, L-тирозин.
Как и предполагалось, при использовании усовершенствованного методического подхода в данной работе удалось получить не только такие же, как и раньше, качественные результаты [6], но и важные количественные характеристики кооперативного синтеза ДА недофаминергическими нейронами. Так, независимо от использования суспензии нейронов или срезов ТИС и различных ингибиторов мембранного переносчика L-ДОФА – L-тирозина или АНК, общее содержание ДА в нейронах/срезах и в среде после инкубации в буфере Кребса-Рингера было намного выше, чем после инкубации в буфере Кребса-Рингера с добавлением конкурентного ингибитора мембранного переносчика L-ДОФА. При этом в данной и в предыдущей работах было обнаружено увеличение содержания L-ДОФА в инкубационной среде при использовании ингибитора мембранного переносчика нейтральных аминокислот. В совокупности приведенные данные, полученные в предыдущем [6] и в данном исследовании, являются прямым качественным доказательством наличия кооперативного синтеза ДА моноферментными нейронами у крыс в конце пренатального периода. Однако в данной работе был дополнительно получен ряд важных количественных результатов. Во-первых, использование АНК в качестве конкурентного ингибитора L-ДОФА привело к многократному снижению содержания/синтеза ДА как в срезах, так и в среде, а в предыдущей работе с использованием L-тирозина – только в среде. Эти данные подтверждают наше предположение о том, что основной синтез ДА в моноферментных нейронах осуществляется в терминалях аксонов в срединном возвышении. Во-вторых, разница между общим содержанием ДА в срезах и в среде после инкубации в буфере Кребса-Рингера и в этом же буфере, но с добавлением АНК значительно превышает разницу между общим содержанием ДА в суспензии нейронов и в среде после инкубации в буфере Кребса-Рингера и после инкубации в буфере с добавлением L-тирозина. Эти данные подтверждают более высокую специфичность АНК по сравнению с известными конкурентными ингибиторами мембранного переносчика больших молекул нейтральных аминокислот.
Преимущество использования АНК – неметаболизирующегося синтетического ингибитора мембранного переносчика L-ДОФА, по сравнению с использованием L-тирозина – предшественника ДА, проявилось также в контроле. Так, при инкубации суспензии нейронов черной субстанции в присутствии L-тирозина значительно увеличились содержание/синтез ДА, в то время как при инкубации срезов черной субстанции в присутствии АНК содержание/синтез ДА не изменились.
Синтез ДА недофаминергическими нейронами тубероинфундибулярной системы у взрослых крыс. Только через десять лет после получения прямых доказательств синтеза ДА недофаминергическими нейронами ТИС у крыс в конце пренатального периода [6], появились доказательства наличия такого же синтеза у взрослых животных [8]. Исследование кооперативного синтеза ДА у взрослых животных было выполнено на более высоком уровне, чем исследование кооперативного синтеза ДА у плодов. А именно, синтез ДА оценивали не в суспензии нейронов, а в срезах ТИС. При этом в качестве конкурентного ингибитора мембранного переносчика L-ДОФА использовали L-лейцин, не включающийся в метаболизм ДА [4, 20]. Учитывая то, что в отличие от плодов, у взрослых животных в ТИС, наряду с моноферментными нейронами, содержатся ДА-ергические нейроны и моноаминергические аксоны (серотонинергические, норадренергические, дофаминергические) экстрагипоталамического происхождения, представления о спектре нейронов, участвующих в кооперативном синтезе были существенно расширены. Единственным обязательным и ключевым элементом кооперативного синтеза ДА недофаминергическими нейронами, независимо от возраста животного, остаются моноферментные нейроны, экспрессирующие ТГ и синтезирующие L-ДОФА. Что касается дальнейшей судьбы L-ДОФА, то он может превращаться в ДА не только в моноферментных ДАА-экспрессирующих нейронах, но и во всех моноаминергических нейронах, обладающих ДАА [5].
В данной работе, как и в предыдущей, исследование кооперативного синтеза ДА проводили, используя срезы ТИС взрослых крыс, однако вместо L-лейцина в буфере Кребса-Рингера вводили АНК – синтетический неметаблизирующийся ингибитор (рис. 7а), с более высокой аффинностью к мембранному переносчику L-ДОФА [17–19]. Это позволило подтвердить наличие кооперативного синтеза ДА и получить его новые важные количественные характеристики. Так, в данной работе получено дополнительное доказательство кооперативного синтеза ДА в нейронах ТИС у взрослых крыс в виде повышения содержания L-ДОФА в инкубационной среде в присутствии АНК. В предыдущей работе с использованием L-лейцина в качестве конкурентного ингибитора мембранного переносчика больших нейтральных аминокислот увеличение содержания L-ДОФА было обнаружено только после дополнительного применения толкопона – ингибитора катехол-О-метилтрансферазы – фермента деградации L-ДОФА [21]. Самое важное то, что с помощью АНК удалось показать, что абсолютное значение кооперативного синтеза ДА недофаминергическими нейронами ТИС значительно выше, чем это представлялось на основе данных полученных при инкубации срезов в присутствии L-лейцина.
Сравнительный количественный анализ кооперативного синтеза ДА в тубероинфундибулярной системе у крыс в онтогенезе. В исследованиях развития мозга с акцентом на дифференцировку моноаминергических нейронов было показано, что в ряде отделов мозга в перинатальном периоде доминируют моноферментные нейроны, экспрессирующие только ТГ или только ДАА [5]. Наиболее ярким примером является развивающаяся ТИС. Так, у крыс в конце пренатального периода более 99% нейронов, экспрессирующих ферменты синтеза ДА, представлены в равной пропорции моноферментными нейронами, содержащими только ТГ или только ДАА. В постнатальном периоде, наряду с моноферментными нейронами появляются ДА-ергические нейроны, число и доля которых постепенно возрастает в постнатальном периоде. У взрослых животных около половины нейронов ТИС, экспрессирующих ферменты синтеза ДА, являются моноферментными и столько же ДА-ергическими [7]. Однако по соотношению нейронов с различным набором ферментов невозможно судить об уровне кооперативного синтеза ДА на различных этапах индивидуального развития. Поэтому в данной работе для решения этой задачи проведен сравнительный количественный анализ кооперативного синтеза ДА недофаминергическими моноферментными нейронами в ТИС у крыс в конце пренатального периода и у взрослых животных. При этом показано, что доля кооперативного синтеза ДА от общего синтеза ДА моноферментными и ДА-ергическими нейронами в ТИС у плодов крыс почти в два раза больше, чем у взрослых животных (рис. 7б). Этот показатель в определенной степени коррелирует с изменением количественного соотношения моноферментных и ДА-ергических нейронов у плодов и у взрослых крыс [7]. С точки зрения функциональной роли ДА, произведенного моноферментными нейронами, особый интерес представляют наши данные, указывающие на шестикратное увеличение синтеза ДА моноферментными нейронами ТИС у крыс с Э21 до П60 (рис. 7в). При этом концентрация ДА, синтезированного моноферментными нейронами ТИС снижается в три раза с Э21 до П60 у крыс (рис. 7г).
Таким образом, доля синтеза ДА недофаминергическими моноферментными нейронами по отношению к общему синтезу ДА гораздо выше у плодов крыс, чем у взрослых животных, причем абсолютное значение кооперативного синтеза ДА в этот период онтогенеза многократно возрастает.
ЗАКЛЮЧЕНИЕ
В данной работе был применен усовершенствованный оригинальный метод изучения кооперативного синтеза на срезах ткани с использованием синтетического неметаболизируемого ингибитора мембранного переносчика больших нейтральных аминокислот – АНК. Это позволило провести сравнительный анализ кооперативного синтеза ДА недофаминергическими нейронами в ТИС в онтогенезе – у плодов и взрослых крыс. Было впервые показано шестикратное увеличение синтеза ДА моноферментными нейронами ТИС у крыс с конца пренатального периода до взрослого состояния. Также впервые показано, что доля кооперативного синтеза ДА от общего синтеза ДА моноферментными и ДА-ергическими нейронами в ТИС у плодов крыс почти в два раза больше, чем у взрослых животных.
Таким образом, доля синтеза ДА недофаминергическими моноферментными нейронами по отношению к общему синтезу ДА гораздо выше у плодов крыс, чем у взрослых животных, причем абсолютное значение кооперативного синтеза ДА в этот период онтогенеза многократно возрастает.
Список литературы
Ben-Jonathan N., Hnasko R. // Endocrine Reviews. 2001. V. 22. P. 724–763.
Carli M., Evenden J.L., Robbins T.W. // Nature. 1985. V. 313. P. 679–682.
McDowell K., Chesselet M.F. // Neurobiol. Dis. 2012. V. 46. P. 597–606.
Vieira-Coelho M.A., Soares-Da-Silva P. // Am. J. Phys. 1998. V. 275. P. 104–112.
Ugrumov M.V. // Adv. Pharmacol. 2013. V. 68. P. 37–91.
Ugrumov M.V., Melnikova V.I., Lavrentyeva A.V., Kudrin V.S., Rayevsky K.S. // Neuroscience. 2004. V. 124. P. 629–635.
Ershov P.V., Ugrumov M.V., Calas A., Krieger M., Thibault J. // J. Comp. Neurol. 2002. V. 446. P. 114–122.
Ugrumov M., Taxi J., Pronina T., Kurina A., Sorokin A., Sapronova A., Calas A. // Neuroscience. 2014. V. 277. P. 45–54.
Paxinos G., Watson C. // The Rat Brain in Stereotaxic Coordinates. Compact 6th ed. London: Academic Press, 2009.
Ashwell K.W.S., Paxinos G. // Atlas of the Developing Rat Nervous System. Compact 3d ed. London: Academic Press, 2008.
Meister B., Hökfelt T., Steinbusch H.W., Skagerberg G., Lindvall O., Geffard M., Joh T.H., Cuello A.C., Goldstein M. // J. Chem. Neuroanat. 1988. V. 1. P. 59–64.
Okamura H., Kitahama K., Mons N., Ibata Y., Jouvet M., Geffard M. // Neurosci. Lett. 1988. V. 95. P. 42–46.
Nagatsu I., Komori K., Takeuchi T., Sakai M., Yamada K., Karasawa N. // Brain Res. 1990. V. 511. P. 55–62.
Ikemoto K., Kitahama K., Nishimura A., Jouvet A., Nishi K., Arai R., Jouvet M., Nagatsu I. // Neurosci. Lett. 1999. V. 269. P. 37–40.
Melnikova V.I., Orosco M., Rouch C., Calas A., Nicolaidis S., Proshlyakova E.V., Sapronova A.Y., Ugrumov M.V. // Eur. J. Endocrinol. 1998. V. 139. P. 337–342.
Melnikova V., Orosco M., Calas A., Sapronova A., Gainetdinov R., Delhaye-Bouchaud N., Nicolaidis S., Rayevsky K., Ugrumov M. // Neuroscience. 1999. V. 89. P. 235–241.
Pankovich J.M., Jimbow K. // Biochem. J. 1991. V. 280. P. 721–725.
Sebastianelli L., Ledonne A., Marrone M.C., Bernardi G., Mercuri N.B. // Experimental. Neurology. 2008. V. 212. P. 230–233.
Handlogten M.E., Weissbach L., Kilberg M.S. // Biochem. Biophys. Res. Commun. 1982. V. 104. P. 307–313.
Uchino H., Kanai Y., Kim D.K., Wempe M.F., Chairoungdua A., Morimoto E., Anders M.W., Endou H. // Mol. Pharmacol. 2002. V. 61. P. 729–737.
Reenilä I., Männistö P.T. // Medical. Hypotheses. 2001. V. 57. P. 628–632.
Дополнительные материалы отсутствуют.


