Нейрохимия, 2020, T. 37, № 1, стр. 540-63
Производное аминоадамантана гимантан ослабляет морфин-индуцированную гиперлокомоторную реакцию, модулируя активность дофаминергической и серотонинергической систем
Л. Г. Колик 1, А. В. Надорова 1, В. Б. Наркевич 1, В. С. Кудрин 1
1 ФГБНУ “НИИ фармакологии им. В.В. Закусова”
Москва, Россия
Поступила в редакцию 29.12.2018
После доработки 26.04.2019
Принята к публикации 06.08.2019
Аннотация
Известно, что морфин вызывает продолжительную гиперлокомоторную реакцию, усиливая высвобождение дофамина в прилежащем ядре посредством активации дофаминергических нейронов в вентральной области покрышки. Ранее была показана способность низко-аффинного антагониста NMDA-рецепторов гимантана ослаблять этанол-индуцированную стимуляцию поведения за счет воздействия на дофамин- и норадренергические системы. В данной работе изучено влияние производного аминоадамантана гимантана на изменение баланса моноаминов и их метаболитов в структурах мозга мышей С57Bl/6 на фоне острого введения морфина. Гимантан в дозе 20.0 мг/кг, в/б, при однократном введении, не влияя на спонтанную двигательную активность per se, ослаблял индуцированную морфином (20.0 мг/кг, п/к) стимуляцию поведения (p < 0.01). В опытах ex vivo гимантан препятствовал вызываемому морфином значительному увеличению соотношения ДОФУК/ДА и 5‑ОИУК/5-ОТ в стриатуме (p < 0.05, p < 0.05), ГВК/ДА в прилежащем ядре (p < 0.01), способствовал восстановлению показателя ДОФУК/ДА до значений контрольной группы в гипоталамусе. Полученные данные указывают на способность гимантана ингибировать морфин-индуцированную стимуляцию поведения, вероятно, через модуляцию дофаминергической и серотонинергической систем.
ВВЕДЕНИЕ
Известно, что подкрепляющие и психомоторные эффекты опиоидов определяются гиперполяризацией ГАМКергических интернейронов в результате активации µ-опиоидных рецепторов, что способствует растормаживанию дофаминергических нейронов в вентральной области покрышки (ventral tegmental area, VTA) и увеличению высвобождения дофамина (ДА) в вентральном стриатуме (n. аccumbens), отвечающем за контроль двигательной активности и, в особенности, за формирование мотивационного поведения в ответ на действие психоактивных веществ [1, 2]. Последующая активация дофамином сопряженных с G-белками дофаминовых (Д) рецепторов проявляется в изменении различных реакций, включая подкрепляющие эффекты и поведенческую сенсибилизацию. Механизмы, ответственные за опиоид-индуцированное усиление локомоторной реакции, не нарушаются у мышей-нокаутов по гену Д2-рецептора [3]. Предполагается, что за опиоид-индуцированное усиление психомоторной реакции в основном отвечают Д1-рецепторы [4] и недофаминергические системы [5]. Так, вызываемая морфином повышенная локомоторная активность купируется при системном введении антагониста Д1-рецепторов SCH23390 [6] и полностью отсутствует у мышей-нокаутов по гену Д1-рецептора [7].
Согласно данным литературы, активация аденозин-3',5'-цикломонофосфата и зависимой протеинкиназы А (cAMP/PKA пути) в стриатуме опосредует психотропные эффекты многих психоактивных веществ. В работе Borgkvist A. et al. (2007) показано, что в прилежащем ядре (n. accumbens) у мышей морфин при остром введении вызывает увеличение фосфорилирования дофамин-и cAMP-регулирующего фосфопротеина 32 кДа (DARPP-32), которое устраняется при предварительной блокаде Д1-рецепторов, что доказывает участие cAMP/PKA/DARPP-32 пострецепторного сигнального пути в развитии психостимулирующего действия морфина [8]. Однако, наблюдаемая умеренная стимуляция двигательной активности у мышей-нокаутов DARPP-32 при введении морфина предполагает существование дополнительных сигнальных путей, участвующих в проявление данного поведения. В 2011г. Urs N.M. et al. опубликовали результаты исследований, свидетельствующие о возможной роли зависимого от активации Д1-рецепторов сигнального комплекса бета-аррестин 2/внеклеточно сигнал-регулируемая киназа (β-arrestin2/ERK) в реализации психостимулирующего, но не подкрепляющего, действующего на систему “награды”, эффекта морфина [9]. Таким образом, многочисленные полученные экспериментальные данные указывают на вовлеченность Д1-рецепторов в индуцированную опиоидами психостимулирующую реакцию.
В пионерской работе Bernard J. Carroll and Peter T. Sharp (1972) показано, что ДА, норадреналин (НА) и серотонин (5-ОТ) участвуют в формировании морфин-индуцированной гиперлокомоторной реакции, при этом ведущая роль принадлежит ДА-ергической системе. Кроме того, необратимый селективный ингибитор моноаминоксидазы (МАО) паргилин при одновременном введении с морфином статистически значимо увеличивал ответную реакцию на морфин [10]. С другой стороны, клоргилин, избирательный ингибитор МАО-А, заметно ослаблял психостимулирующее действие морфина [11].
Широко представленные в прилежащем ядре дофаминовые и глутаматные рецепторы посредством тесного межрецепторного взаимодействия способствуют развитию многих нейропсихических заболеваний, включая зависимость от психоактивных веществ. Так, в опытах in vivo выявлена роль Д3-рецепторов в формировании морфин-индуцированной поведенческой двигательной сенсибилизации путем регулирования субъединиц ионотропных N-метил-D-аспартат(NMDA)-рецепторов в прилежащем ядре [12].
Синтезированный и фармакологически разработанный в ФГБНУ “НИИ фармакологии им. В.В. Закусова” препарат для лечения болезни Паркинсона гимантан [13, 14] обладает выраженным антиаддиктивным потенциалом, доказанным в опытах in vivo на моделях экспериментального алкоголизма [15] и опиоидной зависимости [16]. При изучении механизма действия гимантана ранее показана его способность проявлять свойства конкурентного ингибитора МАО-В на культуре клеток [17], увеличивать плотность связывающих сайтов Д1-рецепторов без изменения их сродства к селективным лигандам у крыс Wistar [18] и снижать содержание 5-ОТ и его метаболитов в стриатуме у мышей линии С57Bl/6 в дозе 20 мг/кг [19]. Принимая во внимание многокомпонентный характер действия оригинального производного аминоадамантана, включающий также неконкурентную блокаду NMDA-рецепторов [20], целью работы было изучение поведенческих эффектов и нейрохимических механизмов влияния гимантана на баланс моноаминов и их метаболитов в структурах мозга мышей на фоне острого введения морфина.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Животные. Эксперименты выполнены на мышах-самцах линии С57Bl/6 (n = 92) c массой тела 22–24 г. (“Научный центр биомедицинских технологий Федерального медико-биологического агентства”, филиал “Столбовая”). Животных содержали по 15 особей в клетке стандарта Т/3 в условиях вивария ФГБНУ “НИИ фармакологии имени В.В. Закусова” при регулируемом световом режиме 12 ч/12 ч (свет/темнота) и постоянной температуре (21–23°С) со свободным доступом к воде и гранулированному корму (ГОСТ Р 50258-92) в течение 10 сут до начала тестирования в соответствии с приказом МЗ РФ № 199н от 23.08.2010 “Об учреждении Правил лабораторной практики”. Проведение экспериментов одобрено Комиссией по биомедицинской этике ФГБНУ “НИИ фармакологии им. В.В. Закусова”. Для исключения влияния суточных биоритмов на скорость биосинтеза и метаболизма нейромедиаторов, эксперименты проводили между 10 и 12 ч дня.
Препараты. Гимантан (N-(2-адамантил)-гексаметиленимина гидрохлорид, субстанция, синтезированная в ФГБНУ “НИИ фармакологии им. В.В. Закусова”) в дозе 20 мг/кг, внутрибрюшинно (в/б) и морфина гидрохлорид (Минмедбиопром объединение “Чимкентбиофарм”, субстанция) в дозе 20 мг/кг, подкожно, растворяли в воде для инъекций и вводили однократно из расчета 0.1 мл/10 г веса животного. Животные контрольных групп получали воду для инъекций в эквивалентных объемах. Выбор дозы морфина основан на данных литературы [21].
Дизайн исследования. Животных разделяли случайным образом на следующие группы:
для исследования поведения:
группа 1 “Контроль”, n = 11: вода для инъекций + через 30 мин вода для инъекций – посадка в актометр;
группа 2 “Морфин”, n = 10: вода для инъекций + + через 30 мин морфин, 20 мг/кг – посадка в актометр;
группа 3 “Гимантан”, n = 11: Гимантан, 20 мг/кг + через 30 мин вода для инъекций – посадка в актометр;
группа 4: “Гимантан + Морфин”, n = 12: Гимантан, 20 мг/кг + через 30 мин морфин, 20 мг/кг – посадка в актометр;
для нейрохимических исследований (в скобках указано время экспозиции до декапитации):
группа 1 “Контроль”, n = 12: вода для инъекций (за 50 мин до декапитации) + вода для инъекций (20 мин);
группа 2 “Морфин”, n = 12: вода для инъекций (50 мин) + морфин, 20 мг/кг (20 мин);
группа 3 “Гимантан”, n = 12: Гимантан, 20 мг/кг (50 мин) + вода для инъекций (20 мин);
группа 4: “Гимантан + Морфин”, n = 12: Гимантан, 20 мг/кг (50 мин) + раствор морфина, 20 мг/кг (20 мин).
Поведенческие исследования. Спонтанную двигательную активность мышей оценивали в актометре Opto-Varimex 4 (Columbus Instruments, США). Установка представляет собой квадратную плексигласовую арену со сторонами 42 × 42 см и высотой 20 см. По периметру арены расположены четыре пары чувствительных оптоэлектронных датчиков (λ = 875 нм) на высоте 2 см от пола, автоматически регистрирующие параметры двигательной активности животных (пройденное расстояние, см) и передающие их на блок управления, соединенный с компьютером. Двигательную активность животных регистрировали непрерывно в течение 30 мин [22, 23].
Нейрохимические исследования. Структуры головного мозга (фронтальная кора (ФК), гипоталамус, миндалевидное тело, прилежащее ядро, стриатум и гиппокамп) извлекали на льду и замораживали в жидком азоте. После этого выделенные структуры размельчали в 1 мл среды выделения в гомогенизаторе (тефлон–стекло) при 10°С и скорости вращения пестика 3000 об./мин. В качестве среды выделения использовали 0.1 н HClO4 с добавлением дигидроксибензиламина (ДГБА, 0.25 нмоль/мл) в качестве внутреннего стандарта. Пробы центрифугировали при 10 000 g в течение 15 мин. Получившийся супернатант в дальнейшем использовали для определения содержания моноаминов и их метаболитов: НА (норадреналин), ДА (дофамин), ДОФУК (3,4-диокси(гидрокси)фенилуксусная кислота), ГВК (гомованилиновая кислота), 3-МТ (3-метокситирамин), 5-ОT (серотонин), 5‑ОИУК (5-оксииндолуксусная кислота). Содержание моноаминов и их метаболитов определялось с помощью метода высокоэффективной жидкостной хроматографии с электрохимической детекцией (ВЭЖХ/ЭД) на хроматографе LC-304T (BAS, West Lafayette, США) с инжектором Rheodyne 7125 (петля для нанесения образцов 20 мкл). Изучаемые вещества разделяли на обращенно-фазной колонке ReproSil-Pur, ODS-3, 4 × × 100 мм, 3 мкм (Dr.Majsch GMBH, Германия). Насос PM-80 (BAS, США), скорость элюции подвижной фазы 1.0 мл/мин, при давлении 200 атм. Мобильная фаза: 0.1 M цитратно-фосфатный буфер, содержащий 1.1 мM октансульфоновой кислоты, 0.1 мM ЭДТА и 9% ацетонитрила (pH 3.0). Измерение проводили с помощью электрохимического детектора LC-4B (BAS США) на стеклоугольном электроде (+0.85 V) против электрода сравнения Ag/AgCl. Регистрация образцов проводилась с применением аппаратно-программного комплекса Мультихром 1.5 (“Амперсенд”, Россия). Все использовавшиеся для анализа реактивы были высокой степени чистоты: “ос. ч.”, “х. ч.” Для калибровки хроматографа использовались смеси рабочих стандартов определяемых веществ в концентрации 500 пмоль/мл. Величины концентрации моноаминов в опытных образцах рассчитывали методом “внутреннего стандарта”, исходя из отношений площади пиков в стандартной смеси и в образце [22].
В силу отсутствия данных о стрессиндуцированных изменениях при пересадке из домашней клетки в установку Оptovarimex уровней кортизола или адреналина/норадреналина в крови, содержания моноаминов, индоламинов и их метаболитов в ЦНС – исследование имеет ограничение при сравнении поведенческого и биохимического экспериментов. Выбор временного интервала для момента декапитации животных выбран на основании данных, полученных при исследовании двигательной реакции в актометре, где было зарегистрировано статистически значимое увеличение двигательной активности с 12 по 30 мин. На 20 мин наблюдалось максимально выраженное ослабление морфин – индуцированной гиперлокомоторной реакции под действием гимантана.
Статистическую обработку полученных результатов проводили в ПСП Statistica v.8.0 (StatSoft, USA) при помощи двухфакторного дисперсионного анализа для повторных измерений (анализируемые факторы: “Гимантан” и “Морфин”) с последующим использованием критерия Дункана, двухфакторного дисперсионного анализа (ANOVA) с последующим использованием критерия Дункана. Критический уровень значимости α = 0.05. Данные представлены в виде М ± SEM: М – средние значения, SEM – стандартная ошибка среднего.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ОБСУЖДЕНИЕ
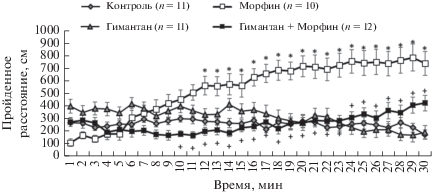
Поведенческие исследования. В опытах in vivo при поведенческом тестировании с помощью двухфакторного дисперсионного анализа для повторных измерений установлено взаимодействие факторов “Гимантана” и “Морфина” (F(29, 1160) = = 4.4719, p = 0.00000). Факторы “Гимантан” (F(29, 1160) = 9.7613, p = 0.0000) и “Морфин” (F(29, 1160) = 19.463, p = 0.0000) оказывали существенное влияние на локомоторную двигательную активность. При межгрупповом сравнении с помощью критерия Дункана морфин в дозе 20.0 мг/кг, п/к, статистически значимо увеличивал двигательную активность (p < 0.01) мышей С57Bl/6 по сравнению с контрольной группой, начиная с 12-й мин наблюдения (рис. 1). Гимантан в дозе 20 мг/кг не оказывал самостоятельного влияния на поведение животных, что соответствует ранее полученным данным у мышей DBA/2 [22]. При введении гимантана за 30 мин до инъекции морфина наблюдалось ослабление психостимулирующего действия морфина уже на 10-й мин (p < 0.01), которое сохранялось в течение последующих 20-ти мин наблюдения (рис. 1).
Рис. 1.
Влияние гимантана на развитие морфин-индуцированной гиперлокомоторной реакции у мышей C57Bl/6. Поминутная регистрация. M ± SEM. Примечание: Множественные сравнения с использованием критерия Дункана: * – p < 0.01 между группами “Контроль” и “Морфин” для соответствующего отрезка времени; + – p < 0.01 между группами “Морфин” и “Гимантан + Морфин” для соответствующего отрезка времени.
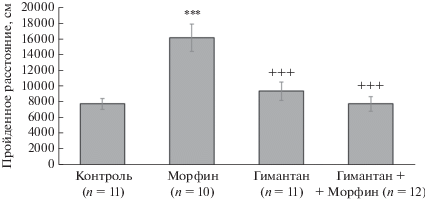
На рис. 2 представлен суммарный показатель общего пройденного расстояния в течение 30 мин после введения морфина. Анализ данных с помощью двухфакторного дисперсионного анализа позволил установить, что оба изучаемых фактора (“Гимантан” (F(1, 40) = 8.5751, p = 0.00560) и “Морфин” (F(1, 40) = 8.5995, p = 0.00554)) оказывали статистически значимое влияние на суммарные показатели общего пройденного расстояния. Выявлено взаимодействие между факторами “Гимантан + Морфин” F(1, 40) = 18.735, p = 0.00010). При межгрупповом сравнении с помощью критерия Дункана показателей общего пройденного расстояния выявлено статистически значимое (p < 0.001) снижение гимантаном психостимулирующего действия морфина (рис. 2).
Рис. 2.
Гимантан ослабляет морфин-индуцированную гиперлокомоторную активность у мышей C57Bl/6. Суммарные показатели (в течение 30 мин). M ± SEM. Множественные сравнения с использованием критерия Дункана:: *** – p < < 0.001 по отношению к группе “Контроль”; +++ – p < 0.001 по отношению к группе “Морфин”.
Нейрохимические исследования. В настоящей работе не выявлено влияния морфина и гимантана на изменения содержания норадреналина в изученных структурах мозга мышей С57Bl/6 по сравнению с контрольной группой, хотя ранее было показано снижение уровня норадреналина в префронтальной коре при остром введении гимантана у мышей DBA/2 [22]. Также, не обнаружено статистически значимых изменений при действии изучаемых препаратов в префронтальной коре. Расхождение результатов, по-видимому, может объясняться разным временем экспозиции животных с препаратом и использованием инбредных мышей разных линий. Также не было отмечено статистически значимых влияний морфина и гимантана на содержание 3-МТ во всех изученных структурах мозга мышей С57Bl/6.
Как и предполагалось, морфин вызывал наиболее значительные сдвиги в концентрации дофамина и его метаболитов в стриатуме и прилежащем ядре, не влияя на баланс моноаминов в префронтальной коре, гипоталамусе, гиппокампе и миндалевидном теле (табл. 1). Увеличение содержания ДОФУК с соответствующим возрастанием показателя ДОФУК/ДА, свидетельствующего об увеличении скорости метаболизма дофамина, наблюдалось в стриатуме (р < 0.001) и прилежащем ядре (р < 0.001), тогда как уровень ГВК, другого метаболита ДА, повышался только в прилежащем ядре (р < 0.01) (табл. 1). Зарегистрированные изменения свидетельствуют об активирующем действии морфина на ДА-ергическую систему мышей C57Bl/6 и согласуются с работой Suzuki T. et al. (1995), в которой показано резкое увеличение под действием морфина содержания метаболитов дофамина, ДОФУК и ГВК в лимбической системе, в частности, в прилежащем ядре [24].
Таблица 1.
Влияние гимантана на морфин-индуцированные изменения содержания дофамина и его основных метаболитов в разных структурах мозга мышей C57Bl/6 (М ± SEM)
| Группы | ДОФУК | ДА | ГВК | ДОФУК/ДА | ГВК/ДА |
|---|---|---|---|---|---|
| Гипоталамус | |||||
| Контроль, n = 12 | 0.96 ± 0.04 | 2.48 ± 0.41 | 1.84 ± 0.24 | 0.43 ± 0.03 | 0.84 ± 0.12 |
| Морфин, n = 12 | 1.09 ± 0.05 | 2.27 ± 0.17 | 1.89 ± 0.15 | 0.49 ± 0.02 | 0.87 ± 0.10 |
| Гимантан, n = 12 | 1.05 ± 0.05 | 2.52 ± 0.14 | 1.83 ± 0.20 | 0.42 ± 0.03 | 0.65 ± 0.03 |
| Гимантан + Морфин, n = 11 | 1.14 ± 0.05 | 3.25 ± 0.35 | 1.81 ± 0.11 | 0.38 ± 0.03++ | 0.60 ± 0.05 |
| По фактору “Гимантан” | F(1, 43) = 2.4627, p = 0.12391 | F(1, 43) = 3.1634, p = 0.08238 | F(1, 43) = 0.06795, p = 0.79559 | F(1, 43) = 6.2823, p = 0.01606 | F(1, 43) = 7.2585, p = 0.01002 |
| По фактору “Морфин” | F(1, 43) = 5.6556, p = 0.02191 | F(1, 43) = 0.80185, p = 0.37553 | F(1, 43) = 0.00849, p = 0.92701 | F(1, 43) = 0.19546, p = 0.66063 | F(1, 43) = 0.02403, p = 0.87754 |
| По факторам “Гимантан + Морфин” | F(1, 43) = 0.17399, p = 0.67867 | F(1, 43) = 2.6572, p = 0.11038 | F(1, 43) = 0.03645, p = 0.84949 | F(1, 43) = 3.4766, p = 0.06908 | F(1, 43) = 0.27962, p = 0.59967 |
| Стриатум | |||||
| Контроль, n = 12 | 4.42 ± 0.12 | 16.57 ± 0.55 | 8.34 ± 0.35 | 0.27 ± 0.00 | 0.50 ± 0.02 |
| Морфин, n = 12 | 5.51 ± 0.19 *** | 16.81 ± 0.42 | 9.05 ± 0.49 | 0.33 ± 0.01*** | 0.54 ± 0.03 |
| Гимантан, n = 12 | 4.41 ± 0.10+++ | 17.29 ± 0.49 | 7.85 ± 0.28 | 0.25 ± 0.01+++ | 0.46 ± 0.02+ |
| Гимантан + Морфин, n = 12 | 5.24 ± 0.23** хх | 17.52 ± 0.87 | 8.37 ± 0.36 | 0.30 ± 0.01** + ххх | 0.48 ± 0.02 |
| По фактору “Гимантан” | F(1, 44) = 0.71395, p = 0.40271 | F(1, 44) = 1.3820, p = 0.24608 | F(1, 44) = 2.4208, p = 0.12690 | F(1, 44) = 8.0417, p = 0.00688 | F(1, 44) = 6.5496, p = 0.01401 |
| По фактору “Морфин” | F(1, 44) = 33.238, p = 0.00000 | F(1, 44) = .14862, p = 0.70171 | F(1, 44) = 2.6783, p = 0.10886 | F(1, 44) = 55.623, p = 0.00000 | F(1, 44) = 2.2528, p = 0.14052 |
| По факторам “Гимантан + Морфин” | F(1, 44) = 0.60986, p = 0.43902 | F(1, 44) = 0.00022, p = 0.98823 | F(1, 44) = 0.06630, p = 0.79800 | F(1, 44) = 0.80779, p = 0.37367 | F(1, 44) = 0,05824, p = 0.81042 |
| Гиппокамп | |||||
| Контроль, n = 12 | 0.28 ± 0.03 | 1.79 ± 0.67 | 0.66 ± 0.11 | 0.27 ± 0.06 | 0.58 ± 0.09 |
| Морфин, n = 12 | 0.32 ± 0.03 | 0.98 ± 0.14 | 0.46 ± 0.06 | 0.37 ± 0.03 | 0.55 ± 0.11 |
| Гимантан, n = 12 | 0.22 ± 0.02+ | 0.86 ± 0.08 | 0.47 ± 0.06 | 0.32 ± 0.06 | 0.68 ± 0.18 |
| Гимантан + Морфин, n = 12 | 0.36 ± 0.02* хх | 1.08 ± 0.23 | 0.51 ± 0.06 | 0.46 ± 0.09 | 0.60 ± 0.11 |
| По фактору “Гимантан” | F(1, 44) = 0.13753, p = 0.71253 | F(1, 44) = 1.2946, p = 0.26135 | F(1, 44) = 0.74142, p = 0.39388 | F(1, 44) = 1.2836, p = 0.26336 | F(1, 44) = 0.37737, p = 0.54218 |
| По фактору “Морфин” | F(1, 44) = 12.106, p = 0.00115 | F(1, 44) = 0.66027, p = 0.42084 | F(1, 44) = 1.0837, p = 0.30356 | F(1, 44) = 3.4244, p = 0.07096 | F(1, 44) = 0.20713, p = 0.65127 |
| По факторам “Гимантан + Морфин” | F(1, 44) = 2.5257, p = 0.11917 | F(1, 44) = 1.9868, p = 0.16570 | F(1, 44) = 2.1337, p = 0.15120 | F(1, 44) = 0.11716, p = 0.73377 | F(1, 44) = 0.06365, p = 0.80199 |
| Прилежащее ядро | |||||
| Контроль, n = 12 | 3.82 ± 0.24 | 36.19 ± 2.72 | 5.62 ± 0.48 | 0.11 ± 0.00 | 0.16 ± 0.01 |
| Морфин, n = 12 | 5.88 ± 0.30*** | 42.86 ± 2.86 | 7.95 ± 0.50** | 0.14 ± 0.01*** | 0.19 ± 0.01* |
| Гимантан, n = 12 | 3.60 ± 0.19+++ | 35.92 ± 1.67 | 4.58 ± 0.42+++ | 0.10 ± 0.00+++ | 0.12 ± 0.01* +++ |
| Гимантан + Морфин, n = 11 | 5.84 ± 0.61*** ххх | 41.00 ± 2.43 | 5.99 ± 0.68+ | 0.14 ± 0.01*** ххх | 0.14 ± 0.01++ |
| По фактору “Гимантан” | F(1, 43) = 0.12762, p = 0.72266 | F(1, 43) = 0.18390, p = 0.67018 | F(1, 43) = 8.2095, p = 0.00642 | F(1, 43) = 0.18768, p = 0.66702 | F(1, 43) = 16.031, p = 0.00024 |
| По фактору “Морфин” | F(1, 43) = 35.427, p = 0.00000 | F(1, 43) = 5.6678, p = 0.02178 | F(1, 43) = 12.725, p = 0.00090 | F(1, 43) = 34.596, p = 0.00000 | F(1, 43) = 7.5067, p = 0.00891 |
| По факторам “Гимантан + Морфин” | F(1, 43) = 0.06546, p = 0.79928 | F(1, 43) = 0.10407, p = 0.74857 | F(1, 43) = 0.77878, p = 0.38242 | F(1, 43) = 0.31465, p = 0.57775 | F(1, 43) = 0.27802, p = 0.60071 |
| Миндалевидное тело | |||||
| Контроль, n = 12 | 0.87 ± 0.11 | 6.60 ± 0.79 | 1.69 ± 0.18 | 0.17 ± 0.05 | 0.29 ± 0.04 |
| Морфин, n = 12 | 0.83 ± 0.13 | 4.01 ± 0.87 | 2.31 ± 0.25 | 0.30 ± 0.06 | 0.93 ± 0.22 |
| Гимантан, n = 12 | 0.91 ± 0.16 | 6.71 ± 1.59 | 1.85 ± 0.33 | 0.16 ± 0.04 | 0.32 ± 0.06 |
| Гимантан + Морфин, n = 11 | 0.98 ± 0.17 | 4.44 ± 1.14 | 1.75 ± 0.26 | 0.92 ± 0.61 | 2.41 ± 1.39 |
| По фактору “Гимантан” | F(1, 43) = 0.45690, p = 0.50269 | F(1, 43) = 0.05668, p = 0.81296 | F(1, 43) = 0.54651, p = 0.46377 | F(1, 43) = 1.1485, p = 0.28984 | F(1, 43) = 1.3130, p = 0.25819 |
| По фактору “Морфин” | F(1, 43) = 0.01039, p = 0.91930 | F(1, 43) = 4.5454, p = 0.03876 | F(1, 43) = 0.98437, p = 0.32667 | F(1, 43) = 2.4025, p = 0.12847 | F(1, 43) = 4.2856, p = 0.04448 |
| По факторам “Гимантан + Морфин” | F(1, 43) = 0.12498, p = 0.72542 | F(1, 43) = 0.01960, p = 0.88933 | F(1, 43) = 1.8747, p = 0.17804 | F(1, 43) = 1.2066, p = 0.27813 | F(1, 43) = 1.2080, p = 0.27784 |
Примечание: Данные представлены в нмоль/г ткани. Двухфакторный дисперсионный анализ (Factorial ANOVA) для факторов “Гимантан” и “Морфин”. Множественные сравнения с использованием критерия Дункана: * – p < 0.05, ** – p < 0.01, *** – p < 0.001 статистически значимо по отношению к соответствующей группе “Контроль”; + – p < 0.05, ++ – p < 0.01, +++ – p < 0.001 статистически значимо по отношению к соответствующей группе “Морфин”; хх – p < 0.01, ххх – p < 0.001 статистически значимо по отношению к соответствующей группе “Гимантан”.
Гимантан per se не изменял содержание дофамина и его метаболитов по сравнению с контрольной группой. Исключение составило только снижение показателя ГВК/ДА в прилежащем ядре (p < 0.05) (табл. 1), что не противоречит ранее полученным данным на мышах в опытах ex vivo [22]. Следует отметить, что ранее при исследовании влияния гимантана на содержание моноаминов и их метаболитов у крыс с помощью метода микродиализа, выявлено дозо-зависимое снижение внеклеточного содержания ДОФУК и ГВК, а также 5-ОИУК в стриатуме, что свидетельствует об угнетении активности моноаминоксидазы в ЦНС [25] и соответствует данным, полученным на культуре клеток [17]. В то же время в работе Андяржановой Э.А. и соавт. показано, что значимый эффект гимантана на содержание ДОФУК и ГВК развивается не ранее, чем через 1 ч после введения и удерживается в течение 6 ч [25], т.е. в настоящей работе через 30 мин после введения эффект гимантана, по-видимому, еще не проявился.
Гимантан при предварительном введении препятствовал вызываемым морфином сдвигам метаболизма ДА, а именно соотношения ДОФУК/ДА в стриатуме (p < 0.05), в гипоталамусе гимантан способствовал восстановлению показателя соотношения ДОФУК/ДА до значений контрольной группы (табл. 1). Восстановление показателя происходило, по-видимому, за счет увеличения концентрации ДА в обеих случаях в группе “Гимантан + Морфин” (p > 0.05). Значительное снижение величины другого показателя скорости метаболизма ДА, ГВК/ДА, отмечалось в прилежащем ядре (p < 0.01), что было обусловлено уменьшением содержания ГВК по сравнению с группой “Морфин” (p < 0.05). В условиях данной модели при совместном использовании с морфином гимантан статистически значимо повышал уровень ДОФУК в гиппокампе (p < 0.05) по сравнению с контрольной группой и группой “гимантан”, животные которых были свободны от морфина, не влияя при этом на оборот ДОФУК/ДА.
В отношении функциональной активности 5‑ОТ-ергической системы наблюдалось снижение под действием морфина содержания продукта метаболизма серотонина 5-ОИУК в миндалевидном теле (p < 0.05) и повышение 5-ОТ в гиппокампе (p < 0.01), которое не сопровождалось изменением оборота 5-ОИУК/5-ОТ в указанных структурах мозга. Напротив, в стриатуме зарегистрировано значительное увеличение оборота 5-ОИУК/5-ОТ в группе “Морфин” по сравнению с контрольными животными (p < 0.05) (табл. 2).
Таблица 2.
Влияние гимантана на морфин-индуцированные изменения содержания серотонина и его метаболита в разных структурах мозга мышей C57Bl/6 (М ± SEM)
| Группы | 5-ОТ | 5-ОИУК | 5-ОИУК/5-ОТ |
|---|---|---|---|
| Гипоталамус | |||
| Контроль, n = 12 | 7.35 ± 0.34 | 4.45 ± 0.19 | 10.14 ± 1.29 |
| Морфин, n = 12 | 7.43 ± 0.40 | 4.87 ± 0.20 | 16.03 ± 3.16 |
| Гимантан, n = 12 | 7.76 ± 0.37 | 4.57 ± 0.29 | 9.78 ± 1.62 |
| Гимантан + Морфин, n = 11 | 7.24 ± 0.23 | 3.84 ± 0.13# ++ х | 12.83 ± 2.47 |
| По фактору “Гимантан” | F(1, 43) = 0.10818, p = 0.74383 | F(1, 43) = 4.3985, p = 0.04189 | F(1, 43) = 0.62584, p = 0.43323 |
| По фактору “Морфин” | F(1, 43) = 0.40301, p = 0.52890 | F(1, 43) = 0.54584, p = 0.46404 | F(1, 43) = 3.9457, p = 0.05339 |
| По факторам “Гимантан + Морфин” | F(1, 43) = 0,76421, p = 0.38687 | F(1, 43) = 7.0492, p = 0.01108 | F(1, 43) = 0.39812, p = 0.53140 |
| Стриатум | |||
| Контроль, n = 12 | 4.22 ± 0.24 | 4.16 ± 0.24 | 1.65 ± 0.17 |
| Морфин, n = 12 | 4.81 ± 0.17 | 4.74 ± 0.23 | 2.46 ± 0.37* |
| Гимантан, n = 12 | 3.88 ± 0.30++ | 3.53 ± 0.32++ | 1.26 ± 0.15++ |
| Гимантан + Морфин, n = 12 | 4.52 ± 0.16 | 3.89 ± 0.19+ | 1.63 ± 0.17+ |
| По фактору “Гимантан” | F(1, 44) = 2.0227, p = 0.16201 | F(1, 44) = 8.7808, p = 0.00490 | F(1, 44) = 6.8402, p = 0.01216 |
| По фактору “Морфин” | F(1, 44) = 7.4280, p = 0.00918 | F(1, 44) = 3.4765, p = 0.06893 | F(1, 44) = 6.4088, p = 0.01500 |
| По факторам “Гимантан + Морфин” | F(1, 44) = 0.01150, p = 0.91509 | F(1, 44) = 0.18590, p = 0.66846 | F(1, 44) = .89010, p = 0.35060 |
| Гиппокамп | |||
| Контроль, n = 12 | 3.28 ± 0.24 | 3.24 ± 0.25 | 7.33 ± 1.05 |
| Морфин, n = 12 | 4.42 ± 0.25** | 3.77 ± 0.23 | 7.30 ± 1.82 |
| Гимантан, n = 12 | 3.39 ± 0.25+ | 3.10 ± 0.22 | 7.15 ± 1.26 |
| Гимантан + Морфин, n = 12 | 4.01 ± 0.33 | 3.24 ± 0.19 | 6.48 ± 0.93 |
| По фактору “Гимантан” | F(1, 44) = 0.32470, p = 0.57169 | F(1, 44) = 2.3197, p = 0.13490 | F(1, 44) = 0.14581, p = 0.70441 |
| По фактору “Морфин” | F(1, 44) = 11.057, p = 0.00179 | F(1, 44) = 2.2003, p = 0.14511 | F(1, 44) = 0.07079, p = 0.79143 |
| По факторам “Гимантан + Морфин” | F(1, 44) = 0.97324, p = 0.32927 | F(1, 44) = 0.76430, p = 0.38673 | F(1, 44) = 0.06237, p = 0.80395 |
| Прилежащее ядро | |||
| Контроль, n = 12 | 4.52 ± 0.39 | 2.90 ± 0.25 | 1.59 ± 0.16 |
| Морфин, n = 12 | 4.28 ± 0.38 | 2.80 ± 0.19 | 1.64 ± 0.38 |
| Гимантан, n = 12 | 3.67 ± 0.21 | 2.15 ± 0.14 | 1.85 ± 0.44 |
| Гимантан + Морфин, n = 11 | 6.10 ± 1.25 | 3.11 ± 0.53 | 2.77 ± 0.99 |
| По фактору “Гимантан” | F(1, 43) = 0.53035, p = 0.47041 | F(1, 43) = 0.54731, p = 0.46344 | F(1, 43) = 1.5779, p = 0.21585 |
| По фактору “Морфин” | F(1, 43) = 2.7535, p = 0.10432 | F(1, 43) = 2.0179, p = 0.16267 | F(1, 43) = 0.76686, p = 0.38606 |
| По факторам “Гимантан + Морфин” | F(1, 43) = 4.1324, p = 0.04827 | F(1, 43) = 3.0507, p = 0.08784 | F(1, 43) = 0.60367, p = 0.44144 |
| Миндалевидное тело | |||
| Контроль, n = 12 | 1.02 ± 0.28 | 0.36 ± 0.07 | 0.69 ± 0.25 |
| Морфин, n = 12 | 0.42 ± 0.10 | 0.12 ± 0.02* | 0.29 ± 0.11 |
| Гимантан, n = 12 | 1.22 ± 0.25 | 0.31 ± 0.10 | 0.66 ± 0.25 |
| Гимантан + Морфин, n = 11 | 0.80 ± 0.20 | 0.17 ± 0.04# | 0.98 ± 0.85 |
| По фактору “Гимантан” | F(1, 43) = 1.7856, p = 0.18849 | F(1, 43) = 0.00001, p = 0.99695 | F(1, 43) = 0.58222, p = 0.44961 |
| По фактору “Морфин” | F(1, 43) = 5.3931, p = 0.02502 | F(1, 43) = 8.4717, p = 0.00569 | F(1, 43) = 0.00917, p = 0.92416 |
| По факторам “Гимантан + Морфин” | F(1, 43) = 0.15832, p = 0.69268 | F(1, 43) = 0.56861, p = 0.45492 | F(1, 43) = 0.67016, p = 0.41751 |
Примечание: Данные представлены в нмоль/г ткани. Двухфакторный дисперсионный анализ (Factorial ANOVA) для факторов “Гимантан” и “Морфин”. Множественные сравнения с использованием критерия Дункана: * – p < 0.05, ** – p < 0.01, # – p < 0.06 по отношению к соответствующей группе “Контроль”; + – p < 0.05, ++ – p < 0.01, статистически значимо по отношению к соответствующей группе “Морфин”; х – p < 0.05 статистически значимо по отношению к соответствующей группе “Гимантан”.
Гимантан per se не оказывал существенного влияния на активность серотонинергической системы в условиях данного эксперимента. На фоне предварительного введения гимантана наблюдалось снижение морфин-индуцированного незначительного повышения концентрации 5-ОИУК и статистически значимо повышенного показателя 5-ОИУК/5-ОТ в стриатуме (p < 0.05 и p < 0.05 соответственно).
Результаты проведенных экспериментов свидетельствуют о корригирующем влиянии гимантана на сдвиги баланса моноаминергических нейротрансмиттеров в стриатуме и прилежащем ядре, вызванные острым введением морфина. Наблюдавшиеся эффекты на показатели как ДА-, так и 5-ОТ-ергических систем позволяют предположить, что снижение скорости утилизации катехол- и индоламинов связано с ингибированием фермента МАО двух подтипов. Подобное предположение хорошо согласуется с известными данными о механизме действия гимантана как ингибитора МАО-В [17]. Преимущественное влияние гимантана на баланс моноаминов и их метаболитов в стриатуме может объясняться избирательной тропностью препарата к ткани стриатума, где абсорбируется до 10–5 М радиоактивного эквивалента препарата, что существенно превышает количество в ткани целого мозга [26].
Следует отметить, что большинство исследований in vitro и in vivo указывают на то, что морфин подавляет базальное и увеличивает внеклеточное содержание глутамата в таких областях головного мозга, как кора, дорсальный стриатум [27], прилежащее ядро [28], гиппокамп [29]. Способность морфина влиять на внеклеточные уровни глутамата, вероятно, опосредуется опиоидными рецепторами, расположенными пресинаптически на глутаматергических терминалах. Также морфин может действовать постсинаптически, подавляя глутамат-индуцированное возбуждение нейронов [30]. Снижение активности нейронов находит подтверждение и в других исследованиях, демонстрирующих, что стимулирующее влияние морфина на экспрессию генов быстрого реагирования c-fos и c-jun в дорсальном и вентральном стриатуме блокируется антагонистами NMDA-рецепторов и/или рецепторов α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты (AMPA) [31].
Одно из первых исследований взаимодействия между глутаматом и героином (диацетилморфином), злоупотребление которым обусловлено преимущественно его способностью вызывать эйфорию, показало, что блокада ионотропных глутаматных NMDA-рецепторов в прилежащем ядре ослабляет стимулирующий двигательную активность эффект героина [32].
Существование у гимантана нескольких молекулярных мишеней, включая ионные каналы NMDA-рецепторов [20], его способность как неконкурентного антагониста NMDA-рецепторов купировать соматические проявления синдрома отмены морфина у крыс [16], а также влияние гимантана на плотности связывающих сайтов Д1-, Д2- и Д3-рецепторов в стриатуме у крыс Wistar [18] не исключают модулирующее влияние гимантана на глутаматергическую систему как один из возможных механизмов его потенциального антиаддиктивного действия.
Таким образом, полученные данные указывают на способность производного аминоадамантана гимантана ингибировать морфин-индуцированную стимуляцию поведения через модуляцию дофаминергической и серотонинергической систем в стриатуме, прилежащем ядре и гипоталамусе.
Список литературы
Di Chiara G., Imperato A. // Proc. Natl. Acad. Sci. USA. 1988. V. 85. P. 5274–5278.
Johnson S.W., North R.A. // J. Neurosci. 1992. V. 12. P. 483–488.
Maldonado R., Saiardi A., Valverde O., Samad T.A., Roques B.P., Borrelli E. // Nature. 1997. V. 388. P. 586–589.
Longoni R., Spina L., Di Chiara G. // Psychopharmacology. 1987. V. 93. P. 401–402.
Kalivas P.W., Widerlow E., Stanley D., Breese G., Prange A.J. // J. Pharmacol. Exp. Ther. 1983. V. 227. P. 229–237
Serrano A., Aguilar M.A., Manzanedo C., Rodriguez-Arias M., Minarro J. // Prog. Neuropsychopharmacol. Biol. Psychiatry. 2002. V. 26. P. 1263–1271.
Becker A., Grecksch G., Kraus J., Peters B., Schroeder H., Schulz S., Hollt V. // Naunyn Schmiedebergs Arch. Pharmacol. 2001. V. 363. P. 562–568.
Borgkvist A., Usiello A., Greengard P., Fisone G. // Neuropsychopharmacology. 2007. V. 32. № 9. P. 1995–2003.
Urs N.M., Daigle T.L., Caron M.G. // Neuropsychopharmacology. 2011. V. 36. № 3. P. 551–558.
Carroll B.J., Sharp P.T. // Br. J. Pharmacol. 1972. V. 46. P. 124–139.
Kitanaka N., Kitanaka J., Takemura M. // Neurochem. Res. 2006. V. 31. P. 829–837.
Liu X.S., Hou Y., Yan T.L., Guo Y.Y., Han W., Guan F.L., Chen T., Li T. // CNS Neurosci. Ther. 2014. V. 20. № 9. P. 823–829.
Катунина Е.А., Петрухова А.В., Авакян Г.Н., Вальдман Е.А., Неробкова Л.Н., Воронина Т.А., Саядян Х.С. // Журн. неврол. и психиатр. им. C.C. Корсакова. 2008. Т. 108. № 6. С. 24–27.
Непоклонов А.В., Капица И.Г., Иванова Е.А., Воронина Т.А., Вальдман Е.А. // Эксперим. клин. фармакол. 2012. Т. 75. № 11. С. 3–6.
Колик Л.Г., Надорова А.В., Середенин С.Б. // Бюл. экспер. биол. 2017. Т. 164. № 8. С. 177–183.
Колик Л.Г., Константинопольский М.А. // Бюл. экспер. биол. 2018. Т. 166. № 12. С. 700–705.
Вальдман Е.А., Воронина Т.А., Аксенова Л.Н., Бунеева О.А., Медведев А.Е. // Эксперим. клин. фармакол. 2003. Т. 66. № 5. С. 3–5.
Абаимов Д.А., Зимин И.А., Ковалев Г.И. // Эксперим. клин. фармакол. 2008. Т. 71. № 1. С. 18–21.
Абаимов Д.А., Зимин И.А., Кудрин В.С., Ковалев Г.И. // Эксперим. клин. фармакол. 2009. Т. 72. № 1. С. 64–67.
Елшанская М.В., Соболевский А.И., Ходоров Б.И., Вальдман Е.А. // Эксперим. клин. фармакол. 2001. Т. 64. № 1. С. 18–21.
Mori T., Ito S., Narita M., Suzuki T., Sawaguchi T. // J. Pharmacol. Sci. 2004. V. 96. P. 450–458.
Кудрин В.С., Надорова А.В., Наркевич В.Б., Колик Л.Г. // Нейрохимия. 2018. Т. 35. № 1. С. 62–69.
Melon L.C., Boehm S.L. // Alcohol Clin. Exp. Res. 2011. V. 35. № 7. P. 1351–1360.
Suzuki T., Maeda J., Funada M., Misawa M. // Neurosci. Lett. 1995. V. 187. № 1. P. 45-48.
Андяржанова Э.А., Вальдман Е.А., Кудрин В.С., Раевский К.С., Воронина Т.А. // Эксперим. клин. фармакол. 2001. Т. 64. № 6. С. 13–16.
Ковалёв Г.И., Родионов А.П., Петренко Е.С., Золотарев Ю.А. // Эксперим. клин. фармакол. 2003. Т. 66. № 3. С. 50–52.
Desole M.S., Esposito G., Fresu L., Migheli R., Enrico P., Mura M.A., De Natale G., Miele E., Miele M. // Brain Res. 1996. V. 723. P. 154–161.
Martin G., Przewlocki R., Siggins G.R. // J. Pharmacol. Exp. Ther. 1999. V. 288. P. 30–35.
Guo M., Xu N.J., Li Y.T., Yang J.Y., Wu C.F., Pei G. // Neurosci. Lett. 2005. V. 381. P. 12–15.
Giacchino J.L., Henriksen S.J. // Prog. Neuropsychopharmacol. Biol. Psychiatry. 1998. V. 22. P. 1157–1178.
Liu J., Nickolenko J., Sharp F.R. // Proc. Natl. Acad. Sci. USA. 1994. V. 91. P. 8537–8541.
Pulvirenti L., Swerdlow N.R., Koob G.F. // Pharmacol. Biochem Behav. 1991. V. 40. № 4. P. 841–845.
Дополнительные материалы отсутствуют.


