Нейрохимия, 2020, T. 37, № 2, стр. 183-187
Связывание колхицина с тубулином в структурах головного мозга в норме и при шизофрении
Г. Ш. Бурбаева 1, Л. В. Андросова 1, О. К. Савушкина 1
1 ФГБНУ “Научный центр психического здоровья”
Москва, Россия
Поступила в редакцию 08.04.2019
После доработки 05.09.2019
Принята к публикации 01.10.2019
Аннотация
Одним из компонентов цитоскелета являются микротрубочки (МТ) – сложная внутриклеточная система, повреждение которой может вызвать нарушения, приводящие к развитию патологических процессов в клетке. Это дает повод для изучения при шизофрении тубулина, основного белка МТ. Для оценки относительного количества тубулина было использовано его специфическое свойство связываться с колхицином в эквимолярном соотношении. Цель исследования – определить уровень связывания колхицина (колхицинсвязывающую активность тубулина) в различных структурах головного мозга в норме и при шизофрении. Исследование проведено на образцах структур аутопсийного мозга больных шизофренией (n = 7) и лиц контрольной группы (n = 15). Колхицинсвязывающую активность тубулина определяли по Шерлингу в обогащенных тубулином экстрактах белков (проводилась однократная полимеризация–деполимеризация). В префронтальной (поле 10), лимбической (поле 23/24) и височной (поле 21) коре головного мозга при шизофрении в сравнении с контролем наблюдалось достоверное снижение колхицинсвязывающей активности тубулина. В таламусе колхицинсвязывающая активность при шизофрении не изменяется относительно контроля, но при этом она ниже, чем в полях коры. При шизофрении выявлено снижение колхицинсвязывающей активности тубулина в префронтальной (поле 10), лимбической (поле 23/24) и височной (поле 21) коре головного мозга, но не в таламусе (подкорковой структуре мозга).
ВВЕДЕНИЕ
Среди белков мозга доля цитоскелетных белков является наибольшей. Одним из главных компонентов цитоскелета являются микротрубочки (МТ), в состав которых входит белок тубулин и ассоциируемые с ним белки.
Тубулин представляет собой димер из 2-х субъединиц: альфа и бета [1, 2]. Основным свойством альфа-, бета-димеров тубулина является их полимеризация в МТ, которые способны к деполимеризации. Эти два процесса находятся в динамическом равновесии [3, 4].
МТ, кроме цитоскелетной функции, выполняют и другие важные функции, а именно обеспечивают клеточную миграцию, образование новых синапсов, транспорт через аксоплазму белков, нейромедиаторов, фактора роста нервов и органелл, выброс нейромедиаторов, активность внутриклеточных ферментных систем, функции и экспрессию различных мембранных рецепторов, активность клеток иммунной системы [1, 3–5].
Повреждение микротубулярной системы может способствовать развитию широкой картины внутриклеточных нарушений, приводящих к развитию патологических процессов в клетке, что дает повод для изучения тубулина и МТ при различных заболеваниях, в том числе нервных и психических.
В настоящей работе проводилось сравнительное исследование связывания колхцина с тубулином в префронтальной (поле 10), лимбической (поле 23/24) и височной (поле 21) коре головного мозга в норме и при шизофрении. Известно, что тубулин связывается с митотическим ядом колхицином в эквимолярном соотношении и поэтому по связыванию с колхицином можно составить представление о количестве тубулина [6].
Цель исследования – определить уровень связывания колхицина (колхицинсвязывающую активность тубулина) в различных структурах головного мозга: префронтальной (поле 10), височной (поле 21), лимбической коре (поле 23/24) и таламусе – в норме и при шизофрении.
Выбранные области коры наиболее часто изучаются при шизофрении в связи с выявлением в них аномального функционирования некоторых биохимических систем [7–9]. Выбор таламуса обусловлен данными о нарушении его связей с корой головного мозга и структурным изменениям при шизофрении [10–12].
МАТЕРИАЛЫ И МЕТОДЫ
В настоящем исследовании использовались образцы аутопсийного мозга из коллекции лаборатории нейрохимии ФГБНУ НЦПЗ, собранной на базе Психиатрической клинической больницы № 1 им. Н.А. Алексеева. У госпитализированных пациентов (n = 7) с хроническим течением заболевания шизофрения была диагностирована по критериям МКБ-10 при жизни F 20.0 (приступообразно-прогредиентная форма). В контрольную группу включались образцы аутопсийного мозга, полученные из московских больниц (отделений травматологии) от лиц без психических, неврологических и наркологических расстройств (n = 15). Не все зоны мозга от каждого испытуемого были доступны для анализа. В обеих группах причинами смерти были острая сердечно-сосудистая недостаточность или тромбоэмболия легочной артерии. Образцы коры мозга — префронтальной коры (поле 10), височной коры (поле 21), лимбической коры (поля 23/24) и таламуса выделяли по картам полей по Бродману при температуре 4°С и использовали для выделения тубулина.
Группа больных шизофренией состояла из 6 мужчин и 1 женщины в возрасте 42–76 лет (медиана 59 лет). Контрольную группу составляли 12 мужчин и 3 женщины без психической патологии в возрасте 46–90 лет (медиана 58 лет).
Колхицинсвязывающую активность тубулина определяли в обогащенных тубулином экстрактах белков из образцов структур мозга человека (проводилась однократная сборка–разборка) [13].
В полученных растворах тубулинового препарата измеряли концентрацию белка и разливали по аликвотам, которые замораживали в жидком азоте и хранили при –80°С.
Концентрацию белка определяли спектрофотометрическим методом Лоури с использованием набора реагентов Bio-Rad DC Protein Assay (США) и с использованием БСА в качестве белкового стандарта.
Колхицинсвязывающую активность тубулина определяли по методу Sherline [6] с небольшими модификациями как описано в статье [13] по следующей схеме:
1) 40 мкл 3H-колхицина (4.9 Кю/ммоль) Amersham (Англия) высушивали под струей газообразного азота и добавляли к нему 100 мкл свежеприготовленного 0.11 мМ водного раствора немеченного колхицина (фирма Sigma, С9754).
2) В пробирки разливали по 100 мкл 50 мM К-Na-фосфатного буферa /1 мМ MgCl2, pH 6.7, затем добавляли в контрольную и стандартную пробирку 100 мкл того же буфера, а в тестируемые по 100 мкл белкового раствора в концентрации от 1.4 до 7 мг/мл в 50 мM К-Na-фосфатном буфере /1 мМ MgCl2, pH 6.7
3) В каждую пробирку добавляли по 10 мкл смеси меченого и немеченого колхицина.
4) Пробирки инкубировали в течении 90 мин при 37°С.
5) После инкубации во все пробирки, кроме стандарта, добавляли 1 мл водно-угольной суспензии (3 мкг/мл) (активированный уголь, фирма Sigma, С9157) для остановки реакции. В пробирку со стандартом добавляли 1 мл деионизованной воды.
6) Пробы перемешивали и инкубировали в течении 20 мин при комнатной температуре.
7) Для осаждения угля растворы центрифугировали при 1200 g 30 мин при 4°С.
8) Из каждой пробирки отбирали по 100 мкл супернатанта и переносили во флакон с 4 мл сцинтилляционной жидкости.
9) Проводили измерение на счетчике 1211 Rackbeta (LKB, Швеция).
10) Связывание колхицина (в %) определяли по формуле:
Для статистической обработки данных использовался непараметрический анализ (поиск статистически значимых различий между группами – тест Манна–Уитни, корреляционный анализ – поиск ранговых корреляций и определение коэффициента корреляции Спирмена).
РЕЗУЛЬТАТЫ
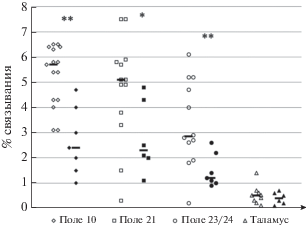
Величины связывания колхицина (в %) в префронтальной (поле 10), височной (поле 21), лимбической коре (поле 23/24) и в таламусе в норме и при шизофрении представлены на рис. 1. Можно видеть, что во всех исследуемых областях коры головного мозга при шизофрении в сравнении с контрольными случаями наблюдалось с высокой степенью достоверности снижение колхицинсвязывающей активности. В то же время в таламусе таких изменений не происходило – как в норме, так и при шизофрении колхицинсвязывающая активность оставалась низкой.
Рис. 1.
Колхицинсвязывающая активность в препаратах тубулина, выделенных из префронтальной (поле 10), височной (поле 21), лимбической коры (поле 23/24) и таламуса в контроле и у больных шизофренией. Данные представлены в процентах связывания меченого колхицина. Ромбы – префронтальная (поле 10), квадраты – височная (поле 21), круги – лимбическая кора (поле 23/24) и треугольники – таламус. Не закрашенные символы – контрольные случаи, закрашенные символы – больные шизофренией, горизонтальные черные линии – медианы для групп. Достоверные изменения между контрольной группой и группой больных шизофренией: * р < 0.05, ** р < 0.01.
Далее было проведено сравнение колхицинсвязывающей активности в исследуемых структурах мозга между собой как в контрольной группе, так и при шизофрении. Уровни достоверности, полученные при этом анализе, приведены в табл. 1.
Таблица 1.
Сравнение колхицинсвязывающей активности тубулина в префронтальной (поле 10), височной (поле 21), лимбической коре (поле 23/24) и таламусе между собой в контрольной группе и при шизофрении
| Контрольная группа | Больные шизофренией | ||||
|---|---|---|---|---|---|
| сравниваемые области мозга | сравниваемые области мозга | ||||
| Поле 10 (n = 15) | Поле 21 (n = 13) | p = 0.4396 | Поле 10 (n = 7) | Поле 21 (n = 6) | p = 0.7308 |
| Поле 10 (n = 15) | Поле 23/24 (n = 12) | p = 0.0014 | Поле 10 (n = 7) | Поле 23/24 (n = 7) | p = 0.0728 |
| Поле 10 (n = 15) | Таламус (n = 9) | p < 0.0001 | Поле 10 (n = 7) | Таламус (n = 6) | p = 0.0012 |
| Поле 21 (n = 13) | Поле 23/24 (n = 12) | p = 0.0976 | Поле 21 (n = 6) | Поле 23/24 (n = 7) | p = 0.1014 |
| Поле 21 (n = 13) | Таламус (n = 9) | p = 0.0002 | Поле 21 (n = 6) | Таламус (n = 6) | p = 0.0022 |
| Поле 23/24 (n = 12) | Таламус (n = 9) | p = 0.0005 | Поле 23/24 (n = 7) | Таламус (n = 6) | p = 0.0012 |
В обеих группах колхицинсвязывающая активность в поле 10 и в поле 21, а также в поле 21 и в поле 23/24 между собой не различалась, в то же время активность в поле 10 достоверно отличалась от таковой в поле 23/24 только в контрольной группе. Как в контрольной группе, так и при шизофрении колхицинсвязывающая активность значительно снижена в таламусе по сравнению с этим показателем во всех исследуемых областях коры головного мозга.
ОБСУЖДЕНИЕ
Исследование тубулина и МТ активно развивается при шизофрении: получены экспериментальные данные, указывающие на аномалии цитоскелета нервных клеток; выявлено изменение иммунореактивности ассоциированного с тубулином белка МАР-2; обнаружено, что дигидропироминидазы, входящие в семейство тубулин-ассоциированных белков, могут быть связаны с повышенным риском развития шизофрении; показано значительное снижение количества первичной цилии – органеллы с высоким содержанием МТ [14–17].
В настоящей работе исследовалось связывание колхицина с тубулином в различных структурах мозга в норме и при шизофрении.
Полученные результаты определения колхицинсвязывающей активности тубулина указывают на ее относительно равномерное распределение в исследованных областях коры в контрольной группе и при шизофрении, кроме выявления достоверных различий между полем 10 и полем 23/24 в контрольной группе, но не при шизофрении.
При сопоставлении колхицинсвязывающей активности тубулина в полях коры лиц контрольной группы и соответствующих полях коры больных шизофренией наблюдается ее достоверное снижение.
Выявленное уменьшение колхицинсвязывающей активности в областях коры при шизофрении не зависело от возраста, пола и постмортального интервала (ПМИ), так как сравниваемые группы были подобраны с учетом этих факторов. По данным литературы не выявлено значимых корреляций между возрастом и экспрессией белка для изоформ тубулина [2].
Ранее нами было показано, что психотропные препараты в терапевтических дозах не влияли на колхицинсвязывающую активность тубулина как in vitro, так и in vivo [13]. Moehle et al. [2] не обнаружили влияние антипсихотиков на экспрессию тубулина.
В таламусе колхицинсвязывающая активность в норме и при шизофрении остается на том же уровне, но при этом она ниже, чем в полях коры.
Так как колхицин связывается с тубулином в эквимолярном соотношении, то снижение колхицинсвязывающей активности, по-видимому, указывает на уменьшение количества тубулина. Однако, данные литературы об экспрессии тубулина в мозге при шизофрении весьма противоречивы.
В ряде работ показано не только снижение [14] уровня тубулина в отдельных структурах мозга при шизофрении, но и его увеличение [15]. Эти трудно сопоставимые результаты могут быть связаны с различиями в используемой коллекции структур мозга, в применяемых методах и методологическом подходе.
Результаты этих работ, как и нашего исследования, показывают, что экспрессия тубулина и его изоформ [16–18] может быть изменена в отдельных структурах мозга при шизофрении.
ЗАКЛЮЧЕНИЕ
Показано уменьшение при шизофрении колхицинсвязывающей активности тубулина в префронтальной (поле 10), лимбической (поле 23/24) и височной (поле 21) коре головного мозга. Поскольку уровень связывания колхицина зависит от количества тубулина, то можно предположить, что и содержание тубулина в исследуемых областях коры снижено, что согласуется с данными литературы об изменении цитоскелета именно в этих регионах шизофрении [15, 19].
Список литературы
Guo J., Walss-Bass C., Ludueña R.F. // Cytoskeleton. 2010. V. 67. № 7. P. 431–441.
Moehle M.S., Luduena R.F., Haroutunian V., Meador-Woodruff J.H., McCullumsmith R.E. // Schizoph. Res. 2012. V. 135. № 1–3. P. 181–186.
Gardiner J., Overall R., Marc J. // Synapse. 2011. V. 65. № 3. P. 249–56.
Janke C. // J. Cell Biol. 2014 V. 206. № 4. P. 461–72.
Verstraelen P., Detrez J.R., Verschuuren M., Kuijlaars J., Nuydens R., Timmermans J.P., De Vos W.H. // Front. Cell Neurosci. 2017. V. 11. P. 173.
Sherline P., Bodwin C.K., Kipnis D.M. // Anal. Biochem. 1974. V. 62. № 2. P. 400–407.
Савушкина О.К., Терешкина Е.Б., Прохорова Т.А., Воробьева Е.А., Бокша И.С., Бурбаева Г.Ш. // Журн. неврол. психиатрии им. С.С. Корсакова. 2016. Т. 116. № 9. С. 62–68.
Терешкина Е.Б., Прохорова Т.А., Бокша И.С., Савушкина О.К., Воробьева Е.А., Бурбаева Г.Ш. // Журн. неврол. психиатрии им. С.С. Корсакова. 2017. Т. 117. № 11. С. 101–107.
Boksha I.S., Tereshkina E.B., Savushkina O.K., Prokhorova T.A., Vorobyeva E.A., Burbaeva G.Sh. // Neurochemical J. 2018. V. 12. № 1. P. 95–101.
Yao B., Neggers S.F.W., Rolfs M., Rösler L., Thompson I.A., Hopman H.J., Ghermezi L., Kahn R.S., Thakkar K.N. // J. Neurosci. 2019. V. 39. № 11. P. 2102–2113.
Lencer R., Yao L., Reilly J.L., Keedy S.K., McDowell J.E., Keshavan M.S., Pearlson G.D., Tamminga C.A., Gershon E.S., Clementz B.A., Lui S., Sweeney J.A. // Hum. Brain Mapp. 2019. V. 40. № 1. P. 163–174.
Dorph-Petersen K.A., Lewis D.A. // Schizophr. Res. 2017. V. 180. P. 28–35.
Бурбаева Г.Ш., Андросова Л.В., Клинцова А.Ю. // Журн. неврол. психиатрии им. С.С. Корсакова. 1988. Т. 88. С. 119–123.
Sivagnanasundaram S., Crossett B., Dedova I., Cordwell S., Matsumoto I. // Proteomics Clin. Appl. 2007. V. 1. № 10. P. 1291–1305.
Chan M.K., Tsang T.M., Harris L.W., Guest P.C., Holmes E., Bahn S. // Mol. Psychiatry. 2011. V. 16. № 12. P. 1189–1202.
Beasley C.L., Pennington K., Behan A., Wait R., Dunn M.J., Cotter D. // Proteomics. 2006. V. 6. № 11. P. 3414–3425.
Behan A.T., Byrne C., Dunn M.J., Cagney G., Cotter D.R. // Mol. Psychiatry. 2009. V. 14. № 6. P. 601–613.
English J.A., Dicker P., Föcking M., Dunn M.J., Cotter D.R. // Proteomics. 2009. V. 9. № 12. P. 3368–3382.
Hayashi-Takagi A., Takaki M., Graziane N., Seshadri S., Murdoch H., Dunlop A.J., Makino Y., Seshadri A.J., Ishizuka K., Srivastava D.P., Xie Z., Baraban J.M., Houslay M.D., Tomoda T., Brandon N.J., Kamiya A., Yan Z., Penzes P., Sawa A. // Nat. Neurosci. 2010. V. 13. № 3. P. 327–332.
Дополнительные материалы отсутствуют.


