Нейрохимия, 2020, T. 37, № 2, стр. 140-147
Паттерны экспрессии серотониновых рецепторов 1А и 7 подтипа в мозге крыс с генетически детерминированным защитно-оборонительным агрессивным поведением или его отсутствием
Т. В. Ильчибаева 1, А. С. Цыбко 1, Е. М. Кондаурова 1, А. И. Ковецкая 1, Р. В. Кожемякина 1, В. С. Науменко 1
1 Федеральный исследовательский центр Институт цитологии и генетики
Сибирского отделения Российской академии наук
Новосибирск, Россия
Поступила в редакцию 03.06.2019
После доработки 29.07.2019
Принята к публикации 05.08.2019
Аннотация
Известно, что серотониновые рецепторы 1А подтипа (5-HT1A) вовлечены в регуляцию агрессивного поведения. Однако, в свете новых данных об их гетеродимеризации и антагонистическом взаимодействии с серотониновыми рецепторами 7 типа (5-HT7), актуальным является исследование вовлечения 5-НТ7-рецепторов в агрессивное поведение. Для этого необходимо прежде всего исследовать паттерны совместной экспрессии 5-НТ1А- и 5-НТ7-рецепторов в мозге животных, различающихся по выраженности генетически детерминированного агрессивного поведения. В данной работе нами была изучена экспрессия серотониновых 5-НТ1А- и 5-НТ7-рецепторов в ряде структур головного мозга крыс с генетически обусловленным агрессивным поведением или его отсутствием. Были выявлены значительные изменения в экспрессии данных типов рецепторов как на уровне мРНК, так и на уровне белка. Особый интерес представляют обнаруженные изменения в уровнях мембранного белка 5-НТ1А- и 5-НТ7-рецепторов в среднем мозге и гиппокампе агрессивных крыс. Снижение уровня 5-НТ1А-рецептора в среднем мозге сопровождается увеличением уровня данного рецептора в гиппокампе, в то время как уровень 5-НТ7-рецептора повышается в среднем мозге и снижается в гиппокампе агрессивных животных по сравнению с ручными. Эти данные также свидетельствуют о наличии взаимодействия между 5-НТ7- и 5-НТ1А-рецепторами. Также обращает на себя внимание усиление экспрессии 5-НТ7-рецепторов во фронтальной коре и снижение уровня мРНК гена 5‑НТ7-рецепторов в гипоталамусе агрессивных животных по сравнению с ручными. Таким образом, впервые выявлены значительные изменения в экспрессии 5-НТ7-рецепторов в мозге крыс, селекционированных на высокий уровень агрессии, вызванной страхом по отношению к человеку. Обнаружены генотип-зависимые особенности совместной экспрессии 5-НТ1А- и 5-НТ7-рецепторов в структурах мозга исследованных животных. Полученные данные позволяют предположить, что взаимодействие между 5-НТ1А- и 5-НТ7-рецепторами может быть одним из важнейших факторов регуляции генетически-детерминированного агрессивного поведения.
ВВЕДЕНИЕ
Хорошо известно, что серотониновая (5-НТ) система мозга играет важнейшую роль в регуляции агрессивного поведения [1, 2]. Свои функции серотонин выполняет посредством большого числа рецепторов, среди которых особое внимание привлекают рецепторы 1А подтипа (5-НТ1А), в первую очередь благодаря их способности к ауторегуляции функциональной активности 5-НТ нейронов [3]. Неоднократно был продемонстрирован ингибирующий эффект агонистов 5-НТ1А-рецептора на агонистическое поведение у мышей и крыс (см. обзор Takahashi и др. [2]). Также было показано, что мыши со сверхэкспрессией 5-НТ1А-рецептора (особенно в ядрах шва) проявляют повышенную агрессивность из-за хронического снижения активности 5-НТ нейронов и сопутствующего дефицита 5-НТ [4].
В последние годы особое внимание стало уделяться серотониновым рецепторам 7 типа (5-НТ7). Важной особенностью 5-НТ7-рецепторов является способность к гетеродимеризации с 5-НТ1А-рецепторами [5]. В 5-НТ1А-5-НТ7 комплексах у 5-НТ1А-рецепторов снижена способность к активации Gi белка и, как следствие, К+-каналов, и в то же время облегчена интернализация гетеродимеров при связывании с агонистом, что очень редко наблюдается вне гетеродимерных комплексов. Способность 5-НТ7-рецепторов образовывать гетеродимеры с 5-НТ1А-рецепторами, приводя тем самым к усилению интернализации последних, делает 5-НТ7-рецепторы перспективной мишенью для терапии тревожности и депрессии [5]. Однако спектр физиологических функций 5‑НТ7‑рецепторов гораздо шире и включает в себя также регуляцию циркадных ритмов, обучения и памяти, терморегуляции, боли и ответа на стресс [6]. Вместе с тем нет ни одной работы, в которой бы изучалось участие 5-НТ7-рецепторов в механизмах агрессивного поведения.
Интересной моделью агрессивного поведения являются крысы, селекционированные на высокий уровень защитно-оборонительной агрессии, вызванной страхом по отношению к человеку. Однако селекционированные агрессивные животные демонстрируют высокий уровень агрессии не только по отношению к человеку, но и по отношению к другим крысам в зоосоциальных взаимодействиях [7, 8]. Также показано, что агрессивные крысы отличаются от неагрессивных (“ручных”) крыс и по многим другим поведенческим и физиологическим характеристикам, таким как высокие тревожность и двигательная активность [9, 10], сниженное исследовательское поведение [11], а также уровнями моноаминов, аминокислот и гормонов [12, 13]. Как на ранних, так и на более поздних этапах селекции у высокоагрессивных крыс отмечались повышенный уровень кортикостерона в сыворотке крови [12, 14, 15], сниженный метаболизм 5-НТ [14], повышенный уровень глутамина и, наоборот, сниженный уровень ГАМК [15], а также изменение иммунного статуса [16], уровня цитокинов [17] и окситоцинергической системы [18]. В недавних работах также показаны изменения в экспрессии нейротрофических факторов BDNF и GDNF в мозге высокоагрессивных крыс [19–21]. Был показан вклад 5-НТ1А-рецепторов и в регуляцию генетически-детерминированного агрессивного поведения. Так, было выявлено снижение плотности 5-НТ1А-рецепторов в гипоталамусе, фронтальной коре и миндалевидном комплексе агрессивных крыс [22], что сопровождалось снижением функциональной активности рецепторов [23]. Десенситизация 5-НТ1А-рецепторов, правда, не сопровождающаяся снижением их плотности, была обнаружена и у детенышей агрессивных крыс [24]. И у взрослых, и у молодых агрессивных крыс однократная инъекция агониста 5-НТ1А-рецепторов 8-ОН-DPAT вызывала снижение агрессивности [24]. Однако, паттерны совместной экспрессии 5-НТ1А- и 5-НТ7-рецепторов в структурах мозга этих крыс все еще не были изучены.
Таким образом, целью данного исследования стало изучение экспрессии серотониновых 5-НТ1А- и 5-НТ7-рецепторов в структурах мозга у крыс с генетической предрасположенностью к агрессивному поведению или ее отсутствием.
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные. Эксперименты проводили на взрослых (3 мес., 300–350 г) самцах серых крыс (Rattus norvegicus), селекционированных в Институте цитологии и генетики СО РАН г. Новосибирск. Селекция проводилась в течение более чем 85 поколений в двух направлениях: на высокий уровень агрессии, вызванной страхом по отношению к человеку, и на его отсутствие. Животных содержали по 4 особи в металлических клетках размером 50 × 33 × 20 см в стандартных лабораторных условиях (температура 18–22°С, относительная влажность 50–60%, естественное освещение (12 ч света и 12 ч темноты) со свободным доступом к стандартной пище и воде. В эксперименте использовали по 8 животных каждой линии. После декапитации из мозга выделяли следующие структуры: гиппокамп, фронтальная кора, область среднего мозга, гипоталамус и миндалевидный комплекс. Структуры мозга заморозили в жидком азоте и хранили при –80°С до процедуры выделения общей РНК и мембранного белка. Содержание экспериментальных животных и все процедуры выполняли в соответствии с международными правилами обращения с животными National Institute of Health Guide for the Care and Use of Laboratory Animals (NIH Publications No. 80023), 1996.
Работу с животными выполняли в Центре генетических ресурсов лабораторных животных ИЦиГ СО РАН (гранты Минобрнауки России № RFMEFI61914X0005 и № RFMEFI62114X0010).
Количественный ОТ-ПЦР в реальном времени. Суммарную РНК выделяли с помощью TRIzol Reagent (“Life technologies”, США), обрабатывали ДНКазой без РНКазной активности (RQ1RNase-Free DNase, #M6101 Promega Corporation, США) в соответствии с протоколами производителей. Присутствие примесей геномной ДНК в препаратах РНК определяли в соответствии с протоколом, описанным ранее [25–27]. РНК разводили водой до концентрации 0.125 мкг/мкл и хранили при –80°С.
Реакция обратной транскрипции. 1 мг общей РНК смешивали с рандомными гексануклеотидными праймерами (конечная концентрация праймера составила 5 мкМ) и 2.25 мкмолями стерильного KCl, денатурировали при 94°C в течение 5 мин на амплификаторе БИС № 111-05.60 (Россия), после чего проводили отжиг при 41°C в течение 15 мин, затем добавляли смесь, содержащую обратную транскриптазу M-MLV (200 ед.), Tris-HCl (pH 8.3, 0.225 мкмоль), смесь dNTP (0.015 мкмоль каждого), DTT (0.225 мкмоль) и MnCl2 (0.03 мкмоль). Полученную смесь инкубировали при 41°C в течение 60 мин. Синтезированную кДНК хранили при температуре –20°C.
Полимеразная цепная реакция в реальном времени. Праймеры, используемые для амплификации кДНК исследуемых генов (табл. 1), разрабатывали на основе последовательностей, опубликованных в базе данных EMBL Nucleotide database, при помощи инструментов Oligoanalizer (https://eu.idtdna.com/ calc/analyzer) и Ensemble (https://www.ensembl.org/ index.html) и синтезировали в компании “Биосан” (Новосибирск, Россия). Для проведения ПЦР в реальном времени 1 мкл кДНК смешивали c универсальным набором реагентов для проведения ПЦР-РВ в присутствии красителя SYBR Green I (R-402, Синтол, Москва, Россия) в соответствии с инструкцией производителя. ПЦР проводили на амплификаторе LightCycler 480 (Roche Applied Science, Швейцария) в соответствии со следующим протоколом: 3 мин 95°C, 1 цикл; 10 с при 95°C, 30 с при соответствующей температуре отжига (табл. 1), 30 с при 72°C, 40 циклов. Серию разведений геномной ДНК с концентрацией 0.125, 0.25, 0.5, 1, 2, 4, 8, 16, 32 и 64 нг/мкл амплифицировали одновременно в отдельных пробирках и использовали как внешний экзогенный стандарт для построения калибровочной кривой. Калибровочная кривая в координатах Ct (значение порогового цикла) – lg P (десятичный логарифм количества стандарта ДНК) была построена автоматически программным обеспечением LightCycler 480. Для контроля специфичности амплификации использовали анализ кривой плавления ПЦР-продукта для каждого прогона каждой пары праймеров. Экспрессия генов Htr1A (5-HT1A-рецептор) и Htr7 (5-HT7-рецептор) представлена как отношение количества кДНК исследуемого гена к 100 копиям гена ДНК-зависимой РНК-полимеразы 2 (rPol_II), выполняющей функцию внутреннего стандарта.
Таблица 1.
Нуклеотидные последовательности праймеров и их характеристики
| Ген/область | Нуклеотидная последовательность | Температура отжига, °C | Длина ПЦР продукта, п.н. |
|---|---|---|---|
| Htr1a | F 5'-ctgtcactctctgccctacttctg-3' R 5'-ccagagcacataacccagagtagt-3' |
62 | 175 |
| Htr7 | F 5'-tgatctcggtgtgcttcgtc-3' R 5'-gtgacactaacgaaaggcatgac-3' |
63 | 115 |
| Rpol_II | F 5'-ttgtcgggcagcagaacgtg-3' R 5'-caatgagaccttctcgtcctccc-3' |
64 | 186 |
Вестерн-блот анализ. Мембранный белок выделяли, гомогенизируя образцы в буфере, содержащем 300 мM сахарозы, 10 мМ Tris-HCl, рН 7.2, 1 мМ EDTA, 5 мМ β-меркаптоэтанол и ингибиторы протеаз (GE Healthcare, США). Центрифугировали на 500 g 15 мин при 4°С, отбирали супернатант и центрифугировали на 20 000 g при 4°С в течение часа. Отбирали супернатант, оставшийся в пробирке осадок ресуспензировали в гомогенизирующем буфере.
Концентрацию общего белка оценивали с помощью BCA метода, используя коммерческий набор Pierce BCA Protein Assay Kit (Thermo Fisher Scientific Inc., USA) и спектрофотометр Eppendorf (BioPhotometer plus, Eppendorf, США). В дальнейшем образцы приводили к равной концентрации (1мг/мл) с помощью 4-кратного Леммли буфера, содержащего 62 мМ Tris-HCl, pH 6.8, 10% сахарозы, 2% SDS, 5% β-меркаптоэтанол и денатурировали с помощью нагрева в течение 10 мин при 95°C. Образцы (10–15 мкг на дорожку) разделяли с помощью 10%-ного SDS-PAGE гель-электрофореза и переносили на нитроцеллюлозую мембрану (Bio-Rad Laboratories, Inc., США), используя полусухой электроблоттинг, в течение ночи при силе тока 50 мА. Для переноса использовали буфер, содержащий 190 мМ глицина, 25 мМ Tris-HCl pH 8.3 и 20% метанола. В качестве маркера использовали смесь Precision Plus Protein Kaleidoscope Standards (Bio-Rad Laboratories, Inc., США).
Для иммунодетекции белка мембрану блокировали с 5%-ным сухим обезжиренным молоком Blotting-Grade Blocker (Bio-Rad Laboratories, Inc., США), разведенном в TBS-T буфере (Tris Bufferd Saline, Bio-Rad Laboratories, Inc., США) с добавлением 0.1% Tween 20), в течение часа при комнатной температуре и инкубировали с первичными антителами при 4°C в течение ночи. Были использованы первичные поликлональные антитела кролика к 5-НТ1А-рецептору (1 : 1000, ab85615, Abcam, UK) или моноклональные антитела кролика к 5-НТ7-рецептору (1 : 500, ab128892, Abcam, UK). В качестве внутреннего контроля были использованы поликлональные антитела кролика к GAPDH, конъюгированные с пероксидазой хрена (1 : 500; G-21234, Invitrogen, США). Отмывали мембрану 5 × 5 мин буфером TBS-T, добавляли вторичные поликлональные антитела козы, направленные против иммуноглобулинов кролика, конъюгированные с пероксидазой хрена (1 : 10 000, sc-2004, Thermo Fisher Scientific Inc., США), и инкубировали в течение часа при комнатной температуре. Повторяли отмывку мембраны. Все связанные антитела визуализировали с помощью Clarity Western ECL Substrate (Bio-Rad Laboratories, Inc., США) в соответствии с инструкцией производителя и сканера C-DiGit для документации хемилюминесцентных блотов (LI-COR, США). Полученное изображение денситометрировали, и количественно оценивали содержание белка при помощи программы Scion Image (Scion Corporation, www.scioncorp.com). Экспрессию белка выражали в относительных единицах, нормировали на экспрессию GAPDH, которая конститутивна для клеток мозга, и представляли, как процент от экспрессии белка у ручных животных.
Статистическая обработка результатов. Результаты представляли как m ± SEM и сравнивали с использованием однофакторного дисперсионного анализа ANOVA с последующим апостериорным сравнением с помощью LSD теста Фишера. Критерий значимости результатов – p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
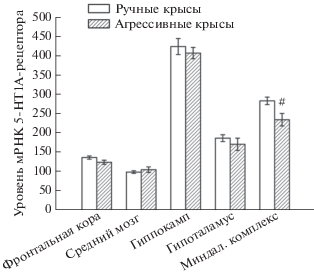
Длительная селекция на высокий уровень агрессии не привела к значительным различиям в уровне мРНК гена Htr1a (рис. 1). В исследуемых структурах мозга достоверных различий не было установлено, однако в миндалевидном комплексе высокоагрессивных крыс наблюдается тенденция к снижению уровня мРНК гена Htr1a по сравнению с ручными (F(1,9) = 4.53, p = 0.06).
Рис. 1.
Уровень мРНК гена Htr1a в структурах мозга у высокоагрессивных и ручных крыс. Число копий кДНК рецептора отнесено на 100 копий кДНК Rpol_II. #p = 0.06 – по сравнению с ручными крысами.
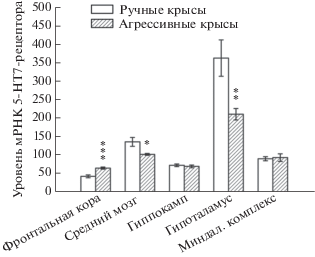
В то же время у животных с высоким уровнем защитно-оборонительной агрессии обнаружили значительные изменения в экспрессии гена Htr7 (рис. 2). Было выявлено статистически значимое снижение уровня мРНК гена Htr7 в среднем мозге (F(1,12) = 5.73, p < 0.05) и гипоталамусе (F(1,12) = 8.64, p < 0.01) агрессивных животных. Одновременно с этим во фронтальной коре уровень мРНК данного гена выше у агрессивных крыс по сравнению с ручными (F(1,13) = 23.42, p < 0.001). В остальных исследуемых структурах различий между агрессивными и не агрессивными крысами в экспрессии гена Htr7 не найдено.
Рис. 2.
Уровень мРНК гена Htr7 в структурах мозга у высокоагрессивных и ручных крыс. Число копий кДНК рецептора отнесено на 100 копий кДНК Rpol_II. *p < 0.05; **p < 0.01; ***p < 0.001 – по сравнению с ручными крысами.
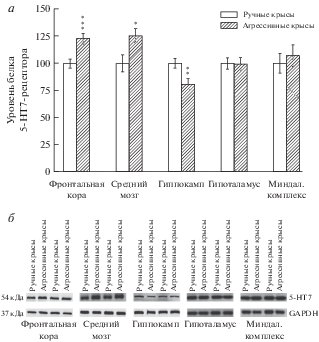
Интересные результаты были обнаружены при исследовании уровней мембранного белка 5-НТ1А- и 5-НТ7-рецептора. Было установлено, что высокоагрессивные животные имеют более низкий уровень белка 5-НТ1А-рецептора в среднем мозге (F(1,11) = 36.77, p < 0.001), а в гиппокампе более высокий (F(1,12) = 9.37, p < 0.01) по сравнению с неагрессивными (рис. 3). В тоже время в данных структурах мозга наблюдается обратная картина с уровнем 5-НТ7-рецептора: в среднем мозге больше белка 5-НТ7-рецептора (F(1,11) = 6.24, p < 0.05), в гиппокампе меньше белка (F(1,10) = 9.66, p < 0.01) у агрессивных крыс по сравнению с ручными (рис. 4). Также был выявлен более высокий уровень белка 5-НТ7-рецептора во фронтальной коре агрессивных животных (F(1,11) = 12.67, p < 0.001). В остальных исследуемых структурах различий в уровнях изучаемых белков не было обнаружено.
Рис. 3.
Уровень белка 5-НТ1А-рецептора в структурах мозга у высокоагрессивных и ручных крыс. a – количественная оценка интенсивности хемилюминесцентного сигнала; б – результат иммуноблота на мембране. Уровень белка 5-НТ1А-рецептора выражен в относительных единицах, нормализованных на соответствующий уровень GAPDH, и представлен, как процент от экспрессии белка у ручных животных. **p < 0.01; ***p < 0.001 – по сравнению с ручными крысами.
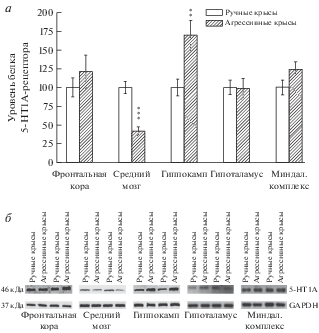
Рис. 4.
Уровень белка 5-НТ7-рецептора в структурах мозга у высокоагрессивных и ручных крыс. a – количественная оценка интенсивности хемилюминесцентного сигнала; б – результат иммуноблота на мембране. Уровень белка 5-НТ7-рецептора выражен в относительных единицах, нормализованных на соответствующий уровень GAPDH, и представлен, как процент от экспрессии белка у ручных животных. *p < 0.05; **p < 0.01; ***p < 0.001 – по сравнению с ручными крысами.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Выявленные нами разнонаправленные различия в уровнях мембранного белка 5-НТ1А- и 5‑НТ7-рецепторов в среднем мозге и гиппокампе агрессивных крыс свидетельствуют о гетеродимеризации между этими рецепторами, хорошо известной из литературы. Ранее нами было сделано предположение, что транскрипционная регуляция, вероятно, незначительно влияет на паттерн экспрессии 5-НТ1А-рецепторов у агрессивных крыс [28]. Учитывая, что в данной работе не обнаружено существенных различий в уровне мРНК 5-НТ1А-рецептора между агрессивными и ручными крысами, и одновременно выявлены значительные изменения уровня мембранного белка 5-НТ1А-рецептора у агрессивных животных, высказанное нами предположение имеет под собой все основания. Более того, эти изменения, наблюдаемые исключительно на посттрансляционном уровне, могут быть обусловлены именно влиянием 5-НТ7-рецепторов. Интересно, что еще в первой работе, посвящённой оценке плотности 5-НТ1А-рецепторов в мозге высокоагрессивных крыс с помощью лиганда [3H]8-OH-DPAT [22], была высказана догадка, что выявленные различия в равной степени отражают вовлечение и 5-НТ7-рецепторов в регуляцию защитно-оборонительной агрессии, вызванной страхом по отношению к человеку. Надо отметить, что полученные нами результаты не воспроизводят данные о снижении плотности 5-НТ1А-рецепторов во фронтальной коре, гипоталамусе и миндалевидном комплексе агрессивных крыс более ранних поколений селекции [22, 23]. В миндалевидном комплексе нами обнаружено только снижение уровня мРНК 5-НТ1А-рецептора, и лишь на уровне тенденции. Возможно, расхождение в результатах связано, с одной стороны, с низкой селективностью использовавшегося [3H]8-OH-DPAT. Также следует иметь в виду, что определение плотности рецепторов с помощью меченного тритием лиганда показывает количество активных рецепторов на мембране клетки, тогда как определение белка с помощью Вестерн-блот анализа показывает количество общего мембранного белка рецепторов. С другой стороны стоит учитывать и тот факт, что между настоящим и предыдущим исследованиями находится, по меньшей мере, 40 поколений селекции крыс.
Более высокий уровень 5-НТ7-рецепторов в среднем мозге агрессивных крыс сопровождается низким уровнем 5-НТ1А-рецепторов, что косвенно свидетельствует о гетеродимеризации между ними, ведущей к усиленной интернализации и снижению числа 5-НТ1А-рецепторов на мембране. Гипотетически, гетеродимеризация 5-НТ7-рецепторов с 5-НТ1А-рецепторами [5] и предполагаемое ингибирование ГАМК-интернейронов в среднем мозге [29] должны усиливать секрецию и обмен серотонина, однако сниженный уровень серотонина у высокоагрессивных крыс это хорошо известный факт [12, 14]. Таким образом, вклад 5-НТ7-рецепторов в регуляцию обмена серотонина у крыс с генетически детерминированным агрессивным поведением требует дальнейшего исследования.
Особое внимание привлекает сниженный уровень белка 5-НТ7-рецептора в гиппокампе и мРНК в гипоталамусе агрессивных крыс. В настоящее время не вызывает сомнения значительная роль данных рецепторов в регуляции гипоталамо-гипофизарно-надпочечниковой системы (ГГНС) и стрессорного ответа [30]. И если активность 5‑НТ7-рецепторов в коре надпочечников напрямую связана с усилением секреции кортикостерона при остром и хроническом стрессе [31], 5‑НТ7-рецепторы в ЦНС, в особенности в гиппокампе, вовлечены в поддержание отрицательной обратной связи в ГГНС, так как отвечают за регуляцию экспрессии глюкокортикоидных рецепторов (ГР) [32]. Показано, что снижение экспрессии 5-НТ7-рецепторов в гиппокампе влечет за собой снижение экспрессии ГР, что нарушает отрицательную обратную связь и провоцирует избыточную секрецию кортикостерона [33]. Принимая во внимание, что исследуемые нами крысы имеют более низкий уровень мРНК ГР в гиппокампе [34], и отличались повышенным базальным уровнем кортикостерона на всех этапах селекции [14, 35, 36], можно предположить, что всe это является следствием сниженной экспрессии гиппокампальных 5-НТ7-рецепторов. Впрочем, сам кортикостерон может подавлять экспрессию 5-НТ7-рецепторов [30], и его высокий уровень в раннем постнатальном развитии способствует нарушению их функции и, как следствие, разбалансировке ГГНС [32]. Вероятно, у высокоагрессивных крыс изменения в ГГНС должны происходить еще в пренатальный период, поскольку высокий уровень кортикостерона у них наблюдается уже на эмбриональной стадии развития [37]. Возможно, основания для дисрегуляции ГГНС у агрессивных крыс были заложены еще на ранних этапах селекции и имеют эпигенетическую природу, связанную с гиперметиллированием промоторов ГР [34]. Полученные нами результаты существенно дополняют эту картину и позволяют представить нарушение стрессорного ответа у высокоагрессивных крыс как комплексный процесс разрушения отрицательной обратной связи в ГГНС, где изначально высокий уровень метилирования промоторов ГР создаeт условия для повышения уровня кортикостерона, что, в свою очередь, подавляет экспрессию 5-НТ7 рецепторов, влекущее за собой еще более сильное подавление экспрессии ГР.
Имеется ряд свидетельств важной роли 5-НТ7-рецептора в регуляции гиппокамп-зависимого обучения [6]. Вероятно, здесь немаловажную роль играет способность 5-НТ7-рецепторов изменять морфологию нейронов, удлиняя нейриты, индуцируя синаптогенез и формирование новых шипиков на дендритах [6]. В то же время нами выявлено снижение уровня белка 5-НТ7-рецептора в гиппокампе агрессивных крыс. Ранее нами был продемонстрирован сниженный уровень полной и усеченной форм TrkB рецептора и преобладание proBDNF в гиппокампе агрессивных крыс [21]. Эти данные, вкупе с новыми результатами об экспрессии 5‑НТ7-рецептора, свидетельствуют о серьезных нарушениях в синаптической пластичности и могут объяснить нарушение пространственного обучения у высокоагрессивных крыс [11].
Поскольку реакция страха по определению является важнейшим компонентом защитно-оборонительной агрессии, вызванной страхом, важным вопросом является вклад, который вносят 5-НТ1А- и 5-НТ7-рецепторы в реализацию данного поведения. Известно, что антагонизм между обоими подтипами рецепторов вовлечен в процесс консолидации/реконсолидации памяти о страхе [38]. Считается, что повышенная активность постсинаптических 5-НТ1А-рецепторов в гиппокампе снижает формирование памяти о страхе за счет общего снижения активности нейронов [38], в то время как активация 5-НТ7-рецепторов производит противоположный эффект [6]. Напротив, активация пресинаптических 5-НТ1А-рецепторов снижает секрецию 5-НТ, что оказывает положительное влияние на формирование памяти [38]. Вместе с тем, известно, что активация 5-НТ1А-рецепторов в гиппокампе, но не ядрах шва среднего мозга, снижает амплитуду рефлекса вздрагивания [39]. До сих пор неизвестно, как происходит формирование памяти о ситуации, вызвавшей страх у крыс с генетически детерминированным высоким уровнем агрессивного поведения, показано только, что они характеризуются более выраженной рефлекторной реакцией на неожиданные средовые стимулы [9, 21, 40]. В то же время мы выявили снижение уровня 5-НТ7-рецепторов в гиппокампе агрессивных крыс и одновременное повышение там уровня 5-НТ1А-рецепторов. С одной стороны это противоречит представлениям о вкладе данных рецепторов в формирование рефлекторной реакции вздрагивания. С другой стороны указывает на то, что рефлекс вздрагивания у высокоагрессивных крыс слабо зависит от контекста и таким образом повышение уровня 5-НТ1А-рецепторов в гиппокампе не оказывает решающего влияния на амплитуду вздрагивания. Кроме того, даже большую роль здесь может играть миндалевидный комплекс [39], однако оценка соотношения 5-НТ1А- и 5-HT7-рецепторов в данной структуре у высокоагрессивных крыс является предметом дальнейших исследований.
Таким образом, нами впервые выявлены особенности экспрессии 5-НТ7-рецепторов в мозге крыс, селекционированных на высокий уровень агрессии, вызванной страхом по отношению к человеку по сравнению с ручными животными. Полученные результаты позволяют предполагать, что 5-НТ7-рецепторы могут быть вовлечены в регуляцию стресса и формирование реакции страха у высокоагрессивных крыс. В ходе данной работы выявлены гентотип-зависимые особенности паттернов экспрессии 5-НТ1А- и 5-НТ7-рецепторов в мозге высокоагрессивных и неагрессивных крыс, что позволяет предположить роль взаимодействия между этими рецепторами в регуляции агрессивного поведения. Однако, гетеродимеризация между 5-НТ1А- и 5-НТ7-рецепторами требует более пристального исследования, поскольку может быть одним из важнейших факторов регуляции генетически-детерминированного агрессивного поведения.
Список литературы
Popova N.K. // Bioessays. 2006. V. 28. P. 495–503.
Takahashi A., Quadros I.M., de Almeida R.M., Miczek K.A. // Curr. Top. Behav. Neurosci. 2012. V. 12. P. 73–138.
Popova N.K., Naumenko V.S. // Rev. Neurosci. 2013. V. 24. P. 191–204.
Audero E., Mlinar B., Baccini G., Skachokova Z.K., Corradetti R., Gross C. // J. Neurosci. 2013. V. 33. P. 8678–8888.
Naumenko V.S., Popova N.K., Lacivita E., Leopoldo M., Ponimaskin E.G. // CNS Neurosci. Ther. 2014. V. 20. P. 582–590.
Blattner K.M., Canney D.J., Pippin D.A., Blass B.E. // ACS Chem. Neurosci. 2019. V. 10. P. 89–119.
Plyusnina I.Z., Solov’eva M.Y., Oskina I.N. // Behav. Genet. 2011. V. 41. P. 583–592.
Ilchibaeva T.V., Tsybko A.S., Kozhemyakina R.V., Konoshenko M.Y., Popova N.K., Naumenko V.S. // J. Ethology. 2017. V. 35. P. 75–81.
Науменко В.С., Кожемякина Р.В., Плюснина И.З., Попова Н.К. // Бюллетень экспериментальной биологии и медицины. 2009. Т. 147. № 1. С. 86–90.
Plyusnina I.Z., Oskina I.N., Tibeikina M.A., Popova N.K. // Behav. Genet. 2009. V. 39. P. 202–212.
Plyusnina I.Z., Shchepina O.A., Os’kina I.N., Trut L.N. // Neurosci. Behav. Physiol. 2008. V. 38. P. 511–516.
Albert F.W., Shchepina O., Winter C., Römpler H., Teupser D., Palme R., Ceglarek U., Kratzsch J., Sohr R., Trut L.N., Thiery J., Morgenstern R., Plyusnina I.Z., Schöneberg T., Pääbo S. // Horm. Behav. 2008. V. 53. P. 413–421.
Гулевич Р.Г., Акулов А.Е., Шихевич С.Г., Кожемякина Р.В., Плюснина И.З. // Вавиловский журн. генетики и селекции. 2015. Т. 19. № 4. С. 432–438.
Naumenko E.V., Popova N.K., Nikulina E.M., Dygalo N.N., Shishkina G.T., Borodin P.M., Markel A.L. // Pharmacol. Biochem. Behav. 1989. V. 33. P. 85–91.
Plyusnina I., Oskina I. // Physiol. Behav. 1997. V. 61. P. 381–385.
Idova G., Alperina E., Plyusnina I., Gevorgyan M., Zhukova E., Konoshenko M., Kozhemyakina R., Shui-Wu W. // Neurosci. Lett. 2015. V. 609. P. 103–108.
Alperina E., Idova G., Zhukova E., Zhanaeva S., Kozhemyakina R. // Neurosci. Lett. 2019. V. 692. P. 193–198.
Gulevich R., Kozhemyakina R., Shikhevich S., Konoshenko M., Herbeck Y. // Physiol. Behav. 2019. V. 199. P. 210–218.
Ilchibaeva T.V., Kondaurova E.M., Tsybko A.S., Kozhemyakina R.V., Popova N.K., Naumenko V.S. // Behav. Brain Res. 2015. V. 290. P. 45–50.
Ilchibaeva T.V., Tsybko A.S., Kozhemyakina R.V., Popova N.K., Naumenko V.S. // Eur. J. Neurosci. 2016. V. 44. P. 2467–2473.
Ilchibaeva T.V., Tsybko A.S., Kozhemyakina R.V., Kondaurova E.M., Popova N.K., Naumenko V.S. // Behav. Brain Res. 2018. V. 343. P. 102–110.
Popova N.K., Avgustinovich D.F., Kolpakov V.G., Plyusnina I.Z. // Pharmacol. Biochem. Behav. 1998. V. 59. P. 793–797.
Popova N.K., Naumenko V.S., Plyusnina I.Z., Kulikov A.V. // J. Neurosci. Res. 2005. V. 80. P. 286–292.
Naumenko V.S., Kozhemyakina R.V., Plyusnina I.F., Kulikov A.V., Popova N.K. // Behav. Brain Res. 2013. V. 243. P. 97–101.
Kulikov A.V., Naumenko V.S., Voronova I.P., Tikhonova M.A., Popova N.K. // J. Neurosci. Methods. 2005. V. 141. P. 97–101.
Науменко В.С., Куликов А.В. // Мол. биол. Т. 40. № 1. С. 37–44.
Naumenko V.S., Osipova D.V., Kostina E.V., Kulikov A.V. // J. Neurosci. Methods. 2008. V. 170. P. 197–203.
Kondaurova E.M., Ilchibaeva T.V., Tsybko A.S., Kozhemyakina R.V., Popova N.K., Naumenko V.S. // Behav. Brain Res. 2016. V. 310. P. 20–25.
Hauser S.R., Hedlund P.B., Roberts A.J., Sari Y., Bell R.L., Engleman E.A. // Front. Neurosci. 2015. V. 8. P. 448. https://doi.org/10.3389/fnins.2014.00448
Terrón J.A. // Rev. Neurosci. 2014. V. 25. P. 439–449.
García-Iglesias B.B., Mendoza-Garrido M.E., Gutiérrez-Ospina G., Rangel-Barajas C., Noyola-Díaz M., Terrón, J.A. // Neuropharmacology. 2013. V. 71. P. 216–227.
Hellstrom I.C., Dhir S., Diorio J.C., Zhang T.Y., Meaney M.J. // Philosoph. Transact. R. Soc. B. Biol. Sci. 2012. V. 367. P. 2495–2510.
Laplante P., Diorio J., Meaney M.J. // Brain Res. Dev. Brain Res. 2002. V. 139. P. 199–203.
Гербек Ю.Э., Оськина И.Н., Гулевич Р.Г., Плюснина И.З. // Цитология и генетика. 2010. Т. 44. № 2. С. 45–52.
Оськина И.Н., Плюснина И.З., Сысолетина А.Ю. // Журн. эвол. биохим. и физиологии. 2000. Т. 36. № 2. С. 120–126.
Gulevich R.G., Shikhevich S.G., Konoshenko M.Y., Kozhemyakina R.V., Herbeck Y.E., Prasolova L.A., Oskina I.N., Plyusnina I.Z. // Physiol. Behav. 2015. V. 144. P. 116–23.
Трут Л.Н., Оськина И.Н., Прасолова Н.А., Плюснина И.З. // Доклады Академии наук. 1998. Т. 360. № 3. С. 428–432.
Stiedl O., Pappa E., Konradsson-Geuken Å., Ögren S.O. // Frontiers in Pharmacology. 2015. V. 6. P. 162. https://doi.org/10.3389/fphar.2015.00162
Almada R.C., Borelli K.G., Albrechet-Souza L., Brandão M.L. // Behav. Brain Res. 2009. V. 203. P. 279–287.
Науменко В.С., Кожемякина Р.В., Плюснина И.З., Попова Н.К. // Журн. высшей нервной деятельности им. И.П. Павлова. 2013. Т. 63. № 4. С. 479–485.
Дополнительные материалы отсутствуют.


