Нейрохимия, 2020, T. 37, № 2, стр. 153-160
Способность к обучению и экспрессия гена инсулиноподобного фактора роста II в мозге самцов крыс – потомков отцов, подвергнутых стрессирующему воздействию в парадигме “стресс–рестресс”
Н. Э. Ордян 1, О. В. Малышева 1, 2, В. К. Акулова 1, С. Г. Пивина 1, Г. И. Холова 1
1 Федеральное государственное бюджетное учреждение науки
“Институт физиологии им. И.П. Павлова РАН”
Санкт-Петербург, Россия
2 Федеральное государственное бюджетное научное учреждение
“Институт акушерства, гинекологии и репродуктологии им. Д.О. Отта”
Санкт-Петербург, Россия
Поступила в редакцию 21.05.2019
После доработки 09.07.2019
Принята к публикации 03.09.2019
Аннотация
Изучена способность к обучению реакции пассивного избегания и скорость ее угашения у самцов крыс, являющихся потомками отцов, которых в период сперматогенеза подвергали стрессированию в парадигме “стресс–рестресс” (модель посттравматического стрессового расстройства). В мозге обученных и необученных крыс анализировали экспрессию гена инсулиноподобного фактора роста II (Igf2) и гена Н19, экспрессия которых импринтируется на ранних стадиях онтогенеза. Показано, что у подопытных самцов нарушен процесс консолидации памяти и ускорено угашение реакции пассивного избегания. Экспрессия Igf2 в гиппокампе и неокортексе необученных самцов – потомков стрессированных отцов, была снижена. Через 20 ч после обучения у крыс, являющихся потомками контрольных самцов, обнаружено повышение экспрессии генов Igf2 и Н19 в гиппокампе, тогда как у подопытных крыс изменение экспрессии данных генов не выявлено. Полученные данные свидетельствуют о том, что нарушение памяти у самцов крыс, рожденных от стрессированных отцов, может быть обусловлено снижением экспрессии гена Igf2.
ВВЕДЕНИЕ
В настоящее время накоплено определенное количество экспериментальных и эпидемиологических данных, свидетельствующих о влиянии стресса не только матери, но и отца на поведение и физиологические функции потомков. Эпидемиологические исследования, проведенные в семьях больных посттравматическим стрессовым расстройством (ПТСР), выявили усиление ПТСР-подобных симптомов у их потомков, которые сами по себе воздействию травматического стресса не подвергались [1, 2]. Следует отметить, что такие ПТСР-подобные симптомы, как сниженный уровень секреции кортикостерона и усиление чувствительности гипофизарно-адренокортикальной системы (ГАС) к сигналам отрицательной обратной связи выявлены у потомков матерей, страдавших ПТСР, тогда как у потомков болеющих отцов, напротив, чувствительность ГАС к сигналам обратной связи снижалась [3]. Эти данные свидетельствуют о дифференцированном влиянии данной психопатологии отца или матери на их потомков.
Экспериментальные исследования также выявили эффекты стресса отцов на развитие, стрессорную реактивность ГАС, поведение и способность к обучению потомков. Установлено, что стрессирование взрослых самцов мышей и крыс до спаривания их с самками в различных парадигмах приводит у их потомков обоего пола к снижению секреции кортикостерона в ответ на 15-минутный иммобилизационный стресс [4], усиливает депрессивноподобное и тревожное поведение, а также повышает базальный уровень кортикостерона [5, 6].
В качестве стрессорных воздействий в этих работах использовали стрессирующие процедуры, вызывающие у животных депрессивноподобное состояние, т.е. являющиеся моделью депрессии у человека и сопровождающиеся длительным повышением уровня глюкокортикоидных гормонов в крови. Моделирование такого состояния путем хронического введения самцам мышей в течение 4 нед. кортикостерона и получение в последующем от них потомства выявило существенное влияние повышенного уровня гормона перед спариванием на поведение их потомков и экспрессию гена инсулиноподобного фактора роста II (ИФР-II) в гиппокампе [7]. Последний факт представляет значительный интерес, поскольку показано, что ИФР-II играет значительную роль в консолидации памяти: мРНК и уровень белка ИФР-II повышается в гиппокампе крыс через 20 ч после первой сессии обучения оборонительной реакции пассивного избегания (РПИ), а нокдаун гена Igf2 в дорсальном гиппокампе с использованием антисмысловых РНК значительно ухудшает длительность сохранения памяти при выработке РПИ [8].
Ген Igf2 интересен еще и тем, что он является одним из импринтированных генов, то есть его экспрессия во многих изученных тканях зависит от статуса метилирования находящейся рядом регуляторной последовательности – Igf2/H19 – центра, контролирующего импринтинг (Imprinting Control Region, ICR). Метилирование ICR происходит в период гаметогенеза, его паттерн различен на хромосомах материнского и отцовского происхождения, что и определяет различия в экспрессии генов, находящихся в импринтированном локусе. Результатом импринтинга является аллель-специфическая экспрессия генов данного локуса: в большинстве соматических клеток экспрессируется только отцовский аллель Igf2 и только материнский аллель H19 [9]. Ген Igf2 необходим для нормального роста и развития в эмбриональный период, поэтому мутация или гиперметилирование отцовской копии гена приводят к задержке роста плода [10]. Однако преимущественная экспрессия отцовского аллеля Igf2 характерна только для периферических тканей, тогда как в мозге наблюдается биаллельная экспрессия этого гена с существенным преобладанием продукта материнского аллеля [11].
В отличие от депрессии, которую экспериментально моделировали в приведенных выше работах и которая сопровождается повышенной базальной активностью ГАС, ПТСР характеризуется преимущественно сниженной активностью этой системы, что проявляется в низком уровне глюкокортикоидных гормонов в крови [12]. Низкий уровень глюкокортикоидов в крови отцов перед зачатием может оказывать иные специфические эффекты на их потомство. В связи с этим, в настоящем исследовании предпринята попытка экспериментально оценить влияние ПТСР-подобного состояния отца на способность к выработке РПИ их взрослых потомков. Учитывая участие ИФР-II в консолидации памяти, изучена экспрессия гена Igf2 в гиппокампе и неокортексе у необученных потомков таких отцов и в гиппокампе через 20 ч после первой сессии обучения РПИ. Также была проведена оценка уровня РНК гена Н19, экспрессия которого, по крайней мере, в соматических клетках, тесно связана с геном Igf2. Оценка экспрессии гена Н19 также проведена в структурах мозга необученных потомков контрольных и стрессированных самцов-отцов и через 20 ч после первой сессии обучения.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперименты выполнены на крысах линии Вистар из ЦКП “Биоколлекция” Института физиологии им. И.П. Павлова РАН. Животных содержали в стандартных условиях вивария без ограничения доступа к воде и пище и со сменой темной и светлой фаз суток 12/12 ч. Все манипуляции с животными были проведены с соблюдением требований, изложенных в директиве Европейского сообщества 1986 г. (2010/63/EEC) и согласно правилам, изложенным в “Guide for the Care and Use of Laboratory Animals”.
Для формирования ПТСР-подобного состояния использовали парадигму “стресс–рестресс”. В этой парадигме самцов в возрасте 3 мес. и весом 220–250 г подвергали травматическому воздействию, состоящему из последовательно применяемых стрессоров: двухчасовая иммобилизация, 20-мин плавание и эфирный стресс до потери сознания с последующим “рестрессом” (30-мин иммобилизация) на 7 сут после травматического стресса, как описано ранее [13]. Контрольных животных (n = 5) оставляли интактными. Для контроля развития ПТСР-подобного состояния (сниженный базальный уровень кортикостерона в крови) на 10 сут после “рестресса” (17 сут после травматического стресса) у подопытных и контрольных самцов из хвостовой вены отбирали пробы крови, которые центрифугировали при 2500 об./мин и 4°С. Полученную плазму хранили при –20°С до момента анализа содержания кортикостерона. Для получения потомства использовали только тех самцов (n = 5), у которых базальный уровень гормона был снижен по сравнению с контрольными самцами.
Через 35–38 сут после “рестресса” подопытных и контрольных самцов поодиночке подсаживали к двум рецептивным самкам (стадия проэструс–эструс). На следующий день у самок брали вагинальные мазки с целью обнаружения сперматозоидов. Оплодотворенных самок сразу отсаживали в другую клетку. Если сперматозоиды в мазке не обнаруживались, то самца оставляли с самками еще на 4 дня (один эстральный цикл). От контрольных самцов получено 10 пометов, а от подопытных самцов – 8.
Беременных самок содержали по 4–5 особей в клетке до 17 дня беременности, а далее рассаживали в индивидуальные клетки. Полученное потомство на 2-й день жизни подсчитывали, учитывали количество самцов и самок в пометах, а сами пометы выравнивали до 8–10 крысят с равным соотношением полов. Пометы содержали с матерями до 30-дневного возраста, а далее по 6–7 особей в клетке. В эксперимент брали самцов в возрасте 3 мес., формируя группы таким образом, чтобы в каждой группе присутствовало не более 2 животных, рожденных от разных подопытных или контрольных самцов и соответствующих самок.
Оборонительную реакцию пассивного избегания вырабатывали в камере, состоящей из светлого (50 × 50 см) и темного (15 × 15 см) отсеков, разделенных отверстием с дверцей. Темный отсек имел пол из металлических прутьев, подключенных к источнику электрического тока. За один день до обучения крысу помещали в светлый отсек камеры и в течение 5 мин позволяли ей обследовать новую обстановку. На следующий день проводили обучение РПИ (первая сессия): крысу помещали в светлый отсек, через 10 с дверцу в темный отсек открывали. После перехода крысы в темный отсек дверцу закрывали, а животное получало электрокожное раздражение 0.9 мА длительностью 2 с. Затем животное возвращали в домашнюю клетку. Через 24 ч после первого тестирования крысу вновь помещали в светлый отсек (вторая сессия). Фиксировали латентный период входа животного в темный отсек. Максимальная длительность тестирования составляла 300 с. Для изучения угашения реакции пассивного избегания крыс повторно тестировали через 1, 2 и 3 нед. Каждая экспериментальная группа состояла из 10 самцов.
Для изучения влияния ПТСР-подобного состояния отцов на экспрессию гена Igf2 в гиппокампе и неокортексе их половозрелых потомков использовали отдельную группу потомков-самцов, рожденных от контрольных или подопытных отцов-самцов. Животные, рожденные от подопытных и контрольных самцов, были разделены на 2 подгруппы. Экспрессия гена Igf2 в гиппокампе и неокортексе была исследована у первой подгруппы до обучения, а у второй подгруппы в гиппокампе через 20 ч после первой сессии выработки РПИ. В каждой подгруппе контрольных и подопытных самцов число животных составило 7 самцов. Количественный анализ экспрессии гена Igf2 оценивали с применением метода ПЦР в реальном времени с обратной транскрипцией.
Крыс декапитировали, из черепной коробки извлекали мозг, из которого на льду выделяли гиппокамп и часть неокортекса, содержащую фронтальную и префрональную области. Полученные области мозга помещали в пробирки с реагентом RNA-later (“Евроген”, Россия) и хранили до выделения РНК при –80°С.
Для выделения тотальной РНК использовали набор PureLink RNA Mini Kit (Thermo Fisher Scientific, США). Выделение проводили согласно протоколу фирмы-производителя.
Обратную транскрипцию проводили с помощью набора High Capacity Reverse Transcription Kit (Thermo Fisher Scientific, США) в соответствии с инструкциями производителя. Каждую реакцию проводили в объеме 20 мкл, в присутствии 10 ммоль dNTP, 200 Е/мл обратной транскриптазы MMLV, рассеянной затравки (3 мг/мл) и с добавлением от 100 до 500 нг тотальной РНК. Полученную кДНК использовали для проведения ПЦР в реальном времени.
ПЦР в реальном времени проводили на приборе Real-Time PCR System 7500 (Applied Biosystems, США) с использованием расходных материалов производства ThermoFisher Scientific, США. Для исследования экспрессии использовали набор зондов и праймеров (TaqMan® Gene Expression Assays, ThermoFisher Scientific, США): для гена Igf2 Rn01454518_m1, для гена Н19 – Rn01759947_g1. В качестве внутреннего контроля использовали ген Hprt1 (Rn01527840_m1). Относительный уровень экспрессии мРНК рассчитывали методом 2–ΔΔСt [14]. Измерения проводили не менее чем в 3-х параллельных пробах для каждого опыта.
Содержание кортикостерона в плазме крови анализировали методом ИФА, используя стандартные наборы производства “ХЕМА”, Россия.
Статистический анализ проводили с использованием параметрических критериев ANOVA и t-критерия Стьюдента. Для проверки гипотезы нормальности распределения данных в выборках использовали критерий Шапиро–Уилка. Анализ каждой выборки показал, что данные распределены нормально (p-value > 0.05). Выработку РПИ оценивали с использованием двухфакторного дисперсионного анализа ANOVA (группа животных – день тестирования) с последующими парными post-hoc сравнениями (тест Тьюки) отдельных групп. Результаты показателей экспрессии гена Igf2 и Н19 оценивали с использованием t-критерия Стьюдента. Статистически значимыми считали различия при p < 0.05. Данные представлены в виде M ± m.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
В связи с тем, что характерным клиническим признаком ПТСР является сниженный уровень глюкокортикоидных гормонов в крови, в данном эксперименте использовали только потомков самцов-отцов, которые в парадигме “стресс–рестресс” демонстрировали сниженный уровень кортикостерона в крови по сравнению с контрольными самцами. Данный показатель составил у стрессированных самцов-отцов 97.2 ± 15.3 нмоль/л, а у контрольных самцов 202.3 ± 28.5 нмоль/л (p < 0.05).
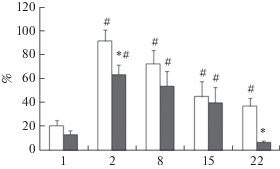
Выработка и угашение рефлекса пассивного избегания. Проведенные исследования показали, что при первой сессии обучения латентный период захода в темный отсек камеры у необученных самцов – потомков стрессированных и контрольных самцов-отцов не различался (рис. 1). Во время второй сессии обучения данный показатель возрастал у обеих групп экспериментальных животных, что является признаком обучения, при котором крысы испытывают страх перед темным отсеком камеры, где при первой сессии они получали удар током. При последующем помещении самцов в камеру с разницей в 1 нед. от первой сессии выявлено постепенное снижение латентного периода захода в темный отсек камеры, как у контрольной группы самцов, так и у подопытной группы животных. Двухфакторный анализ ANOVA не выявил влияния фактора отца (группа животных) на характер угашения РПИ (F(1,79) = 2.63, p = = 0.18), показал статистически значимое влияние дня тестирования (F(3,79) = 4.8, p = 0.012) и взаимодействие факторов день тестирования – группа животных (F(3,79) = 5.8, p = 0.017). Post-hoс сравнение показателей отдельных групп для каждого дня тестирования показало, что латентный период захода в темный отсек камеры во время второй сессии обучения был статистически значимо ниже у самцов – потомков стрессированных отцов. Кроме того, статистически значимые различия латентного периода захода в темную камеру между контрольными и подопытными крысами были обнаружены через 3 нед. после первой сессии обучения: у контрольных животных латентный период оставался повышенным по сравнению с необученными животными, тогда как у самцов-потомков стрессированных отцов этот показатель между обученными и необученными животными не различался. Полученные данные свидетельствуют не только об ухудшении процесса обучения у самцов – потомков стрессированных отцов, но и о значительном нарушении памяти у этих животных.
Рис. 1.
Выработка и угашение рефлекса пассивного избегания самцов крыс – потомков отцов, подвергнутых стрессированию в парадигме “стресс–рестресс”. По оси ординат – латентный период захода в темный отсек камеры пассивного избегания в % от общего времени тестирования (300 с). По оси абсцисс – день тестирования. Светлые столбики крысы – потомки контрольных отцов, темные столбики – крысы – потомки стрессированных отцов. *Достоверные различия между контрольными и подопытными самцами. #Достоверные различия между обученными и необученными животными (первый день обучения).
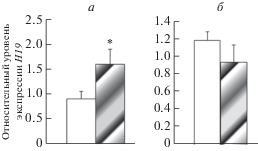
Экспрессия генов Igf2 и Н19 в гиппокампе и неокортексе необученных животных. Анализ экспрессии Igf2 методом ПЦР в реальном времени показало статистически значимое снижение экспрессии данного гена в гиппокампе и неокортексе самцов – потомков отцов, находившихся в период созревания сперматозоидов в ПТСР-подобном состоянии, по сравнению с животными – потомками контрольных отцов (рис. 2). При этом экспрессия Н19 в исследованных структурах мозга между контрольными и подопытными самцами не различалась (рис. 3).
Рис. 2.
Уровень экспрессии гена Igf2 в гиппокампе (а) и неокортексе (б) необученных самцов крыс – потомков отцов, подвергнутых стрессированию в парадигме “стресс–рестресс”. Светлые столбики – крысы – потомки контрольных отцов, темные столбики – крысы – потомки стрессированных отцов. По оси ординат – относительные показатели экспрессии. *Достоверные различия между контрольными и подопытными самцами.
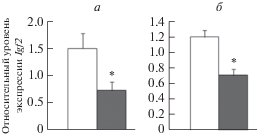
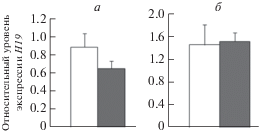
Рис. 3.
Влияние стресса отца на уровень экспрессии гена Н19 в гиппокампе (а) и неокортексе (б) необученных самцов крыс. Светлые столбики – крысы – потомки контрольных отцов, темные столбики – крысы – потомки стрессированных отцов. По оси ординат – относительные показатели экспрессии. *Достоверные различия между контрольными и подопытными самцами.
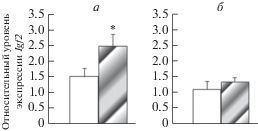
Экспрессия генов Igf2 и Н19 в гиппокампе обученных животных. Обнаружено, что у животных, являющихся потомками контрольных отцов через 20 ч после обучения (первая сессия) наблюдается рост экспрессии Igf2, который составил 167% от уровня необученных животных (рис. 4). У самцов, отцы которых подвергали стрессированию в парадигме “стресс–рестресс”, экспрессия данного гена не изменялась по сравнению с необученными животными.
Рис. 4.
Изменение экспрессии гена Igf2 через 20 ч после обучения пассивному избеганию у самцов – потомков контрольных отцов (а), и самцов – потомков стрессированных отцов (б). Светлые столбики – уровень экспрессии до обучения; столбики со штриховкой – после первой сессии обучения. По оси ординат – относительные показатели экспрессии. *Достоверные различия между уровнем экспрессии гена Igf2 до и после обучения.
Статистически значимый рост экспрессии Н19 после обучения также выявлен в гиппокампе самцов – потомков контрольных отцов (рис. 5). В то время как у подопытных обученных самцов рост экспрессии гена Н19 не наблюдался.
Рис. 5.
Изменение экспрессии гена Н19 через 20 ч после обучения пассивному избеганию у самцов – потомков контрольных отцов (а), и самцов – потомков стрессированных отцов (б). Светлые столбики – уровень экспрессии до обучения; столбики со штриховкой – после первой сессии обучения. По оси ординат – относительные показатели экспрессии. *Достоверные различия между уровнем экспрессии гена Н19 до и после обучения.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ИФР-II представляет из себя полипептид, который структурно схож с инсулином и ИФР-I и играет важнейшую роль в соматическом росте и развитии в эмбриональный период развития [15]. В связи с этим его количество в клетках различных периферических органов, таких как почки, печень, селезенка, сердце и многих других максимально именно в эмбриональный период. После рождения в соматических клетках количество ИФР-II прогрессивно снижается, за исключением взрослого мозга, где экспрессия Igf2 достигает величин, значительно превышающих этот показатель для периферических тканей [11, 16].
Экспрессия Igf2 во взрослом мозге обнаружена во многих областях, в том числе в гиппокампе и коре [17]. Chen с коллегами показали, что повышение ИФР-II в гиппокампе крыс после обучения необходимо для консолидации и реконсолидации памяти [8], а билатеральное введение в дорсальный гиппокамп ИФР-II, но не ИФР-I, улучшает зависимую от гиппокампальных нейронов память и длительность ее сохранения [18].
В нашем исследовании также было обнаружено повышение экспрессии Igf2 в гиппокампе крыс через 20 ч после обучения, но только у контрольных самцов. У животных, являющихся потомками стрессированных отцов, повышение экспрессии Igf2 не наблюдали, с чем, вероятнее всего, и связано не только ухудшение реализации реакции пассивного избегания, но и снижение длительности сохранения данного вида обучения. Через 3 нед. контрольные крысы все еще демонстрировали реакцию пассивного избегания и их латентный период захода в темный отсек камеры был выше, чем у необученных животных, тогда как подопытные животные у этому моменту полностью утратили память об аверсивном воздействии в темном отсеке камеры: латентный период захода в темный отсек был такой же, как у необученных животных. Изменение процессов, связанных с памятью, у крыс – потомков стрессированных отцов – может быть также следствием изначально сниженной экспрессии Igf2 в гиппокампе и коре, которые вовлечены в консолидацию памяти. Показано, что у старых крыс экспрессия Igf2 в гиппокампе снижена, что сопровождается ухудшением памяти, тестируемой в различных парадигмах, а билатеральное введение в гиппокамп рекомбинантного ИФР-II устраняло дефицит памяти [19]. Кроме того, введение ИФР-II в желудочки мозга мышам в экспериментальной модели болезни Альцгеймера снижало поведенческий дефицит, способствовало формированию дендритных шипиков в гиппокампе и нормализовало функцию этой мозговой структуры [20].
Интересно, что в большинстве соматических тканей мышей, крыс и человека уже на самых ранних этапах эмбриогенеза ген Igf2 экспрессируется только с отцовского аллеля [21]. Тем не менее, во взрослом мозге наблюдается биаллельная экспрессия этого гена. В элегантных исследованиях коллектива, возглавляемого С. Alberini, было показано, что в гиппокампе и префронтальной коре наблюдается высокая экспрессия Igf2, причем источником почти 90% мРНК является материнский аллель [11]. После обучения экспрессия Igf2 повышается за счет как материнского, так и отцовского аллеля, при этом соотношение между экспрессией данного гена с материнского и отцовского аллелей сохраняется. При этом показано, что во взрослом мозге не происходит потери импринтинга данного локуса, то есть метилирование ICR на отцовском аллеле остается неизменным [11]. Таким образом, паттерн экспрессии аллелей материнского и отцовского происхождения локуса Igf2/H19 в ЦНС отличен от наблюдаемого в большинстве периферических тканей и может значительно меняться в ходе онтогенеза, при этом метки импринтинга на материнском и отцовском аллелях остаются неизменными.
Механизмы, обеспечивающие диаметрально противоположные паттерны моно- или биаллельной экспрессии Igf2 в разных тканях, неизвестны. Можно предполагать, что определенная роль в этом процессе принадлежит разным промоторам данного гена [21]. Также в процессе дифференциальной моноаллельной экспрессии родительских аллелей гена Igf2 может быть задействовано метилирование DMR (дифференциально метилированный регион). В настоящее время известно о существовании двух таких DMR. Считается, что исходно оба DMR, также как и ICR, метилированы на отцовском аллеле, но в течение онтогенеза профили метилирования этих локусов могут меняться, что приводит к значительным изменениям экспрессии Igf2 в некоторых тканях [21].
Помимо повышения экспрессии Igf2 после обучения в гиппокампе крыс, являющихся потомками контрольных отцов, нами выявлена активация экспрессии и Н19 в гиппокампе этих животных, что не наблюдалось в гиппокампе крыс – потомков стрессированных отцов. Следует отметить, что различий в экспрессии этого гена в исследованных областях мозга необученных контрольных и подопытных самцов нами не обнаружены, хотя в гиппокампе самцов опытной группы наблюдалась тенденция к снижению экспрессии данного гена. В настоящий момент сложно судить о роли в обучении повышенной экспрессии Н19 в гиппокампе.
Ген Н19 экспрессируется в значительных количествах в развивающемся эмбрионе, а после рождения, как и в случае Igf2, его экспрессия прогрессивно снижается [22]. Продуктом Н19 является длинная некодирующая РНК, которая имеет собственную функцию [23, 24]. В стволовых клетках, участвующих в нейрогенезе, наблюдается биаллельная экспрессия генов Н19 и Igf2, при этом, в случае снижения экспрессии Н19, экспрессия Igf2 также снижается [25]. Однако во взрослом мозге экспрессия Н19 осуществляется исключительно с материнского аллеля. Таким образом, показанное нами повышение экспрессии генов Igf2 и Н19 в гиппокампе при обучении у потомков животных контрольной группы вероятно обусловлено усилением экспрессии материнского аллеля.
Можно полагать, что за выявленное нами снижение экспрессии Igf2 в гиппокампе самцов опытной группы также отвечает материнский аллель. Механизмы, благодаря которым стрессирование самцов может влиять на экспрессию генов с материнского аллеля у их потомков не ясны. К числу молекулярно-клеточных и геномных механизмов, посредством которых может реализовываться отцовская передача признаков, относятся метилирование ДНК, модификации гистонов и других белков хроматина, а также эффекты малых некодирующих РНК и длинных некодирующих РНК [26, 27]. Было показано, что стрессорные воздействия на самцов мышей сопровождались изменением экспрессии ряда микроРНК в сперме, а введение в ооцит смеси микроРНК или тотальной РНК из спермы стрессированных отцов воспроизводило эффекты отцовского стресса [28]. Сходные результаты о значимости микроРНК спермы самцов для нормального развития эмбриона в предимплантационный период показано с использованием нокаутных мышей, имеющих сниженную экспрессию микроРНК [29]. Можно предположить, что некоторые микро РНК спермы отцов могут связываться с материнским аллелем локуса Igf2/H19 и приводить к его эпигенетическим модификация уже на эмбриональной стадии. Кроме того, на уровень аллель-специфичной экспрессии генов импринтированных локусов может оказывать влияние метилирование регуляторных участков ДНК, модификация гистонов и других белков хроматина, взаимодействие с длинными некодирующими РНК [30, 31]. Нарушение любого из этих процессов может приводить к подавлению экспрессию материнского аллеля или невозможности ее активации. Однако все высказанные предположения нуждаются в дальнейшей экспериментальной проверке.
ЗАКЛЮЧЕНИЕ
В результате проведенных исследований мы выявили специфические эффекты ПТСР-подобного состояния, характеризующегося низким уровнем кортикостерона в крови отцов, на способность к обучению реакции пассивного избегания и длительность ее сохранения у их половозрелых потомков, и показали, что одним из вероятных механизмов влияния отцовского стресса на потомков может быть изменение экспрессии гена Igf2 в мозге.
Список литературы
Yehuda R., Halligan S.L., Bierer L.M. // J. Psychiatr. Res. 2001. V. 35. P. 261–270.
Scharf M. // Dev. Psychopathol. 2007. V. 19. P. 603–622.
Yehuda R., Daskalakis N.P., Lehrner A., Desarnaud F., Bader H.N., Makotkine I., Flory J.D., Bierer L.M., Meaney M.J. // Am. J. Psychiatry. 2014. V. 171. P. 872–880.
Rodgers A.B., Morgan C.P., Bronson S.L., Revello S., Bale T.L. // J. Neurosci. 2013. V. 33. P. 9003–9012.
Dietz D.M., Lapiant Q., Watts E.L., Hodes G.E., Russo S.J., Feng J., Oosting R.S., Vialou V., Nestler E.J. // Biol. Psychiatry. 2011. V. 70. P. 408–414.
Harker A., Carroll C., Raza S., Kolba B., Gibb R. // Neuroscience. 2018. V. 388. P. 474–485.
Short A.K., Fennell K.A., Perreau V.M., Fox A., O’Bryan M.K., Kim J.H., Bredy T.W., Pang T.Y., Hannan A.J. // Transl. Psychiatry. 2016. V. 6. e837.
Chen D.Y., Stern S.A., Garcia-Osta A., Saunier-Rebori B., Pollonini G., Bambah-Mukku D., Blitzer R.D., Alberini C.M. // Nature. 2011. V. 469(7331). P. 491–497.
Sasaki H., Ishihara K., Kato R.J. // Biochem. 2000. V. 127. P. 711–715.
Tycko B., Morison I.M. // J. Cell. Physiol. 2002. V. 192. P. 245–258.
Ye. X., Kohtz A., Pollonini G., Riccio A., Alberini C.M. PLoS One. 2015. V. 10. e0141078
Yehuda R. // Ann. N.Y. Acad. Sci. 2009. V. 1179. P. 56–59.
Ordyan N.E., Smolenskiy I.V., Pivina S.G., Akulova V.K., Rakitskaya V.V. // Neurosci. Behav. Physiol. 2014. V. 44. P. 657–663.
Livak K.J., Schmittgen T.D. // Methods. 2001. V. 25. P. 402–408.
Bergman D., Halje M., Nordin M., Engström W. // Gerontology. 2013. V. 59. P. 240–249.
Ho-Shing O., Dulac C. // Current Opinion in Behavioral Sciences. 2019. V. 25. P. 66–76.
Russo V.C., Goldin A., Feldman E.L., Werther G.A. // Endocr. Rev. 2005. V. 26. P. 916–943
Stern S.A., Chen D.Y., Alberini C.M. // Learn. Memory. 2014. V. 21. P. 556–563.
Steinmetz A.B., Johnson S.A., Iannitelli D.E., Pollonini G., Alberini C.M. // Neurobiol Aging. 2016. V. 44. P. 9–21.
Pascual-Lucas M., Viana da Silva S., Di Scala M., Garcia-Barroso C., González-Aseguinolaza G., Mulle C., Alberini C.M., Cuadrado-Tejedor M., Garcia-Osta A. // EMBO Mol. Med. 2014. V. 6. P. 1246–1262.
Nordin M., Bergman D., Halje M., Ehgström W., Ward A. // Cell Prolifer. 2014. V. 47. P. 189–199.
Gabory A., Jammes H., Dandolo L. // Bioessays. 2010. V. 32. P. 473–480.
Ratajczak M.Z. // Folia Histochem. Cytobiol. 2012. V. 50. P. 171–179.
Smith G., Mungall A.J., Griffiths-Jones S, Smith P., Buery D., Matthews L., Rogers J., Pask A.J., Shaw G., VandeBerg J.L., McCarrey J.R., the SAVOIR Consortium, Renfree M.B., Reik W., Dunhan I. // Nature Genetics. 2008. V. 40. P. 971–996.
Farzi-Molan A., Babashah S., Bakhshinejad B., Atashi A., Fakhr Taha M. // Cell Biol. Int. 2018. V. 42. P. 940–948.
Chan J.C., Nugent B.M., Bale Y.L. // Biol. Psychiatry. 2018. V. 83. P. 886–894.
Okada Y., Yamaguchi K. // Cell. Mol. Life Sci. 2017. V. 74. P. 1957–1967.
Chen Q., Yan W., Duan E. // Nature Rev. 2016. V. 17. P. 733–743.
Yuan S., Schuster A., Tang C., Yu T., Ortogero N., Bao J., Zheng H., Yan W. // Development. 2016. V. 143. P. 635–647.
Mychasiuk R., Harker A., Ilnytskyy S., Gibb R. // Neuroscience. 2013. V. 241. P. 100–105.
Pedone H.V., Pikaart M.J., Cerrato F., Vernucci M., Undagro P., Bruni C.B., Riccio A. // FEBS Lett. 1999. V. 458. P. 45–50.
Дополнительные материалы отсутствуют.


