Нейрохимия, 2020, T. 37, № 2, стр. 125-131
Синтез L-диоксифенилаланина моноферментными тирозингидроксилаза-содержащими нервными волокнами в супрахиазматическом ядре у крыс в онтогенезе
Т. С. Пронина 1, Ю. О. Никишина 1, Л. К. Дильмухаметова 1, А. Р. Муртазина 1, М. В. Угрюмов 1, 2
1 Лаборатория нервных и нейроэндокринных регуляций, Федеральное государственное бюджетное учреждение науки Институт биологии развития им. Н.К. Кольцова РАН
Москва, Россия
2 Отделение психологии, факультет социальных наук, Национальный исследовательский университет
“Высшая школа экономики”
Москва, Россия
Поступила в редакцию 15.07.2019
После доработки 03.08.2019
Принята к публикации 04.09.2019
Аннотация
Супрахиазматическое ядро (СХЯ) обеспечивает регуляцию функционирования организма в соответствии с циркадными ритмами благодаря содержащимися в нем нейронам-пейсмейкерам и афферентам, модулирующими эти нейроны. Один из афферентов представлен нервными волокнами, содержащими только первый фермент синтеза катехоламинов – тирозингидроксилазу (ТГ). В онтогенезе концентрация этих волокон (количество на единицу объема ткани) достигает максимума на 10-й постнатальный день (П10), а затем постепенно снижается. Целью данной работы явилась проверка нашего предположения о том, что в ТГ-содержащих волокнах в СХЯ у крыс из L-тирозина синтезируется L-ДОФА как конечный секреторный продукт, причем эффективность этого синтеза выше в раннем постнатальном периоде, чем у взрослых. Синтез L-ДОФА оценивали по увеличению суммарного содержания L-ДОФА в СХЯ и в инкубационной среде после двухчасовой инкубации СХЯ в среде с L-тирозином или без него. Показано, что добавление L-тирозина в среду инкубации приводило к многократному увеличению суммарного содержания L-ДОФА в СХЯ и в среде, что является доказательством синтеза L-ДОФА как конечного продукта в ТГ-содержащих волокнах. Сравнительный анализ синтеза L-ДОФА в СХЯ на П10 и П60 показал, что скорость синтеза (отношение суммарного содержания L-ДОФА в СХЯ и в инкубационной среде кo времени инкубации) на П60 превосходит скорость синтеза на П10, в то время как эффективность синтеза L-ДОФА (отношение скорости синтеза L-ДОФА к содержанию общего белка в СХЯ) выше на П10. Таким образом, получены доказательства синтеза L-ДОФА в ТГ-содержащих нервных волокнах СХЯ, причем эффективность этого синтеза у крыс в раннем постнатальном периоде выше, чем у взрослых животных.
ВВЕДЕНИЕ
Супрахиазматическое ядро (СХЯ) – уникальная структура мозга, обеспечивающая регуляцию важнейших функций организма в соответствии с циркадными ритмами [1, 2]. Хотя генерация циркадных ритмов в этом ядре нейронами-пейсмейкерами предетерминирована генетически, их функциональная активность модулируется в определенной степени тремя афферентными входами – аксонами: нейропептид-Y продуцирующих нейронов коленчатого тела, серотонинергических нейронов ядра шва и нейронов сетчатки [3, 4].
Наряду с упомянутыми тремя афферентными входами существует и четвертый, который, однако, хорошо выражен только в раннем постнатальном периоде. Он представлен аксонами нейронов, распложенных вблизи от СХЯ, в которых содержится тирозингидроксилаза (ТГ) – первый скорость-лимитирующий фермент синтеза катехоламинов [5]. Получены доказательства того, что, несмотря на наличие первого ключевого фермента синтеза катехоламинов, эти аксоны не являются катехоламинергическими – они не экспрессируют декарбоксилазу ароматических L-аминокислот (далее – “декарбоксилаза”) – второй фермент синтеза катехоламинов, и не обладают механизмом обратного захвата катехоламинов [6]. На этом основании предполагается, что конечным секреторным продуктом моноферментных ТГ-содержащих нервных волокон в СХЯ является L-диоксифенилаланин (L-ДОФА).
Судьба L-ДОФА, гипотетически синтезированного в ТГ-содержащих нервных волокнах в СХЯ может быть двоякой. Во-первых, он может захватываться вазопрессинергическими нейронами и серотонинергическими аксонами, содержащими декарбоксилазу, где будет служить субстратом для синтеза дофамина (ДА) [7]. Наличие такого рода кооперативного синтеза ДА недофаминергическими нейронами, содержащими только ТГ, и нейронами, содержащими декарбоксилазу, было показано в ряде отделов мозга в норме и при патологии [8, 9]. Во-вторых, L-ДОФА может играть роль нейротрансмиттера [10], который оказывает действие на специфический рецептор к L-ДОФА GPR143 [11]. Несмотря на то, что уже давно было высказано предположение о возможности синтеза L-ДОФА в ТГ-содержащих волокнах СХЯ у животных в раннем постнатальном периоде [12], до сих пор это не было доказано. Поэтому целью данной работы явилась проверка нашего предположения о том, что в СХЯ синтезируется L-ДОФА, как конечный секреторный продукт, причем в раннем постнатальном периоде это синтез выражен в большей степени, чем у взрослых животных.
МАТЕРИАЛЫ И МЕТОДЫ
Животные, эксперименты. Работу проводили на самцах крыс линии Вистар на 10-й постнатальный день (П10) и П60. День рождения крысят считали П1. Животных содержали в стандартных условиях вивария при свободном доступе к пище и воде и 12-часовом режиме день–ночь. Все манипуляции с животными были проведены в соответствии с национальными и международными требованиями и правилами, утвержденными комитетом по охране животных ФГБУН Института биологии развития им. Н.К. Кольцова РАН.
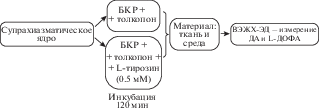
Инкубация срезов супрахиазматического ядра. Крыс на П10 (n = 15) и П60 (n = 25) под наркозом изофлураном декапитировали, и затем выделяли мозг. Далее на вибратоме (Vibratome 1000 plus Sectioning system, Германия) в буфере Кребса–Рингера (мМ: NaCl 120, KCl 4.8, CaCl2 2, MgSO4 1.3, NaHCO3 25, d-глюкозу 10, HEPES 20, аскорбиновая кислота 0.1, pH 7.4, 4°C) приготавливали фронтальные срезы мозга толщиной 300 мкм на уровне СХЯ: на П10 в соответствии с атласом Ashwell and Paxinos [13] и на П60 в соответствии с атласом Paxinos and Watson [14]. Далее под контролем бинокулярной лупы при 4°C каждое из билатеральных СХЯ вырезали из фронтальных срезов мозга. В термостатируемые (37°С) непроточные камеры объемом 1000 мкл помещали по одной пробе ткани: (а) оба билатеральных СХЯ от 5-ти животных на П10; (б) оба билатеральных СХЯ от 3-х животных на П60. В половину исследуемых камер добавляли буфер Кребса–Рингера, содержащий 0.1 мМ толкапона (Sigma, США) – ингибитора катехол-о-метилтрансферазы (фермента деградации катехоламинов и L-ДОФА) и 0.5 мМ L-тирозина (Sigma, США), а в оставшиеся камеры – буфер Кребса–Рингера с толкапоном в конечной концентрации 0.1 мМ. Затем пробы инкубировали в течение 2-х часов (рис. 1). После окончания инкубации пробы центрифугировали 10 мин при 1000 g при 4°C и разделяли осадок (ткань СХЯ) и супернатант (инкубационную среду). Осадок замораживали в жидком азоте. В собранный супернатант добавляли по 100 мкл 1 М HClO4 и по 2 пмоль/мл 3,4-дигидроксибензиламина в качестве внутреннего стандарта для высокоэффективной жидкостной хроматографии с электрохимической детекцией (ВЭЖХ-ЭД). После этого супернатант также замораживали в жидком азоте. Замороженные образцы хранили при –70°C до определения ДА и L-ДОФА.
Рис. 1.
Схема эксперимента: инкубация срезов супрахиазматического ядра в буфере Кребса–Рингера и толкапона с добавлением и в отсутствии L-тирозина. ВЭЖХ-ЭД, высокоэффективная жидкостная хроматография с электрохимической детекцией; ДА, дофамин; L-ДОФА, L-диоксифенилаланин; БКР, буфер Кребса–Рингера.
Высокоэффективная жидкостная хроматография с электрохимической детекцией. Содержание ДА и L-ДОФА определяли в срезах СХЯ, полученных от крыс на П10 и П60, а также в срезах СХЯ и в инкубационной среде после инкубации с помощью ВЭЖХ-ЭД. Перед проведением ВЭЖХ-ЭД образцы с замороженным осадком гомогенизировали с помощью ультразвукового гомогенизатора в 50 мкл 0.02 Н HClO4 с 25 пмоль/мл 3,4-дигидроксибензиламина. Полученные гомогенаты центрифугировали 20 минут при 20 000 g при 4°C и собирали супернатант, в котором затем определяли содержание ДА и L-ДОФА.
Определение проводили на обращенно-фазовой колонке (100 × 4 mm ReproSil-Pur C18, 3 μm) (Dr. Maisch, Германия). Подвижной фазой служил 0.1 М цитратно-фосфатный буфер, содержащий 0.25 мМ октансульфоната натрия, 0.1 М ЭДТА и 9% ацетонитрила (pH 2.5). Потенциал веществ выходящих из колонки определяли с помощью электрохимического детектора DECADE II (Antec Leyden, Нидерланды) (+0.8 B, чувствительность детектора 1 нА). Регистрацию и обработку данных проводили с помощью программы LabSolutions Analysis Data System (Shimadzu, Япония). Во всех пробах ткани определяли содержание общего белка с помощью набора “BCA Protein Assay Kit” в соответствии с инструкцией производителя (The Thermo Scientific Pierce, США). Общее содержание ДА и L-ДОФА в образцах, включающих СХЯ от нескольких животных пересчитывали на билатеральные СХЯ от одного животного.
Статистика. Статистический анализ данных выполняли с использованием GraphPad Prism 6.0 (GraphPad Software, США). Нормальность данных проверяли с помощью критерия Шапиро–Вилка. Для статистического сравнения выбранных групп использовали t-тест Стьюдента для параметрических данных и U-тест Манна–Уитни для непараметрических данных. Данные представлены как среднее ± стандартная ошибка среднего (SEM). Значение p < 0.05 считалось статистически значимым.
Скорость синтеза L-ДОФА ТГ-содержащими нейронами в СХЯ рассчитывали как:
СТ– – содержание L-ДОФА в СХЯ после инкубации без добавления L-тирозина, приведенное на массу белка СХЯ от одного животного,
СС– – содержание L-ДОФА в инкубационной среде после инкубации без добавления L-тирозина, приведенное на массу белка СХЯ от одного животного,
СТ+ – содержание L-ДОФА в СХЯ после инкубации с добавлением L-тирозина, приведенное на массу белка СХЯ от одного животного,
СС+ – содержание L-ДОФА в инкубационной среде после инкубации с добавлением L-тирозина, приведенное на массу белка СХЯ от одного животного,
h – время инкубации в часах.
Коэффициент эффективности синтеза L-ДОФА ТГ-содержащими нейронами в СХЯ рассчитывали как:
SДОФА – скорость синтеза L-ДОФА,
m – масса белка СХЯ от одного животного.
РЕЗУЛЬТАТЫ
Содержание дофамина в супрахиазматическом ядре и в инкубационной среде после инкубации срезов с L-тирозином и без L-тирозина
Содержание ДА в билатеральном СХЯ крысы. На П10 содержание ДА в срезах билатерального СХЯ (далее – СХЯ) крысы после их инкубации с L-тирозином не менялось по сравнению с содержанием ДА в срезах СХЯ крысы после их инкубации без L-тирозина (табл. 1). На П60 содержание ДА в срезах СХЯ после их инкубации с L-тирозином не менялось по сравнению с содержанием ДА в срезах СХЯ после их инкубации без L-тирозина (табл. 1). При этом содержание ДА в СХЯ на П60 было в 1.5 раза больше, чем содержание ДА в СХЯ на П10.
Таблица 1.
Содержание дофамина, приведенное к содержанию в билатеральных супрахиазматических ядрах (СХЯ), полученных от одной крысы на 10-й постнатальный день (П10) или на П60 в срезах СХЯ, инкубационной среде и суммарно в срезах СХЯ и инкубационной среде после инкубации СХЯ в буфере Кребса–Рингера с добавлением L-тирозина (Тир+) или в буфере Кребса–Рингера без L-тирозина (Тир–)
| Возраст крыс | П10 | П60 | ||
|---|---|---|---|---|
| Буфер Кребса–Рингера с или без L-тирозина | Тир– | Тир+ | Тир– | Тир+ |
| Содержание дофамина, пг: | ||||
| В срезах СХЯ | 2.526 ± 0.423 | 1.914 ± 0.441 | 3.929 ± 0.961 | 4.44 ± 0.698 |
| В инкубационной среде | 2.665 ± 1.223 | 4.567 ± 1.002 | 25.932 ± 10.581 | 41.452 ± 10.819 |
| Суммарно в срезах СХЯ и в инкубационной среде |
5.345 ± 1.076 | 6.481 ± 0.855 | 29.861 ± 11.26 | 45.891 ± 10.793 |
Содержание ДА в инкубационной среде после инкубации СХЯ крысы. На П10 содержание ДА в инкубационной среде после инкубации срезов СХЯ крысы с L-тирозином не менялось по сравнению с содержанием ДА в инкубационной среде после инкубации срезов СХЯ без L-тирозина (табл. 1). На П60 содержание ДА в инкубационной среде после инкубации срезов СХЯ крысы с L-тирозином не менялось по сравнению с содержанием ДА в инкубационной среде после инкубации срезов СХЯ без L-тирозина (табл. 1). При этом содержание ДА в инкубационной среде на П60 было в 9.5 раз больше, чем содержание ДА в инкубационной среде на П10.
Суммарное содержание ДА в срезах СХЯ и в инкубационной среде. На П10 суммарное содержание ДА в срезах СХЯ и в инкубационной среде после инкубации срезов с L-тирозином не менялось по сравнению с содержанием ДА в СХЯ и инкубационной среде после инкубации срезов без L-тирозина (табл. 1). На П60 суммарное содержание ДА в срезах СХЯ и в инкубационной среде после инкубации срезов с L-тирозином не менялось по сравнению с содержанием ДА в срезах СХЯ и в инкубационной среде после инкубации срезов без L-тирозина (табл. 1). При этом суммарное содержание ДА в СХЯ и в инкубационной среде увеличилось в 5.6 раза с П10 по П60.
Содержание L-ДОФА в супрахиазматическом ядре и в инкубационной среде после инкубации срезов с L-тирозином и без L-тирозина
Содержание L-ДОФА в билатеральном СХЯ крысы. На П10 содержание L-ДОФА в срезах СХЯ крысы после инкубации срезов с L-тирозином (48 ± 8.1 пг) было в 27 раз больше, чем содержание L-ДОФА в срезах СХЯ после их инкубации без L‑тирозина (1.8 ± 0.3 пг) (рис. 2а). На П60 содержание L-ДОФА в срезах СХЯ после их инкубации с L-тирозином (75.7 ± 13.3 пг) было в 28 раз больше, чем содержание L-ДОФА в срезах СХЯ после их инкубации без L-тирозина (2.7 ± 1.1 пг) (рис. 2б). При этом содержание L-ДОФА в срезах СХЯ на П60 было в 1.5 раза больше, чем содержание L‑ДОФА в срезах СХЯ на П10.
Рис. 2.
Содержание L-диоксифенилаланина (L-ДОФА) в билатеральном супрахиазматическом ядре (СХЯ) крысы на 10-й постнатальный день (П10) (а, в, д) и на П60 (б, г, е): а, б – в срезах СХЯ (а, б), в инкубационной среде (в, е) и суммарно в срезах СХЯ и в инкубационной среде (д, е) после инкубации СХЯ в буфере Кребса–Рингера и толкапона с добавлением L‑тирозина (Тир+) или в его отсутствиe (Тир–). *р < 0.05, при сравнении групп после инкубации с L-тирозином (Тир+) и без него (Тир–).
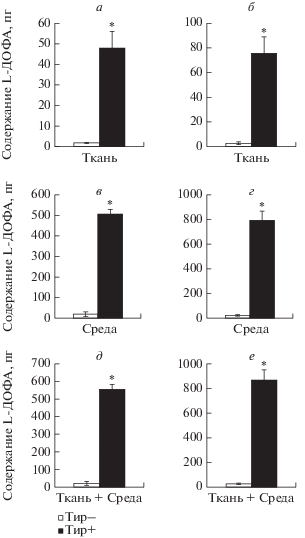
Содержание L-ДОФА в инкубационной среде после инкубации СХЯ крысы. На П10 содержание L-ДОФА в инкубационной среде после инкубации срезов СХЯ с L-тирозином (506 ± 23 пг) было в 25.5 раз больше по сравнению с содержанием L‑ДОФА в инкубационной среде после инкубации срезов СХЯ без L-тирозина (19.9 ± 11 пг) (рис. 2в). На П60 содержание L-ДОФА в инкубационной среде после инкубации срезов СХЯ с L‑тирозином (793 ± 76 пг) было в 34 раза больше по сравнению с содержанием L-ДОФА в инкубационной среде после инкубации срезов СХЯ без L-тирозина (23.4 ± 6 пг) (рис. 2г). При этом содержание L-ДОФА в инкубационной среде при инкубации СХЯ без L-тирозина на П60 было на 17% больше, чем на П10.
Суммарное содержание ДА в срезах СХЯ и в инкубационной среде. На П10 суммарное содержание L-ДОФА в срезах СХЯ и в инкубационной среде после инкубации срезов СХЯ с L-тирозином (554 ± 28 пг) было в 27 раз больше по сравнению с содержанием L-ДОФА в срезах СХЯ и в инкубационной среде после инкубации срезов СХЯ без L-тирозина (21.1 ± 11 пг) (рис. 2д). На П60 суммарное содержание L-ДОФА в срезах СХЯ и в инкубационной среде после инкубации срезов СХЯ с L-тирозином (868 ± 81 пг) было в 33 раз больше по сравнению с содержанием L-ДОФА в срезах СХЯ и в инкубационной среде после инкубации срезов СХЯ без L-тирозина (26.1 ± 5.9 пг) (рис. 2е). При этом суммарное содержание L-ДОФА в СХЯ и в инкубационной среде после инкубации срезов СХЯ без L-тирозина на П60 была на 24% меньше, чем на П10.
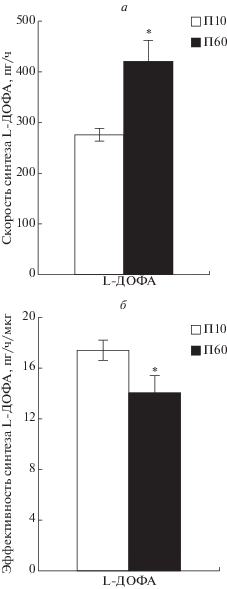
Синтез L-ДОФА. Скорость синтеза L-ДОФА на П10 (276 ± 12.6 пг/ч) была в 1.5 раза меньше, чем на П60 (421 ± 40.7 пг/ч) (рис. 3а). При этом эффективности синтеза L-ДОФА с учетом размеров СХЯ на П10 (17.4 ± 0.8 пг/ч/мкг) была на 24% больше, чем на П60 (14 ± 1.4 пг/ч/мкг) (рис. 3б).
ОБСУЖДЕНИЕ
Несмотря на то, что уже десять лет назад было сформулировано предположение о том, что конечным секреторным продуктом в многочисленных ТГ-иммунореактивных немоноаминергических волокнах в СХЯ у грызунов в раннем постнатальном периоде является L-ДОФА [12], до сих пор отсутствовали попытки проверить это предположение [12]. Не было также предпринято попыток проверить и второе предположение о том, что L-ДОФА, синтезирующийся в ТГ-содержащих моноферментных волокнах после выделения может захватываться в нейроны, содержащие декарбоксилазу (вазопрессинергические нейроны и серотонинергические аксоны) для последующего синтеза ДА (рис. 4) [12]. В первую очередь, это объясняется трудностями, связанными с выделением и манипуляциями с СХЯ животных, особенно в раннем постнатальном периоде из-за его малого размера. Более того, содержание в таком малом объеме нервной ткани моноаминов и их метаболитов a priori должно находиться на грани или за пределами разрешающей способности даже таких высокочувствительных биохимических методов как ВЭЖХ-ЭД. Объем СХЯ у крыс на П10 равен 0.0024 мм3 (6.3 мкг белка), а на П60 – 0.0055 мм3 (21.5 мкг белка). Действительно нам удалось выявить ДА и L-ДОФА с помощью ВЭЖХ-ЭД только при пулирования СХЯ от нескольких животных и добавлении в инкубационную среду ингибитора фермента деградации.
Рис. 4.
а – Схема кооперативного синтеза дофамина моноферментными недофаминергическими нейрональными элементами – ТГ-содержащими нервными волокнами и декарбоксилаза-соджержащими серотонинергическими нервными волокнами и/или вазопрессинергическими нейронами. б – Схема синтеза L-ДОФА, как конечного секреторного продукта, моноферментными ТГ-содержащими нервными волокнами. ДАА, декарбоксилаза ароматических L‑аминокислот; L-ДОФА, L-диоксифенилаланин; ТБА, транспортер больших нейтральных аминокислот; ТГ, тирозингидроксилаза.
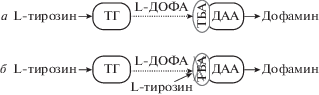
Предполагается, что в отсутствии катехоламинергических волокон в СХЯ [6], детектируемый в этом ядре ДА может синтезироваться только совместно недофаминергическими нейрональными структурами, содержащими по одному из комплементарных ферментов синтеза ДА – ТГ или декарбоксилазу (рис. 4). Так, в процессе доказательства наличия кооперативного синтеза ДА недофаминергическими моноферментными нейронами в аркуатном ядре было показано, что L-ДОФА, синтезированный, как конечный продукт, в моноферментных ТГ-содержащих нейронах, поступает в моноферментные декарбоксилаза-содержащие нейроны, где происходит синтез ДА [8]. По аналогии L-ДОФА, синтезирующийся в моноферментных ТГ-содержащих нервных волокнах, может поступать в серотонинергические волокна и в вазопрессинергические нейроны, экспрессирующие декарбоксилазу, где возможно его превращение в ДА [12].
В этой работе нами впервые была предпринята попытка получить прямое доказательство синтеза L-ДОФА в моноферментных ТГ-содержащих волокнах СХЯ, как конечного секреторного продукта. С этой целью выделенные СХЯ инкубировали в буфере Кребса–Рингера с добавлением в среду L‑тирозина – субстрата синтеза, и толкапона – ингибитора катехол-о-метил трансферазы, метаболизирующего L-ДОФА и ДА [15]. По нашим представлениям, в этом опыте экзогенный L-тирозин должен, с одной стороны, включаться в синтез L-ДОФА в моноферментных ТГ-содержащих нервных волокнах, а с другой стороны, выделившись из моноферментных ТГ-содержащих волокон, накапливаться в среде. При этом захват L-ДОФА в вазопрессинергические нейроны и серотонинергические волокна, содержащие декарбоксилазу, с последующим синтезом ДА можно исключить, поскольку мембранный транспортер больших ароматических аминокислот и L-ДОФА ингибируется L-тирозином (рис. 4).
В проведенных экспериментах были получены доказательства сформулированного выше предположения о синтезе L-ДОФА в моноферментных ТГ-содержащих волокнах. Так, добавление L-тирозина в среду инкубации СХЯ крыс как на П10, так и на П60 привело к многократному увеличению суммарного содержания L-ДОФА в ткани СХЯ и в среде на фоне неизменного суммарного содержания ДА в ткани и в среде. Важно подчеркнуть, что при инкубации СХЯ в присутствии L‑тирозина содержание L-ДОФА увеличивается в гораздо большей степени в инкубационной среде, чем в ткани ядра. Этот факт свидетельствует о том, что в моноферментных ТГ-содержащих нервных волокнах отсутствует механизм запасания L-ДОФА как конечного секреторного продукта. Предполагается, что L-ДОФА, секретируемый ТГ-содержащими волокнами, может в качестве нейротрансмиттера участвовать в регуляции функций СХЯ как биологических часов в течение всей жизни, и в качестве морфогенетического фактора в регуляции развития СХЯ в раннем постнатальном периоде онтогенеза. Кроме того, L-ДОФА, секретируемый ТГ‑содержащими волокнами, вероятно, может служить субстратом для синтеза ДА в декарбоксилаза-содержащих нейрональных структурах СХЯ – в вазопресинергических нейронах и серотонинергических нервных волокнах.
Второй задачей данной работы было оценить количественно и сравнить синтез L-ДОФА в СХЯ у крыс на П10 и П60. В нашем раннее проведенном количественном иммуноцитохимическом исследовании было показано, что плотность сплетения моноферментных ТГ-содержащих волокон (количество волокон на единицу объема ткани) в СХЯ быстро возрастает от П2 до П10, а затем постепенно снижается [6]. На этом основании было сделано предположении о снижении после П10 с возрастом уровня кооперативного синтеза ДА в СХЯ [12]. С этой точки зрения, наиболее важными количественными характеристиками синтеза L-ДОФА, по которым его можно сравнивать на различных этапах онтогенеза, является скорость синтеза L-ДОФА на ядро (отношение суммарного содержания L-ДОФА в ткани ядра и в инкубационной среде к времени инкубации) и эффективность синтеза L-ДОФА на единицу содержания общего белка в СХЯ (отношение скорости синтеза L-ДОФА на ядро к содержанию общего белка в ядре). По первому показателю скорость синтеза L-ДОФА в СХЯ у крыс на П60 превосходит скорость синтеза L-ДОФА в СХЯ у крыс на П10. Дополнительным доказательством этого является вдвое большое увеличение содержания L-ДОФА в инкубационной среде при инкубации СХЯ в присутствии L-тирозина у крыс на П60, чем на П10. По второму, наиболее важному и объективному показателю – эффективность синтеза L-ДОФА в СХЯ у крыс в раннем постнатальном периоде выше, чем в СХЯ у взрослых животных.
Таким образом, получены доказательства синтеза L-ДОФА в моноферментных ТГ-содержащих нервных волокнах СХЯ, причем эффективность этого синтеза у крыс в раннем постнатальном периоде выше, чем у взрослых животных.
Список литературы
Moore R.Y. // Ciba Found. Symp. 1995. V. 183. P. 88–99.
Kartasoreos I.N., Silver R. // Endocrinology. 2007. V. 148. P. 5640–5647.
Medanic M., Gillette M.U. // J. Physiol. 1992. V. 450. P. 629–642.
Medanic M., Gillette M.U. // Brain Res. 1993. V. 620. P. 281–286.
Мирочник В.В., Макаренко И.Г., Угрюмов М.В. // Онтогенез. 2002. V. 33. P. 182–186.
Beltramo M., Calas M., Chernigovskaya E., Borisova N., Polenova O., Tillet Y., Thibault J., Ugrumov M. // Neuroscience. 1994. V. 63. P. 603–610.
Ugrumov M.V. // Adv. Pharmacol. 2013. V. 68. P. 37–91.
Ugrumov M., Taxi J., Pronina T., Kurina A., Sorokin A., Sapronova A., Calas A. // Neuroscience. 2014. V. 277. P. 45–54.
Kozina E.A., Kim A.R., Kurina A.Y., Ugrumov M.V. // Neurobiol. Dis. 2017. V. 98. P. 108–121.
Misu Y., Kitahama K., Goshima Y. // Pharmacol. Therapeut. 2003. V. 97. P. 117–137.
Fukuda N., Naito S., Masukawa D., Kaneda M., Miyamoto H., Abe T., Yamashita Y., Endo I., Nakamura F., Goshima Y. // Brain Res. 2015. V. 1602. P. 62–74.
Ugrumov M.V. // J. Chem. Neuroanat. 2009. V. 38. P. 241–256.
Ashwell K.W.S., Paxinos G. // Atlas of the Developing Rat Nervous System. Compact 3d ed. London: Academic Press, 2008.
Paxinos G., Watson C. // The Rat Brain in Stereotaxic Coordinates. Compact 6th ed. London: Academic Press, 2009.
Reenilä I., Männistö P.T. // Medical Hypotheses. 2001. V. 57. P. 628–632.
Дополнительные материалы отсутствуют.