Нейрохимия, 2020, T. 37, № 2, стр. 132-139
Синтез дофамина недофаминергическими нейронами, содержащими декарбоксилазу ароматических аминокислот, в супрахиазматическом ядре у крыс в онтогенезе
Т. С. Пронина 1, Л. К. Дильмухаметова 1, Ю. О. Никишина 1, А. Р. Муртазина 1, М. В. Угрюмов 1, 2
1 Лаборатория нервных и нейроэндокринных регуляций, Федеральное государственное бюджетное учреждение науки Институт биологии развития им. Н.К. Кольцова РАН
Москва, Россия
2 Отделение психологии, факультет социальных наук, Национальный исследовательский университет
“Высшая школа экономики”
Москва, Россия
Поступила в редакцию 30.08.2019
После доработки 10.09.2019
Принята к публикации 12.09.2019
Аннотация
Супрахиазматическое ядро (СХЯ) обеспечивает регуляцию функций в соответствии с циркадными ритмами благодаря содержащимся в нем нейронам-пейсмейкерам и модулирующим их активность афферентам. Одним из афферентов являются нервные волокна, содержащие только тирозингидроксилазу (ТГ) и секретирующие (L-диоксифенилаланин) L-ДОФА. Целью данной работы явилась проверка гипотезы о том, что L-ДОФА, поступает из ТГ-содержащих волокон в нейроны, содержащие только декарбоксилазу ароматических L-аминокислот (ДАА), где происходит синтез дофамина. Синтез дофамина оценивали по его содержанию в СХЯ у интактных крыс на 10-й постнатальный день (П10) и на П60, а также по суммарному содержанию дофамина в СХЯ и в инкубационной среде после инкубации этого ядра в среде с L-ДОФА или без него. Было показано, что у интактных крыс в СХЯ содержится дофамин, в одинаковой концентрации на П10 и П60. Часть экспериментов с инкубацией срезов СХЯ проводили на крысах, которым вводили нейротоксины моноаминергических нейронов, чтобы исключить синтез дофамина из L-ДОФА в монаминергических структурах. На П10 при инкубации СХЯ в среде с L-ДОФА наблюдалось увеличение синтеза дофамина в равной степени у животных в контроле (норма) и после воздействия нейротоксинов, что свидетельствует о синтезе дофамина только в моноферментных ДАА-содержащих нейронах. В аналогичном опыте на П60 введение L-ДОФА в инкубационную среду также приводило к увеличению синтеза дофамина, однако у животных, подвергшихся воздействию нейротоксинов, в меньшей степени, чем в контроле. Это означает, что у взрослых животных дофамин синтезируется в СХЯ в основном в моноферментных ДАА-содержащих нейронах и в меньшей степени в моноаминергических структурах. Таким образом, показано, что дофамин в СХЯ синтезируется в моноферментных ДАА-содержащих нейронах из L-ДОФА, секретируемого моноферментными ТГ-содержащими волокнами.
ВВЕДЕНИЕ
Супрахиазматическое ядро (СХЯ) гипоталамуса – “биологические часы”, играющие ключевую роль в регуляции большинства функций организма в соответствии с циркадными ритмами [1–3]. Несмотря на то, что генерация циркадных ритмов в этом ядре, обеспечиваемая нейронами-пейсмейкерами, детерминирована генетически, их функциональная активность может модулироваться афферентными входами. К ним относятся аксоны нейропептид-Y-продуцирующих нейронов коленчатого тела, серотонинергических нейронов ядра шва и нейронов сетчатки [4, 5]. Наряду с упомянутыми тремя афферентными входами существует и четвертый, представленный нервными волокнами, содержащими тирозингидроксилазу (ТГ) – первый скорость-лимитирующий фермент синтеза катехоламинов [6]. Однако в этих волокнах отсутствуют декарбоксилаза ароматических L-аминокислот (ДАА), транспортер дофамина и серотонин [7, 8].
На основе приведенных выше фактов возникает вопрос, каково функциональное значение в СХЯ L-диоксифенилаланина (L-ДОФА), секретируемого из моноферментных ТГ-содержащих нервных волокон в межклеточное пространство. Теоретически существуют две возможности. Во-первых, как показано ранее, L-ДОФА может играть роль нейротрансмиттера, действуя на специфические рецепторы, либо роль нейромодулятора, действуя на адренорецепторы [9, 10]. Во-вторых, в наших предыдущих работах при изучении медиобазального гипоталамуса и стриатума получены доказательства того, что L-ДОФА, секретируемый моноферментными ТГ-содержащими нейронами, поступает в моноферментные ДАА-содержащие нейроны, где он превращается в дофамин [11, 12]. В СХЯ также присутствуют моноферментные ДАА-содержащие нейроны, ко-экспрессирующие вазопрессин [13].
Несмотря на то, что уже давно предполагается, что кооперативный синтез дофамина недофаминергическими моноферментными нейронами, происходит в СХЯ [14], до сих пор это не удалось доказать. Тем не менее, в нашем недавно проведенном исследовании показано, что моноферментные ТГ-содержащие нервные волокна СХЯ являются источником L-ДОФА, причем эффективность этого синтеза у крыс в раннем постнатальном периоде, гораздо выше, чем у взрослых животных [15]. Исходя из приведенных рассуждений, целью данной работы явилась проверка нашего предположения о том, что в СХЯ L-ДОФА, секретируемый моноферментными ТГ-содержащими нервными волокнами, превращается в дофамин в моноферментных ДАА-содержащих вазопрессинергических нейронах, причем эффективность такого синтеза в раннем постнатальном периоде выше, чем у взрослых животных.
МАТЕРИАЛ И МЕТОДЫ
Животные, эксперименты. Работу проводили на самцах крыс линии Вистар на 10-й постнатальный день (П10) и П60. День рождения крысят считали П1. Животных содержали в стандартных условиях вивария при свободном доступе к пище и воде и 12-часовом режиме день–ночь. Все манипуляции с животными были проведены в соответствии с национальными и международными требованиями и правилами, утвержденными комитетом по охране животных ФГБУН Института биологии развития им. Н.К. Кольцова РАН.
Определение дофамина в супрахиазматическом ядре. Крыс на П60 (n = 25) и П10 (n = 35) под наркозом изофлураном декапитировали, и затем выделяли мозг. Далее на вибратоме (Vibratome 1000 plus Sectioning system, Германия) в растворе Кребса–Рингера (мМ: NaCl 120, KCl 4.8; CaCl2 2; MgSO4 1.3; NaHCO3 25; d-глюкоза 10; HEPES 20; аскорбиновая кислота 0.1; pH 7,4; 4°C) приготавливали срезы мозга на уровне СХЯ толщиной 300 мкм: на П10 в соответствии с атласом Ashwell and Paxinos [16] и на П60 в соответствии с атласом Paxinos and Watson [17]. Далее под контролем бинокулярной лупы при 4°C из фронтальных срезов мозга вырезали каждое из билатеральных СХЯ. В одну пробу брали ткань: (а) оба билатеральных СХЯ от 7-ми животных на П10; (б) оба билатеральных СХЯ от 5-ти животных на П60. Пробы замораживали в жидком азоте и хранили при –70°C до определения дофамина.
Стереотаксические операции. Крысам на П8 (n = 8) под наркозом изофлураном стереотаксически в боковые желудочки мозга вводили по 70 мкг 6-гидроксидофамина (6ГДА) (Sigma, США) и 30 мкг 5,7-дигидрокситриптамина (ДГТ) (Sigma, США) в 5 мкл 0.9% NaCl с 0.1% аскорбиновой кислотой. Крысам на П58 (n = 8) под наркозом изофлураном стереотаксически в боковые желудочки мозга вводили по 200 мкг 6ГДА и 100 мкг ДГТ в 10 мкл 0.9% NaCl с 0.1% аскорбиновой кислотой. В контроле крысам вводили 0.9% NaCl с 0.1% аскорбиновой кислотой в объеме: 5 мкл на П8 (n = 8) и 10 мкл на П58 (n = 8). Дозы токсинов были подобраны так, что бы они вызывали минимальную летальность у крыс в соответствующем возрасте.
Инкубация срезов с L-ДОФА. Крыс через 48 ч после внутрижелудочкового введения смеси нейротоксинов на П60 (n = 16) и П10 (n = 16) под наркозом изофлураном декапитировали, и затем выделяли мозг. Далее на вибратоме в буфере Кребса–Рингера (при 4°C) приготавливали фронтальные срезы мозга толщиной 300 мкм на уровне СХЯ: на П10 в соответствии с атласом Ashwell and Paxinos [17] и на П60 в соответствии с атласом Paxinos and Watson [18]. Далее под контролем бинокулярной лупы при 4°C из фронтальных срезов мозга вырезали каждое из билатеральных СХЯ. Оба билатеральных СХЯ от одного животного помещали в термостатируемые (37°С) непроточные камеры объемом 1000 мкл в качестве одной пробы. В половину исследуемых камер добавляли буфер Кребса–Рингера, содержащий 0.1 мМ толкапона (Sigma, США) – ингибитора катехол-о-метилтрансферазы (фермента деградации катехоламинов и L-ДОФА), 1 мМ паргилина (Sigma, США) – ингибитора моноаминоксидазы (фермента деградации катехоламинов) и 0.2 мкМ L-ДОФА (Sigma, США), а в оставшиеся камеры – буфер Кребса–Рингера с толкапоном и паргилином в конечной концентрации 0.1 и 1 мМ соответственно (рис. 1). Затем срезы инкубировали в течение 2-х ч. После окончания инкубации пробы центрифугировали 10 минут при 1000 g при 4°C и разделяли осадок (ткань СХЯ) и супернатант (инкубационную среду). Осадок замораживали в жидком азоте. В собранный супернатант добавляли по 100 мкл 1 М HClO4 и по 2 пмоль/мл 3,4-дигидроксибензиламина в качестве внутреннего стандарта для высокоэффективной жидкостной хроматографии с электрохимической детекцией. После этого супернатант так же замораживали в жидком азоте. Замороженные образцы хранили при –70°C до определения дофамина.
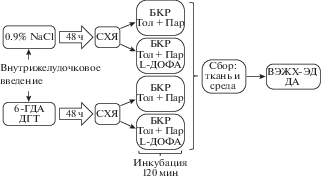
Рис. 1.
Схема экспериментов: введение в боковые желудочки мозга смеси 6-гидроксидофамина (6ГДА) и 5,7-дигидрокситриптамина (ДГТ), а в контроле 0.9% NaCl (NaCl) с последующим (через 48 ч) выделением срезов супрахиазматического ядра (СХЯ) крыс для инкубации в буфере Кребса–Рингера (БКР) с толкапоном (Тол) и паргилином (Пар) при добавлении L‑диоксифенилаланина (L-ДОФА) или без него на 10-й постнатальный день (П10) и П60. ВЭЖХ-ЭД, высокоэффективная хроматография с электорхимической детекцией, ДА, дофамин.
Высокоэффективная жидкостная хроматография с электрохимической детекцией. Содержание дофамина определяли с помощью высокоэффективной жидкостной хроматографии с электрохимической детекцией в пробах ткани (СХЯ) без инкубации и после инкубации, а также в инкубационной среде после инкубации. Перед проведением высокоэффективной жидкостной хроматографии с электрохимической детекцией образцы с замороженными неинкубированными пробами СХЯ и пробы с замороженным осадком (ткань СХЯ после инкубации) гомогенизировали с помощью ультразвукового гомогенизатора в 50 мкл 0.1 М HClO4 с 25 пмоль/мл 3,4-дигидроксибензиламина. Полученные гомогенаты центрифугировали 20 мин при 20 000 g при 4°C, и собирали супернатант, в котором затем определяли содержание дофамина. Определение проводили на обращенно-фазовой колонке (100 × 4 mm ReproSil-Pur C18, 3 μm) (Dr. Maisch, Германия). Подвижной фазой служил 0,1 М цитратно-фосфатный буфер, содержащий 0.25 мМ октансульфоната натрия, 0.1 М ЭДТА и 9% ацетонитрила (pH 2.5). Потенциал веществ выходящих из колонки определяли с помощью электрохимического детектора DECADE II (Antec Leyden, Нидерланды) (+0.8 B, чувствительность детектора 1 нА). Регистрацию и обработку данных проводили с помощью программы LabSolutions Analysis Data System (Shimadzu, Япония). Во всех пробах ткани определяли содержание общего белка с помощью набора “BCA Protein Assay Kit” в соответствии с инструкцией производителя (The Thermo Scientific Pierce, США). Содержание дофамина в образцах, включающих билатеральные СХЯ от нескольких животных пересчитывали на билатеральные СХЯ от одного животного.
Статистика. Статистический анализ данных выполняли с использованием GraphPad Prism 6.0 (GraphPad Software, США). Нормальность данных проверяли с помощью критерия Шапиро-Вилка. Для статистического сравнения выбранных групп использовали t-тест Стьюдента для параметрических данных и U-тест Манна–Уитни для непараметрических данных. Данные представлены как среднее ± стандартная ошибка среднего (SEM). Значение p <0.05 считалось статистически значимым.
Используя данные по содержанию дофамина в ткани и в среде после инкубации СХЯ с ДОФА и без него была рассчитана эффективность синтеза дофамина в процессе инкубации СХЯ.
Коэффициент эффективности синтеза дофамина нейронами, содержащими ДАА, в СХЯ рассчитывали как:
СТ– – содержание дофамина в ткани билатеральных СХЯ от одного животного после инкубации без добавления L-ДОФА,
СС– – содержание дофамина в инкубационной среде после инкубации билатеральных СХЯ от одного животного без добавления L-ДОФА,
СТ+ – содержание дофамина в билатеральных СХЯ от одного животного после инкубации с добавлением L-ДОФА,
СС+ – содержание дофамина в инкубационной среде после инкубации билатеральных СХЯ от одного животного с добавлением L-ДОФА,
m – масса белка билатеральных СХЯ от одного животного.
РЕЗУЛЬТАТЫ
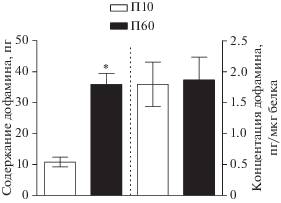
Дофамин в супрахиазматическом ядре. Содержание дофамина в СХЯ на П10 (10.8 ± 1.6 пг) в 3.3 раза меньше, чем на П60 (35.9 ± 3.6 пг) (рис. 2). При этом концентрация дофамина на П60 (1.87 ± 0.37 пг/мкг белка) такая же, как на П10 (1.8 ± 0.36 пг/мкг белка) (рис. 2).
Рис. 2.
Содержание и концентрация дофамина в билатеральных супрахиазматических ядрах у крыс на 10-й постнатальный день (П10) и на П60. *р < 0.05, при сравнении групп на П10 и П60.
Суммарное содержание дофамина в супрахиазматическом ядре и в инкубационной среде после инкубации срезов с L-ДОФА и без L-ДОФА. На П10 при инкубации срезов билатеральных ядер СХЯ от одного животного в буфере Кребса–Рингера с толкапоном и паргилином без добавления L-ДОФА содержание дофамина в ткани и инкубационной среде не определялось в большинстве проб (3 из 4-х). На П10 в контроле суммарное содержание дофамина в СХЯ и инкубационной среде после инкубации срезов с L-ДОФА (117.4 ± 23.1 пг) возрастало по сравнению с содержанием дофамина в СХЯ и инкубационной среде после инкубации срезов без L-ДОФА (рис. 3). В группах после введения смеси 6ГДА и ДГТ содержание дофамина в СХЯ и инкубационной среде после инкубации срезов с L-ДОФА (107.9 ± 15.3 пг) возрастало по сравнению с содержанием дофамина в СХЯ и инкубационной среде после инкубации срезов без L-ДОФА (рис. 3). При этом после инкубации срезов с L-ДОФА содержание дофамина в СХЯ и инкубационной среде в группе после инъекций токсинов не изменялось по сравнению с контрольной группой.
Рис. 3.
Суммарное содержание дофамина в билатеральных супрахиазматических ядрах (СХЯ) и в инкубационной среде после инкубации срезов СХЯ в буфере Кребса–Рингера с толкапоном и паргилином при добавлении L-диоксифенилаланина на 10-й постнатальный день (П10) и на П60. СХЯ для инкубации были получены через 48 часов после введения в боковые желудочки мозга смеси 6-гидроксидофамина и 5,7-дигидрокситриптамина (6ГДА/ДГТ), а в контроле – 0.9% NaCl (NaCl). *р < 0.05, при сравнении групп после введения токсинов (6ГДА/ДГТ) и контроля (NaCl), **р < 0.05, при сравнении групп на П10 и П60.
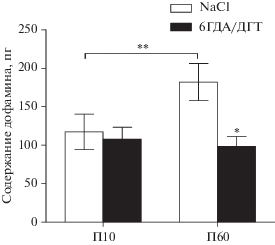
На П60 при инкубации билатеральных ядер СХЯ от одного животного в буфере Кребса–Рингера с толкапоном и паргилином без добавления L-ДОФА содержание дофамина в ткани было ниже разрешающих способностей метода высокоэффективной жидкостной хроматографии с электрохимической детекцией, а в инкубационной среде не определялось. На П60 в контроле суммарное содержание дофамина в СХЯ и инкубационной среде после инкубации срезов с L-ДОФА (181.9 ± 24.1 пг) возрастало по сравнению с содержанием дофамина в СХЯ и инкубационной среде после инкубации срезов без L-ДОФА (рис. 3). В группах после введения смеси 6ГДА и ДГТ содержание дофамина в СХЯ и инкубационной среде после инкубации срезов с L-ДОФА (98.4 ± 12.8 пг) возрастало по сравнению с содержанием дофамина в СХЯ и инкубационной среде после инкубации срезов без L-ДОФА (рис. 3). При этом после инкубации срезов с L-ДОФА содержание дофамина в СХЯ и инкубационной среде в группе после инъекций токсинов снижалось в 2 раза по сравнению с контрольной группой.
Синтез дофамина из L-ДОФА в супрахиазматическом ядре на П10 и П60. На П10 коэффициенты эффективности синтеза дофамина, учитывающие содержание белка в СХЯ, не различались в СХЯ в контрольной группе и после введения смеси токсинов (рис. 4). На П60 коэффициент эффективности синтеза дофамина из экзогенной L-ДОФА, учитывающий содержание белка в СХЯ, в контрольной группе был в 1.8 раза больше, чем в группе после введения смеси токсинов (рис. 4).
Рис. 4.
Коэффициент эффективности синтеза дофамина в билатеральных супрахиазматических ядрах (СХЯ) в процессе инкубации в буфере Кребса–Рингера с толкапоном и паргилином при добавлении L-диоксифенилаланина на 10-й постнатальный день (П10) и на П60. СХЯ для инкубации были получены через 48 часов после введения в боковые желудочки мозга смеси 6-гидроксидофамина и 5,7-дигидрокситриптамина (6ГДА/ДГТ), а в контроле – 0.9% NaCl (NaCl). *р < 0.05, при сравнении групп после введения токсинов (6ГДА/ДГТ) и контроля (NaCl), ), ** р < < 0.05, при сравнении групп на П10 и П60.
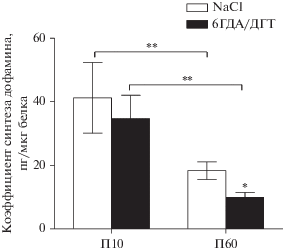
Коэффициент эффективности синтеза дофамина из экзогенной L-ДОФА в контрольной группе на П10 был в 2.3 раза больше, чем в контрольной группе на П60, а на П10 в группе после введения токсинов – был в 3.5 раза больше, чем на П60 (рис. 4).
ОБСУЖДЕНИЕ
В системах нервной и нейроэндокринной регуляций функций организма важное место занимает СХЯ, которое обеспечивает модуляцию этих функций в соответствии с циркадными ритмами [1–3]. Поскольку способность СХЯ выполнять роль биологических часов детерминирована генетически на уровне уникальных нейронов-пейсмейкеров, она проявляется уже в эмбриональном периоде развития [18]. Тем не менее, можно предположить, что в процессе дальнейшего развития, особенно в критическом периоде морфогенеза – у грызунов в перинатальном периоде, на формирование СХЯ влияют и эпигенетические факторы, синтезирующиеся в самом ядре или поступающие по афферентным нервным волокнам.
Несмотря на то, что роль эпигенетических факторов в регуляции развитии СХЯ практически не изучена, существуют факты, которые косвенно указывают на возможность участия в этой регуляции дофамина. Так, уже более двадцати лет назад было показано, что в СХЯ у грызунов в перинатальном периоде высокий уровень экспрессии рецепторов к дофамину [19]. По данным одних авторов, экспрессия рецепторов к дофамину прекращается к препубертатному периоды [20], а по данным других она сохраняется и у взрослых животных, но на гораздо более низком уровне [21]. Первоначально экспрессия рецепторов к дофамину рассматривалась как “случайная”, не имеющая физиологического смысла, поскольку в СХЯ практически отсутствуют источники дофамина – дофаминергические нейроны или их отростки [7, 8]. Только много лет спустя появилось предположение о том, что практически в отсутствие в СХЯ дофаминергических нейронов (тел и отростков нейронов) дофамин в раннем постнатальном периоде может синтезироваться совместно моноферментными нейронами, содержащими по одному из ферментов – ТГ или ДАА [14]. Возможность синтеза дофамина недофаминергическими моноферментными нейронами была ранее нами доказана при изучении медиобазального гипоталамуса и стриатума [11, 12].
В раннем постнатальном периоде моноферментные нейроны представлены в СХЯ у грызунов обширным сплетением ТГ-содержащих волокон и вазопрессинергическими нейронами, экспрессирующими ДАА [8, 13]. При этом L-ДОФА, синтезированный в ТГ-содержащих волокнах может играть роль нейротрансмиттера оказывая влияние на специфические рецепторы [9, 10] и/или, как мы предполагаем, в качестве промежуточного продукта участвовать в кооперативном синтезе дофамина. В случае кооперативного синтеза в СХЯ L-ДОФА, синтезируемый в моноферментных ТГ-содержащих нейронах, переносится в моноферментные нейроны, содержащие ДАА, где и происходит синтез дофамина. При этом захват L-ДОФА в ДАА-содержащие нейроны происходит с помощью мембранного транспортера больших нейтральных L-аминокислот и L-ДОФА [14, 22].
Доказательства кооперативного синтеза дофамина недофаминергическими нейронами в медиобазальном гипоталамусе и в стриатуме удалось получить благодаря использованию оригинальной методологии, при которой синтез дофамина оценивали в слайсах мозга, содержащих моноферментные нейроны, при их инкубации в среде с добавлением конкурентного ингибитора мембранного транспортера больших нейтральных L-аминокислот и без него (контроль) [23]. Величину синтеза дофамина определяли как разницу между суммарным содержанием дофамина в ткани и в среде после инкубации без ингибитора мембранного транспортера больших нейтральных L-аминокислот и суммарным содержанием дофамина в ткани и в среде после инкубации с ингибитором мембранного транспортера больших нейтральных L-аминокислот [14]. Наши попытки использовать этот методический подход для доказательства наличия кооперативного синтеза дофамина в СХЯ не привели к успеху, поскольку СХЯ настолько мало, особенно в раннем постнатальном периоде, что чувствительности высокоэффективной жидкостной хроматографии с электрохимической детекцией не хватает для измерения моноаминов и их метаболитов в билатеральных СХЯ, полученных от одного животного. Поэтому для измерения содержания дофамина в СХЯ у интактных крыс в раннем постнатальном периоде и даже у взрослых животных эти ядра пришлось пулировать от нескольких животных. Пулировать же срезы СХЯ от нескольких животных для их двухчасовой инкубации было невозможно, поскольку эта процедура требовала времени, превышающего время переживания нервной ткани ex vivo. Поэтому нами была проведена двухступенчатая экспериментальная проверка нашей гипотезы о синтезе дофамина в СХЯ моноферментными нейронами. На первом этапе – в нашей предыдущей работе было показано, что L-ДОФА синтезируется в моноферментных ТГ-содержащих нервных волокнах [15], а на втором этапе – в данной работе предполагалось получить доказательство того, что L-ДОФА превращается в дофамин в моноферментных ДАА-содержащих вазопрессинергических нейронах СХЯ.
В первой серии экспериментов, как и ожидалось, не удалось измерить содержание дофамина в срезах СХЯ, полученных от одного животного на П10. Так, общее содержание дофамина в срезах СХЯ и в среде после двухчасовой инкубации было на грани разрешающей способности высокоэффективной жидкостной хроматографии с электрохимической детекцией или за его пределами. На П60, хотя дофамин и определялся, но на весьма низком уровне и только в ткани. Поэтому во второй серии экспериментов при инкубации срезов СХЯ, полученных у крыс на П10 и П60 в среду вводили одинаковое количество L-ДОФА. Это привело к значительному увеличению общего содержания дофамина в срезах СХЯ и в среде после инкубации, причем на П60 в большей степени, чем на П10.
Данные, полученные во второй серии экспериментов, с высокой вероятностью свидетельствуют о синтезе дофамина из L-ДОФА в моноферментных ДАА-содержащих вазопрессинергических нейронах, хотя и не могут рассматриваться как прямое доказательство (рис. 5). Так, при инкубации срезов СХЯ нельзя исключить, что дофамин синтезируется из L-ДОФА не только в моноферментных ДАА-содержащих нейронах, но и в серотонинергических волокнах этого ядра. Кроме того, учитывая данные литературы о высоком содержании в СХЯ у взрослых животных норадреналина и дофамина [24], нельзя исключить, что в этом ядре и/или окружающей его нервной ткани, которая также попадает в инкубируемые срезы СХЯ, существуют катехоламинергические структуры. Действительно, по данным ряда авторов в СХЯ и особенно по его границе содержатся нейроны, экспрессирующие ТГ [7, 25].
Рис. 5.
Схема синтеза дофамина недофаминергическими нейронами, содержащими только тирозингидроксилазу (ТГ) и только декарбоксилазу ароматических L-аминокислот (ДАА). L-ДОФА, L-диоксифенилаланин; ТБА, транспортер больших нейтральных аминокислот.

Для получения прямого доказательства синтеза дофамина из L-ДОФА в моноферментных ДАА-содержащих нейронах СХЯ, этот синтез оценивали в процессе инкубации слайсов СХЯ животных, которым за двое суток до этого в желудочки мозга вводили в максимально высокой дозе смесь нейротоксинов – 6ГДА и ДГТ, вызывающих дегенерацию, соответственно, катехоламинергических и серотонинергических нейронов. Согласно полученным данным, уровень синтеза дофамина в СХЯ, определяемый как общее содержание дофамина в слайсах СХЯ и в среде после инкубации с L-ДОФА, не отличался у нормальных (контрольных) крыс на П10 и у крыс после предварительного внутрижелудочкового введения нейротоксинов. Эти данные являются доказательством того, что у крыс на П10 дофамин синтезируется в СХЯ только в моноферментных ДАА-содержащих нейронах из L-ДОФА, секретируемого моноферментными ТГ-содержащими нервными волокнами. При проведении аналогичного эксперимента на крысах на П60 оказалось, что уровень синтеза дофамина из экзогенного L-ДОФА в СХЯ у крыс после предварительного внутрижелудочкового введения смеси нейротоксинов был примерно в 2 раза ниже, чем в СХЯ у нормальных (контрольных) животных. Отсюда следует, что у взрослых крыс, в отличие от молодых, дофамин синтезируется в СХЯ не только в моноферментных ДАА-содержащих нейронах, но и в ДАА-содержащих моноаминергических структурах, однако в меньшей степени.
Особого внимания заслуживает тот факт, что эффективность кооперативного синтеза дофамина из L-ДОФА в моноферментных нейронах в СХЯ, т.е. синтез на единицу массы белка этого ядра, на П10 выше, чем на П60. Очевидно, это обусловлено тем, что в СХЯ на П10 плотность сплетения моноферментных ТГ-содержащих нервных волокон, которые являются основным источником L-ДОФА – субстратом для синтеза дофамина в моноферментных ДАА-содержащих нейронах, гораздо выше, чем на П60.
ВЫВОДЫ
Получены доказательства того, что в СХЯ из L-ДОФА, продуцируемого в моноферментных ТГ-содержащих нервных волокнах, в моноферментных нейронах, экспрессирующих ДАА, синтезируется дофамин (рис. 5), причем эффективность этого синтеза в раннем постнатальном периоде выше, чем у взрослых крыс.
Список литературы
Honma S., Ono D., Suzuki Y., Inagaki N., Yoshikawa T., Nakamura, W., Honma K. // Progress in Brain Research. 2012. V. 199. P. 129–141.
Moore R.Y. // Ciba Found. Symp. 1995. V. 183. P. 88–99.
Kartasoreos I.N., Silver R. // Endocrinology. 2007. V. 148. P. 5640-5647.
Medanic M., Gillette M.U. // J. Physiol. 1992. V. 450. P. 629–642.
Medanic M., Gillette M.U. // Brain Res. 1993. V. 620. P. 281–286.
Мирочник В.В., Макаренко И.Г., Угрюмов М.В. // Онтогенез. 2002. V. 33. P. 182–186.
Battaglia A.A., Beltramo M., Thibault J., Krieger M., Calas A. // Brain Research. 1995. V. 696. P. 7–14.
Beltramo M., Calas M., Chernigovskaya E., Borisova N., Polenova O., Tillet Y., Thibault J., Ugrumov M. // Neuroscience. 1994. V. 63. P. 603–610.
Misu Y., Kitahama K., Goshima Y. // Pharmacol. Therapeut. 2003. V. 97. P. 117–137.
Fukuda N., Naito S., Masukawa D., Kaneda M., Miyamoto H., Abe T., Yamashita Y., Endo I., Nakamura F., Goshima Y. // Brain Res. 2015. V. 1602. P. 62–74.
Ugrumov M., Taxi J., Pronina T., Kurina A., Sorokin A., Sapronova A., Calas A. // Neuroscience. 2014. V. 277. P. 45–54.
Kozina E.A., Kim A.R., Kurina A.Y., Ugrumov M.V. // Neurobiol. Dis. 2017. V. 98. P. 108–121.
Jaeger C.B., Albert V.R., Joh T.H., Reis D.J. // Brain Res. 1983. V. 276. P. 362–366.
Ugrumov M.V. // Adv Pharmacol. 2013. V. 68. P. 37–91.
Пронина Т.С., Никишина Ю.О., Дильмухаметова Л.К., Муртазина А.Р., Угрюмов М.В. // Нейрохимия. 2020. В печати.
Ashwell K.W.S., Paxinos G. // Atlas of the Developing Rat Nervous System. Compact 3d ed. London: Academic Press, 2008.
Paxinos G., Watson C. // The Rat Brain in Stereotaxic Coordinates. Compact 6th ed. London: Academic Press, 2009.
Carmona-Alcocer V., Abel J.H., Sun T.C., Petzold L.R., Doyle F.J. 3rd, Simms C.L., Herzog E.D. // J. Neurosci. 2018. V. 38. P. 1326–1334.
Shearman L.P., Zeitzer J., Weaver D.R. // Brain Res. Dev. Brain Res. 1997. V. 102. P. 105–115.
Schambra U.B., Duncan G.E., Breese G.R., Fornaretto M.G., Caron M.G., Fremeau R.T. Jr. // Neuroscience. 1994. V. 62. P. 65–85.
Strother W.N., Norman A.B., Lehman M.N. // Brain Res. Dev. Brain Res. 1998. V. 106. P. 137–144.
Fernández E., Torrents D., Zorzano A., Palacín M., Chillarón J. // J. Biological Chemistry. 2005. V. 280. P. 19364–19372.
Ugrumov M.V. // J. Chem. Neuroanat. 2009. V. 38. P. 241–256.
Matsumura T., Nakagawa H., Suzuki K., Ninomiya C., Ishiwata T. // Chronobiol. Int. 2015. V. 32. P. 1449–1457.
Novak C.M., Nunez A.A. // J. Chemical Neuroanatomy. 1998. V. 14. P. 87–94.
Дополнительные материалы отсутствуют.


