Нейрохимия, 2020, T. 37, № 3, стр. 263-270
Влияние пинеалона на обучение и экспрессию генов субъединиц НМДА-рецепторов в гиппокампе у крыс в модели экспериментального диабета
Г. В. Карантыш 1, М. П. Фоменко 1, А. М. Менджерицкий 1, 3, В. Н. Прокофьев 1, Г. А. Рыжак 2, Е. В. Бутенко 1
1 ФГАОУ ВО “Южный федеральный университет”
Ростов-на-Дону, Россия
2 Санкт-Петербургский институт биорегуляции и геронтологии
Санкт-Петербург, Россия
3 ФГБОУ ВО “Донской государственный технический университет”
Ростов-на-Дону, Россия
Поступила в редакцию 03.07.2019
После доработки 13.10.2019
Принята к публикации 06.11.2019
Аннотация
Проведено исследование влияния пептидного препарата пинеалона (Glu-Asp-Arg) в дозировках 50, 100 и 200 нг/кг на обучение крыс в лабиринте Морриса и сохранность выработанного навыка после развития экспериментального диабета, а также на изменения в субъединичном составе НМДА-рецепторов в гиппокампе в данных экспериментальных моделях. В лабиринте Морриса в течение 3 дней проводили оценку пространственного обучения, пинеалон вводили в течение 5 дней после обучения животных. После обучения животным однократно вводили стрептозотоцин в дозе 50 мг/кг массы тела крыс. Сохранность выработанного навыка и молекулярные исследования (с использованием метода ПЦР в реальном времени) проведены на 21 день после моделирования экспериментального диабета. Показано, что пинеалон оказывает дозозависимое влияние на исследованные показатели: наиболее благоприятное влияние на сохранность выработанного навыка установлено при введении пинеалона в дозе 100 нг/кг на фоне развития стрептозотоцинового диабета. В данной модели обнаружены наименее выраженные изменения уровня экспрессии генов Grin1, Grin2b и Grin2d относительно контрольных значений, а также повышенные значения Grin2a/Grin2b по сравнению с группами животных в моделях введения пинеалона в дозировках 50 или 200 нг/кг на фоне экспериментального диабета.
Сахарный диабет является одним из социально значимых заболеваний, распространенность которого продолжает расти, особенно, в развитых странах [1]. Механизмы, лежащие в основе сахарного диабета и роли инсулина в его развитии, широко описаны в литературе.
Большинство работ, посвященных инсулину, направлены на изучение его периферических функций. Однако, в последние годы активно исследуют механизмы, связанные с ролью инсулина в центральной нервной системе, в первую очередь, с нейрональной пластичностью. Установлено, что инсулин способен влиять на интенсивность свободнорадикальных процессов, на разные типы глутаматных рецепторов, апоптоз, активность проапоптотических протеаз и т.д. [2].
Традиционно считали, что инсулин не способен проникать через гематоэнцефалический барьер (ГЭБ), а продуцируется in situ в ряде областей мозга [3], в том числе, в гипофизе [4]; установлено, что в ядрах гипоталамуса, миндалине, гиппокампе и неокортексе экспрессируются инсулиновые рецепторы и субстратные рецепторы инсулина-1 [5]. Тем не менее, уже получены доказательства рецептор-опосредованного эндоцитоза проникновения инсулина через ГЭБ [6]. В экспериментальных моделях и при развитии патологических процессов происходит усиление поступления через ГЭБ как экзогенных, так и эндогенных веществ [7], что, очевидно, характерно и при развитии сахарного диабета. При этом как изменяются процессы, лежащие в основе нейрональной пластичности в условиях развития сахарного диабета, на сегодняшний день остается мало исследованным. В том числе, вызывает интерес влияет ли развитие сахарного диабета на субъединичный состав НМДА-рецепторов.
Роль глутамата и его рецепторов в нейропластических процессах заключается в его влиянии на синаптическую пластичность, долгосрочную потенциацию, а также на эксайтотоксичность, уровень которой снижается в результате передачи сигналов через инсулиновые рецепторы [8–13]. На клеточных линиях подтвержден антиапоптотический эффект инсулина в мозге [14]. В мозге и в периферических тканях экспрессируются две изоформы инсулиновых рецепторов (A и B); нейроны экспрессируют исключительно А-изоформу инсулиновых рецепторов, которая проявляет высокую аффинность связывания и активируется в условиях низких концентраций инсулиноподобного фактора роста-2 (IGF-2), регулятора нейрональной пластичности. Нарушение регуляции IGF-2 связано с нейропатологическими процессами. Низкая активация инсулиновых рецепторов и доступность инсулина могут привести к нарушению опосредованных с инсулиновыми рецепторами функций и, как следствие, к широкому спектру нарушений функций головного мозга: развитию новообразований, нейродегенеративных заболеваний и депрессии [15]. Инсулиновые рецепторы включены в опосредованную передачу сигналов, влияющих на модуляцию долгосрочной потенциации (LTP), развитие депрессии (LTD), на обучение, память [16, 17], изменение энергетического баланса, аппетита и питания [18, 19]. Таким образом, к настоящему времени доказана взаимосвязь глутаматэргической и инсулиновой систем в регуляции пластических процессов, что определяет вероятность их вовлечения в изменение поведенческих реакций при развитии сахарного диабета. В этом плане является перспективным исследование механизмов действия фармакологических средств, способных оказывать влияние на экспрессию генов, продукты которых включены в регуляцию поведенческих реакций в условиях развития сахарного диабета.
Целью данного исследования явилось изучение влияние пептидного препарата пинеалона (Glu-Asp-Arg) на пространственное обучение и его сохранность после развития стрептозотоцинового диабета, а также на экспрессию генов субъединиц НМДА-рецепторов в мозге у крыс в данной экспериментальной модели.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперимент проведен на беспородных белых крысах-самцах весом 200–250 г, которые были разделены на следующие группы (табл. 1):
Таблица 1.
Дизайн эксперимента: последовательность выработки и оценки сохранности пространственного обучения (ПО), моделирования стрептозотоцинового диабета (СД) и введения пинеалона (П)
| Дни эксперимента | Группы | |||||||
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | |||||
| К | СД | П50 | П100 | П200 | СД + П50 | СД + П100 | СД + П200 | |
| 1–3 (ПО) | + | + | + | + | + | + | + | + |
| 4 | СД | П50 | П100 | П200 | СД + П50 | СД + П100 | СД + П200 | |
| 5–8 | П50 | П100 | П200 | П50 | П100 | П200 | ||
| 9–23 | ||||||||
| 24 (ПО) | + | + | + | + | + | + | + | + |
1 – контрольная группа (n = 16), в которой изучали пространственное обучение, сохранность выработанного навыка оценивали на 24 день эксперимента;
2 – группа животных (n = 16), у которых моделировали стрептозотоциновый диабет (СД): перед моделированием СД проводили изучение пространственного обучения у животных, сохранность выработанного навыка оценивали на 24 день эксперимента (далее, СД);
3 – группа животных (n = 48), которым моделировали СД и вводили пинеалон в трех разных дозировках 50, 100 или 200 нг/кг веса, соответственно, в течение 5-ти дней; перед введением препарата проводили изучение пространственного обучения, сохранность выработанного навыка оценивали на 24 день эксперимента (далее, П50, П100, П200);
4 – группа животных (n = 48), которым моделировали СД и вводили пинеалон в трех разных дозировках 50, 100 или 200 нг/кг веса, соответственно, в течение 5-ти дней; перед введением препарата и моделированием СД проводили изучение пространственного обучения, сохранность выработанного навыка оценивали на 24 день эксперимента (далее, СД + П50, СД + П100, СД + П200).
Для изучения пространственного обучения экспериментальных животных использовали водный лабиринт Морриса [20], представляющий собой бассейн диаметром 120 см и высотой бортика – 30 см. На время обучения в центр бассейна помещали платформу размером 10 × 10 × 21 см, которая была на 0.5 см погружена под воду (воду подкрашивали с помощью нетоксичной водорастворимой краски). С одной стороны бассейна помещали лампу для подсветки. Положение платформы и окружающая среда вокруг бассейна во время обучения были постоянными. Перед тестированием проводили обучение: помещали животное в лабиринт Морриса на время не более 120 с, после чего если животное самостоятельно не находило платформу, принудительно его туда помещали. Обучение проводили 3 дня подряд по 3 попытки каждый день (интервал между попытками – 10 мин). Оценивали время нахождения платформы на 3-й день обучения (усредненное значение за 3 попытки). Сохранность выработанного навыка оценивали на 24 день эксперимента: брали усредненный показатель времени трех повторов тестирования в водном лабиринте Морриса.
Статистическую обработку результатов исследования пространственного обучения проводили с использованием метода ANOVA и программы Statistica 10.0. Статистически значимыми считали различия при p < 0.05.
Экспериментальный диабет вызывали (на 4‑й день эксперимента) путем однократного введения крысам раствора стрептозотоцина (Sigma) в 0.4 мл цитратного буфера в дозе 50 мг/кг массы тела после 18-часового голодания [21]. На 21 сутки после введения стрептозотоцина проводили декапитацию и в крови определяли уровень гликозилированного гемоглобина (HbA1) с использованием анализатора DS5 Glycomat (Великобритания).
Относительный уровень траскриптов изучаемых генов исследовали с использованием метода полимеразной цепной реакции в реальном времени (ПЦР-РВ) после обратной траскрипции. Образцы тканей гиппокампа крыс мгновенно замораживали в жидком азоте и хранили при –80°C. Для избегания деградации образцы размораживали однократно. Тотальную РНК из тканей гиппокампа выделяли при помощи набора Aurum Total RNA fatty and fibrous tissue kit (BioRad). Количество и чистоту выделенной РНК оценивали спектрофотометрически на приборе NanoPhotometer (Implen). OD260/280 образцов РНК колебалось от 1.80 до 2.00. Тотальную РНК (0.5 мкг) подвергали обратной транскрипции в кДНК, в объеме смеси 25 мкл. Реакцию обратной транскрипции проводили c использованием реагентов фирмы Евроген (Россия), в соответствии с инструкцией производителя при 40°С в течение 40 мин, после чего инактивировали при 92°С в течение 10 мин. Дизайн прямых и обратных праймеров фирмы Синтол (Россия) для проведения ПЦР-РВ проводили в программе Primer3 с последующей проверкой в IDT. Последовательности праймеров приведены в табл. 2.
Таблица 2.
Последовательности праймеров
| Ген | Прямой праймер | Обратный праймер | Tпл, °С |
|---|---|---|---|
| Grin1 | gca-ggt-gga-gtt-gag-tac-cat-gta-c | cag-ctt-gtt-gtc-ccg-cac-a | 60 |
| Grin2a | cct-cga-acc-ctt-cag-tgc-ct | aat-ggc-tga-gac-gat-gag-cag | 60 |
| Grin2b | tct-gcc-ttc-tta-gag-cca-ttc-ag | aga-cag-cca-ccg-cag-aaa-c | 60 |
| Grin2c | ccc-cct-cag-ctt-ttc-tgg-a | gat-ggc-aac-cac-cgt-gag-a | 60 |
| Grin2d | cga-gcc-cta-cag-ccc-tgc | gga-ctg-agg-tac-tca-aag-atg-aaa-act | 60 |
| HPRT1 | tcc-tcc-tca-gac-cgc-ttt-tc | atc-act-aat-cac-gac-gct-ggg | 60 |
ПЦР-РВ была проведена на амплификаторе CFX-96 фирмы Bio-Rad c использованием готовой реакционной смеси iQ BioRad в объеме 25 мкл, включая по 50 пмоль прямого и обратного праймеров и 1 мкл кДНК. Условия для проведения ПЦР: первичную денатурацию проводили при 95°С 3 мин. Проводили 35 циклов амплификации: 20 с при 95°С, 10 с при 60°С, 20 с при 72°С. Для проверки специфичности после окончания циклов амплификации строили кривую плавления от 65 до 95°С с шагом 0.5°С. В качестве красителя использовали SYBR Green I. Реакцию амплификации для каждого исследуемого гена проводили отдельно в дупликатах. В качестве референсного гена был использован ген HPRT1, кодирующий фермент гипоксантин фосфорибозилтрансферазу 1.
Расчет относительной экспрессии проводили, оценивая величины Ct (Threshold cycle), получаемые в ходе проведения ПЦР-РВ. Далее сравнивали уровни экспрессии исследуемых генов в опытных и контрольных образцах с использованием метода 2–ΔΔCt [22].
Статистическую обработку результатов исследования экспрессии генов проводили в программе Statistica 10.0 с использованием критериев Колмагорова-Смирнова и Ливиня, а также однофакторного дисперсионного анализа ANOVA. Данные представлены в виде средних значений и стандартных ошибок. Статистически значимыми считали различия при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
При изучении уровня HbA1 в крови экспериментальных животных в модели стрептозотоцинового диабета было показано, что данный показатель повышался в группе крыс СД (p < 0.05), а при введении пинеалона в разных дозировках у животных в модели СД уровень HbA1 в крови крыс соответствовал контрольным значениям (табл. 3).
Таблица 3.
Уровень HbA1 в крови крыс в модели стрептозотоцинового диабета и при введении пениалона в разных дозировках
| Группы | HbA1 | |
|---|---|---|
| 1 | Контроль | 7.13 ± 0.31 |
| 2 | СД | 19.47 ± 1.42* |
| 4 | СД +П50 | 7.05 ± 0.27# |
| СД +П100 | 7.25 ± 0.36# | |
| СД +П200 | 7.32 ± 0.34# | |
Среднее время выхода на платформу всех экспериментальных животных к 3-му дню эксперимента снизился (p < 0.05) по сравнению с 1-м днем выработки условного навыка в лабиринте Морриса (в среднем – 27.35 ± 1.68 с). Наиболее выраженные изменения данного показателя установлены в контрольной группе животных и у крыс при введении пинеалона в дозировке 100 нг/кг и моделировании СД (СД + П100). При введении пинеалона в дозировках 50 нг/кг и 200 нг/кг в модели стрептозотоцинового диабета время поиска скрытой платформы на 3-й день тестирования было выше уровня группы животных в модели СД, соответственно, на 42% (p < 0.05) и 69% (p < 0.05).
На 24-й день эксперимента анализировали показатель сохранности выработанного навыка у крыс. В контрольной группе и группе крыс в модели стрептозотоцинового диабета время выхода на платформу не изменилось относительно показателя на 3-й день выработки условного навыка. При введении пинеалона в дозировках 50 и 200 нг/кг и моделировании СД значения времени выхода на платформу были выше, а в модели СД + П100 ниже, чем в контрольной группе (табл. 4).
Таблица 4.
Время выхода на платформу (с) у крыс в разных экспериментальных моделях
| Группы | Дни эксперимента | ||
|---|---|---|---|
| 3 | 24 | ||
| 1 | К | 6.64 ± 0.31 | 8.02 ± 0.16 |
| 2 | СД | 8.78 ± 0.39# | 11.61 ± 0.33# |
| 3 | П50 | 5.72 ± 0.23 | 10.44 ± 0.31# |
| П100 | 5.21 ± 0.20 | 7.21 ± 0.28 | |
| П200 | 7.86 ± 0.34 | 9.28 ± 0.37 | |
| 4 | СД + П50 | 12.43 ± 0.61#$ | 11.47 ± 0.51# |
| СД + П100 | 6.88 ± 0.31 | 8.46 ± 0.24$ | |
| СД + П200 | 14.82 ± 0.71#$ | 11.29 ± 0.42# | |
Ранее было показано, что введение пинеалона в дозировке 100 нг/кг перед моделированием стресса предотвращает чрезмерную интенсификацию свободнорадикальных процессов и повышение активности каспазы-3 в крови и в мозге [23, 24], а также улучшает способность к воспроизведению приобретенного навыка у экспериментальных животных. Поскольку введение данного пептидного препарата в дозировках 50 нг/кг и 200 нг/кг в модели СД не приводило к снижению времени выхода на платформу относительно группы крыс при моделировании СД без введения пинеалона, можно предполагать, что его воздействие на обучение и сохранность ранее выработанного навыка носит дозозависимый характер.
Анализ экспрессии генов субъединиц глутаматных НМДА-рецепторов в гиппокампе показал, что на 24 день эксперимента уровень транскриптов гена Grin1 снижался (p < 0.05) в группе крыс в модели СД (p < 0.05), тогда как при введении пинеалона в дозировках 50 и 200 нг/кг и моделирования СД, напротив, возрастал (p < 0.05) относительно контроля.
Рис. 1.
Относительная экспрессия гена Grin1 у контрольной группы крыс (K) и экспериментальных животных в условиях введения пинеалона в разных дозировках и моделирования стрептозотоцинового диабета. * Статистически значимые отличия показателей относительно контрольных значений (при p < 0.05) (рис. 1–5).
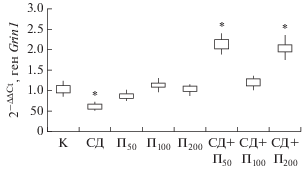
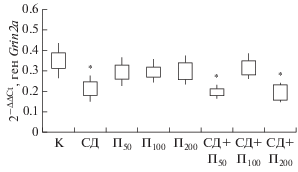
Снижение (p < 0.05) уровня транскриптов гена Grin2a относительно контроля было установлено в группах животных, которым моделировали СД и вводили пинеалон в дозировках 50 и 200 нг/кг, а также у животных, которым моделировали СД без введения препарата (рис. 1, 2). Противоположные изменения транскриптов генов Grin1 и Grin2a в данных группах животных относительно контроля позволяют сделать предположение о том, что в результате данных воздействий происходит изменение доли GluN1- и GluN2a-содержащих НМДА-рецепторов в сторону возрастания 1-го и снижения 2-го типов рецепторов.
Рис. 2.
Относительная экспрессия гена Grin2a у контрольной группы крыс (K) и экспериментальных животных в условиях введения пинеалона в разных дозировках и моделирования стрептозотоцинового диабета.
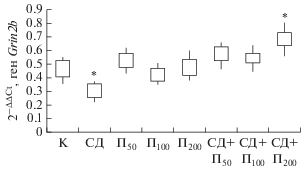
Уровень экспрессии транскрипта гена Grin2b в модели СД снижался (p < 0.05), а в группе крыс, которым вводили пинеалон в дозировке 200 нг/кг и моделировали СД, возрастал (p < 0.05). В исследовании [25] показано влияние снижения GluN2B на уменьшение количества клеток гипоталамуса, синтезирующих агути-подобный белок, что приводит к понижению массы тела, жировой ткани и потребления пищи. Изменение транскрипта гена Grin2b в остальных группах не выявлено (рис. 3).
Рис. 3.
Относительная экспрессия гена Grin2b у контрольной группы крыс (K) и экспериментальных животных в условиях введения пинеалона в разных дозировках и моделирования стрептозотоцинового диабета.
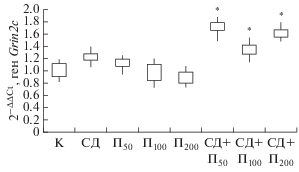
В экспериментальных группах животных, которым вводили пинеалон и моделировали СД, наблюдали возрастание (p < 0.05) экспрессии транскриптов гена Grin2с относительно контроля и 2-й и 3-й групп (рис. 4). Как известно, НМДА-рецепторы являются динамичными образованиями, изменение субъединичного состава которых способствует синаптическому созреванию [26]. В исследовании [27] было установлена роль сигнального пути HIPK2-JNK-c-Jun в подавлении транскрипции генов Grin2a и Grin2c, кодирующих GluN2A- и GluN2C-субъединицы НМДА-рецепторов, соответственно, в раннем постнатальном периоде развития мозга у мышей. Гомеодомен-взаимодействующая протеинкиназа 2 (HIPK2) является онкосупрессором, индуцирующим клеточную гибель в условиях недостатка глюкозы. При этом снижение HIPK2 приводит к уменьшению влияния сигнального пути JNK-c-Jun, увеличению мРНК Grin2a и Grin2c из-за снижения влияния c-Jun и к повышению уровня белков GluN2A и GluN2C в дофаминергических нейронах черной субстанции и нейронах коры головного мозга и, как предполагают, в гиппокампе.
Рис. 4.
Относительная экспрессия гена Grin2с у контрольной группы крыс (K) и экспериментальных животных в условиях введения пинеалона в разных дозировках и моделирования стрептозотоцинового диабета.
При изучении показателей экспрессии гена Grin2d в гиппокампе у экспериментальных животных было установлено, что во 2-й и особенно 4-й группах крыс (введение пинеалона в дозировках 50 и 200 нг/кг) экспрессия этого гена была выше (p < < 0.05) контрольных значений (рис. 5).
Рис. 5.
Относительная экспрессия гена Grin2d у контрольной группы крыс (K) и экспериментальных животных в условиях введения пинеалона в разных дозировках и моделирования стрептозотоцинового диабета.
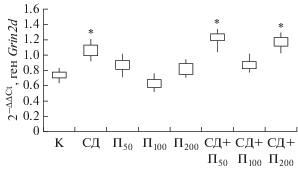
Роль данного гена значительно меньше изучена по сравнению с генами, экспрессирующими GluN2A и GluN2C: уровень экспрессии GluN2D значительно ниже и подавляется уже на первых неделях постнатального периода, после чего, как предполагают, только интернейроны продолжают экспрессировать GluN2D. Показано, что экспрессия GluN2D происходит в шипиковом аппарате гиппокампа и аксо-аксональных синапсах [28]. Следовательно, экспрессия как Grin2с, так и Grin2d в норме снижается уже в начале постнатального периода, тогда как в условиях СД и введения пинеалона в дозировках 50 и 200 нг/кг уровень их экспрессии повышен (p < 0.05) относительно контрольных значений.
Таким образом, в данной работе впервые было установлено изменение экспрессии генов субъединиц НМДА-рецепторов (Grin1, Grin2a, Grin2b, Grin2c и Grin2d) в гиппокампе у крыс в модели стрептозотоцинового диабета, а также влияние введения пинеалона в разных дозировках на эти показатели. Кроме того, исследовано, как влияет изменение субъединичного состава НМДА-рецепторов на сохранность условного навыка (навигационного обучения в водном лабиринте Морриса) при развитии СД.
Трипептид пинеалон (Glu-Asp-Arg) обладает способностью стимулировать функциональную активность основных клеточных элементов ткани мозга, снижать уровень спонтанной гибели клеток, усиливать регенераторноадаптационные процессы в клетках [24]).
Очевидно, пинеалон, введенный в разных дозировках, по-разному действует на сохранность ранее выработанного навыка, причиной чему, является дозозависимое влияние пинеалона на экспрессию субъединиц НМДА-рецепторов. Известно, что в гиппокампе GluN2A и GluN2B являются основными регуляторными субъединицами этих рецепторов: их экспрессия динамично и строго регулируется. В том числе, доказано, что после определенного воздействия наблюдается быстрое увеличение GluN2A в постсинапсах в составе НМДА-рецептора, обусловленное мобилизацией латеральных рецепторов из соседних мест. Позднее НМДА-рецепторы мобилизуются из других пулов, и происходит синтез de novo в нейронной соме. Изменения уровней GluN1 или НМДАR, связанные с синаптической пластичностью и формированием пространственной памяти, по-видимому, определяются процессами, связанными с их транспортом, экспрессией или деградацией [9].
В различных экспериментальных моделях наблюдали возрастание уровней субъединиц НМДА-рецепторов. В том числе, это показано в эксперименте с выработкой пространственного обучения у крыс с использованием метода лабиринта Морриса [29]: установлено, что уровень экспрессии мРНК GluN1 снижался через 1 ч после четырех последовательных тренировочных сессий, тогда как уровень экспрессии мРНК GluN2A не отличался от контроля. В тоже время, при сохранении долговременной памяти в CA1 у крыс повышен уровень GluN1 [30]. Поэтому предполагают, что увеличение экспрессии GluN1 в CA1, а также в зубчатой извилине может быть вовлечено в формирование пространственной долговременной памяти. Однако, в большинстве работ указывается, что максимум повышения уровня экспрессии этих генов достигает примерно через 1.0–1.5 ч после воздействия, после чего наступает спад уровня их экспрессии [31, 32].
Об изменениях экспрессии субъединиц НМДА‑рецепторов также описано в другой работе при предъявлении иных пространственных задач [33]. В том числе было установлено, что в синаптосомальной фракции, извлеченной через 6 ч после тренировки крыс в радиальном лабиринте в течение 10 дней подряд, происходит повышение уровня GluN1 и GluN2B в гиппокампе и увеличение GluN1 и GluN2A в префронтальной коре, а в синаптосомальной фракции дорсального гиппокампа выявлено увеличение GluN1 и GluN2A.
Таким образом, до сих пор не было установлено длительных изменений уровня экспрессии субъединичного состава НМДА-рецепторов после выработки навыка, как это было показано в данной работе. С одной стороны, это может быть результатом того, что на 24-й день эксперимента (когда проводили оценку сохранности ранее выработанного навыка) тестирование проводили трижды, т.е. последнее тестирование приходилось на время не менее 180 мин после начала 1-го тестирования. При этом значительного разброса значений времени выхода на платформу при 1–2–3 тестированиях не установлено. Можно также предполагать, что фармакологическое воздействие пептидных препаратов (в данном случае, – пинеалона) может оказывать отставленное во времени действие на облегчение синаптической передачи. Это, предположительно, и является результатом влияния пинеалона на соотношение уровней экспрессии генов Grin2a/Grin2b, которое в модели введения трипептида в дозировке 100 нг/кг на фоне моделирования СД оставалось на уровне контрольных значений на 24 день эксперимента, тогда как при введении пинеалона в дозировках 50 или 200 нг/кг на фоне СД это соотношение значительно понижалось по сравнению с контролем. Известно, что повышение уровня GluN2B приводит к гибели клеток in vitro и in vivo, тогда возрастание уровня GluN2A предотвращает гибель нейронов [34, 35]. Также вызывает интерес полученные результаты повышенных уровней экспрессии генов Grin2c и Grin2d у животных, которым вводили пинеалон в дозировках 50 и 200 нг/кг на фоне СД, а также в модели СД без введения препарата.
Следовательно, в условиях развития стрептозотоцинового диабета и введения пинеалона в разных дозировках наблюдается изменение субъединичного состава НМДА-рецепторов, что отражается на сохранности выработанного ранее навыка (пространственного обучения). Более высокое по значению отношение уровня экспрессии генов Grin2a/Grin2b характерно для группы животных, у которых наблюдали наименьшие значения времени выхода на платформу при оценке сохранности ранее выработанного навыка в водном лабиринте Морриса. Это согласуется с данными других авторов [35].
ЗАКЛЮЧЕНИЕ
Проведенное исследование показало, что трипептид оказывает дозозависимые эффекты на сохранность ранее приобретенного навыка в лабиринте Морриса, а также экспрессию разных субъединиц НМДА-рецепторов в гиппокампе крыс в модели СД. Наиболее благоприятное влияние на сохранность приобретенного навыка пинеалон в модели СД оказывает в дозировке 100 нг/кг, что можно объяснить характером перераспределения уровня экспрессии генов Grin2a и Grin2b в данной модели по сравнению с другими экспериментальными моделями (введения препарата в дозировках 50 или 200 нг/кг на фоне СД). Не до конца ясна связь изменения уровня экспрессии других исследованных генов субъединичного состава НМДА-рецепторов с сохранностью выработанного навыка. Чтобы понять механизм действия данного пептидного препарата на процесс обучения и его сохранность, необходимо проведение последовательного изучения экспрессии генов не только НМДА-рецепторов, но и других генов, связанных с обучением и адаптацией к стрессорному фактору (в данном случае, к стрептозотоциновому диабету) в динамике повреждающего его воздействия.
Список литературы
Дедов И.И., Шестакова М.В., Викулова О.К., Железнякова А.В., Исаков М.А. // Сахарный диабет. 2018. Т. 21. № 3. С. 144–159.
Nampoothiri M., Reddy N.D., John J. // Behavioural Neurology. 2014. V. 2014. Article ID 674164. 8 p. https://doi.org/10.1155/2014/674164
Devaskar S.U., Giddings S.J., Rajakumar P.A., Carnaghi L.R., Menon R.K., Zahm D.S. // J. Biol. Chem. 1994. V. 269. P. 8445–8454.
Caruso MA, Sheridan MA. // Gen. Comp. Endocrinol. 2011. V. 173. P. 227–247.
Baskin D.G., Schwartz M.W., Sipols A.J., D’Alessio D.A., Goldstein B.J., White M.F. // Endocrinology. 1994. V. 34. P. 1952–1955.
Baura G.D., Foster D.M., Kaiyala K., Porte D.Jr., Kahn S.E., Schwartz M.W. // Diabetes. 1996. V. 45. P. 86–90.
Блинов Д.В. // Эпилепсия и пароксизмальные состояния. 2014. Т. 6. № 1. С. 70–84.
Wu L.-J., Xu H., Ren M. // Molecular Pain. 2007. V. 3. P. 11.
Baez M.V., Cercato M.C., Jerusalinsky D.A. // Neural Plasticity. V. 2018. Article ID 5093048. 11 p.
Cercato M.C., Vázquez C.A., Kornisiuk E. // Frontiers in Behavioral Neuroscience. 2017. V. 10. P. 242.
Shohami E., Biegon A. // CNS and Neurological Disorders – Drug Targets. 2014. V. 13. № 4. P. 567–573.
Bannerman D.M., Niewoehner B., Lyon L. // J. Neuroscience. 2008. V. 28. № 14. P. 3623–3630.
Tse Y.C., Bagot R.C., Hutter J.A., Wong A.S., Wong T.P. // PLoS One. 2011. V. 6. № 11. e27215.
Nampoothiri Lai T.W., Zhang S., Wang Y.T. // Progress in Neurobiology. 2014. V. 115. P. 157–188.
Pomytkin I., Costa-Nunes J.P., Kasatkin V. // CNS Neuroscience & Therapeutics. 2018. V. 24. Is. 9. https://doi.org/10.1111/cns.12866
McNay E.C., Recknagel A.K. // Neurobiol. Learn. Mem. 2011. V. 96. P. 432–342.
Kullmann S., Heni M., Hallschmid M. // Physiol Rev. 2016. V. 96. P. 1169–1209.
Qiu J., Zhang C., Borgquist A. // Cell Metab. 2014. V. 19. P. 682–693.
Chen W., Balland E., Cowley M.A. // Neuroendocrinology. 2017. V. 104. P. 364–381.
Morris R.G. // J. Neurosci. Meth. 1984. V. 11. P. 47–60.
Szkudelski T. // Ibed. 2001. V. 50(6). P. 536–546.
Livak K.J. Schmittgen T.D. // Methods. 2001. V. 25. P. 402–408.
Карантыш Г.В., Абрамчук В.А., Рыжак Г.А., Менджерицкий А.М. // Фундаментальные исследования. 2013. № 6. С. 1406–1410.
Менджерицкий А.М., Карантыш Г.В., Рыжак Г.А., Демьяненко С.В. // Успехи геронтологии. 2014. Т. 27. № 1. С. 94–97.
Aykut Ü., Gonçalves G.H.M., Li W. // Molecular Metabolism. 2015. V. 4(10). P. 678–691.
Paoletti P., Bellone C., Zhou Q. // Nat. Rev. Neurosci. 2013. V. 14. P. 383–400.
Shang Y., Zhang J., Huang E.J. // J. Neurosci. 2018 V. 38(16). P. 4006–4019.
von Engelhardt J., Bocklisch C., Tönges L. et al. // Front. Cell. Neurosci. 2015. V. 9. P. 95.
Cavallaro S., D’Agata V., Manickam P., Dufour F., Alkon D.L. // Proceedings of the National Academy of Sciences of the United States of America. 2001. V. 99. № 25. P. 16279–16284.
Zhang L., Yu W., Han T.-Z., Xie W., Luo Y. // Sheng Li Xue Bao. 2006. V. 58. № 5. P. 442–448.
Baez M.V., Oberholzer M.V., Cercato M.C., Snitcofsky M., Aguirre A.I., Jerusalinsky D.A. // PLoS One. 2013. V. 8. № 2. e55244.
Hepp Y., Salles A., Carbo-Tano M., Pedreira M.E., Freudenthal R. // Learning and Memory. 2016. V. 23. № 8. P. 427–434.
Shanmugasundaram B., Sase A., Miklosi A.G. // Behavioural Brain Research. 2015. V. 289. P. 157–168.
Liu Y., Wong T.P., Aarts M. // J. Neuroscience. 2007. V. 27. № 11. P. 2846–2857.
Taghibiglou C., Martin H.G.S., Lai T.W. // Nature Medicine. 2009. V. 15. № 12. P. 1399–1406.
Дополнительные материалы отсутствуют.


