Нейрохимия, 2020, T. 37, № 3, стр. 201-207
Влияние стресса на экспрессию нейротрофического фактора мозга (BDNF) и его предшественника proBDNF у мышей, различающихся чувствительностью серотониновых 5-НТ1А рецепторов
Е. М. Кондаурова 1, Т. В. Ильчибаева 1, Д. В. Базовкина 1, Н. К. Попова 1, В. С. Науменко 1
1 Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения
Российской академии наук
Новосибирск, Россия
Поступила в редакцию 22.07.2019
После доработки 01.10.2019
Принята к публикации 03.10.2019
Аннотация
В последнее время становится очевидным, что взаимодействие между серотониновой (5-НТ) системой и системой нейротрофического фактора мозга (BDNF) играет важную роль в механизмах регуляции поведения, различных физиологических и нейропластических процессов. При этом имеется ряд данных указывающих на вовлечение ключевого регулятора функциональной активности 5-НТ системы мозга – 5-НТ1А рецептора в механизмы контроля BDNF системы. Недавно нами были созданы новые рекомбинантные линии мышей B6.CBA-D13Mit76C (B6-M76C) и B6.CBA-D13Mit76B (B6-M76B), различающиеся по чувствительности 5-НТ1А рецепторов к хронической активации. В данной работе с использованием этих мышей мы исследовали вызванные острым стрессом изменения в уровнях белка BDNF и его белка-предшественника proBDNF. Было показано, что мыши B6-M76С со сниженной чувствительностью пресинаптических 5-НТ1А рецепторов отличаются от мышей B6-M76B пониженным уровнем proBDNF в среднем мозге и гиппокампе и увеличенным соотношением BDNF/proBDNF в гиппокампе. При этом острый стресс вызывал снижение уровня proBDNF в среднем мозге мышей контрольной линии B6-M76B, вызывая существенное повышение соотношения BDNF/proBDNF, отражающее интенсивность “созревания” BDNF, в среднем мозге мышей линии B6-M76B, но не мышей линии B6-M76С. Таким образом, впервые обнаружено, что изменения чувствительности ключевого регулятора 5-НТ системы мозга – 5-НТ1А рецептора, приводят к значительным изменениям в ответе BDNF системы на острый стресс. Также выявлено, что функция 5-НТ1А рецептора связана и с паттернами базальной экспрессии элементов BDNF системы, а именно, с экспрессией белка-предшественника proBDNF. Кроме того, полученные данные дают основание предположить, что вызываемые острым стрессом изменения функциональной активности BDNF системы связаны, в первую очередь, с механизмами нейропластичности, определяющими эмоциональную и поведенческую реакцию на эмоциональный стресс.
ВВЕДЕНИЕ
В последнее время стало очевидно, что две ведущие системы нейропластичности мозга, серотонинергическая (5-НТ) и система нейротрофического фактора мозга (BDNF), тесно связаны между собой и их взаимодействие крайне важно как для функционирования обеих систем, так и для регуляции различных физиологических процессов [1, 2].
Как 5-НТ, так и BDNF системы мозга весьма сложны. BDNF производится в клетке из белка-предшественника preproBDNF, который разрезается до proBDNF в аппарате Гольджи [3]. Далее proBDNF может подвергнуться редактированию с образованием BDNF [4]. И proBDNF, и BDNF обладают функциональной активностью, однако, если BDNF, связываясь с TrkB рецептором, приводит к синтезу белка, росту аксонов, созреванию дендритов, увеличивая синаптическую пластичность [3], то proBDNF связывается с p75 рецептором и ингибирует рост нейритов, сокращает размеры нейронов и запускает процессы апоптоза [5, 6]. Противоположные функции BDNF и его предшественника дают основание считать соотношение BDNF/proBDNF ауторегуляторным механизмом синаптической пластичности [2, 7].
Действие 5-НТ на нейроны опосредуется множеством рецепторов, среди которых особое внимание привлекает 5-НТ1А рецептор. Этот рецептор является ключевым ауторегулятором 5-НТ системы мозга. Он может локализоваться как пре-, так и постсинаптически, и активация пресинаптического 5-НТ1А рецептора приводит к подавлению секреции 5-НТ в синаптическую щель [8]. Недавно в нашей лаборатории были созданы новые рекомбинантные линии мышей B6.CBA-D13Mit76C (B6-M76C) и B6.CBA-D13Mit76B (B6-M76B) на генетическом фоне линии C57BL/6 [9]. Мыши B6-M76C несут дистальный фрагмент хромосомы 13 (102.73–110.56 Mbp), полученный от линии CBA и содержащий ген 5-HT1A-рецептора, и этим мыши линии B6-M76C отличаются от линии B6-M76B. Мыши линии B6-M76B прошли те же процедуры бэккросирования и инбридинга, что и мыши линии B6-M76C, однако, вместо фрагмента линии CBA, несут все тот же фрагмент линии С57BL/6. Различия между линиями B6-M76С и B6-M76B проявляются в чувствительности 5-HT1A рецепторов: хроническое введение агониста этих рецепторов 8-OH-DPAT устраняет опосредованный преимущественно постсинаптическими 5-НТ1А рецепторами гипотермический ответ у мышей B6-M76C, но не у мышей B6-M76B. В то же время хроническая активация 5-HT1A рецептора приводит к увеличению двигательной активности только у мышей B6-M76B. Кроме того, мыши B6-M76C характеризуются сниженным метаболизмом 5-HT в гиппокампе, и этот эффект сопровождается повышенной экспрессией 5-HT1A рецептора в этой структуре по сравнению с мышами B6-M76B [9]. На основании этих данных мы предположили, что перенос 102.73–110.56 Mbp фрагмента хромосомы 13, содержащего 5-HT1A рецептор, от линии CBA на генетический фон линии C57BL/6 привел к усилению чувствительности постсинаптических и ослаблению чувствительности пресинаптических 5-HT1A-рецепторов [9]. Интересно отметить, что мыши B6-M76C показали пониженную экспрессию гена Bdnf в гипоталамусе после воздействия стресса по сравнению с контрольной группой [10].
Целью работы было изучение эффектов острого эмоционального стресса на уровень белка BDNF, его белка-предшественника proBDNF и соотношения BDNF/proBDNF в структурах мозга мышей линий B6-M76C и B6-M76B, различающихся по чувствительности 5-НТ1А рецепторов.
МЕТОДЫ ИСЛЕДОВАНИЯ
Животные. Эксперименты проводили на взрослых (10–12 нед., 20–25 г) самцах мышей линий B6.CBA-D13Mit76C (B6-M76C) и B6.CBA-D13Mit76B (B6-M76B), полученных в ФИЦ Институт цитологии и генетики СО РАН г. Новосибирск, путем переноса фрагмента 102.73–110.56 Mbp хромосомы 13, содержащего ген 5-HT1A рецептора, из генома линии CBA (B6-M76C) или линии C57BL/6 (B6-M76B) в геном мышей линии C57BL/6 [9, 11]. Животные содержались в клетках размером 40 см × 25 см × 15 см в стандартных условиях (20–22°C, свободный доступ к еде и воде, 12-ч цикл свет/темнота). За два дня до эксперимента мышей взвешивали и рассаживали в индивидуальные клетки для снятия групповых эффектов.
В эксперименте мыши каждой линии были разделены на две группы (n = 6–10) – контроль и острый стресс. Мыши экспериментальной группы подвергались эмоциональному рестрикционному стрессу путем содержания в течение 40 мин в металлической трубке (8.5 см × 2.5 см) с 48 вентиляционными отверстиями диаметром 0.4 см. Ограничительное устройство позволяло мышам вытягивать лапы, но не двигаться внутри него. Непосредственно после воздействия стресса мышей декапитировали. На льду выделяли гипоталамус, гиппокамп и область ядер шва среднего мозги, замораживали структуры мозга в жидком азоте и хранили при –80°С до процедуры выделения общей РНК и белка.
Работы с животными проводились с использованием ресурсов Центра генетических ресурсов лабораторных животных ИЦиГ СО РАН (RFMEFI-61914X0005 и RFMEFI62114X0010). Содержание экспериментальных животных и все процедуры выполнены в соответствии с международными правилами обращения с животными National Institute of Health Guide for the Care and Use of Laboratory Animals (NIH Publications No. 80023), 1996.
Определение количества белка (Western blot analysis). Уровни белков proBDNF и BDNF определяли при помощи Вестерн блот анализа. Для получения общей фракции белка соответствующие структуры мозга (кора, гиппокамп и средний мозг) гомогенизировали в лизирующем буфере, содержащем 300 мМ NaCl, 100 мМ Tris pH 8.0, 4 мМ EDTA, 0.2% Triton, 1 мМ Sodium orthovanadate, 2 мМ PMSF и ингибиторы протеаз (Thermo Fisher Scientific Inc., USA). Ингибиторы протеаз использовали в рекомендованных производителем концентрациях. Гомогенат оставляли на льду в течении часа, затем центрифугировали 15 мин на 12 000 g при 4°С. Отбирали супернатант в чистую пробирку. Количество общего белка оценивали с помощью BCA метода (Thermo Fisher Scientific Inc., USA). В дальнейшем образцы приводили к равной концентрации 1 мг/мл с помощью 2-кратного Леммли буфера (4% SDS, 12.5% Glycerol, 120 мM Tris (pH 6.8), 10% меркаптоэтанол, 0.02% Bromphenol blue) и денатурировали в течениe 5 мин при 95°C.
Белок разделяли с помощью SDS-PAGE гель-электрофореза, используя 15%-ный разделяющий гель, и переносили с помощью электроблоттинга на нитроцеллюлозную мембрану 0.45 мкм (Bio-Rad laboratories Ltd., USA) в течение ночи при силе тока 50 мА. Для переноса использовали буфер, содержащий 190 мМ глицина, 25 мМ Tris pH 8.3 и 20% метанола. В качестве маркера использовали смесь Precision Plus Protein™ Kaleidoscope™ Prestained Protein Standards (Bio-Rad laboratories Ltd., США). Для иммунодетекции белка мембрану блокировали с 5%-ным сухим обезжиренным молоком, разведенным в TBS буфере с 0.05% Tween 20 (Bio-Rad laboratories Ltd., USA), в течение 3-х часов при комнатной температуре и инкубировали c первичными антителами (табл. 1). После детекции белков (как описано ниже) все мембраны обрабатывали с помощью restore plus western blot stripping buffer (ThermoFisher Scientific Inc. USA), для дальнейшей реиммунодетекции внутреннего контроля GAPDH (табл. 1). Для детекции всех белков мембрану отмывали 5 × 5 мин буфером TBST, добавляли вторичные поликлональные антитела (табл. 1). Повторяли отмывку мембраны.
Таблица 1.
Список использованных антител и условия иммунодетекции
| Антитела, производитель | Разведение | Время инкубации, условия |
|---|---|---|
| Первичные антитела кролика к белку BDNF, Abcam, UK ab 4 6176 | 1 : 1000 в 5% сухом молоке с TBST | Ночь при 4°С |
| Первичные антитела мыши к белку pro-BDNF, Santa Cruz, USA, cat. No. sc 65513 | 1 : 250 в 5% сухом молоке с TBST | Ночь при 4°С |
| Антитела к белку GAPDH, конъюгированные с пероксидазой хрена, Santa Cruz, USA, cat. No. sc 25778 | 1 : 500 в 5% сухом молоке с TBST | 2 ч, при комнатной температуре |
| Вторичные антитела козы, направленные против иммуноглобулинов мыши, конъюгированные с пероксидазой хрена, Abcam, UK ab 6728 | 1 : 2000 в 5% сухом молоке с TBST | 1 ч, при комнатной температуре |
| Вторичные антитела козы, направленные против иммуноглобулинов кролика, конъюгированные с пероксидазой хрена, ThermoFisher Scientific Inc. USA | 1 : 10 000 в 5% сухом молоке с TBST | 1 ч, при комнатной температуре |
Все связанные антитела визуализировались с помощью Super Signal TM West Femto Maximum Sensitivity Substrate (Thermo Fisher Scientific Inc., USA), в соответствии с инструкцией производителя, и гельдокументирующей системы Fusion FX7-820 System (Vilber Lourmat, France). Полученное изображение денситометрировали и количественно оценивали содержание белка при помощи программы Scion Image. Экспрессию белка выражали в относительных единицах и нормировали на экспрессию GAPDH, которая конститутивна для клеток мозга. Результаты представляли, в процентах относительно уровня белка у интактных мышей B6-M76B, принятого за 100%.
Статистическая обработка результатов. Экстремальные значения были определены при помощи метода Диксона [12] и исключены из анализа. Результаты представлены как m ± SEM и сравнивались с использованием двухфакторного дисперсионного анализа ANOVA (фактор 1 – генотип, фактор 2 – стресс) с последующим апостериорным сравнением по Фишеру. Критерий значимости результатов – p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
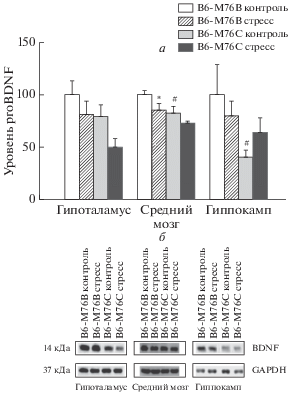
Мыши линии B6-M76С не отличались от мышей контрольной линии B6-M76B по уровню BDNF во всех исследованных структурах (рис. 1). Существенные различия были выявлены в экспрессии предшественника BDNF. Двухфакторный дисперсионный анализ выявил эффект генотипа (F(1,14) = 12.1, p < 0.01) и эффект стресса (F(1,14) = 7.6, p < 0.05) на уровень proBDNF в среднем мозге. Выявлен эффект генотипа и на уровень proBDNF в гиппокампе (F(1,17) = 4.9, p < 0.05). Мыши B6-M76С отличались от мышей B6-M76B пониженным уровнем proBDNF в среднем мозге (p < 0.05) и в гиппокампе (p < 0.05) (рис. 2). В гипоталамусе различий по уровню proBDNF выявлено не было. Сравнение по Фишеру показало, что острый стресс вызывал существенное (p < 0.05) снижение уровня proBDNF в среднем мозге мышей контрольной линии B6-M76B, но не у мышей линии B6-M76С (рис. 2).
Рис. 1.
а – Уровень белка BDNF в структурах мозга интактных и подвергавшихся острому стрессу мышей B6-M76С и B6-M76B. б – Хемилюминисцентный сигнал белка BDNF. Уровень белка BDNF выражали в относительных единицах хемилюминесценции и нормировали на экспрессию GAPDH. Результаты представлены в процентах относительно уровня белка у интактных мышей B6-M76B, принятого за 100%. Данные представлены как значения m ± SEM и сравнены при помощи двухфакторного дисперсионного анализа ANOVA (N ≥ 4).
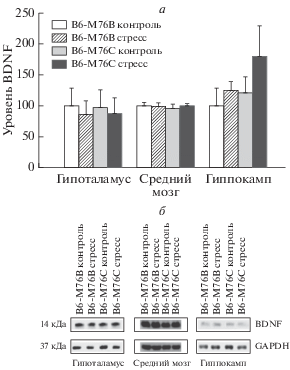
Рис. 2.
а – Уровень белка proBDNF в структурах мозга интактных и подвергавшихся острому стрессу мышей B6-M76С и B6-M76B. б – Хемилюминисцентный сигнал белка proBDNF. Уровень белка proBDNF выражали в относительных единицах хемилюминесценции и нормировали на экспрессию GAPDH. Результаты представлены в процентах относительно уровня белка у интактных мышей B6-M76B, принятого за 100%. Данные представлены как значения m ± SEM и сравнены при помощи двухфакторного дисперсионного анализа ANOVA (N ≥ 4). *p < 0.05 – по сравнению с интактными мышами соответствующей линии; #p < 0.05 – по сравнению с интактными мышами линии B6-M76B.
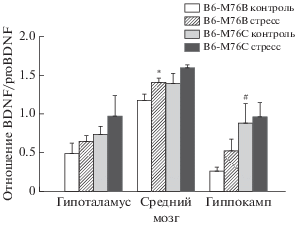
Обнаружен эффект генотипа (F(1,13) = 6.6, p < 0.05) и эффект стресса (F(1,13) = 7.5, p < 0.05) на соотношение BDNF/proBDNF в среднем мозге. В гиппокампе также обнаружен эффект генотипа (F(1,16) = = 9.4, p < 0.01) на соотношение BDNF/proBDNF. Действительно, мыши B6-M76С контрольной группы демонстрировали увеличенное соотношение BDNF/proBDNF по сравнению с мышами B6-M76B контрольной группы (p < 0.05) (рис. 3). Сравнение по Фишеру показало, что стресс вызывает существенное (p < 0.05) повышение отношения BDNF/proBDNF в среднем мозге мышей контрольной линии B6-M76B, но не у мышей линии B6-M76С (рис. 3).
Рис. 3.
Соотношение уровня белка BDNF к уровню белка proBDNF в структурах мозга интактных и подвергавшихся острому стрессу мышей B6-M76С и B6-M76B. Все данные представлены, как значения m ± ± SEM и сравнены при помощи двухфакторного дисперсионного анализа ANOVA (N ≥ 4). *p < 0.05 – по сравнению с интактными мышами соответствующей линии; #p < 0.05 – по сравнению с интактными мышами линии B6-M76B.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Имеющиеся в литературе данные указывают на существование связи BDNF с 5-НТ1А рецепторами мозга [13]. Также показано, что 5-НТ1А рецептор может регулировать экспрессию BDNF в условиях стресса. Острый стресс в сочетании с введением агониста 5-НТ1А рецепторов 8-OH-DPAT вызывал повышение уровня мРНК Bdnf в структурах мозга крыс, а сочетание острого стресса с введением антагониста 5-НТ1А рецепторов MDL73005, напротив, приводило к снижению уровня мРНК bdnf в структурах мозга крыс [14–17].
Ранее мы показали [9], что мыши B6-M76С отличаются от мышей B6-M76B повышенной чувствительностью постсинаптических и сниженной чувствительностью пресинаптических 5-HT1A рецепторов. Результаты, полученные в настоящей работе, выявили влияние генетически детерминированной функциональной активности 5-НТ1А рецепторов на систему BDNF и ее реакцию на эмоциональный стресс. Интересно отметить, что уровень BDNF у мышей B6-М76С с измененной чувствительностью 5-НТ1А рецепторов существенно не отличался от уровня контрольной линии. Основные изменения происходили в экспрессии предшественника BDNF – proBDNF. Мыши линии B6-М76С отличались от контрольной линии B6-М76B пониженным уровнем proBDNF в среднем мозге и гиппокампе, что увеличило отношение BDNF/proBDNF, отражающее интенсивность “созревания” BDNF. Достаточно неожиданно, но эти изменения оказались сходными с изменениями BDNF/proBDNF среднего мозга, обнаруженными при действии эмоционального стресса на контрольную линию мышей. Примененный эмоциональный стресс, не повлияв на уровень белка BDNF у мышей B6-М76B, понизил уровень proBDNF и увеличил отношение BDNF/proBDNF. Интересно отметить, что индуцированные стрессом изменения в экспрессии proBDNF и в соотношении BDNF/proBDNF, обнаруженные в среднем мозге контрольной линии B6-M76B, отсутствовали в среднем мозге мышей B6-M76С со сниженной чувствительностью 5-НТ1А рецепторов. Средний мозг – структура мозга, где преобладают пресинаптические 5-НТ1А рецепторы [18]. Это позволяет предположить, что понижение чувствительности именно пресинаптических 5-НТ1А рецепторов привело к ослаблению ответа BDNF системы на острый стресс. Также можно предположить, что пониженный базальный уровень proBDNF в среднем мозге мышей B6-M76С является причиной, по которой острый эмоциональный стресс не вызвал у них снижения экспрессии proBDNF, наблюдаемого у мышей B6-M76B. Также следует иметь в виду, что количество белка proBDNF или BDNF зависит от множества факторов. Например, количество proBDNF зависит от транскрипции, трансляции, транспортировки в другие структуры и процессинга до BDNF, а количество BDNF зависит от процессинга proBDNF, транспортировки и разрушения самого BDNF.
Изменения экспрессии proBDNF и отношения BDNF/proBDNF в среднем мозге при неизменном уровне BDNF было отмечено нами и ранее у высоко агрессивных крыс, селекционированных в течение более 70 поколений на высокую агрессивность [19]. Это дает основание предположить, что (1) одним из факторов, модулирующих генетически детерминированную функциональную активность системы BDNF, является его предшественник proBDNF, (2) 5-HT1A рецептор регулирует экспрессию proBDNF, (3) генетически детерминированная активность 5-НТ1А рецептора является одним из факторов, влияющих на уровень proBDNF и отношение BDNF/proBDNF, (4) неизмененный уровень самого белка и мРНК BDNF без информации об экспрессии proBDNF может ввести в заблуждение при оценке функционального состояния системы BDNF.
Учитывая прямо противоположное влияние BDNF и proBDNF на нейрогенез – антиапоптотическое BDNF и проапототическое действие proBDNF, увеличение BDNF/proBDNF, обнаруженное у мышей B6-М76С и при действии стресса на мышей B6-М76В, повышает нейропластичность мозга и должно рассматриваться как положительное. На первый взгляд это противоречит сложившимся взглядам о негативном действии стресса. Однако это предположение хорошо укладывается в представления основателя концепции стресса Ганса Селье о разном влиянии различающихся по силе и продолжительности действия стрессоров и о положительном, активирующим действии слабого или умеренного стресса (eustress) [20]. Примененный нами эмоциональный стрессор, кратковременно ограничивающий двигательную активность мышей, относится к умеренным видам стрессирования. Существенных различий в гормональной реакции этих линий мышей обнаружено не было: базальный уровень кортикостерона в крови мышей B6-М76В и мышей B6-М76В, как и его повышение в ответ на стресс было сходным [9, 21]. Не было выявлено и изменений и в уровне BDNF и proBDNF в ключевом звене реакции гипоталамо-гипофизарно-надпочечниковой системы на стресс–гипоталамусе. Это дает основание предположить, что основное влияние комплекса proBDNF–BDNF связано не с механизмами гормональной регуляции стресса, а с механизмами нейропластичности, определяющими эмоциональную и поведенческую реакцию на эмоциональный стресс.
Список литературы
Popova N.K., Ilchibaeva T.V., Naumenko V.S. // Biochemistry (Mosc.). 2017. V. 82. № 3. P. 308–317.
Попова Н.К., Ильчибаева Т.В., Науменко В.С. // Биохимия. 2017. Т. 82. № 3. C. 449–459.
Benarroch E.E. // Neurology. 2015. V. 84. № 16. P. 1693–1704.
Lu B., Pang P.T., Woo N.H. // Nat. Reviews. Neurosci. 2005. V. 6. № 8. P. 603–614.
Kenchappa R.S., Tep C., Korade Z., Urra S., Bronfman F.C., Yoon S.O., Carter B.D. // J. Biol. Chem. 2010. V. 285. № 26. P. 20358–20368.
Deinhardt K., Chao M.V. // Neuropharmacol. 2014. V. 76. Pt. C. P. 603–609.
Бородинова А.А., Саложин С.В. // Журн. высш. нервн. деят. 2016. Т. 66. C. 3–23.
Popova N.K., Naumenko V.S. // Rev. Neurosci. 2013. V. 24. № 2. P. 191–204.
Kulikova E.A., Bazovkina D.V., Akulov A.E., Tsybko A.S., Fursenko D.V., Kulikov A.V., Naumenko V.S., Ponimaskin E., Kondaurova E.M. // Br. J. Pharmacol. 2016. V. 173. № 13. P. 2147–2161.
Kulikova E.A., Bazovkina D.V., Antonov Y.V., Akulov A.E., Kulikov A.V., Kondaurova E.M. // Neurosci. Res. 2017. V. 117. P. 14–21.
Кондаурова Е.М., Базовкина Д.В., Куликов А.В. // Росс. физиол. журн. им. И.М. Сеченова. 2015. Т. 101. № 6. C. 670–677.
Dixon W.J. // Biometrics. 1953. V. 9. № 1. P. 74–89.
Popova N.K., Naumenko V.S. // Exp. Opin. Ther. Targ. 2019. V. 23. № 3. P. 227–239.
Jiang D.G., Jin S.L., Li G.Y., Li Q.Q., Li Z.R., Ma H.X., Zhuo C.J., Jiang R.H., Ye M.J. // Neural Regen. Res. 2016. V. 11. № 9. P. 1471–1479.
Nibuya M., Morinobu S., Duman R.S. // J. Neurosci. 1995. V. 15. № 11. P. 7539–7547.
Altar C.A. // Trends Pharmacol. Sci. 1999. V. 20. № 2. P. 59–61.
Castren E., Rantamaki T. // Dev. Neurobiol. 2010. V. 70. № 5. P. 289–297.
Barnes N.M., Sharp T. // Neuropharmacol. 1999. V. 38. № 8. P. 1083–1152.
Ilchibaeva T.V., Kondaurova E.M., Tsybko A.S., Kozhemyakina R.V., Popova N.K., Naumenko V.S. // Behav. Brain Res. 2015. V. 290. P. 45–50.
Selye H. // J. Hum. Stress. 1975. V. 1. № 2. P. 37–44.
Попова Н.К., Понимаскин Е.Г., Науменко В.С. // Росс. физиол. журн. им. И.М. Сеченова. 2015. Т. 101. № 11. C. 1270–1278.
Дополнительные материалы отсутствуют.


