Нейрохимия, 2020, T. 37, № 3, стр. 195-200
Локализация аннексина V и агрина в волокнах интактного седалищного нерва мыши
Г. Ф. Шаймарданова 1, В. В. Сальников 1, 2
1 Казанский институт биохимии и биофизики ФИЦ КазНЦ РАН
Казань, Россия
2 Казанский (Приволжский) федеральный университет
Казань, Россия
Поступила в редакцию 21.10.2019
После доработки 27.11.2019
Принята к публикации 28.11.2019
Аннотация
Методы иммуногистохимии широко применяются в современных микроскопических исследованиях. Преимуществом иммуноэлектронной микроскопии является возможность локализации функциональных белков в ультраструктурах клетки. Однако различные ткани и антигены по-разному реагируют на традиционно применяемые фиксирующие реагенты. Подбор оптимальных условий приготовления иммунологически меченых образцов для электронномикроскопических исследований во многом опирается на эмпирический опыт и зависит не только от вида ткани, но и цели исследования. Нервная ткань сочетает в себе механически слабые (миелин) и плотные (коллаген, клеточная стенка) структуры, что ставит противоречивую задачу одновременного обеспечения фиксации структуры ткани и взаимодействия антител с антигеном по всей толщине образца. В настоящей работе представлена методика иммуногистохимического мечения, адаптированная для исследования локализации аннексина V и агрина в ультраструктуре различных отделов седалищного нерва мыши. Полученные результаты выявили преимущественную локализацию обоих белков в миелиновых оболочках нервных волокон, что указывает на возможную роль этих белков в функционировании миелина. Плотность осадка анти-агрина на миелине кожной ветви оказалась существенно выше, чем в большеберцовой, тогда как аннексин V распределен более равномерно.
ВВЕДЕНИЕ
Использование методов иммуногистохимии в ультраструктурных исследованиях создает новые перспективы в части исследования взаимосвязи между структурой и функцией. Возможность локализации функциональных белков в ультраструктурах клетки в сочетании с морфологическим анализом представляет несомненное преимущество электронно-микроскопической иммуногистохимии перед другими микроскопическими техниками, несмотря на методологические сложности. Основное ограничение связано с противоречивым требованием максимального сохранения интактной структуры ткани в процессе пробоподготовки и максимальной чувствительности к антигену, что особенно справедливо в отношении нервной ткани, в которой сочетаются механически слабые (миелин) и плотные (соединительная ткань и клеточные стенки) структуры. Изготовление ультратонких срезов для трансмиссионной электронной микроскопии (ТЭМ) требует предварительного обезвоживания и помещения образца в твердую матрицу, в качестве которых широко используются эпоксидные смолы. Одним из факторов, влияющих на сохранность ультраструктурных компонентов ткани, является нарушение ее целостности во время проникновения в нее смолы. В процессе удаления воды из исследуемой ткани, пропитки и полимеризации смолы при повышенных температурах развиваются значительные деформирующие силы, что требует предварительной обработки тканей фиксирующими реагентами (глутаральдегид), для придания прочности слабым структурам образца. В то же время фиксация ухудшает доступность антигенных сайтов для антител [1, 2]. Кроме того, поскольку антитело само по себе неразличимо под ТЭМ, необходимо проведение вторичной реакции с антителом, конъюгированным с контрастной меткой, в качестве которой используются частицы золота. Крупные частицы хорошо различимы при ТЭМ, однако плохо проникают в глубину ткани, что приводит к значительным погрешностям при количественной оценке сайтов связывания. Визуализацию мелких субнанометровых частиц можно значительно улучшить, применяя технику усиления серебром [3, 4]. Усиление серебром – идеальный метод при использовании реагентов содержащих частицы наноразмерного золота (вторичных антител, коньюгированных с частицами золота малого размера). Применение усиления серебром имеет следующие преимущества при проведении иммуногистохимических реакций:
1. Высокий контраст видимого сигнала для световой микроскопии;
2. Низкий неспецифический фон по сравнению с другими контрастирующими реагентами;
3. Высокая чувствительность этого реагента;
4. Возможность наблюдать увеличенные частицы также в световой микроскоп;
5. Короткое время инкубации (2-30 мин) для создания необходимого размера видимых частиц в зависимости от размера частиц золота;
6. Применимость к частицам коллоидного золота любого размера.
Наличие плотных клеточных мембран в миелиновом волокне также ограничивает доступность антигенных участков, что требует применения разрыхляющих (пермеабилизующих) средств, например, детергентов (Тритон), отрицательно действующих на сохранность структуры миелина. Проблема отчасти решается проведением иммунной реакции на тонких срезах, полученных после заливки образца в матрицу из гидрофильных акриловых смол, способных полимеризоваться при низких температурах (LR White, LR Gold) [5] и обладающих хорошей проницаемостью для водорастворимых антител [1]. Подбор оптимальных условий приготовления иммунологически меченых образцов для ТЭМ исследований во многом опирается на эмпирический опыт и зависит не только от вида ткани, но и цели исследования.
В настоящей работе ставилась задача адаптировать методику иммуногистохимического мечения для исследования локализации аннексина V и агрина в ультраструктуре седалищного нерва мыши.
Седалищный нерв мышей широко используется в качестве модели при исследовании травм, регенерации и патологий периферической нервной системы. Кроме того, небольшой вес и размеры этих животных делают предпочтительным их использование при изучении медико-физиологических последствий пребывания в условиях космического полета [6]. Несмотря на актуальность, данные о морфологии и экспрессии ключевых факторов в различных отделах седалищного нерва мышей на ультраструктурном уровне представлены недостаточно и нуждаются в дальнейшем расширении и систематизации.
Аннексин V несет множественные функции в организме и вырабатывается различными тканями, проявляя высокое сродство к мембранным липидам, в особенности фосфатидилсерину. Установлена связь аннексина V с мембранными процессами [7], в частности, участие в экзо- и эндоцитозе, регуляции кальциевых каналов, сигнальных путях, воспалении, росте и дифференцировке клеток и апоптозе, в том числе в нейронах. В периферических нервах было показано, что аннексин V обнаруживается исключительно в Шванновских клетках, где он диффузно распределен в цитоплазме или ассоциирован с плазматической мембраной [8]. Отмечено полное отсутствие иммунной реакции в осевых цилиндрах аксонов. Применявшаяся Spreca с соавт. методика (вторичная пероксидазная реакция с последующим окрашиванием продукта четырехокисью осмия) не позволила ответить на вопрос о наличии аннексина V в миелиновых оболочках из-за интенсивного неспецифического окрашивания последних осмием.
Агрин, согласно данным ряда исследований, синтезируется в нейрональных телах двигательных нейронов и транспортируется к нервным окончаниям, где затем секретируется во внеклеточное пространство, участвуя в образовании и поддержании целостности синаптических контактов. Максимальная плотность иммунопреципитации по агрину при исследовании в световом микроскопе обнаруживается в нейронах и в области базальной мембраны синаптических контактов, а также в перисинаптических Шванновских клетках [9]. В периферических нервных волокнах агрин обнаруживается на всем протяжении волокон на внешней поверхности миелиновых волокон, что позволяет говорить о его возможной роли в периферическом миелогенезе [10]. Данные об ультраструктурной локализации аннексина V и агрина в литературе отсутствуют.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты выполнены на белых мышах-самцах массой 25 ± 3 г. Животных содержали в стандартных условиях вивария. Выделяли седалищные нервы на уровне нижней трети бедра. Для исследования использовали участки большеберцовой и кожной ветви седалищного нерва.
Образцы фиксировали в 2% параформальдегиде и 0.5% глутаровом альдегиде на 0.1 M PBS (фосфатный буфер), pH 7.4, 1–3 ч. Большие концентрации глутарового альдегида отрицательно сказываются на чувствительности иммунной реакции, низкие – не обеспечивают достаточной фиксации. Мы сочли концентрацию в 0.5% глутарового альдегида оправданным компромиссом. Постфиксировали в 0.5% четырехокиси осмия на 0.1 M PBS, pH 7.4, 1 ч. Образцы были обезвожены в спиртах, абсолютном ацетоне. Инфильтрировали в смеси водорастворимой акриловой смолы (LR White, R14381, Sigma-Aldrich) и ацетона до повышения концентрации смолы до 100%. Полимеризовали образцы в течение 24 ч в термостате при температуре 60°С. Ультратонкие срезы получали с помощью алмазного ножа на ультрамикротоме (LKB 8800 Ultratome III, Швеция). Проведение иммуногистохимических реакций осуществляли по классической схеме для работы с первичными и вторичными антителами с собственными модификациями [2, 11].
В качестве первичных антител использовали коммерческие поликлональные антитела, специфичные к агрину (Rabbit anti-mouse polyclonal Agrin antibody, ab85174, Abcam), и к аннексину V (Rabbit anti-mouse polyclonal Annexin V antibody, ab14176, Abcam).
Для иммунолокализации срезы на никелевых сетках:
а) блокировали (15 мин) во влажной камере в TBST (Tris-Buffered Saline/Tween 20–20 мМ Трис-буферный раствор с добавлением 150 мМ NaCl, 0.2% NaN3 и 0.05% Tween 20) с добавлением 5% NGS (normal goat serum – нормальная козья сыворотка) при комнатной температуре;
б) инкубировали в первичном антителе на TBST (1 : 100) + 5% нормальная козья сыворотка, 2 ч при комнатной температуре;
в) промывка в Трис-буфере (ТВ) три раза;
г) инкубация во вторичном антителе, конъюгированным с коллоидным золотом (Anti-Rabbit Goat, Sigma, размер частиц 5 нм) на TB + 5% NGS + + 0.06% БСА (бычий сывороточный альбумин) (1 : 50), 2 ч при комнатной температуре;
д) промывка в ТВ три раза;
е) промывка в воде три раза.
Для усиления сигнала коллоидного золота применяли процедуру усиления метки серебром [12], для чего сетки со срезами инкубировали в растворе (BBInternational Silver Enhancing Kit, Ted Pella, Inc., Redding, CA). Размер получаемых в результате реакции частиц серебра зависит от времени инкубации и доступности частиц золота, то есть глубины их расположения в объеме образца. Опытным путем определена оптимальная длительность инкубации 4 мин.
Срезы контрастировали в 2.0% растворе уранил ацетата 20 мин и в растворе цитрата свинца 2 мин при комнатной температуре [13]. В качестве контроля использовали срезы, обработанные аналогичным образом, но без внесения первичных антител. Образцы просматривали на трансмиссионном электронном микроскопе модели Hitachi 7700 (Япония) при рабочем напряжении 80 кВ.
Морфометрию проводили с применением программы ImageJ v.1.48 (NIH, USA). Статистический анализ данных во всех экспериментах проводили с применением стандартных математических методов пакета программы Microsoft Excel 2003. Результаты морфометрии представляли в виде среднего ± среднеквадратическое отклонение. Количество биологических повторностей – 3, аналитических – 3. Результаты морфометрии обрабатывали с использованием t-критерия Стьюдента, ANOVA, программа OriginPro.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Морфологически волокна большеберцовой и кожной ветвей выглядят достаточно сохранными (рис. 1). Случайно расположенные волокна с признаками расслоения миелина немногочисленны и могут быть результатом прохождения среза в области насечек Шмитта–Лантермана [14]. В образцах наблюдается выраженная пропорциональность между диаметром волокна и толщиной миелина: волокна большего диаметра имеют и более толстый миелин. Волокна малого диаметра преобладают на срезах кожной ветви, а крупные волокна – в большеберцовой ветви, что связано с функциональными различиями. Известно, что значительную долю волокон большеберцовой ветви составляют отростки мотонейронов, имеющие больший диаметр и более толстый миелин сравнительно с афферентными сенсорными волокнами, тогда как в кожной ветви представлены только сенсорные волокна [15, 16].
Рис. 1.
Иммунопреципитация по аннексину V (а, г) и агрину (б, д) в ультраструктуре кожной и большеберцовой ветвей седалищного нерва мыши. Контроль без использования первичных антител (в, е). Верхний ряд: кожная ветвь, нижний ряд: большеберцовая ветвь.
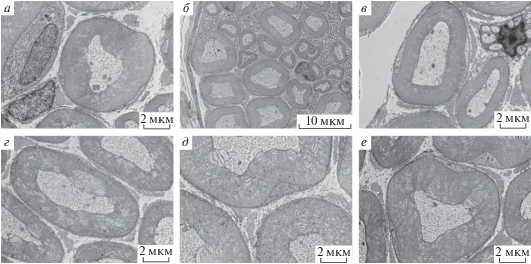
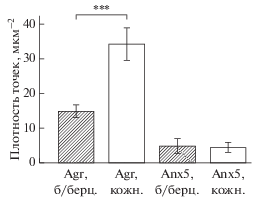
На микрофотографиях срезов кожной и большеберцовой ветвей седалищного нерва, обработанных антителами, частицы золота контрастируют с окружающими диффузно окрашенными участками ткани, что позволяет уверенно обозначить сайты иммунопреципитации (рис. 1а, 1б и 1г, 1д). Антитела к агрину и аннексину V сорбируются предпочтительно на миелиновых оболочках нервных волокон. Плотность преципитации максимальна на плотных слоях миелина и незначительна на участках расслоения миелина. В то же время, иммуносорбция в аксональных цилиндрах, в безмиелиновых волокнах, а также на коллагене отсутствует или незначительна. Уровень фонового мечения незначителен, а при контрольном окрашивании без первичных антител отсутствует вообще (рис. 1в и 1е). Сравнение большеберцовой и кожной ветвей по плотности и равномерности распределения осадка показало, что осадок по аннексину V распределяется равномерно по миелиновым оболочкам волокон в обеих ветвях. В то же время, по агрину наблюдается существенная разница в плотности осадка – в кожной ветви плотность более чем в два раза выше по сравнению с большеберцовой (рис. 2).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Мы применили в настоящей работе иммунногистохимическое окрашивание ультратонких срезов седалищного нерва после фиксации глутаральдегидом и заливки в смолу LR White. Известно, что акриловые смолы, в частности LR White, благодаря своей гидрофильности, обладают хорошей проницаемостью для водных растворов антител. В то же время, липидные структуры, такие как миелин, в LR White могут подвергаться деструкции [5], что требует особого внимания к условиям фиксации. Как следует из представленных микрофотографий, фиксация в 2% параформальдегиде и 0.5% глутаровом альдегиде обеспечила достаточно хорошую сохранность миелиновых структур нерва. Однако для достижения высокой плотности иммунопреципитации потребовалось использовать достаточно концентрированные растворы первичных антител, что делает процедуру менее экономичной. Использование серийных срезов позволило проводить раздельное иммунное окрашивание двумя антителами на морфологически идентичных структурах, что уменьшает вариабельность при количественных оценках плотности иммунопреципитации и существенно облегчает подбор концентрации первичных антител.
Для визуализации антигенных сайтов мы применили антитела, конъюгированные с частицами золота размером 5 нм. Частицы такого размера достаточно малы и хорошо проникают в структуру ткани, а также обеспечивают высокую степень пространственного разрешения. Хотя такие частицы плохо различимы на фоне окраски тканей осмием, усиливающая реакция с серебром позволяет легко обойти эту трудность.
В согласии с данными [8], аннексин V обнаруживается в мембране и цитоплазме Шванновских клеток, в то время как аксональные цилиндры практически свободны от преципитата. Однако, в отличие от цитированной работы, наши данные однозначно свидетельствуют о предпочтительной сорбции антител к аннексину V на миелиновых оболочках нервных волокон, что может быть связано с присутствием в миелине значительного количества фосфатидилсерина [17], к которому аннексин V имеет значительное сродство [18].
Неожиданным явилось обнаружение интенсивной иммунопреципитации по агрину по всей площади миелина. Методами световой иммуногистохимии ранее было показано, что агрин в периферическом нерве локализуется исключительно на внешней стороне миелиновых оболочек нервных волокон, где для него имеются специфические рецепторы [10]. Указанное расхождение, возможно, связано с существованием различных изоформ агрина, имеющих специфичные антитела, на что также указывали авторы упомянутой работы.
ЗАКЛЮЧЕНИЕ
Описанная методика является адекватной для электронно-микроскопического исследования миелинизованной нервной ткани и при этом доступной для широкого применения. Используя методику, мы обнаружили, что миелиновые оболочки периферических нервных волокон изобилуют аннексином V и агрином, что указывает на возможную роль белков в функционировании миелина. Плотность осадка анти-агрина на миелине кожной ветви седалищного нерва более чем в два раза выше, чем в большеберцовой, тогда как аннексин V распределяется более равномерно.
Список литературы
Keita M., Magy L., Richard L., Piaser M., Vallat J.M. // J. Peripher. Nerv. Syst. 2002. V. 7. P. 128–133.
Salnikov V.V., Lukyanenko Y.O., Lederer W.J., Lukyanenko V.I. // J. Muscle Res. Cell Motil. 2009. V. 30. P. 161–170.
Oliver C. // Methods in Molecular Biology (Methods and Protocols). Eds Oliver C., Jamur M. Humana Press, 2010. V. 588. P. 311–316.
Lukyanenko V., Salnikov V. // Cellular and Subcellular Nanotechnology. Methods in Molecular Biology (Methods and Protocols). Eds Weissig V., Elbayoumi T., Olsen M. Humana Press, Totowa, N.J., 2013. V. 991. P. 33–39.
Migheli A., Attanasio A., Schiffer D. // Histochemistry. 1992. V. 97. P. 413–419.
Ronca A.E., Moyer E.L., Talyansky Y., Lowe M., Padmanabhan S., Choi S., Gong C., Cadena S.M., Stodieck L., Globus R.K. // Scientific Reports. 2019. V. 9. Article number 4717.
Bouter A., Carmeille R., Gounou C., Bouvet F., Degrelle S.A., Evain-Brion D., Brisson A.R. // Placenta. 2015. V. 36. P. 43–49.
Spreca A., Rambotti M.G., Giambanco I., Pula G., Bianchi R., Ceccarelli P., Donato R. // J. Cell Physiol. 1992. V. 152. P. 587–598.
Magill-Solc C., McMahan U.J. // J. Exp. Biol. 1990. V. 153. P. 1–10.
Yamada H., Denzer A.J., Hori H., Tanaka T., Anderson L.V., Fujita S., Fukuta-Ohi H., Shimizu T., Ruegg M.A., Matsumura K. // J. Biol. Chem. 1996. V. 271. P. 23418–23423.
Salnikov V.V., Lukyanenko Y.O., Frederick C.A., Lederer W.J., Lukyanenko V.I. // Biophys. J. 2007. V. 92. P. 1058–1071.
Baude A., Nusser Z., Molnár E., McIlhinney R.A., Somogyi P. // Neuroscience. 1995. V. 69. P. 1031–1055.
Reynolds E.S. // J. Cell Biol. 1963. V. 17. P. 208–212.
Ghabriel M.N., Allt G. // Progress in Neurobiology. 1981. V. 17. P. 25–58.
King R. Handbook of Clinical Neurology, vol. 115. Eds Said G., Krarup C., Elsevier, 2013. P. 7–27.
Schmalbruch H. // Anat. Rec. 1986. V. 215. P. 71–81.
Blewett M.M. // Medical Hypotheses. 2010. V. 74. P. 433–442.
Lizarbe M.A., Barrasa J.I., Olmo N., Gavilanes F., Turnay J. // Int. J. Mol. Sci. 2013. V. 14. P. 2652–2683.
Дополнительные материалы отсутствуют.
Инструменты
Нейрохимия