Нейрохимия, 2020, T. 37, № 4, стр. 328-337
Возможные механизмы влияния супрамамиллярного ядра на функционирование зубчатой извилины и поля СА2 гиппокампа (роль растормаживания)
И. Г. Силькис 1, В. А. Маркевич 1
1 Федеральное государственное бюджетное учреждение науки Институт высшей нервной деятельности
и нейрофизиологии Российской академии наук
Москва, Россия
Поступила в редакцию 11.03.2020
После доработки 28.04.2020
Принята к публикации 30.04.2020
Аннотация
Проведен анализ возможных механизмов влияния супрамамиллярного ядра гипоталамуса (СМЯ) на активность гранулярных клеток зубчатой извилины и пирамидных нейронов поля СА2 гиппокампа. Использованы известные данные о функциональной организации возбудительных и тормозных взаимодействий в нейронной сети, включающей СМЯ, гиппокамп, перегородку и энторинальную кору. Предположено, что индукции длительной потенциации на перфорантных входах к гранулярным клеткам и к пирамидным нейронам поля СА2 при условии одновременной стимуляции СМЯ и энторинальной коры способствует растормаживание, в котором участвуют взаимосвязанные тормозные нейроны, расположенные в разных полях гиппокампа, перегородке и СМЯ. В состоянии бодрствования глутаматергический вход из СМЯ в поле СА2 способствует потенциации входов к пирамидным нейронам поля СА2 из энторинальной коры и из поля СА3, что облегчает прохождение сигналов через трисинаптический гиппокампальный путь. С учетом известных данных о повышенной активности СМЯ при парадоксальном сне, об участии СМЯ в увеличении активности гранулярных клеток и пирамидных нейронов поля СА2, а также о высокой эффективности входа из поля СА2 в поле СА1, выдвинуто предположение, что при парадоксальном сне, когда передача информации через классический трисинаптический путь затруднена, ее перенос в поле СА1 осуществляется через зубчатую извилину и поле СА2. Из проведенного анализа следует, что облегчение под влиянием СМЯ прохождения сигналов через разные поля гиппокампа, а также увеличение активности СМЯ и гранулярных клеток при парадоксальном сне, способствующее нейрогенезу, могут лежать в основе участия СМЯ в процессах памяти.
Принятые сокращения:
ГК – гранулярные клетки зубчатой извилины;
ДП – длительная потенция эффективности возбудительного синаптического входа;
ЗИ – зубчатая извилина;
МК – мшистые клетки хилуса;
КК – ГАМКергические корзинчатые клетки;
ККД – ГАМКергические клетки канделябры;
МП – медиальная перегородка;
ПВ – парвальбумин;
ПС – парадоксальный сон;
ПП – перфорантный путь;
СМЯ – супрамамиллярное ядро гипоталамуса;
ЭК – энторинальная кора.
ВВЕДЕНИЕ
Ранее полагали, что мамиллярные тела участвуют в процессах памяти, поскольку способствуют переносу информации из гиппокампа через субикулюм в передний таламус, а оттуда в цингулярную кору. Однако при этом игнорировали потенциальную значимость других связей мамиллярных тел. Например, супрамамиллярное ядро (СМЯ) гипоталамуса связано не только с зубчатой извилиной (ЗИ) и полем СА2 гиппокампа, но также с энторинальной корой (ЭК), медиальной перегородкой (МП) и латеральной перегородкой [1–4]. Было предположено, что благодаря этим связям СМЯ является одним из ключевых звеньев нейронной сети обработки информации и может способствовать интеграции когнитивных аспектов целенаправленного поведения [1]. Показано, что инактивация или повреждение СМЯ приводят к нарушению пространственного обучения [5]. Подробный анализ возможностей участия СМЯ в эпизодической памяти проведен в работе [6[.
Существует мнение, что в консолидации пространственной памяти участвуют структуры, чья активность велика во время парадоксального сна (ПС) [7]. В этом функциональном состоянии СМЯ, ЗИ и медиальная ЭК сильно активированы [8]. Примечательно, что тоническая активация ЗИ и ЭК связана не только с глутаматергическими проекциями к ним из СМЯ, но и с ГАМКергическими проекциями из МП [7].
Принято считать, что в основе обучения и памяти лежит длительная модификация эффективности синаптической передачи. К настоящему времени получены немногочисленные свидетельства того, что совместная стимуляция СМЯ и перфорантного входа из ЭК в ЗИ способствует увеличению реакций гранулярных клеток (ГК) ЗИ на стимуляцию перфорантного пути (ПП). Так, в экспериментах in vivo показано, что совместная тетанизация СМЯ и ПП приводит к увеличению популяционных разрядов ГК примерно на 50% [9]. Поскольку появлению эффекта препятствовало использование блокатора ГАМКа рецепторов пикротоксина, авторы работы [9] предположили, что он связан с вызванным стимуляцией СМЯ ингибированием активности ГАМКергических корзинчатых клеток (КК), т.е. с растормаживанием ГК. На срезах гиппокампа взрослых мышей также показано, что хотя изолированная стимуляция СМЯ не может вызывать разряды ГК, одновременная оптическая стимуляция афферентных входов в ЗИ из СМЯ и электрическая стимуляция медиального ПП способствуют увеличению частоты появления разрядов ГК в ответ на стимуляцию этого пути [10]. Вероятность генерации спайков ГК значимо увеличивалась, только если оптическая стимуляция СМЯ предшествовала стимуляции ПП не более чем на 20 мс. Примечательно, что в экспериментах на срезах эффект наблюдался и в присутствии пикротоксина, т.е. для его возникновения было достаточно суммации ВПСП, возникающих при стимуляции обоих входов. Авторы работы [10] предположили, что поскольку при оптической стимуляции синхронно вовлекались все аксоны нейронов СМЯ (что не происходит в экспериментах in vivo), для достижения эффекта не было необходимости в растормаживании ГК. По-видимому, при этом возбуждение ГК со стороны СМЯ достаточно сильное для подпороговой деполяризации клетки, так что использование одной и той же силы стимуляции ПП уже не приводит к дополнительному увеличению числа разрядов.
Сопоставление результатов работ [9, 10] показало, что связанная со стимуляцией СМЯ выраженность длительной потенциации (ДП) в синапсах перфорантные волокна–ГК больше в экспериментах in vivo, чем в срезах гиппокампа. Отличие экспериментальных условий состоит в том, что в экспериментах in vivo СМЯ может оказывать влияние на активность клеток ЗИ не только непосредственно, за счет моносинаптического входа в ЗИ (как происходит в экспериментах на срезах), но и опосредовано, за счет иннервации МП и поля СА2 гиппокампа. С учетом этого нами выдвигается гипотеза, что в основе большей выраженности ДП в экспериментах in vivo лежат как непосредственное возбуждению ГК со стороны ЭК и СМЯ, так и растормаживание, в котором участвует МП и поле СА2. Задачей настоящей работы являлся анализ возможных механизмов сетевого влияния СМЯ на эффективность перфорантного входа из ЭК к ГК ЗИ и к пирамидным нейронам поля СА2 гиппокампа. Понимание этих механизмов может быть полезным для определения роли СМЯ в функционировании гиппокампа при ПС, когда активность нейронов СМЯ высока [8]. Поскольку получены свидетельства того, что нейронная активность, генерируемая во время ПС, способствует консолидации памяти [11], не исключено, что определенный вклад в этот эффект вносит влияние СМЯ на формирование следов памяти в гиппокампе.
ОСОБЕННОСТИ ОРГАНИЗАЦИИ ВОЗБУДИТЕЛЬНЫХ И ТОРМОЗНЫХ СВЯЗЕЙ В ЗУБЧАТОЙ ИЗВИЛИНЕ
Для понимания возможных путей растормаживания ГК, нами использованы известные из литературы данные о функциональной организации нейронной сети, включающей СМЯ, ЗИ и связанные с ними структуры (рис. 1). Так, показано, что нейроны ЗИ получают моносинаптическую иннервацию из ЭК, СМЯ и МП, причем эти входы в ЗИ организованы топически [12]. В дорзальную часть ЗИ проецируются латеральные части ЭК и СМЯ, а также медиальная часть МП. В вентральную часть ЗИ проецируются медиальные части ЭК и СМЯ, а также латеральная часть МП [12]. В ЗИ имеются два типа возбудительных клеток – ГК и располагающиеся в хилусе мшистые клетки (МК). Также в ЗИ выделено несколько типов ГАМКергических интернейронов, различающихся по морфологическим, электрофизиологическим и нейрохимическим свойствам [13, 14].
Рис. 1.
Схема организации связей в нейронной сети, включающей супрамамиллярное ядро и гиппокамп. ЗИ – зубчатая извилина; Хил – хилус; СА3, СА2, СА1 – поля гиппокампа; Суб – субикулюм; МП – медиальная перегородка; СМЯ – супрамамиллярное ядро; ЛДТЯ и ППТЯ – латеродорзальное и педункулопонтийное тегментальные ядра; ГК – гранулярные клетки; МК – мшистые клетки; КК – корзинчатая клетка; К – клетка канделябр; ПП – перфорантный путь. Незакрашенные треугольники и большие кружки – возбудительные нейроны; большие черные треугольники и кружки – ГАМКергические нейроны; большие заштрихованные кружки – холинергические нейроны; линии, оканчивающиеся маленькими незакрашенными, черными и серыми кружками – возбудительные, тормозные, холинергические входы соответственно.
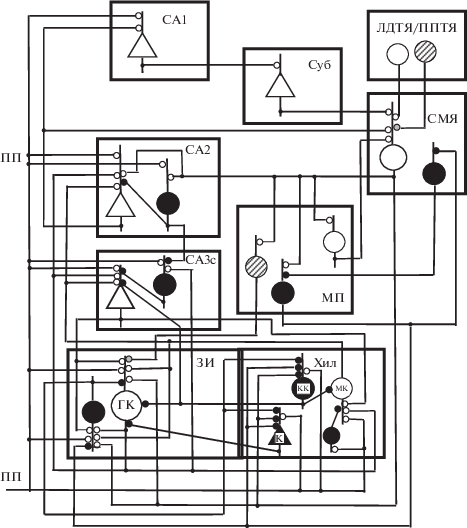
Большинство ГАМКергических клеток ЗИ располагается в хилусе и в гранулярном слое. Терминали ГАМКергических клеток располагаются как в области сомы ГК, так и в области их дендритов в молекулярном слое [15]. В частности, в хилусе имеются интернейроны, которые проецируются на ГК и другие клетки хилуса, содержащие парвальбумин (ПВ) [16]. Эти клетки могут участвовать как в афферентном торможении ГК при поступлении сигналов из ЭК, так и в их растормаживании. Также в хилусе имеются интернейроны пирамидного вида, которые ингибируют и ГК, и интернейроны, а афферентацию получают из гранулярного слоя и внутреннего молекулярного слоя. Отмечено, что только эти интернейроны могут моносинаптически разряжаться при стимуляции ПП [16]. Располагающиеся в хилусе КК иннервируют в основном нейроны гранулярного слоя и частично молекулярного слоя, но могут ингибировать и нейроны пирамидного слоя поля СА3с гиппокампа. Также в хилусе имеются клетки канделябры (ККД), которые образуют аксо-аксонные окончания в гранулярном слое [16] (рис. 1).
Поскольку на дендритах ГАМКергических клеток располагаются и возбудительные, и тормозные синапсы [17], эти клетки могут быть вовлечены не только в цепи афферентного и возвратного торможения, но и растормаживания. Кроме расположенных в молекулярном слое ЗИ тормозных интернейронов, содержащих ПВ и кальбиндин [3], в гиппокампе имеются содержащие кальретинин интернейроны, которые в основном иннервируют другие тормозные интернейроны [18] и поэтому могут участвовать в растормаживании. Содержащие ПВ КК, получающие иннервацию от аксонных коллатералей ГК (мшистых волокон), иннервируют сому, а также базальные дендриты и проксимальные части апикальных дендритов ГК [19]. Поэтому КК могут участвовать в возвратном торможении. Поскольку КК получают также возбуждение из ЭК, они участвуют и в афферентном торможении ГК [20]. Располагающиеся в ЗИ ГАМКергические клетки различаются по электрофизиологическим свойствам. Так, у КК с быстрыми высокоамплитудными спайками длительная следовая гиперполяризация и нет частотной адаптации при длительной деполяризации, тогда как у ККД есть частотная адаптация [21]. Имеются также клетки, характеризующиеся высокочастотными разрядами в ответ на деполяризующий ток [21]. Важно отметить, что содержащие ПВ интернейроны ЗИ с быстрыми спайками эффективно тормозятся (становятся молчащими) при поступлении на их проксимальные или дистальные дендриты сигналов от других тормозных интернейронов [22].
Известно, что пирамидные нейроны поля СА3с посылают проекции обратно в ЗИ [23]. При этом они оказывают влияние на ГК как непосредственно, так и опосредованно через МК хилуса и тормозные интернейроны ЗИ [23]. Таким образом, входы из ЭК, поля СА3с и МК могут оказывать на ГК не только моносинаптическое возбудительное, но и дисинаптическое тормозное влияние (рис. 1). Показано, что в пути из поля СА3с в ЗИ преобладает ингибирование ГК за счет возбуждения тормозных интернейронов, причем даже слабое уменьшение этого торможения может усилить активность ГК [23]. Результаты работы [24] показали, что для появления ВПСП в ГК при стимуляции поля СА3 важно, в каком локусе происходит растормаживание. Если для блокирования торможения через ГАМКа рецепторы бикукуллин апплицировали в область сомы ГК, а также в хилус, то ТПСП уменьшался и можно было индуцировать ВПСП при той же силе стимуляции поля СА3 [24]. Эти данные указывают на важность снятия торможения с сомы ГК для их возбуждения.
Кроме того, в ЗИ оканчиваются аксоны ГАМКергических клеток МП, которые иннервируют только тормозные интернейроны, таким образом обеспечивая растормаживание ГК [25].
РОЛЬ СМЯ И РАСТОРМАЖИВАНИЯ В УВЕЛИЧЕНИИ РЕАКЦИЙ ГРАНУЛЯРНЫХ КЛЕТОК ЗУБЧАТОЙ ИЗВИЛИНЫ НА СТИМУЛЯЦИЮ ПЕРФОРАНТНОГО ВХОДА
Приведенные выше данные о функциональной организации нейронной сети, включающей СМЯ, ЗИ и МП, указывают на то, что в основе наблюдавшейся в экспериментах in vivo высокоамплитудной ДП эффективности перфорантного входа к ГК могут лежать несколько механизмов. Во-первых, вход из СМЯ может способствовать непосредственному возбуждению ГК по цепям, включающим глутаматергические нейроны гиппокампа, МП и ЭК. Во-вторых, поскольку СМЯ участвует в генерации тета-ритма [26], условия для индукции ДП должны улучшиться за счет увеличения синхронизации активности пре- и постсинаптических нейронов и выполнения правила Хебба. В-третьих, СМЯ может способствовать растормаживанию ГК, поскольку в самой ЗИ, полях СА3с и СА2 гиппокампа, а также во взаимодействующей с ними МП имеются взаимосвязанные ГАМКергические клетки (рис. 1).
Нейроны латеральной части СМЯ иннервируют супрагранулярный слой дорзальной части ЗИ и в меньшей степени вентральную часть ЗИ [27]. Из аксонных терминалей субпопуляции этих клеток выделяются глутамат и ГАМК, причем они выделяются из разных пузырьков в независимых симметричных и асимметричных синапсах [28]. Было предположено, что эти нейроны СМЯ могут одновременно гиперполяризовать сому и деполяризовать дендриты ГК [27]. Оптогенетическая активация этих нейронов СМЯ вызывала у 82% ГК ЗИ моносинаптические ответы через АМПА и ГАМКа рецепторы [29]. Однако ГАМК, выделившийся из терминалей нейронов СМЯ, не приводил к ингибированию активности тормозных интернейронов ЗИ. Глутамат, выделившийся при стимуляции СМЯ, вызывал разряды тормозных интернейронов, но не ГК [10]. Поскольку, несмотря на разряжающиеся тормозные интернейроны, стимуляция входа из СМЯ в ЗИ могла способствовать срабатыванию ГК при совпадении во времени со стимуляцией ПП, естественно предположить, что в усилении активности ГК участвует растормаживание. Для реализации растормаживания, интернейроны, получающие возбуждение из СМЯ и ЭК, должны ингибировать другие интернейроны, причем эффективность торможения ГК со стороны последних должна быть велика. С учетом приведенных в предыдущем разделе данных, можно полагать, что растормаживание ГК будет наиболее эффективным при торможении активности расположенных в хилусе КК и ККД, аксонные окончания которых соответственно иннервируют сому и оканчиваются на аксонном холмике ГК [13, 30].
Мы полагаем, что ингибирование активности КК и ККД хилуса и растормаживание ГК может реализоваться при выполнении следующих условий. 1. Возбуждение от кальретинин-содержащих глутаматергических нейронов СМЯ поступает на тормозные клетки ЗИ, которые иннервируют КК и ККД, так что стимуляция СМЯ приведет к ингибированию активности последних и растормаживанию ГК. 2. Поскольку ГАМКергические нейроны МП иннервируют только тормозные клетки ЗИ, включая КК и ККД [25], стимуляция СМЯ и возбуждение тормозных клеток МП может привести к ингибированию КК и ККД.
Примечательно, что аксоны нейронов СМЯ образуют асимметричные возбудительные контакты с ГК, а также с содержащими ПВ и кальбиндин тормозными интернейронами хилуса, но не с МК хилуса [3, 4, 10]. Возбуждение МК получают от нейронов слоя 2 ЭК [31] и от ГК [32], поэтому МК могут участвовать в афферентном и возвратном возбуждении ГК. Поскольку МК не только возбуждают ГК, но и ингибируют их через тормозные нейроны, влияние МК на активность ГК может быть разнонаправленным [33]. По-видимому, дисинаптическое тормозное действие МК на ГК велико, так как в отсутствие входа от МК к тормозным интернейронам последние прекращали разряжаться. Это способствовало растормаживанию ГК [33]. Поскольку СМЯ не иннервирует МК, активность этих клеток может быть невелика, а их возбуждающее действие на тормозные интернейроны слабым. В результате должно быть снижено ингибирование ГК (т.е. будет иметь место растормаживание). Супрамамиллярное ядро также может оказывать опосредованное влияние на активность ГК ЗИ за счет иннервации поля СА2 гиппокампа.
РОЛЬ СМЯ И РАСТОРМАЖИВАНИЯ В ФУНКЦИОНИРОВАНИИ ПИРАМИДНЫХ НЕЙРОНОВ ПОЛЯ СА2 ГИППОКАМПА
Иннервация в поле СА2 поступает из слоя 2 ЭК, поля СА3, СМЯ и МП [34, 35]. Кроме того, пирамидные клетки поля СА2 могут получать возбуждение от ГК по мшистым волокнам [36, 37], т.е. минуя поле СА3 (рис. 1, 2). Возбудительный вход из ЭК на дистальные дендриты нейронов поля СА2 является сильным, а вход из поля СА3 на проксимальные дендриты является слабым [38], по-видимому, вследствие наличия сильного афферентного торможения [39]. В поле СА2 имеется много КК, причем одна небольшая группа этих клеток сходна по свойствам с КК поля СА1. У них быстрые спайки, вертикально ориентированные дендриты и аксоны ветвятся в области расположения самих клеток [40, 41]. Эти КК получают возбуждение также от соседних пирамидных нейронов, т.е. включены в цепи возвратного торможения пирамидных нейронов [42]. По контрасту, большинство содержащих ПВ и кальбиндин КК поля СА2 имеет длинные горизонтально ориентированные дендриты с редкими шипиками, которые располагаются в слое ориенс [40] (т.е. в слое, в который также поступают афференты из СМЯ [10]). На оба типа КК поступает возбуждение как их ЭК, так и из поля СА3 [40]. Аксоны второй группы КК широко ветвятся во всех слоях СА, осуществляя афферентное торможение пирамидных нейронов в полях СА2 и СА1 и возвратное торможение в поле СА3 [40]. По мнению автора указанной работы, поскольку эти КК поля СА2 получают афферентацию из СМЯ, ЭК, ЗИ, поля СА3 и влияют на активность соседних полей СА, они могут играть особую роль в координировании активности всей нейронной сети гиппокампа (с целью упрощения на рис. 1 представлен только один тормозной нейрон в поле СА2; не представлены входы от пирамидных нейронов поля СА3 к пирамидным и тормозным клеткам поля СА2. Также не отображен вход из СМЯ к тормозным клеткам поля СА3 [4] и не анализируется возможная роль этого входа на активность пирамидных нейронов поля СА3 и их клеток-мишеней в других полях гиппокампа).
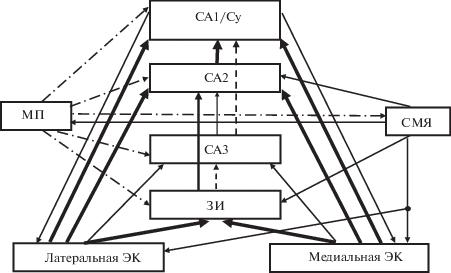
Рис. 2.
Влияние супрамамиллярного ядра на эффективность связей в нейронной сети гиппокампа в состоянии парадоксального сна. По мере продвижения сигналов от латеральной и медиальной областей энторинальной коры (ЭК) через зубчатую извилину (ЗИ) и поле СА2 в поле СА1 гиппокампа на нейронах этих структур последовательно формируются усложняющиеся отображения ассоциаций “объект–место”. Утолщенные линии – потенциированные входы. Пунктирные линии – депрессированные входы. Штрих-пунктированные линии – входы из медиальной перегородки.
Принято считать, что в коллатералях Шаффера, связывающих поле СА3 с полем СА2, классическая ДП не индуцируется [43]. Однако этот вход может быть усилен вследствие длительной депрессии эффективности тормозного входа к пирамидным нейронам поля СА2 от содержащих ПВ тормозных интернейронов, т.е. вследствие растормаживания. Усиления этого растормаживания может быть достаточным для того, чтобы вход из поля СА3 не только вызывал разряды пирамидных клеток поля СА2 [44], но даже приводил к ДП эффективности этого входа, что облегчает прохождение сигналов через поле СА2 [39]. Показано, что совместная стимуляция входов в поле СА2 из ЭК и из поля СА3 может способствовать ДП в пути из поля СА3 в поле СА2 [45].
Поскольку при стимуляции СМЯ пирамидные клетки поля СА2 возбуждаются [34, 46] и поскольку вход из поля СА2 в поле СА1 является сильным и активирует нейроны поля СА1 независимо от поля СА3 [38], СМЯ может опосредованно способствовать возбуждению ГК за счет циркуляции активности по цепи поле СА2–поле СА1–нижние слои ЭК–верхние слои ЭК-ГК. Кроме того, при стимуляции СМЯ возбуждаются тормозные клетки поля СА2, которые ингибируют тормозные клетки поля СА3 (рис. 1). В результате, за счет растормаживания может увеличиться возбуждение пирамидных нейронов поля СА3. Как указано выше, в поле СА3с имеются пирамидные нейроны, проецирующиеся обратно в ЗИ. Они оказывают влияние на активность ГК ЗИ через МК хилуса и тормозные интернейроны ЗИ [23]. Показано, что даже слабое уменьшение торможения может усилить возбуждение между ЗИ и полем СА3 [23]. Поскольку пирамидные нейроны поля СА2 проецируются также в СМЯ и МП [35], они могут через эти структуры опосредованно влиять на активность ГК ЗИ.
Кроме того, стимуляция нейронов СМЯ может способствовать индукции ДП на входе в поле СА2 из ЭК и из поля СА3, поскольку из аксонных терминалей нейронов СМЯ выделяется вещество Р [46]. Показано, что благодаря веществу Р, кратковременная потенциация эффективности входа из поля СА3 в-поле СА2 трансформируется в ДП и что критическую роль в ДП в синапсах СА3–СА2 и ЭК–СА2 играют протеинкиназы [47]. Авторы указанной работы пришли к заключению, что именно вход из СМЯ способствует ассоциативной пластичности в поле СА2. При поступлении сигналов из ЭК нейроны ЗИ и поля СА2 активируются одновременно [48]. Не исключено, что вход из СМЯ способствует не только усилению входа из поля СА3 в поле СА2, но и входа из ЗИ в поле СА2.
Нейроны рассматриваемой нейронной сети, в свою очередь, влияют на активность СМЯ, поскольку в СМЯ поступает иннервация от содержащих кальретинин и кальбиндин нейронов, расположенных на границе МП и латеральной перегородки, получающих возбуждение из ЭК [49] (рис. 1). Эти нейроны оказывают на СМЯ сложное воздействие, так как аксоны 60% из них образуют симметричные тормозные синапсы с нейронами СМЯ, а 40% – асимметричные возбудительные синапсы [50]. Также в СМЯ проецируются нейроны субикулюма [51, 52], который получает возбуждение из поля СА1.
РОЛЬ СМЯ В ФУНКЦИОНИРОВАНИИ ГИППОКАМПА В СОСТОЯНИЯХ ПАРАДОКСАЛЬНОГО СНА И БОДРСТВОВАНИЯ
Показано, что при ПС активность нейронов в СМЯ, ЗИ и медиальной ЭК увеличена по сравнению с состоянием бодрствования [8] и что влияние СМЯ на активность нейронов ЗИ является особенно сильным [53]. Показано также, что появление ПС связано с увеличением активности холинергических нейронов педункулопонтийного и латеродорзального тегментальных ядер. Оптогенетическая стимуляция холинергических нейронов педункулопонтийного ядра приводила к увеличению числа эпизодов ПС [54], тогда как стимуляция глутаматергических нейронов этого ядра приводила к бодрствованию и увеличению активности коры [55]. Ацетилхолин может влиять на активность нейронов СМЯ, так как холинергические нейроны педункулопонтийного и латеродорзального тегментальных ядер проецируются в латеральный гипоталамус [56] и, в частности, в мамиллярные ядра [57]. В частности, показано, что воздействие на никотиновые холинорецепторы на нейронах латерального СМЯ приводит к увеличению активности этих нейронов и их влияния на реактивность нейронов поля СА1 гиппокампа [58, 59]. Эти данные позволяют полагать, что во время ПС, благодаря поступлению ацетилхолина из тегментальных ядер в СМЯ активность нейронов в этом ядре должна быть высокой. Действительно, во время ПС активность нейронов в латеральной части СМЯ была велика. Кроме того, наблюдалось увеличение активности ГК [8]. Поскольку после повреждения СМЯ количество возбужденных нейронов в ЗИ при ПС уменьшалось, увеличение активности ГК при ПС связали с входом в ЗИ из латеральной части СМЯ [8]. Примечательно, что ДП на перфорантном входе в ЗИ индуцируется как во время ПС, так и при спокойном бодрствовании, но не во время медленно-волнового сна [60]. При ПС в ЗИ увеличены, по сравнению с бодрствованием и медленно-волновым сном, уровень цАМФ и количество белков pCREB и pMAPK, которые участвуют в консолидации гиппокамп-зависимой памяти [61]. Эти данные позволили предположить, что во время ПС пластическим перестройкам эффективности возбудительного входа к ГК из ЭК способствует вход в ЗИ из СМЯ [8]. В работе [29] также предположено, что в пластических изменениях в ЗИ во время ПС могут участвовать выделяющие глутамат и ГАМК нейроны СМЯ, которые активны при ПС и вовлечены в генерацию тета-ритма. Полагают, что выделяющие глутамат и ГАМК нейроны СМЯ играют важную роль в активности ГК, благодаря исключительно большой плотности их аксонных окончаний на проксимальных дендритах ГК и возможности обеспечить синхронность срабатывания ГК [29].
Нейроны латеральной части СМЯ, которые выделяют глутамат и ГАМК, активируют нейроны дорзальной части ЗИ, тогда как нейроны вентральной части ЗИ получают возбуждение из медиальной ЭК [62]. Аксонные терминали нейронов задней и медиальной частей СМЯ, из которых выделяется только глутамат, иннервируют исключительно внутренний молекулярный слой вентральной части ЗИ и слой пирамидных нейронов в полях СА2 и СА3а [27]. Эти нейроны СМЯ активны в состоянии бодрствования, а их инактивация приводит к сонливости [29].
Поскольку только 15% от общего количества клеток СМЯ выделяет глутамат и ГАМК [29], численность нейронов СМЯ, выделяющих только глутамат, по-видимому, велика. Поэтому, в состоянии бодрствования концентрация глутамата в поле СА2, выделившегося из аксонных терминалей нейронов СМЯ, должно быть высокой. В результате должны улучшиться условия для индукции ДП на перфорантном входе из ЭК к пирамидным нейронам поля СА2, а возрастание активности последних будет способствовать прохождению сигналов из поля СА2 в поле СА1 (рис. 2). На то, что при наличии входа из поля СА2 в поле СА1 может усилиться связь между полями СА3 и СА1, указано и в работе [63].
С учетом известных из литературы данных о различной концентрации нейромодуляторов в мозге в состояниях ПС и бодрствования, данных о наличии рецепторов разных типов на нейронах разных частей гиппокампа, а также сформулированных нами правил модуляции синаптической передачи, было выдвинуто предположение, что во время ПС депрессируется эффективность передачи в двух звеньях классического трисинаптического пути через гиппокамп (ЗИ–поле СА3 и поле СА3–поле СА1/субикулюм) и одновременно потенциируется эффективность входов из ЭК к пирамидным нейронам поля СА1 [64] (рис. 2). Из проведенного в настоящей работе анализа следует, что при ПС за счет входов из СМЯ может улучшиться эффективность синаптической передачи в путях ЭК–ЗИ, ЗИ–поле СА2 и поле СА2–поле СА1/субикулюм (минуя поле СА3). В состоянии бодрствования вход из СМЯ может способствовать ДП эффективности синаптической передачи в каждом из звеньев классического трисинаптического пути в гиппокампе. Таким образом, вследствие различия проекций из разных частей СМЯ в гиппокамп, а также разной активности клеток в этих частях СМЯ в состояниях бодрствования и ПС, это ядро может по-разному влиять на функционирование гиппокампа в указанных состояниях.
ЗАКЛЮЧЕНИЕ
Из проведенного в настоящей работе анализа возможных механизмов влияния СМЯ на активность ГК ЗИ и пирамидных нейронов поля СА2 гиппокампа следует, что при одновременной стимуляции СМЯ и ЭК индукции ДП на перфорантных входах к ГК и к пирамидным нейронам поля СА2 способствует растормаживание. В этом растормаживании участвуют взаимосвязанные тормозные нейроны, расположенные в разных полях гиппокампа, МП и СМЯ. Вследствие того, что нейроны из разных частей СМЯ проецируются в разные участки гиппокампа и что активность этих нейронов зависит от пребывания в состоянии ПС или бодрствования, СМЯ может по-разному влиять на эффективность прохождения сигналов через гиппокамп в разных функциональных состояниях. Так, в состоянии бодрствования глутаматергический вход из СМЯ в поле СА2 облегчает прохождение сигналов через трисинаптический гиппокампальный путь, а при ПС, когда передача информации из ЗИ в поле СА3 и из поля СА3 в поле СА1 затруднена, ее перенос из ЗИ в поле СА1 осуществляется через поле СА2 (рис. 2).
Ранее нами была выдвинута гипотеза о том, что по мере продвижения активности в пути ЗИ–поле СА3–поле СА1 на нейронах этих областей гиппокампа осуществляется иерархическое обобщение информации об ассоциациях “объект–место” [65]. При этом первоначальное связывание информации о сенсорных свойствах объекта и его пространственном расположении, поступающей соответственно из латеральной и медиальной областей ЭК, происходит на нейронах ЗИ. Затем на нейронах полей СА3 и СА1 формируются отображения ассоциаций более высоких порядков. Такая обработка информации позволяет избежать комбинаторного взрыва и обеспечивает хранение (запоминание) и извлечение из памяти накапливаемых в течение жизни ассоциаций на ограниченном числе нейронов. Если бы при передаче информации происходило комбинированное связывание сенсорных признаков, то увеличение их количества вызывало бы быстрый рост числа возможных комбинаций и для отображения нарастающего числа ассоциаций “объект–место” необходимо было бы экспоненциальное увеличение числа нейронов. По-видимому, при ПС и высокой активности СМЯ по мере прохождения сигналов в пути ЭК–ЗИ–поле СА2–поле СА1 в этих областях формируются новые обобщенные отображения ассоциаций, отличающиеся от тех, которые образуются в состоянии бодрствования.
По-видимому, роль СМЯ в функционировании гиппокампа важна еще и потому, что ПС ассоциируется с пролиферацией ГК в ЗИ взрослых крыс [66]. Депривация сна или избирательная депривация ПС значительно ингибировали пролиферацию клеток [66–68]. По-видимому, нейрогенез зависит от активности ГК, так как он возрастал, если ГК доводили до судорожных разрядов с помощью активации ПП [69]. Не исключено, что при ПС вызванное влиянием СМЯ повышение эффективности входа из ЭК к ГК и последующее возрастание активности ГК способствует нейрогенезу. Нейрогенез ГК в ЗИ во взрослом гиппокампе вносит вклад в пластичность гиппокампа на протяжении всей жизни, поскольку он регулируется активностью этих клеток [70]. При нейрогенезе новые ГК встраиваются в уже существующие нейронные сети и играют важную роль в когнитивных процессах, накоплении информации в память, извлечении ее из памяти и консолидации памяти во время сна [67]. По-видимому, на новых клетках ЗИ могут создаваться отображения вновь появившихся ассоциаций и передаваться в поля СА для дальнейшего обобщения. Роль ПС в консолидации памяти еще недостаточно изучена. Однако недавно с помощью электрофизиологической регистрации и оптогенетической техники впервые продемонстрировано, что нейронная активность, генерируемая именно во время ПС, требуется для консолидации пространственной и контекстуальной памяти [11].
Поскольку временная инактивация СМЯ нарушала способность крыс решать задачи, требующие участия рабочей памяти, было предположено, что СМЯ вовлечено в рабочую память и играет важную роль в обучении и поведении [71]. Из проведенного в настоящей работе анализа следует, что улучшение под влиянием СМЯ условий для потенциации входов из ЭК в ЗИ и в поле СА2, приводящее к облегчению прохождения сигналов через разные поля гиппокампа в поле СА1, а также увеличение активности СМЯ и ГК при ПС, способствующее нейрогенезу, могут лежать в основе участия СМЯ в процессах памяти.
Список литературы
Pan W.X., McNaughton N. // Prog. Neurobiol. 2004. V. 74. № 3. P. 127–166.
Vertes R.P., McKenna J.T. // Synapse. 2000. V. 38. № 3. P. 281–293.
Nitsch R., Leranth C. // J. Comp. Neurol. 1996. V. 364. № 3. P. 425–438.
Leranth C., Hajszan T. // Prog. Brain Res. 2007. V. 163. P. 63–84.
Shahidi S., Motamedi F., Naghdi N. // Brain Res. 2004. V. 1026. P. 267–274.
Vann S.D., Nelson A.J. // Prog Brain Res. 2015. V. 219. P. 163–185.
Luppi P.H., Billwiller F., Fort P. // Curr. Opin. Neurobiol. 2017. V. 44. P. 59–64.
Renouard L., Billwiller F., Ogawa K., Clément O., Camargo N., Abdelkarim M., Gay N., Scoté-Blachon C., Touré R., Libourel P.A., Ravassard P., Salvert D., Peyron C., Claustrat B., Léger L., Salin P., Malleret G., Fort P., Luppi P.H. // Sci. Adv. 2015. V. 1. № 3. e1400177.
Nakanishi K., Saito H., Abe K. // Eur. J. Neurosci. 2001. V. 13. № 4. P. 793–800.
Hashimotodani Y., Karube F., Yanagawa Y., Fujiyama F., Kano M. // Cell. Rep. 2018. V. 25. № 10. P. 2704–2715.
Boyce R., Williams S., Adamantidis A. // Curr. Opin. Neurobiol. 2017. V. 44. P. 167–177.
Ohara S., Sato S., Tsutsui K., Witter M.P., Iijima T. // PLoS One. 2013. V. 8. № 11. e78928.
Alhourani A., Fish K.N., Wozny T.A., Sudhakar V., Hamilton R.L., Richardson R.M. // J. Neurophysiol. 2019. V. [Epub ahead of print]
Han Z.S., Buhl E.H., Lörinczi Z., Somogyi P. // Eur. J. Neurosci. 1993. V. 5. № 5. P. 395–410.
Houser C.R. // Prog. Brain Res. 2007. V. 163. P. 217–232.
Sik A., Penttonen M., Buzsáki G. // Eur. J. Neurosci. 1997. V. 9. № 3. P. 573–588.
Halasy K., Somogyi P. // Eur. J. Neurosci. 1993. V. 5. № 5. P. 411–429.
Tóth K., Maglóczky Z. // Front. Neuroanat. 2014. V. 8. Article 100.
Blasco-Ibáñez J.M., Martínez-Guijarro F.J., Freund T.F. // Neuroreport. 2000. V. 11. № 14. P. 3219–3225.
Ribak C.E., Seress L., Leranth C. // J. Comp. Neurol. 1993. V. 327. № 2. P. 298–321.
Han Z.S. // Neurosci. Res. 1994. V. 19. № 1. P. 101–110.
Elgueta C., Bartos M. // Nat. Commun. 2019. V. 10. № 1. P. 5561.
Scharfman H.E. // Prog. Brain Res. 2007. V. 163. P. 627–637.
Scharfman H.E. // Neuroscience. 1996 . V. 72. № 3. P. 655–668.
Frotscher M., Soriano E., Leranth C. // Epilepsy Res. Suppl. 1992. V. 7. P. 65–78.
Ruan M., Young C.K., McNaughton N. // Front. Neural Circuits. 2017. V. 11. Article 62.
Soussi R., Zhang N., Tahtakran S., Houser C.R., Esclapez M. // Eur. J. Neurosci. 2010. V. 32. № 5. P. 771–785.
Root D.H., Zhang S., Barker D.J., Miranda-Barrientos J., Liu B., Wang H.L., Morales M. // Cell Rep. 2018. V. 23. № 12. P. 3465–3479.
Pedersen N.P., Ferrari L., Venner A., Wang J.L., Abbott S.B.G., Vujovic N., Arrigoni E., Saper C.B., Fuller P.M. // Nat. Commun. 2017. V. 8. № 1. P. 1405.
Hansen M.G., Ledri L.N., Kirik D., Kokaia M., Ledri M. // Front. Cell Neurosci. 2018. V. 11. Article 433.
Patton P.E., McNaughton B. // Hippocampus. 1995. V. 5. № 4. P. 245–286.
Frotscher M., Jonas P., Sloviter R.S. // Cell Tissue Res. 2006. V. 326. № 2. P. 361–367.
Botterill J.J., Lu Y.L., LaFrancois J.J., Bernstein H.L., Alcantara-Gonzalez D., Jain S., Leary P., Scharfman H.E. // Cell Rep. 2019. V. 29. № 9. P. 2875–2889.
Benoy A., Dasgupta A., Sajikumar S. // Exp. Brain Res. 2018. V. 236. № 4. P. 919–931.
Cui Z., Gerfen C.R., Young W.S., 3rd. // J. Comp. Neurol. 2013. V. 521. № 8. P. 1844–1866.
Kohara K., Pignatelli M., Rivest A.J., Jung H.Y., Kitamura T., Suh J., Frank D., Kajikawa K., Mise N., Obata Y., Wickersham I.R., Tonegawa S. // Nat Neurosci. 2014. V. 17. № 2. P. 269–79.
Llorens-Martín M., Jurado-Arjona J., Avila J., Hernández F. // Exp. Neurol. 2015. V. 263. P. 285–292.
Chevaleyre V., Siegelbaum S.A. // Neuron. 2010. V. 66. № 4. P. 560–572.
Nasrallah K., Piskorowski R.A., Chevaleyre V. // Neurobiol. Learn. Mem. 2017. V. 138. P. 173–181.
Mercer A., Trigg H.L, Thomson A.M. J. Neurosci. 2007. V. 27. № 27. P. 7329–7338.
Hayani H., Song I., Dityatev A. // Front. Cell Neurosci. 2018. V. 12. Article 149.
Mercer A., Eastlake K., Trigg H.L., Thomson A.M. // Hippocampus. 2012. V. 22. № 1. P. 43–56.
Caruana D.A., Alexander G.M., Dudek S.M. // Learn. Mem. 2012. V. 19. № 9. P. 391–400.
Nasrallah K., Piskorowski R.A., Chevaleyre V. // eNeuro. 2015. V. 2. № 4. pii: ENEURO.0049-15.
Leroy F., Brann D.H., Meira T., Siegelbaum S.A. // Neuron. 2017. V. 95. № 5. P. 1089–1102.
Berger B., Esclapez M., Alvarez C., Meyer G., Catala M. // J. Comp. Neurol. 2001. V. 429. № 4. P. 515–529.
Dasgupta A., Baby N., Krishna K., Hakim M., Wong Y.P., Behnisch T., Soong T.W., Sajikumar S. // Proc. Natl. Acad. Sci. USA. 2017. V. 114. № 41. P. E8741–E8749.
Bartesaghi R., Migliore M., Gessi T. // Neuroscience. 2006. V. 142. № 1. P. 247–265.
Leranth C., Carpi D., Buzsaki G., Kiss J. // Neuroscience. 1999. V. 88. № 3. P. 701–718.
Borhegyi Z., Freund T.F. // Brain Res. Bull. 1998. V. 46. № 5. P. 453–459.
Christiansen K., Dillingham C.M., Wright N.F., Saunders R.C., Vann S.D., Aggleton J.P. // Eur. J. Neurosci. 2016. V. 43. № 8. P. 1044–1061.
Risold P.Y., Swanson L.W. // Science. 1996. V. 272. P. 1484–1486.
Austin K.B., Bronzino J.D., Morgane P.J. // Exp. Brain Res. 1989. V. 77. № 3. P. 594–604.
Van Dort C.J., Zachs D.P, Kenny J.D., Zheng S., Goldblum R.R., Gelwan N.A., Ramos D.M., Nolan M.A., Wang K., Weng F-Ju., Lin Y., Wilson M.A., Brown E.N. // Proc. Natl. Acad. Sci. USA. 2015. V. 112. № 2. P. 584–589.
Kroeger D., Ferrari L.L., Petit G., Mahoney C.E., Fuller P.M., Arrigoni E., Scammell T.E. // J. Neurosci. 2017. V. 37. № 5. P. 1352–1366.
Hallanger A.E., Wainer B.H. // J. Comp. Neurol. 1988. V. 274. № 4. P. 483–515.
Satoh K., Fibiger H.C. // J. Comp. Neurol. 1986. V. 253. № 3. P. 277–302.
Ariffin M.Z., Jiang F., Low C-M., Khanna S. // Hippocampus. 2010. V. 20. № 7. P. 852–865.
Ariffin M.Z., Low C-M., Khanna S. // Front. Neuroanat. 2017. V. 11. Article 79.
Bramham C.R., Srebro B. // Brain Res 1989. V. 493. № 1. P. 74–86.
Luo J., Phan T.X., Yang Y., Garelick M.G., Storm D.R. // J. Neurosci. 2013. V. 33. P. 6460–6468.
Billwiller F., Renouard L., Clement O., Fort P., Luppi P.H. // Brain Struct. Funct. 2017. V. 222. № 3. P. 1495–1507.
Nasrallah K., Therreau L., Robert V., Huang A.J.Y., McHugh T.J., Piskorowski R.A., Chevaleyre V. // Cell Rep. 2019. V. 27. № 1. P. 86–98.
Силькис И.Г. // Журн. высш.нерв. деят. 2008. Т. 58. № 3. С. 261–275.
Силькис И.Г. // Журн. высш. нерв. деят. 2010. Т. 60. № 6. С. 645–663.
Guzman-Marin R., Suntsova N., Bashir T., Nienhuis R., Szymusiak R., McGinty D. // Sleep. 2008. V. 31. № 2. P. 167–175.
López-Virgen V., Zárate-López D., Adirsch F.L., Collas-Aguilar J., González-Pérez Ó. // Gac. Med. Mex. 2015. V. 151. № 1. P. 99–104.
Mueller A.D., Meerlo P., McGinty D., Mistlberger R.E. // Curr. Top Behav. Neurosci. 2015. V. 25. P. 151–181.
Parent J.M., Yu T.W., Leibowitz R.T., Geschwind D.H., Sloviter R.S., Lowenstein D.H. // J. Neurosci. 1997. V. 17. № 10. P. 3727–3738.
Kempermann G., Song H., Gage F.H. // Cold Spring Harb. Perspect. Biol. 2015. V. 7. № 9. P. a018812.
Aranda L., Santín L.J., Begega A., Aguirre J.A., Arias J.L. // Behav. Brain Res. 2006. V. 167. № 1. P. 156–164.
Дополнительные материалы отсутствуют.


