Нейрохимия, 2021, T. 38, № 1, стр. 52-58
Динамика формирования нарушений моноаминергических систем мозга потомства мышей линии BALB/c при введении вальпроата натрия беременным самкам: нейрохимическое изучение
В. С. Кудрин 1, В. Б. Наркевич 1, А. А. Алымов 1, И. Г. Капица 1, К. А. Касабов 1, Н. В. Кудряшов 1, В. Г. Коньков 1, Т. А. Воронина 1
1 ФГБНУ “НИИ фармакологии имени В.В. Закусова”
Москва, Россия
Поступила в редакцию 15.06.2020
После доработки 15.09.2020
Принята к публикации 05.10.2020
Аннотация
Проводилось изучение состояния дофамин-, серотонин- и норадренергических систем в различных структурах мозга мышей-самцов линии BALB/с на 15, 42 и 64 день постнатального развития (ПНР) при моделировании расстройств аутистического спектра, индуцированных введением вальпроата натрия (400 мг/кг, п/к) беременным самкам. Установлено, что уровень как катехол-, так и индоламинов в структурах мозга мышат контрольной группы в возрасте 15 дней существенно ниже, чем у взрослых животных в возрасте 64 дней. Пренатальное введение вальпроата натрия (ВН) вызывало снижение всех параметров моноаминергической нейропередачи в стриатуме потомства мышей в возрасте 15 дней, но не оказывало влияния на нейрохимические изменения в других изученных структурах мозга. К 42 дню ПНР общий паттерн изменения концентраций нейротрансмиттеров не отличался от динамики созревания нейротрансмиттерных систем контрольной группы. В дальнейшем уровень ДА возрастал и к 64 дню ПНР не отличался от показателей контрольной группы. Параметры серотонинергической системы изменялись по сходной схеме, при этом содержание серотонина достигало максимума к 42 дню, после чего незначительно снижалось к 64 дню, тогда как уровень 5-ОИУК в стриатуме увеличивался постепенно и максимальные отличия наблюдались к 64 дню ПНР. Таким образом, полученные нами данные позволяют предполагать, что введение ВН беременным самкам отражается на активности дофамин- и серотонинергической систем мозга потомства, вызывая снижение ее активности в стриатуме к 15 дню ПНР с последующим восстановлением до контрольных значений к 64 дню.
ВВЕДЕНИЕ
Расстройства аутистического спектра (РАС) представляют собой группу комплексных дезинтегративных нарушений психического развития, характеризующихся отсутствием способности к социальному взаимодействию, коммуникации, стереотипностью поведения, приводящим к социальной дезадаптации. На сегодняшний день среди различных гипотез патогенеза заболевания одними из основных являются нейрохимические гипотезы, которые рассматривают генез РАС как следствие нарушения формирования нейротрансмиттерных систем мозга в онтогенезе. В частности, выдвинута гипотеза о повреждающем действии дисбаланса возбуждающих (глутамат, аспартат) и тормозных (глицин) аминокислот на головной мозг в пренатальном развитии [1, 2]. Другая группа теорий рассматривает в качестве ключевого фактора формирования РАС нарушение онтогенетического развития моноаминергических систем мозга, в первую очередь серотонинергической [3]. По данным клинических исследований, у 30% (по некоторым данным, до 66%) от числа детей с диагностированным синдромом аутизма наблюдается существенное увеличение концентрации серотонина в плазме крови (гиперсеротонинемия). Функциональное состояние серотонинергической системы мозга зависит от скорости обратного захвата серотонина пресинаптическими нейронами, осуществляемого транспортером обратного захвата серотонина (СЕРТ) [4]. Генетически обусловленная высокая активность СЕРТ приводит к подавлению активности серотонинергической нейропередачи, проявляется повышенной агрессией и гиперактивностью [5, 6].
Данная информация послужила основанием для использования лекарственных средств, воздействующих на серотонинергическую систему, для лечения РАС [7]. Так, использование фенфлурамина, антидепрессанта, увеличивающего высвобождение серотонина и одновременно препятствующего обратному захвату, вызывало улучшение клинической картины у 30% пациентов с аутистическими расстройствами [8]. Рисперидон, антагонист серотониновых и дофаминовых рецепторов, также оказался эффективен в облегчении поведенческих симптомов аутизма, в том числе для снижения самоповреждений [9]. По данным Гориной и соавторов, у больных РАС в онтогенезе нарушается баланс моноаминергических нейромедиаторов серотонина, дофамина и норадреналина, особенно отчетливо это проявляется в возрасте 1 г. и 5 лет: в плазме крови наблюдается снижение содержания серотонина (в 4.9 раза), дофамина (в 2.8 раза) и норадреналина (в 1.2–1.4 раза). Развитие этих нарушений соответствует критическим периодам формирования различных структур головного мозга, что может приводить к проявлению симптомов аутизма [10, 11].
Целью данной работы являлось изучение изменений нейрохимических параметров мозга в онтогенезе мышей линии BALB/с в условиях введения вальпроата натрия (ВН) беременным самкам. Данная экспериментальная модель наиболее часто используется для моделирования РАС [12, 13]. Проводилось изучение состояния дофамин-, серотонин- и норадренергических систем в различных структурах мозга мышей-самцов линии BALB/с на 15, 42 и 64 день (соответственно Р15, Р42 и Р64) постнатального развития (ПНР) (т.е. вплоть до половозрелого состояния) контрольной группы (0.9% NaCl) и группы потомства самок, получавших ВН.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Животные. Опыты проведены на 31 самце мыши линии BALB/c массой тела 10–22 г, родительское поколение которых получено из питомника филиала “Столбовая” ФГБУН “Научный центр биомедицинских технологий ФМБА” (Россия), содержавшихся в условиях лабораторного вивария при 12-часовом световом режиме со свободным доступом к воде и стандартному корму. Для исключения влияния суточных биоритмов на скорость биосинтеза и метаболизма нейромедиаторов эксперименты проводили между 10 и 12 ч дня.
Препараты. Вальпроат натрия (ВН) вводили однократно, подкожно, в дозе 400 мг/кг самкам мышей на 12.5-й день беременности. Самки мышей, потомство которых составило контрольную группу, в эти же сроки получали физиологический раствор в эквивалентном объеме (0.1 мл на 10 г веса). Новорожденных мышат-самцов (31 особь: 14 контрольных и 17 пренатально получавших ВН) отлучали от самок на 21-е сутки жизни, рассаживая по 4–5 животных в клетку (43.5 × 27.5 × × 15.5 см).
Схема эксперимента. Животные были разделены на следующие экспериментальные группы (в скобках указано количество животных):
1. Контроль (потомство интактных самок, получавших физиологический раствор):
1а. Группа “Р15” (n = 4);
1б. Группа “Р42” (n = 6);
1в. Группа “Р64” (n = 4).
2. Опыт (потомство самок, получавших ВН):
2а. Группа “Р15” (n = 8);
2б. Группа “Р42” (n = 3);
2в. Группа “Р64” (n = 6).
Нейрохимические исследования. На 15, 42 или 64 день ПНР животных декапитировали, после чего структуры мозга (гипоталамус, стриатум и гиппокамп) извлекали на льду, замораживали в жидком азоте и взвешивали. Пробы хранили в жидком азоте. Перед экспериментами по определению содержания нейротрансмиттеров пробы размельчали в гомогенизаторе Поттера (тефлон–стекло) в 1 мл 0.1 N HСlO4 с добавлением 3,4-диоксибензиламина (0.5 нмоль/мл) в качестве внутреннего стандарта. Пробы центрифугировали при 10 000 g в течение 10 мин. Содержание моноаминов и их метаболитов (норадреналина (НА), дофамина (ДА), 3,4-диоксифенилуксусной кислоты (ДОФУК), гомованилиновой кислоты (ГВК), серотонина (5-окситриптамина, 5-ОТ) и 5-оксииндолуксусной кислоты (5-ОИУК)) определяли методом высокоэффективной жидкостной хроматографии с электрохимической детекцией (ВЭЖХ/ЭД) на хроматографе LC-304T (ВАS, США) с аналитической колонкой ReproSil-Pur ODS (C18, 100 × 4 мм, 3 мкм) (Dr.Maisch, Германия) при скорости элюции подвижной фазы 1.0 мл/мин и давлении до 200 атм. Мобильная фаза состояла из: 0.1 M цитратно-фосфатного буфера, содержащего 1.1 mM октансульфоновой кислоты, 0.1 mM ЭДТА и 9%-го ацетонитрила (pH 3.0). Измерение проводили с помощью электрохимического детектора LC-4B (BAS, США) на двойном стеклоугольном электроде (+0.85 V) против электрода сравнения Ag/AgCl. Регистрация образцов проводилась с применением аппаратно-программного комплекса “Мультихром” 1.5 (“Амперсенд”) [14]. Все использовавшиеся для анализа реактивы были высокой степени чистоты: о. с. ч. или analytical grade.
После проверки на нормальность распределения по критерию Шапиро–Уилка достоверность отличий между группами определяли методом двухфакторного дисперсионного анализа (АNOVA) с последующим post-hoc тестом Ньюмана–Кейлса, используя в качестве анализируемых факторов возраст животных и используемые вещества (GraphPad Prizm 8.0, GraphPad Software, Inc. США).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
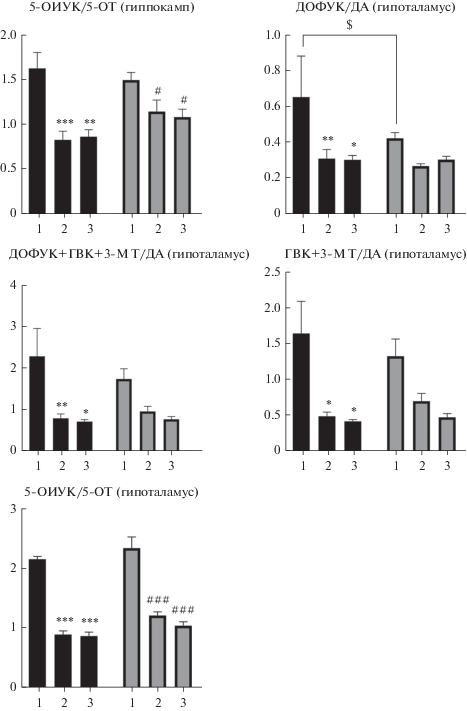
Было показано, что на 15 и 42 сут ПНР нейрохимический профиль структур мозга существенно отличается от показателей зрелых животных возрастом 64 дня, при этом отличия носили разнонаправленный характер. Так, показатели метаболизма ДА-ДОФУК/ДА, ГВК + 3-МТ/ДА и ДОФУК + ГВК + 3-МТ/ДА в гипоталамусе были существенно выше, чем у взрослых (64 дней) животных (на 100–150%), и снижались с увеличением возраста животных, что говорит об активации скорости метаболизма и сдвиге баланса в сторону накопления нейротрансмиттера по мере созревания мозга (рис. 1). Показатель скорости утилизации серотонина – 5-ОИУК/5-ОТ – в той же структуре был ниже в группах “Р42” и “Р64” по сравнению с тем же параметром 15-дневных животных. Интересно отметить, что показатели указанных групп практически не отличались друг от друга, что может свидетельствовать о созревании серотонинергической системы гипоталамуса к 42-му дню. Сходный паттерн развития последней отмечался и в гиппокампе (рис. 1).
Рис. 1.
Динамика изменения метаболизма моноаминов в гиппокампе и гипоталамусе мышей линии BALB/C, матерям которых вводили вальпроат натрия (400 мг/кг, п/к). Черный цвет – контроль. Серый цвет – вальпроат натрия. Цифрами обозначен возраст животных: 1 – 15 дней; 2 – 42 дня; 3 – 64 дня. *; **; *** р < 0.05; <0.01; <0.001 по сравнению с контролем (15 дней). #; ##; ### р < 0.05; <0.01; <0.001 по сравнению с вальпроатом натрия (15 дней). ^; ^^; ^^^ р < 0.05; <0.01; <0.001 по сравнению с вальпроатом натрия (42 дней). $; $$; $$$ р < 0.05; <0.01; <0.001 по сравнению с контролем той же возрастной группы.
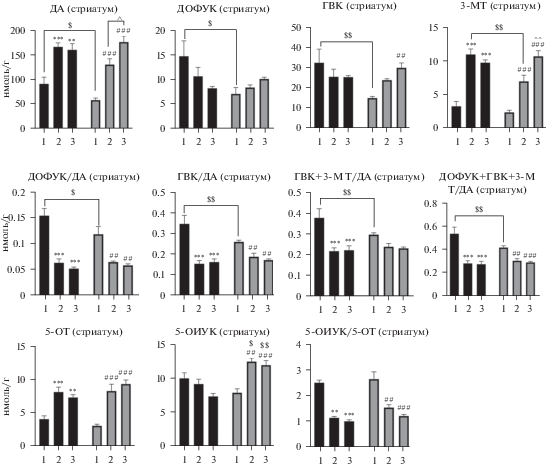
Наиболее динамичное онтогенетическое развитие нейротрансмиттерных систем наблюдалось в стриатуме. Так, содержание ДА в этой структуре выросло почти в 2 раза в период с 15 по 42 сут ПНР, после чего уже к 64 дню развитие практически не изменялось (рис. 2). При этом содержание ДОФУК с 15 по 64 день плавно снижалось. Уровень ГВК сокращался похожим образом, но после 42 дня изменений уже не наблюдалось. Напротив, концентрация 3-МТ к 42 дню ПНР резко возросла (с 3.75 до 11.5 нмоль/г), а к 64 дню она незначительно снизилась. Динамика изменений всех показателей метаболизма ДА (ДОФУК/ДА, ГВК/ДА, ГВК + 3-МТ/ДА и ДОФУК + ГВК + 3-МТ/ДА) имела сходный паттерн – максимальное снижение в период с 15 по 42 сут онтогенеза, затем более плавное уменьшение к 64 дню. Показатель скорости утилизации серотонина изменялся по той же схеме.
Рис. 2.
Динамика изменения содержания моноаминов и их метаболитов (нмоль/г ткани) в стриатуме мышей линии BALB/C, матерям которых вводили вальпроат натрия (400 мг/кг, п/к). Черный цвет – контроль. Серый цвет – вальпроат натрия. Цифрами обозначен возраст животных: 1 – 15 дней; 2 – 42 дня; 3 – 64 дня. *; **; *** р < 0.05; <0.01; <0.001 по сравнению с контролем (15 дней). #; ##; ### р < 0.05; <0.01; <0.001 по сравнению с вальпроатом натрия (15 дней). ^; ^^; ^^^ р < 0.05; <0.01; <0.001 по сравнению с вальпроатом натрия (42 дней). $; $$; $$$ р < 0.05; <0.01; <0.001 по сравнению с контролем той же возрастной группы.
Иная картина онтогенетических изменений нейрохимических параметров структур мозга наблюдалась в группе мышей, матерям которых на 12.5 сут беременности вводили ВН. В гипоталамусе ВН практически не влиял на показатели ДА-ергической системы, за исключением параметра ДОФУК/ДА группы “Р15”, который был более низким по сравнению с контролем. Показатель метаболизма серотонина 5-ОИУК/5-ОТ постепенно снижался с 15 по 42 сут ПНР. Подобное снижение этого параметра наблюдалось и в другой структуре – гиппокампе (рис. 1).
ВН в стриатуме вызывал достоверное снижение уровня ДА у мышат на 15 день ПНР по сравнению с контролем, при этом паттерн увеличения содержания этого нейротрансмиттера в этот период был более плавным, чем на 42 и 64 сут ПНР (рис. 2). Интересно отметить, что уровни ДОФУК и ГВК в той же структуре были также ниже соответствующих значений контрольной группы, при этом достоверно различались лишь показатели на 15 сут ПНР. Профиль изменения прочих показателей ДА-ергической передачи (ДОФУК/ДА, ГВК/ДА, ГВК + 3-МТ/ДА и ДОФУК + ГВК + 3‑МТ/ДА) не отличался от динамики изменений в группах контрольных мышей, при этом четко прослеживаются отличия на уровне 15 сут ПНР. Паттерн онтогенетических изменений концентраций 5-ОТ, 5-ОИУК и показателя 5-ОИУК/5-ОТ не отличался от динамики развития контрольной группы значений, при этом максимальные различия по всем указанным параметрам отмечались на 64 ПНР, когда содержание 5-ОТ и 5-ОИУК возрастало на 20–30% (рис. 2).
Полученные результаты свидетельствуют о том, что уровень как катехоламинов, так и серотонина в структурах мозга мышат в возрасте 15 сут существенно ниже, чем у взрослых животных (64 дня ПНР). Как известно, созревание моноаминергических систем мозга крысиного плода происходит начиная с третьего триместра беременности и охватывает первые три недели постнатального периода [15]. У крыс содержание моноаминов в центральной нервной системе при рождении составляет 8–12% от концентрации у взрослых особей [16–18]. Уровень ДА в мозге к 2-недельному возрасту соответствует примерно 50% от содержания у взрослых. К 4-недельному возрасту содержание ДА находится в пределах от 80 до 100% от значений этого параметра у взрослых крыс. Наблюдавшееся нами увеличение показателей метаболических характеристик ДА-ергической системы на 15 день ПНР можно объяснить недостаточной регуляторной активностью Д2 ауторецепторов в этом возрасте. То же самое можно отнести и к серотониновой системе. Показано, что плотность Д2-рецепторов при рождении колеблется в диапазоне 5–18% от плотности у взрослых [19], к концу первой недели жизни возрастает до 25–45% и к концу 2 нед. жизни достигает значений концентрации у взрослых особей [20, 21].
Введение ВН (400 мг/кг, п/к) на 12.5 день гестации самкам мышей не вызывало значительных изменений в структурах мозга потомства на 15 сут ПНР, за исключением стриатума, в котором отмечалось снижение величины всех параметров моноаминергической нейропередачи. Отличие в метаболитической активности от соответствующей контрольной группы, возможно, связано со снижением активности тирозингидроксилазы – фермента, лимитирующего скорость синтеза ДА под влиянием ВН. В дальнейшем, к 42 сут ПНР, общий паттерн изменения концентраций нейротрансмиттеров не отличался от динамики созревания нейротрансмиттерных систем контрольной группы соответствующей стадии ПНР. Исключение составляла только концентрация серотонина и его метаболита в стриатуме, которая превышала аналогичный показатель группы “Р42” контроля. К 64 дню уровни 5-ОТ и 5-ОИУК в группе мышей, получавших ВН, также были выше величин этих параметров в стриатуме мышей контрольной группы. Уровень катехоламиновых нейротрансмиттеров изменялся в онтогенетическом развитии значительно медленнее, при этом существенных отличий параметров мышей групп, пренатально получавших ВН, от показателей контроля не наблюдалось, за исключением содержания ДА, значительно возросшего в стриатуме в период с 42 по 64 день, тогда как в группе контроля уровень ДА в этот промежуток времени увеличивался более плавно.
Таким образом, полученные нами данные позволяют предполагать, что введение ВН беременным самкам отражается, в первую очередь, на функциональном состоянии дофаминергической системы мозга потомства, вызывая снижение ее активности в стриатуме к 15 сут ПНР. В дальнейшем уровень ДА компенсируется и к 64 сут не отличается от показателей контрольной группы. Параметры серотонинергической системы изменяются по сходной схеме, однако содержание 5-ОТ достигало максимума к 42 дню с последующим небольшим снижением к 64 дню, тогда как уровень 5-ОИУК в стриатуме увеличивался постепенно, и максимальные отличия наблюдались к 64 дню ПНР, т.е. к возрасту половой зрелости.
Следует отметить, что бóльшая часть существующих публикаций, посвященных исследованию вальпроатной модели аутизма, касается либо изучения электрофизиологических параметров нейронов [22], либо определения содержания нейротрансмиттеров в микродиализных образцах [23]. Комплексное изучение влияния ВН на содержание моноаминов и их метаболитов в различных структурах мозга до настоящего времени практически не проводилось. Однако сравнительно недавно появился ряд работ, выполненных коллективом Hara и соавторов, посвященных изучению влияния ВН на параметры ДА-ергической нейропередачи [24]. Если на первых этапах исследования эффекты ВН на содержание ДА, НА и 5-ОТ в ПФК и стриатуме не наблюдались [25], то в дальнейшем ими было продемонстрировано снижение активности ДА-ергической системы префронтальной коры в условиях данной модели [26]. При этом было обнаружено, что как острое, так и хроническое введение атипичных нейролептиков рисперидона и арипразола потомству самок, которым вводили ВН, вызывает ослабление социальной изоляции на поведенческом уровне, а также увеличение внеклеточного содержания ДА и возрастание экспрессии гена C-fos в префронтальной коре [27]. В то же время влияние ВН на динамику изменений активности нейротрансмиттерных систем мозга в онтогенезе практически до настоящего времени не изучалось. Только недавно (6.2020) появилась работа Adam et al., посвященная иммуноцитохимическому и морфологическому гистохимическому изучению состояния дофаминергической системы мозга потомства самок мышей возрастом 7 дней, получавших ВН [28]. При этом было показано отсутствие каких-либо изменений содержания ДА в структурах нигростриарной системы (вентральная область покрышки, дорсолатеральный стриатум) при существенном уменьшении количества дофаминсодержащих нейронов в образованиях, относящихся к мезолимбической системе (прилежащее ядро). По всей видимости, срок между 7 и 15 днями ПНР является ключевым для проявления изменений активности стриатной дофаминергической системы, вызванной ВН.
Таким образом, результаты наших экспериментов представляют определенный интерес и могут использоваться для разработки стратегии фармакотерапии аутистических расстройств.
Список литературы
Moreno-Fuenmayor H., Borjas L., Arrieta A., Valera V., Socorro-Candanoza L. // Invest Clin.1996. V. 37. № 2. P. 113–28.
Shimmura C., Suda S., Tsuchiya K.J., Hashimoto K., Ohno K., Matsuzaki H., Iwata K., Matsumoto K., Wakuda T., Kameno Y., Suzuki K., Tsujii M., Nakamura K., Takei N., Mori N. // PLoS One. 2011. V. 6. № 10. P. E25340.
Adamsen D., Meili D., Blau N., Thöny B., Ramaekers V. // Mol. Genet. Metab. 2011. V. 102. № 3. P. 368–73.
Devlin B., Cook E.H. Jr., Coon H., Dawson G., Grigorenko E.L., McMahon W., Minshew N., Pauls D., Smith M., Spence M.A., Rodier P.M., Stodgell C., Schellenberg G.D. // Mol. Psychiatry. 2005. V. 10. № 12. P. 1110–1116.
Kistner-Griffin E., Brune C.W., Davis L.K., Sutcliffe J.S., Cox N.J., Cook E.H. Jr. // Am. J. Med.Genet. B (Neuropsychiatr. Genet.). 2011. V. 156. № 2. P. 139–144.
Margoob M.A., Mushtaq D. // Indian J. Psychiatry. 2011. V. 53. № 4. P. 289–299.
Castelli M., Nigrelli D., Gorina A.S., Laumonnier F., Bertolino G. // Rivista di Psichiatria. 2000. V. 40. № 5. P. 39–44.
Aman M.G., Kern R.A. // J. Am. Acad. Child. Adolesc. Psychiatry. 1989. V. 28. P. 549–565.
Martineau J., Barthelemy C., Jouve J., Muh J.P., Lelord G. // Dev. Med. Child. Neurol. 1992. V. 34. № 7. P. 593–603.
Горина А.С., Колесниченко Л.С. // Международн. Журн. по иммунореабилитации. 1999. № 5. С. 119–123.
Горина А.С., Колесниченко Л.С., Михнович В.И. // Биомед. Химия. 2011. Т. 57. № 5. С. 562–570.
Narita N., Kato M., Tazoe M., Miyazaki K., Narita M., Okado N. // Pediatr. Res. 2002. V. 52. № 4. P. 576–579.
Bossu J.L., Roux S. // Med Sci (Paris). 2019. V. 35. № 3. P. 236–243.
Lee T., Gorzalka B. // Neurosci. 2012. V. 204. P. 17–30.
Надорова А.В., Колик Л.Г., Клодт П.М., Наркевич В.Б., Наплекова П.Л., Козловская М.М., Кудрин В.С., Середенин С.Б. // Нейрохимия. 2014. Т. 31. № 2. С. 1–7.
Druse M.J., Tajuddin N., Kuo A. // J. Neurosci. Res. 1990. V. 27. № 2. P. 233–240.
Herrregodts P., Velkeniers B., Ebinger G., Michotte Y., Vanhaelst L., Hooghe-Peters E. // J. Neurochem. 1990. № 55. P. 774–779.
Lajtha N.S. // In: Handbook of Neurochemistry and Molecular Neurobiology. 3rd ed. / Eds. Lajtha N.S., Johnson A., Dianna A. N.Y., 2007.
Brady S. // In: Basic Neurochemistry Principles of Molecular, Cellular, and Medical Neurobiology. 8th Ed. / Eds. Brady S., Siegel G., Wayne Albers R., Price D. Oxford, 2012.
Jung A.B., Bennett J.P. // Dev. Brain Res. 1996. № 94. P. 109–120.
Schambra U.B., Duncan G.E., Breese G.R., Fornaretto M.G., Caron M.G., Fremeau R.T. Jr. // J. Neurosci. 1994. V. 62. № 1. P. 65–85.
Antonopoulos J., Dori I., Dinopoulos A., Chiotelli M., Parnavelas J.G. // Neurosci. 2002. V. 110. № 2. P. 245–256.
Brumback A.C., Ellwood I.T., Kjaerby C., Iafrati J., Ro-binson S., Lee A.T., Patel T., Nagaraj S., Davatolhagh F., Sohal V.S. // Mol. Psychiatry. 2018. V. 23. № 10. P. 2078–2089.
Nakasato A., Nakatani Y., Seki Y., Tsujino N., Umino M., Arita H. // Brain Res. 2008. V. 1193. P. 128–135.
Hara Y. // Yakugaku Zasshi. 2019. V. 139. № 11. P. 1391–1396.
Hara Y., Takuma K., Takano E., Katashiba K., Taruta A., Higashino K., Hashimoto H., Ago Y., Matsuda T. // Behav. Brain Res. 2015. V. 289. P. 39–47.
Hara Y., Ago Y., Taruta A., Hasebe Sh., Kawase H., Tanabe W., Tsukada Sh. // Psychopharmacol. (Berlin). 2017. V. 234. P. 3217–3228.
Adam A., Kemecsei R., Company V., Murcia-Ramon R., Juarez I., Gerecsei L.I., Zachar G., Echevarria D., Puelles E., Martinez S., Csillag A. // Front. Neuroanat. 2020.
Дополнительные материалы отсутствуют.


