Нейрохимия, 2021, T. 38, № 1, стр. 88-96
Биохимические маркеры нарушений обмена фолатов при шизофрении в российской выборке
И. В. Семеннов 1, А. С. Пятойкина 2, Я. С. Загряжская 2, Г. В. Рукавишников 3, Е. Д. Касьянов 3, Т. В. Жиляева 1, А. С. Благонравова 1, Г. Э. Мазо 3
1 ФГБОУ ВО “Приволжский исследовательский медицинский университет”
Минздрава России
Нижний Новгород, Россия
2 ГБУЗ НО “Клиническая психиатрическая больница № 1 г. Н. Новгорода”
Нижний Новгород, Россия
3 ФГБУ “Национальный медицинский исследовательский центр психиатрии и неврологии им. В.М. Бехтерева” Минздрава России
Санкт-Петербург, Россия
Поступила в редакцию 15.06.2020
После доработки 18.08.2020
Принята к публикации 21.08.2020
Аннотация
В ряде зарубежных исследований показано, что при шизофрении чаще, чем в общей популяции, отмечается гипергомоцистеинемия. С одной стороны, она может быть интегральным маркером нарушений обмена фолатов (в результате дефицита витаминов и/или генетической предрасположенности), а с другой стороны – может быть вовлечена в патогенез заболевания посредством нескольких возможных молекулярных механизмов. В России аналогичных исследований не проводилось, кроме того, имеются противоречивые результаты исследований о генетических факторах, вовлеченных в обмен фолатов и гомоцистеина при шизофрении. Цель данного исследования – оценить ассоциацию уровня гомоцистеина, фолатов и кобаламина сыворотки крови с шизофренией в Европейской части России (Нижегородский регион). Для этого случайным образом было отобрано 50 пациентов с шизофренией и 36 здоровых добровольцев, у которых было проведено биохимическое исследование уровней гомоцистеина, фолатов и кобаламина (В12) сыворотки крови. Концентрацию гомоцистеина измеряли на анализаторе Сobas (Roche Diagnostics) с использованием ферментативного анализа. Определение содержания фолатов и витамина В12 проводили методом хемилюминесцентного иммуноанализа на микрочастицах (Architect, Abbott lab. S.A.). В результате установлено, что у пациентов уровень гомоцистеина достоверно выше, чем в группе контроля (р = 0.0041), а фолатов – достоверно ниже (p = 0.0072). Уровень гомоцистеина у пациентов изученной выборки имеет слабую отрицательную статистически значимую корреляцию как с уровнем фолатов (ρ = –0,38; p = 0.0063), так и с уровнем В12 (ρ = –0.36; p = 0.0082). Гомоцистеин значимо выше у мужчин, чем у женщин, во всей изученной выборке (Z = –2.1068, p = 0.0351), а также в подгруппах пациентов (Z = –2.11; p = = 0.035) и здоровых (z = 3.4; p = 0.00067). Полученные данные говорят о необходимости дальнейшего изучения гипергомоцистеинемии и других биохимических маркеров нарушений обмена фолатов при шизофрении в Российской популяции и разработки путей их коррекции для оптимизации терапии этого психического расстройства.
АКТУАЛЬНОСТЬ
В настоящее время патогенез шизофрении остается предметом широкого изучения. Одно из наиболее актуальных направлений исследований – поиск и изучение биохимических показателей (биомаркеров), ассоциированных с развитием шизофрении и отдельными ее фенотипическими проявлениями, которые могут быть использованы не только как диагностические маркеры, но и как мишень для персонифицированной терапии.
С этих позиций интерес представляет гомоцистеин – аминокислота, являющаяся продуктом деметилирования другой аминокислоты метионина, задействованной в большом количестве биологически важных процессов. Гипергомоцистеинемия – интегральный биохимический маркер нарушений одноуглеродного метаболизма – отражает и экзогенные (алиментарный дефицит фолатов и/или кобаламина), и эндогенные (генетические) их причины при шизофрении: в обширных мета-анализах показана ассоциация с шизофренией дефицита фолатов плазмы (N = 3700) [1], а также генетических маркеров нарушений обмена фолатов (N = 23441) [2].
В 1994 г. Regland et al. описали случай шизофрении у 27-летней женщины, ассоциированный с низкой активностью фермента метилентетрагидрофолатредуктазы (MTHFR) и повышением уровня гомоцистеина плазмы [3]. Затем Regland et al. (1995) сообщили, что 45% пациентов с шизофренией, которых они обследовали, имеют гипергомоцистеинемию, не связанную с психофармакотерапией или дефицитом в питании фолатов и кобаламина [4], что свидетельствовало о вкладе генетических факторов.
В дальнейшем в многочисленных исследованиях в разных странах было показано, что среди больных шизофренией гипергомоцистеинемия встречается чаще, чем в общей популяции [5–7]. Согласно мета-анализу Muntjewerff et al. (2006) превышение уровня гомоцистеина плазмы на 5 мкмоль/л повышает вероятность шизофрении на 70% [8]. Petronijević et al. (2008) показали, что у пациентов при поступлении в стационар при экзацербации шизофрении уровень гомоцистеина значимо выше, чем в группе контроля, а уровень фолатов и кобаламина от контроля не отличается. Причем уровень гомоцистеина коррелировал с выраженностью негативной симптоматики. У всех пациентов через месяц лечения в период стабилизации состояния уровень гомоцистеина заметно снизился (2.68 ± 1.57 мкмоль/л), но корреляция с выраженностью негативной симптоматики по-прежнему сохранялась (пациенты не получали витамины дополнительно к терапии) [9]. Согласно Mabrouk et al. (2011), среди пациентов с шизофренией уровень гомоцистеина выше, чем в контроле независимо от формы заболевания, возраста и пола больных [10]. Поэтому, согласно авторам, гомоцистеин может иметь отношение к патофизиологическим аспектам шизофрении. К настоящему времени получены обширные мета-анализы, согласно которым гипергомоцистеинемия имеет каузальную связь с шизофренией (N = 25 599) [11].
По данным Kim, Moon (2011), среди женщин с шизофренией гипергомоцистеинемия отмечалась в 33.8% случаев, среди мужчин – в 51.5% [12]. Похожие данные получили Levine et al. (2005): в популяции больных шизофренией и биполярным расстройством уровень гомоцистеина оказался значительно выше, чем среди здорового контроля, и практически полностью за счет молодых пациентов-мужчин [13].
Интересно, что данные о генетических маркерах нарушений обмена фолатов при шизофрении в России остаются противоречивыми [14, 15], возможно в связи с географическими, этническими и методологическими различиями проведенных до настоящего времени исследований, что говорит об актуальности продолжения изучения этой темы в России, необходимости проведения дополнительных исследований и мета-анализов.
Избыток гомоцистеина участвует в процессах оксидативного стресса, оказывает негативное воздействие на глутаматергическую систему, влияет на эндотелий кровеносных сосудов [16, 17]. Важным аспектом изучения данной темы является то, что гипергомоцистеинемия ассоциирована с широким спектром соматических заболеваний (сердечно-сосудистых, метаболических) [18–20], что может вносить вклад в высокую коморбидность шизофрении с этим кругом расстройств, влиять на формирование метаболических осложнений лечения и продолжительность жизни пациентов. При гипергомоцистеинемии повреждения, схожие с атеросклеротическими, могут проявляться даже в молодом возрасте и при отсутствии высокого уровня ЛПНП (липопротеинов низкой плотности) [20].
Публикаций об ассоциации гипергомоцистеинемии с шизофренией в Российской популяции не встречается. Согласно данным литературы, в России дефицит фолатов – один из наиболее распространенных гиповитаминозов (более 50% населения) [21], который может приводить к гипергомоцистеинемии, особенно при наличии полиморфных аллелей в генах ферментов фолатного цикла, что требует специального изучения.
Особенно актуально изучение гипергомоцистеинемии в связи с тем, что она поддается коррекции, поэтому ее гипотетическое патогенетическое воздействие на ЦНС и другие системы организма может компенсироваться, что может благоприятно отразиться на течении заболевания.
Цель данного исследования – оценить ассоциацию уровня гомоцистеина, фолатов и кобаламина сыворотки крови с шизофренией в Европейской части России (Нижегородский регион).
МАТЕРИАЛЫ И МЕТОДЫ
Методом сплошной выборки было обследовано 50 пациентов и 36 здоровых добровольцев. Критериями включения пациентов в исследование были: подтверждение диагноза шизофрении с помощью структурированного клинического диагностического “Международного нейропсихиатрического интервью” Диагностического и статистического руководства 5-й версии (Mini International Neuropsychiatric Interview, MINI для DSM-5); способность пациента дать осознанное добровольное информированное согласие на участие в исследовании; отсутствие хронических соматических заболеваний и неврологических расстройств, ассоциированных с воспалением, оксидативным стрессом, гипергомоцистеинемией, нарушениями обмена фолатов, фенилаланина; отсутствие приема витаминов, противовоспалительных средств, антиоксидантов в течение месяца до включения в исследование. Критериями включения здоровых добровольцев в исследование являлись: отсутствие зарегистрированных ранее на протяжении жизни психических расстройств (здоровый доброволец не наблюдается у психиатра и ранее не обращался к психиатрам по поводу проблем с психическим здоровьем), социальной дезадаптации, злоупотребления психоактивными веществами; соответствие по полу и возрасту пациентам, включенным в исследование; отсутствие хронических соматических заболеваний и неврологических расстройств, ассоциированных с воспалением, оксидативным стрессом, гипергомоцистеинемией, нарушениями обмена фолатов, фенилаланина; отсутствие приема витаминов, противовоспалительных средств, антиоксидантов в течение месяца до включения в исследование.
Как видно из табл. 1, по социодемографическим показателям выборки пациентов и здоровых добровольцев сопоставимы. Все участники исследования – постоянные жители Нижегородской области. Обследование пациентов осуществлялось в период с апреля 2019 г. по февраль 2020 г., здоровых добровольцев – с сентября 2019 по февраль 2020 г.
Таблица 1.
Демографическая характеристика изученных выборок
| Показатель | Пациенты, n = 50 | Здоровые, n = 36 | Р |
|---|---|---|---|
| Женщины : мужчины, абс. | 24 : 26 | 21 : 15 | χ2 = 0.53; p = 0.47 |
| Возраст, Me [Q1; Q3]/[Min; Max] лет | 29 [22; 33 ] /[18; 54 ] | 25 [22; 32 ] /[19; 58 ] | Z = –0.48; p = 0.63 |
Примечание: уровень значимости различий оценивался с помощью таблиц сопряженности (критерий χ2 с поправкой Йетса) и критерия Манна–Уитни (Z), распределение выборки по возрасту отличалось от нормального (тест Шапиро–Уилка: W = = 0.90; p = 0.0001); Me [Q1; Q3] – медиана, межквартильный размах, Min – минимальное значение, Max – максимальное значение.
Средняя длительность заболевания с момента манифестации у пациентов составила 21.5 ± 2.8 мес. (М ± SE), все они получали антипсихотическую терапию: 12 человек в отделениях дневного пребывания, 36 стационарно и 2 в амбулаторных условиях. 17 пациентов получали антипсихотики 1-го поколения, 33 – 2-го поколения. У одной пациентки была комбинированная терапия 2 антипсихотиками 2-го поколения (арипипразол + кветиапин), остальные получали монотерапию. Пациенты изученной выборки не получали антиконвульсанты, метотрексат и другие антагонисты фолатов.
Забор венозной крови осуществлялся строго натощак в утренние часы из локтевой вены, материалом для биохимических исследований служила сыворотка. Концентрация гомоцистеина измерялась на анализаторе Сobas (Roche Diagnostics) с использованием ферментативного анализа. Была исследована сыворотка крови 50 пациентов с диагнозом шизофрения и 36 здоровых добровольцев. Определение содержания фолатов (фолиевой кислоты) и кобаламина (далее В12) проводили методом хемилюминесцентного иммуноанализа на микрочастицах (Architect, Abbott lab. S.A.). Концентрацию гомоцистеина измеряли на анализаторе Сobas (Roche Diagnostics). Использовался ферментативный анализ. Лабораторные исследования выполнены на базе Централизованной лаборатории “АВК-Мед”.
Статистическая обработка полученных данных проводилась с использованием программы Statistica 6.0. Проверка нормальности распределения осуществлялась с помощью критерия Шапиро–Уилка. Распределение полученных данных отличалось от нормального, поэтому при сравнении групп использовался непараметрический критерий Манна–Уитни; при анализе таблиц сопряженности – критерий χ2 с поправкой Йетса на непрерывность, для оценки корреляции между биохимическими параметрами использовался критерий ранговой корреляции Спирмена (ρ). Данные представлены с использованием показателей среднее арифметическое ± стандартное отклонение (m ± σ), медиана и межквартильный размах (Me [Q1; Q3]). Различия считались статистически значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Распределения полученных данных биохимических исследований образцов пациентов и контрольной группы отличались от нормального (критерий Шапиро–Уилка для для уровней гомоцистеина W = 0.65, р < 0.0001; фолатов W = 0.88, p < 0.0001; В12 W = 0.89, р < 0.0001); в связи с этим для дальнейшего анализа этих данных применялись непараметрические критерии.
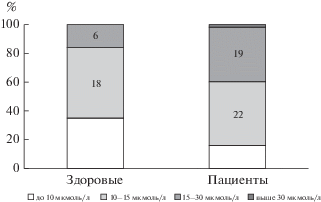
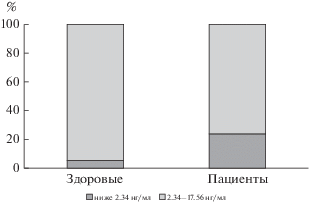
Как видно из табл. 2, уровень фолатов у пациентов статистически значимо ниже, а уровень гомоцистеина – статистически значимо выше, чем у здоровых. Среди пациентов с гипергомоцистеинемией (выше 10 мкмоль/л, n = 42) у 11 (26%) фолаты были ниже референсных значений, у 31 – в пределах нормы.
Таблица 2.
Результаты биохимических исследований в группах пациентов и здорового контроля
| Показатель (в сыворотке) |
Пациенты, n = 50 |
Здоровые, n = 36 |
Критерий Манна–Уитни;
Р/Benjamini- Hohberg Adjusted P |
|---|---|---|---|
| Гомоцистеин, мкмоль/л:
m ± σ; Me [Q1; Q3] |
15.58 ± 8.52; 13.65 [11.06; 17.47] | 12.01 ± 4.33; 11.21 [9.29; 12.96] |
z = –2.99; p = 0.0027/p = 0.0041 |
| Фолаты, нг/мл:
m ± σ, Me [Q1; Q3] |
3.79 ± 2.17; 3.30 [2.40; 4.30 ] |
4.66 ± 1.76; 4.40 [3.50; 5.40 ] |
z = 3.03; p = 0.0024/p = 0.0072 |
| В12, пг/мл: m ± σ, Me [Q1; Q3] |
333.48 ± 159.07; 281.00 [220.00; 440.00] |
291.78 ± 89.98; 263.50 [227.00; 359.50] |
z = –0.63; p = 0.53/p = 0.53 |
Уровень гомоцистеина у пациентов изученной выборки имеет слабую отрицательную статистически значимую корреляцию как с уровнем фолатов (ρ = –0.38; p = 0.0063), так и с уровнем В12 (ρ = –0.36; p = 0.0082). У здоровых добровольцев отмечается слабая отрицательная статистически значимая корреляция с уровнем В12 (ρ = –0.39; p = 0.016), при этом очень слабая отрицательная и статистически не значимая – с уровнем фолатов (ρ = –0,27; p = 0.10).
Гомоцистеин значимо выше у мужчин, чем у женщин во всей изученной выборке (Z = –2.1068, p = 0.0351), как видно из табл. 3, и у пациентов, и у здоровых добровольцев, причем у здоровых различия более выраженные несмотря на малый объем выборки. Кроме того, различия по уровню В12 в выборке здоровых между мужчинами и женщинами приближаются к границе статистической значимости. При проведении дополнительного анализа выявлено, что статистически значимые различия между пациентами и здоровыми по уровню фолатов и гомоцистеина выявлены только внутри подгруппы женщин (Z = –2.6742, p = = 0.0074 и Z = –2.0590, p = 0.0395 соответственно), но не мужчин.
Таблица 3.
Результаты биохимических исследований у мужчин и женщин в подгруппах пациентов и здорового контроля
| Показатель (сыворотка) | Пациенты, n = 50 | Z; P | Здоровые, n = 36 | Z; Р | ||
|---|---|---|---|---|---|---|
| М (n = 26) | Ж (n = 24) | М (n = 15) | Ж (n = 21) | |||
| Гомоцистеин, мкмоль/л: Me [Q1; Q3] |
14.4 [12.8; 18.1 ] |
12.1 [9.5; 17.0] |
Z = –2.11; p = 0.035 | 13.6 [11.3; 16.2 ] |
9.9 [9.0; 11.8] |
z = 3.4; p = 0.00067 |
| Фолаты, нг/мл: Me [Q1; Q3] |
3.3 [2.6; 4.3 ] |
3,1 [2.2; 4.3 ] |
Z = –0.53; p = 0.59 | 3.9 [3.4; 5.1 ] |
4.6 [3.8; 6.5 ] |
z = –1.6; p = 0.11 |
| В12, пг/мл: Me [Q1; Q3] |
276 [193; 382] |
292.5 [237; 451] |
Z = 0.94; p = 0.35 | 247.5 [213.5; 279.5] |
302 [241; 372] |
z = –1.9; p = 0.055 |
Согласно оценке значения коэффициента корреляции, у пациентов ассоциация длительности заболевания с уровнем фолатов (ρ = –0.045; p = 0.76), гомоцистеина (ρ = 0.18; p = 0.22) и В12 (ρ = –0.061; p = 0.67) практически отсутствует.
Отмечается слабая статистически значимая обратная корреляция уровня фолатов с возрастом пациентов (ρ = –0.32; p = 0.024), при этом связь уровня гомоцистеина (ρ = 0.056; p = 0.70) и В12 (ρ = –0.021; p = 0.88) у пациентов с возрастом практически отсутствует. У здоровых добровольцев связь всех изученных биохимических показателей с возрастом практически отсутствует (для фолатов ρ = 0.028; p = 0.87; для гомоцистеина ρ = = 0.11; p = 0.51; для В12 ρ = –0.093; p = 0.58).
ОБСУЖДЕНИЕ
В исследовании получены результаты о повышенном уровне гомоцистеина в сыворотке крови у пациентов с шизофренией, что согласуется с данными аналогичных зарубежных исследований [4–13] и может свидетельствовать о роли гипергомоцистеинемии в патогенезе шизофрении и в российской популяции пациентов. Наличие статистически значимых отрицательных корреляций уровня гомоцистеина у пациентов с уровнями фолатов и В12 отражает известные представления о том, что гомоцистеин является интегральным биохимическим маркером нарушений одноуглеродного метаболизма независимо от их причины.
В подавляющей части случаев у пациентов наблюдается низкий уровень фолатов (в нижнем квартиле разброса данных) и одновременно гипергомоцистеинемия, и у 11 из 42 (26%) пациентов с гипергомоцистеинемией уровень фолатов был ниже референсных значений. При этом у пациентов с уровнем фолатов ниже референсных значений средний уровень гомоцистеина 21.38 ± ± 4.24 мкмоль/л (М ± SE, здесь и далее – среднее ± ± стандартная ошибка среднего), у пациентов с нормальным уровнем фолатов – 13.74 ± 0.68 мкмоль/л (М ± SE). Это говорит о том, что в достаточно большой доле случаев гипергомоцистеинемия у пациентов с шизофренией в российской популяции обусловлена либо экзогенным дефицитом фолатов (например, связанным с их дефицитом в пище), либо нарушениями всасывания фолатов из пищи в кишечнике (известны генетические факторы, предрасполагающие к нарушениям утилизации фолатов из кишечника).
У ряда пациентов с гипергомоцистеинемией фолаты сыворотки были не только в пределах нормы, но в средних и даже высшем квартиле распределения данных в выборке. При этом среди пациентов с гипергомоцистеинемией и нормальным уровнем фолатов средний уровень В12 также выше (335.5 ± 26.6 пг/мл, М ± SE), чем среди пациентов с низким уровнем фолатов (средний уровень В12 – 261.3 ± 43.0 пг/мл, М ± SE). Таким образом, можно говорить об аддитивном эффекте дефицита этих двух витаминов у одних и тех же пациентов. Кроме того, это соответствует полученным ранее сведениям о высокой распространенности среди пациентов с шизофренией низкофункциональных аллелей SNP ключевых ферментов фолатного цикла, способствующих развитию гипергомоцистеинемии даже при достаточном поступлении с пищей и нормальных концентрациях в сыворотке фолатов и В12 [15, 22]. Можно предположить носительство этих низкофункциональных аллелей у пациентов изученной выборки с гипергомоцистеинемией и нормальной концентрацией витаминов в сыворотке, что требует дальнейшего изучения.
Учитывая имеющиеся в литературе данные о том, что гомоцистеин может участвовать в патогенезе шизофрении посредством нескольких (альтернативных или дополняющих друг друга) механизмов [23], требуются дальнейшие исследования об ассоциации гипергомоцистеинемии при шизофрении с показателями окислительного стресса, эндотелиальной дисфункции, нейровоспаления. До сих пор клинически не подтверждено, является ли гипергомоцистеинемия при шизофрении патогенетическим механизмом или является лишь артефактом, отражающим дефицит фолатов и ассоциированные с ним дефициты тетрагидробиоптерина и метионина (которые, в частности, могут приводить к дефициту синтеза дофамина и другим нейрохимическим нарушениям) [3. 23].
Одним из важных аспектов нарушений фолатного обмена при шизофрении является то, что воспалительные и окислительные процессы, ассоциированные с гипергомоцистеинемией, могут быть вовлечены в патогенез сердечно-сосудистых заболеваний, которые при шизофрении встречаются достоверно чаще, чем в общей популяции, и являются одной из ведущих причин снижения продолжительности жизни при шизофрении [24, 25]. Так, гомоцистеин способен вызывать изменения сосудистой стенки, взаимодействуя с особым типом белков соединительной ткани, что в конечном итоге приводит к кальцификации сосудистой интимы [26]. Гомоцистеин также способен взаимодействовать с белками экстрацеллюлярного матрикса, что может способствовать формированию системного органного поражения [27]. Глутаматергическая активность гомоцистеина и его дериватов, опосредованная NMDA-рецепторами, может быть вовлечена как в развитие эксайтотоксичности и нейродегенеративных нарушений при шизофрении, так и обусловливать нарушения свертываемости, воспаление сосудистой интимы и тромбообразование при воздействии на периферические NMDA-рецепторы клеток крови и иммунной системы [28].
Данные, полученные в одном регионе, не могут экстраполироваться на всю территорию России, так как известно, что распределение частот генетических полиморфизмов ключевых ферментов фолатного цикла значительно различается в разных выборках [29], кроме того нет согласованности в данных об ассоциации полиморфизма MTHFR677C>T с шизофренией в разных российских исследованиях [14, 15]. Учитывая, что уровень гомоцистеина у пациентов нижегородского региона является высоким (межквартильный размах полностью находится выше рекомендованного ВОЗ уровня в 10 мкмоль/л, не представляющего угроз для здоровья), дальнейшее изучение данной темы (как биохимических показателей фолатного обмена, так и генетических маркеров) представляется актуальным для других регионов России.
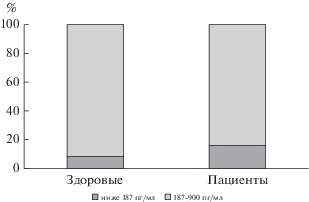
Заслуживает также внимания факт, что у здоровых добровольцев, несмотря на статистически значимо меньший уровень гомоцистеина, чем у пациентов, далеко не у всех он находится в пределах нормы (рис. 1–3). Особенно это настораживает в связи с тем, что были обследованы люди молодого возраста (табл. 1). Так как с возрастом уровень гомоцистеина нарастает (согласно данным литературы), это заставляет предполагать, что средний уровень гомоцистеина в общей популяции средней полосы России еще более высокий, что сопряжено с высоким риском для популяционного здоровья. Учитывая мультисистемное патологическое действие этого патогенетического фактора и его роль в развитии сердечно-сосудистых, акушерских, неврологических расстройств, необходимы масштабные исследования нарушений обмена фолатов и уровня гомоцистеина в общей российской популяции, в частности, для постановки вопроса о фортификации пищи витаминами (по примеру целого ряда стран) или разработки других профилактических стратегий [30].
Имеющиеся различия в уровне гомоцистеина у мужчин и женщин отражают данные литературы [11, 12]. Учитывая то, что более высокий уровень гомоцистеина у мужчин и среди пациентов, и среди здоровых не сопровождается значимыми различиями между мужчинами и женщинами по уровню фолатов и В12, а также то, что полученные ранее данные для того же региона не выявили разницы между мужчинами и женщинами в распространенности генетических факторов, влияющих на уровень гомоцистеина – SNP ключевых ферментов фолатного цикла [15, 22], требуются дополнительные исследования механизмов развития гипергомоцистеинемии у мужчин (или протективных механизмов в отношении гипергомоцистеинемии у женщин).
То, что статистически значимые различия между пациентами и здоровыми по уровню фолатов и гомоцистеина выявлены только внутри подгруппы женщин, но не мужчин, позволяет предположить то, что основной вклад в ассоциацию нарушений обмена фолатов с шизофренией вносит именно женская популяция. Но с другой стороны, в подгруппе мужчин тенденция к более высокому уровню гомоцистеина и меньшему уровню фолатов также прослеживается, поэтому, учитывая малый объем выборки (особенно здоровых мужчин), а также более высокий уровень гомоцистеина у мужчин (и среди пациентов, и среди здоровых), дальнейшее изучение нарушений обмена фолатов при шизофрении в российской популяции представляется актуальным как среди женщин, так и среди мужчин
В проведенном исследовании не оценивались генетические маркеры, влияющие на одноуглеродный обмен, что планируется сделать в дальнейшем. Кроме того, с клинической точки зрения в дальнейших исследованиях важно оценить, какие кластеры симптомов в большей степени ассоциированы с гипергомоцистеинемией. Это имеет практическое значение, так как открывает возможности для персонифицированной диагностики и коррекции уровня гомоцистеина и патогенетической коррекции отдельных симптомов шизофрении.
Персонифицированная психиатрия может дать новые недорогие способы патогенетической коррекции симптомов шизофрении, однако это требует дальнейшего тщательного изучения с анализом отдельных клинических случаев, проспективным дизайном, включением в комплекс биомаркеров для оценки путей коррекции не только биохимических, но и генетических маркеров, влияющих на одноуглеродный обмен.
ЗАКЛЮЧЕНИЕ
Таким образом, в изучаемой выборке пациентов с шизофренией (Нижегородский регион) уровень гомоцистеина статистически значимо выше, чем в выборке здоровых добровольцев, сопоставимой по полу и возрасту, что частично может объясняться статистически значимо меньшим уровнем фолатов и меньшим уровнем В12 в выборке пациентов и говорит о необходимости дальнейшего изучения нарушений обмена фолатов (гипергомоцистеинемии) при шизофрении в российской популяции, а также разработки путей персонифицированной коррекции уровня гомоцистеина у пациентов с шизофренией. Высокая частота выявления биохимических маркеров нарушений обмена фолатов в выборке здоровых добровольцев говорит об актуальности изучения этой темы не только с точки зрения этиопатогенеза шизофрении, но и с позиции популяционного здоровья в России.
Список литературы
Wang D., Zhai J.-X., Liu D.-W. // Psychiatry Res. 2016. V. 235. P. 83–89.
Yadav U., Kumar P., Gupta S., Rai V. // Asian J. Psychiatr. 2016. V. 20. P. 41–51.
Regland B., Johansson B.V., Gottfries C.G. // J. Neural Transm.: Gen. Sect. 1994. V. 98. № 2. P. 143–152.
Regland B., Johansson B.V., Grenfeldt B., Hjelmgren L.T., Medhus M. // J. Neural Transm.: Gen. Sect. 1995. V. 100. № 2. P. 165–169.
Applebaum J., Shimon H., Sela B.A., Belmaker R.H., Levine J. // J. Psychiatr. Res. 2004. V. 38. № 4. P. 413–416.
Levine J., Stahl Z., Sela B.A., Ruderman V., Shumaico O., Babushkin I., Osher Y., Bersudsky Y., Belmaker R.H. // Biol. Psychiatry. 2006. V. 60. № 3. P. 265–269.
Haidemenos A., Kontis D., Gazi A., Kallai E., Allin M., Lucia B. // Prog. Neuro-Psychopharmacol. Biol. Psychiatry. 2007. V. 31. № 6. P. 1289–1296.
Muntjewerff J.W., Kahn R.S., Blom H.J., den Heijer M. // Mol. Psychiatry. 2006. V. 11. № 2. P. 143–149.
Petronijević N.D., Radonjić N.V., Ivković M.D., Marin-ković D., Piperski, V.D., Duricić B.M., Paunović, V.R. // Prog. Neuro-Psychopharmacol. Biol. Psychiatry 2008. V. 32. № 8. P. 1921–1926.
Mabrouk H., Douki W., Mechri A., Younes M.K., Omezzine A., Bouslama A., Gaha L., Najjar M.F. // L’Encéphale. 2011. V. 37. № 4. P. 308–313.
Numata S., Kinoshita M., Tajima A., Nishi A., Imoto I., Ohmori T. // BMC Med. Genet. 2015. V. 16. P. 54.
Kim T.H., Moon S.W. // Psychiatry Invest. 2011. V. 8. № 2. P. 134–140.
Levine J., Sela B.A., Osher Y., Belmaker R.H. // Prog. Neuro-Psychopharmacol. Biol. Psychiatry. 2005. V. 29. № 7. P. 1181–1191.
Коровайцева Г.И., Габаева М.В., Голимбет В.Е. // Журн. неврологии и психиатрии им. С.С. Корсакова. 2020. Т. 120. № 3. Р. 48–52.
Zhilyaeva T.V., Sergeeva A.V., Blagonravova A.S., Kasimova L.N., Kuznetsov K.V., Golovanova V.I., Shebolkova T.B., Korshunova E.A. // Asian J. Psychiatr. 2018. V. 32. P. 29–33.
Boldyrev A.A. // Biochemistry (Moscow). 2009. V. 74. № 6. P. 589–598.
Pratt C.W., Cornely K. // Essential Biochemistry / Wiley. 2018. P. 472.
Ельчанинов А.П., Капустин С.И., Сироткина О.В. // Журн. неврологии и психиатрии им. С.С. Корсакова. 2002. № 5. С. 37–42.
Ford E.S., Smith S.J., Stroup D.F., Steinberg K.K., Mueller P.W., Thacker S.B. // International J. Epidemiology. 2002. V. 31. № 1. P. 59–70.
Trabetti E. // J. Appl. Genet. 2008. V. 49. № 3. P. 267–282.
Торшин И.Ю., Громова О.А., Лиманова О.А., Егорова Е.Ю., Сардарян И.С., Юдина Н.В., Гришина Т.Р., Федотова Л.Э., Галустян А.Н., Малявская С.И., Волков А.Ю., Калачева А.Г., Рудаков К.В., Косенко И.М., Семенов В.А. // Педиатрия. Журн. им. Г.Н. Сперанского. 2015. № 6.
Жиляева Т.В., Македонская О.Г., Чумаков М.Э., Благонравова А.С., Мазо Г.Э. // Социальная и клиническая психиатрия. 2019. Т. 29. № 2. С. 14–22.
Roffman J.L., Petruzzi L.J., Tanner A.S., Brown H.E., Eryilmaz H., Ho N.F., Giegold M., Silverstein N.J., Bottiglieri T., Manoach D.S., Smoller J.W., Henderson D.C., Goff D.C. // Mol. Psychiatry. 2017. V. 23. № 2. P. 316.
Araki A., Hosoi T., Orimo H., Ito H. // Metabolism. 2005. V. 54. P. 809–814.
Hayden M.R., Tyagi S.C. // Nutr J. 2004. V. 3. P. 4.
Liu T., Lin J., Ju T., Chu L., Zhang L. // Mol. Cell. Biochem. 2015. V. 406. P. 139–149.
Sethi M.K., Zaia J. // Anal. Bioanal. Chem. 2016. V. 409. № 2. P. 379–394.
Болдырев А.А., Брюшкова Е.А., Владыченская Е.А. // Биохимия. 2012. Т. 77. №. 2. С. 160–168.
Иевлева К.Д., Баирова Т.А., Калюжная О.В., Первушина О.А., Рычкова Л.В., Колесникова Л.И., Колесников С.И. // Acta Biomedica Scientifica. 2016. № 3–2. P. 109.
Choi J.H., Yates Z., Veysey M., Heo Y.R., Lucock M. // Prev. Nutr. Food Sci. 2014. V. 19. № 4. P. 247–260.
Дополнительные материалы отсутствуют.
Инструменты
Нейрохимия