Нейрохимия, 2021, T. 38, № 1, стр. 67-76
Нейрогенез в гиппокампе, дофаминергические нейроны черной субстанции и поведение стареющих мышей в условиях интраназального введения нативного белка α-синуклеина
В. В. Шерстнев 1, О. А. Соловьева 1, М. А. Грудень 1, А. М. Ратмиров 1, Е. В. Коновалова 1
1 ФГБНУ “Научно-исследовательский институт нормальной физиологии им. П.К. Анохина”
Москва, Россия
Поступила в редакцию 09.09.2020
После доработки 07.11.2020
Принята к публикации 13.11.2020
Аннотация
Исследованы эффекты интраназально введенного нативного белка α-синуклеина, гиперпродукцию и мисфолдинг которого рассматривают в качестве ключевого звена патогенеза болезни Паркинсона и других возрастзависимых нейродегенеративных заболеваний, на нейрогенез в гиппокампе, содержание дофаминергических нейронов в черной субстанции мозга, а также двигательную активность, обучение, память и тревожность стареющих животных. Опыты проводили на 12-месячных самцах мышей C57BL/6, которым в течение 14-ти дней один раз в сутки вводили раствор рекомбинантного нативного α-синуклеина либо физиологический раствор. Для оценки показателей поведения использовали тесты: “Открытое поле”, “Распознавание нового объекта”, “Условная реакция пассивного избегания” и “Приподнятый крестообразный лабиринт”. Пролиферирующие клетки, незрелые нейроны и дофаминергические нервные клетки выявляли иммуногистохимическим методом с помощью антител к бромдезоксиуридину, даблкортину и тирозин-гидроксилазе. Показано, что α-синуклеин вызывает значительное увеличение количества пролиферирующих клеток и снижение числа незрелых нейронов в зубчатой фасции гиппокампе, а также снижение плотности дофаминергических нейронов в компактной части черной субстанции мозга. У мышей, получивших нативный α-синуклеин, выявлено снижение скорости двигательной активности, нарушение долговременной ассоциативной памяти и изменения тревожноподобного поведения. Выполнен сравнительный анализ данных, полученных в работе, и результатов ранее выполненных нами исследований эффектов олигомеров и фибрилл α-синуклеина в условиях аналогичного экспериментального протокола. Документированные факты рассматриваются как экспериментальное свидетельство вовлеченности нарушений постнатального нейрогенеза в развитие синуклеопатий и подтверждают представление о том, что различные конформации α-синуклеина обуславливают формирование определенных видов этих нейродегенеративных заболеваний.
ВВЕДЕНИЕ
Представление о том, что нарушение постнатального нейрогенеза играет важную роль в инициации и развитии болезни Паркинсона (БП) и других синуклеопатий – группы возрастзависимых нейродегенеративных заболеваний, ключевым звеном патогенеза которых является гиперпродукция и мисфолдинг белка α-синуклеина (α-син) с образованием нейротоксических амилоидогенных форм белка, находит весомые клинические и экспериментальные подтверждения. Основные факты были получены при исследовании постмортного и аутопсильного материала больных с синуклеопатиями при изучении трансгенных животных, моделирующих эти заболевания, так, у пациентов с БП и животных, воспроизводящих некоторые признаки БП, выявлены нарушения нейрогенеза в субвентрикулярной зоне, зубчатой фасции (ЗФ) гиппоампа мозга. При этом могли наблюдаться различные двигательные расстройства [1–5].
Важное значение для понимания механизмов участия и роли нейрогенеза в развитии БП и других синуклеопатий представляют данные об особенностях влияния различных конформаций α-син на процессы постнатального нейрогенеза, сопряженные с обеспечением функций, нарушения которых характерны для данных заболеваний.
Однако в настоящее время прямые экспериментальные факты об эффектах конформаций α-син на нейрогенез, двигательные, когнитивные и психо-эмоциональные функции документированы лишь в небольшом числе работ. Наименее исследовано действие нативного белка α-син. При этом полученные результаты неоднозначны и противоречивы, поскольку были использованы различные модели, виды и возраст животных, пути введения и дозы белка, а также сроки наблюдения и регистрируемые показатели [6–9]. Известно, что α-син – небольшой по размеру белок, широко распространенный в нервной системе, локализуется главным образом в пресинаптических терминалях нейронов, а также в глиальных клетках. В нормальных условиях α-син представлен в клетке преимущественно в виде тетрамера и существует в нативной и мембраносвязанной формах. Белок участвует в процессах везикулярного транспорта, стабилизации мембран, обмена и транспорта моноаминов, синаптической пластичности. Накопление α-син в нервных и глиальных клетках вызывает их апоптотическую гибель, опосредованную процессами протеолического стресса, оксидативного повреждения и митохондриальной дисфункции. В определенных условиях, в частности при повышенной концентрации α-син в клетке, происходит изменение его нативной пространственной укладки с образованием амилоидогенных нейротоксических олигомерных и фибриллярных структур [10–12]. Таким образом, в мозге одновременно могут присутствовать различные конформации α-син и вызывать гибель отдельных популяций нейронов и/или глиальных клеток, что обуславливает течение и спектр клинических проявлений, характерных для определенных видов синуклеопатий [12–14].
Ранее нами было проведено сравнительное изучение эффектов, полученных in vitro α-син амилоидогенных олигомерных и фибриллярных структур, выполненное на разработанной оригинальной экспериментальной модели сходных с БП нейродегенеративных состояний. Модель основана на хронической инокуляции в нос стареющим мышам нейротоксических амилоидогенных форм α-син [15, 16]. Полученные результаты показали, что изученные конформационные структуры белка α-син – олигомеры и фибриллы – характеризуются определенным паттерном активности, оказывая избирательное действие на процессы нейрогенеза в ЗФ гиппокампа, дофаминергические нейроны (ДА) компактной части черной субстанции (кЧС) мозга, кратковременную и долговременную память, а также тревожность стареющих мышей [17, 18]. В связи с изложенным, учитывая немногочисленность и противоречивость имеющихся данных, представляется важным исследовать действие нативного α-син в условиях аналогичного экспериментального протокола, что актуально для выяснения механизмов развития синуклеопатий и разработки методов ранней диагностики этих заболеваний.
Целью настоящей работы явилось изучение влияния нативного α-синуклеина при его хроническом интраназальном введении на нейрогенез в зубчатой фасции гиппокампа, содержание ДА-ергических нейронов в компактной части черной субстанции мозга, двигательную активность, тревожность, долговременную и кратковременную память стареющих мышей.
МЕТОДИКА ИССЛЕДОВАНИЯ
Работа проведена на 15-ти самцах мышей линии C57Bl/6 в возрасте 12-ти месяцев (ФГБУН НЦБМТ ФМБА питомник “Столбовая”, Россия). Мыши содержались по 3–5 особей в клетках в стандартных условиях вивария со сменой темной и светлой фаз суток 12/12 ч при свободном доступе к пище и воде. Мыши были разделены на 2 группы, которым ежедневно в течение 14-ти дней вводили поочередно в каждую ноздрю физиологический раствор (“контрольная группа”, ФР, 8 мкл, n = 6) либо раствор рекомбинантного нативного α-син (“экспериментальная группа”, 8 мкл, 0.48 мг/кг, Центр Биотехнологии (Вильнюс, Литва, n = 9).
В работе была использована батарея поведенческих тестов, описанная нами ранее [17, 18]. На 15-й день исследования животных из “контрольной” и “экспериментальной” групп однократно помещали в установку “Открытое поле” (ОП) (Columbus Instruments, Огайо, США) для адаптации в течение 5 мин и последующим тестированием – 6 мин). Поведение животных регистрировали с помощью видеокамеры CNB-BBB-31F (CNB Technology Inc., Корея), размещенной под потолком экспериментальной комнаты. Сбор и анализ данных проводили с помощью программы Ethovision XT 8.5 (Noldus, Голландия). Для осуществления анализа площадь установки делили на 16 равных квадрантов. По перемещению центра тела животного оценивали среднюю скорость движения, а также длительность нахождения и количество заходов в центральную зону (4 центральных квадранта из 16-ти) и углы (4 угловых квадранта). На 16-е сутки оценивали кратковременную память всех мышей в тесте “Распознавание нового объекта” (РНО), используя установку ОП как арену для проведения исследования. Во время сессии обучения длительностью 5 мин животные имели возможность свободно исследовать два идентичных объекта (банки диаметром 5.4 см из стекла с металлическими крышками). Через 1 ч после сеанса обучения проводили 5-минутную сессию тестирования мышей: в установку помещали один, ранее знакомый, и один, новый для мыши, объект (пластмассовый стакан диаметром 7.5 см, зеленого цвета). В тесте РНО зоны интереса определяли по границам размещенных в установке 2 объектов (двух при обучении и двух при тестировании) на расстоянии 2 см от этих объектов (в пограничных зонах). Положение животного в данном тесте определяли по трем точкам (нос, центр тела и хвост), используя видеорегистрацию. Считали, что мышь исследует объект, если ее нос определялся в границах самого объекта или его пограничной зоны. По окончанию экспериментов рассчитывали индекс дискриминации (ИД) = Тнов/(Тнов + Тзнак), где Тнов – длительность нахождения в зоне нового объекта и его пограничной зоне (в секундах), Тзнак – длительность нахождения в зоне знакомого объекта и его пограничной зоне (в секундах). На 18-ые сут эксперимента у животных обеих групп формировали условную реакцию пассивного избегания (УРПИ) в установке PACS Shuttle Box (v.3.13) (Columbus Instruments, Огайо, США), сохранность которой оценивали через 24 ч. Животных адаптировали к освещенному отсеку 15 с, при этом максимальная длительность сессии обусловливания составляла 180 с, а сессии тестирования – 300 с. В случае перехода в темный отсек мышь получала электрокожное раздражение лап и хвоста (сила тока 0.6 мА, длительность разряда – 3 с). С помощью программного обеспечения PACS 30 Shuttle Box v .3.13 в обеих сессиях автоматически фиксировали латентное время (ЛВ) перехода из освещенного в темный отсек камеры. Через 2 дня после проведения УРПИ животных однократно в течение 5 мин тестировали в установке “Приподнятый крестообразный лабиринт” (ПКЛ) (Columbus Instruments, Огайо, США). В ПКЛ выделяли 2 суммарные зоны интереса: 2 открытых рукава и 2 закрытых. Оценивали следующие показатели: среднюю скорость движения, суммарное количество входов и длительность пребывания в двух закрытых и двух открытых рукавах. Опыты в ОП, РНО и ПКЛ проводили в помещении при освещении установки рассеянным светом.
Через сутки после окончания поведенческих экспериментов животным внутрибрюшинно вводили 3 раза с интервалом в 60 мин раствор бромдезоксиуридина (BrdU, Sigma, США) в суммарной дозе 150 мг/кг. Спустя 24 ч после введения BrdU животных наркотизировали внутрибрюшинно препаратом “Золетил” (Virbac Sante Animale, Франция, 40 мг/кг), проводили транскардиальную перфузию 0.1 М фосфатным буфером (PBS, pH 7,4) и 4%-ным раствором параформальдегида с дополнительной фиксацией препаратов мозга в 4%-ном растворе параформальдегида. Для изготовления сагиттальных срезов левого полушария мозга контрольных и экспериментальных животных использовали микротом Leica VT 1200S (Leica Biosystems, Германия). Полученные срезы помещали в лунки 24-луночного культурального планшета (13–15 срезов на лунку, шаг 300 мкм, толщина срезов 50 мкм). Проводили денатурацию ДНК, пермеабилизацию мембран, снижение неспецифического связывания антител с последующей инкубацией с первичными антителами (АТ) к Guinea Pig anti-Doublecortin antibody, (AB2253, Millipore, США) (в разведении 1 : 500) и тирозингидроксилазе (Tyrosine hydroxylase, Mouse anti-Tyrosine Hydroxilase антитела (MAB318, Millipore, США) (в разведении 1 : 200) по описанному ранее протоколу [10]. Далее срезы инкубировали с вторичными АТ, конъюгированными с флуоресцентными красителями в разведении 1 : 500 (Goat anti-mouse Alexa Fluor 594, A-11005, Molecular Probes, США; Goat anti-Guinea Pig Alexa Fluor 647, A‑21450, Molecular Probes, США; Goat anti-Rat Alexa Fluor 488, A-11006, Molecular Probes, США). После стандартного отмывания срезы заключали под покровные стекла с использованием закрепителя для флуоресцентных препаратов (S302380, Dako, США) и хранили при температуре +4°C в темноте.
Для микроскопирования полученных препаратов использовали спиннинг-диск микроскоп Andor Revolution (Andor, Ирландия). Сканирование препаратов осуществляли на всю глубину с шагом 1 мкм, панораму всей ЗФ гиппокампа или компактной части ЧС сшивали с 10%-ным перекрытием. Количество клеток оценивали вручную на 3D-реконструированных образцах (Imaris х64 7.4.2, Bitplane, Швейцария). Содержание BrdU+ и DCX+-положительных клеток оценивали в области субгранулярного слоя ЗФ на всех срезах в отдельной лунке, экстраполируя данные на целую ЗФ [19]. TH+-положительные клетки (в мм3 ткани), считали в области Pars compacta ЧС (Bregma lateral 0.60 mm–lateral 1.32 mm по формуле Vповерхности × × 50 (толщина среза)/n (количество оптических плоскостей) [20]. На графиках иммуногистохимические данные представлены в % от контроля.
Статистический анализ результатов поведенческих экспериментов осуществляли с помощью программ SPSS Statistics 17.0 (SPSS Inc., США), Statistica 7.0 (StatSoft Inc., США) и Prism 6.01 (GraphPad, США). Поведенческие данные представляли как медиану (Me) и межквартильный размах, Q3-Q1( IQR), иммуногистохимические – как средние значения и стандартные ошибки измерения (M ± SEM). Показатели сравнивали с помощью теста Манна–Уитни для двух независимых выборок и теста Вилкоксона для зависимых выборок. Различия считали статистически значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В результате проведенных поведенческих исследований было документировано, что животные, которым на протяжении 14-ти дней интраназально вводили нативный α-син, на 15-ый день исследования статистически значимо не различались от мышей, получивших ФР, по скорости движения в тесте ОП (тест Манна–Уитни, первые 5 мин тестирования: p > 0.2; последующие 6 мин: p = 0.059). При этом на 16-ый день исследования при обучении в модели РНО и на 22-ой день при тестировании в ПКЛ различия в скорости движения стали статистически значимыми (p = 0.034 и p = 0.039 соответственно) (табл. 1).
Таблица 1.
Средняя скорость движения мышей в моделях “Открытоe поле” и “Распознавание нового объекта”, а также в “Приподнятом крестообразном лабиринте”
| Тесты | Нативный α-синуклеин, n = 9 | Физиологический раствор, n = 6 | Различия между группами, критерий Манна–Уитни |
|---|---|---|---|
| ОП, адаптация | (3.7; 3.2 см/с) 4.8 ± 0.7 см/с |
(5.9; 2.5 см/с) 5.8 ± 0.5 см/с |
U = 17.0, Z = –1.179, p > 0.2 |
| ОП, тестирование | (3.2; 2.2 см/с) 3.5 ± 0.4 см/с |
(5.1; 2.5 см/с) 5.2 ± 0.6 см/с |
U = 11.0, Z = –1.886, p = 0.059 |
| РНО, обучение | (3.0; 2.3 см/с) 2.9 ± 0.5 см/с |
(4.0; 0.8 см/с) 4.0 ± 0.2 см/с |
U = 9.0, Z = –2.121, p = 0.034 |
| РНО, тестирование через 1 ч | (2.4; 1.8 см/с) 2.6 ± 0.6 см/с |
(2.2; 1.1 см/с) 2.4 ± 0.3 см/с |
U = 26.0, Z = –0.118, p > 0.2 |
| ПКЛ | (4.5; 1.1 см/с) 4.5 ± 0.2 см/с |
(5.5; 2.0 см/с) 5.8 ± 0.5 см/с |
U = 8.0, Z = –2.066, p = 0.039 |
В тесте ОП животные из разных групп не различались ни по количеству заходов в центр установки (4 центральных квадранта из 16), ни по времени, проведенному в них (тест Манна–Уитни, p > 0.2). Обе группы мышей статистически значимо больше времени провели в углах установки и чаще заходили в них по сравнению с центральной частью (тест Вилкоксона, р < 0.05). Экспериментальные мыши заходили в углы установки в полтора раза реже по сравнению с контролем, однако эти различия не были статистически значимыми (табл. 2).
Таблица 2.
Длительность нахождения и количество заходов в центральную часть и углы установки “Открытое поле”
| Тесты | Нативный α-сининуклеин, n = 9 | Физиологический раствор, n = 6 | Различия между группами, критерий Манна–Уитни |
|---|---|---|---|
| Длительность, первые 5 мин | |||
| ОП, центр | (23.4; 36.6 с) 26.3 ± 6.1 с |
(20.3; 26.2 с) 21.6 ± 5.6 с |
U = 23.0, Z = –0.471, p > 0.2 |
| ОП, углы | (140.5; 33.4 с) 151.8 ± 10.7 с |
(164; 87.7 с) 171.0 ± 19.2 с |
U = 23.0, Z = –0.471, p > 0.2 |
| Различия между центром и углами, критерий Вилкоксона | Z = –2.666, p = 0.008 | Z = –2.201, p = 0.028 | |
| Длительность, последующие 6 мин | |||
| ОП, центр | (17.1; 28.9 с) 25.5 ± 9.5 с |
(32.2; 21с) 30.3 ± 5.7 с |
U = 17.0, Z = –1.179, p > 0.2 |
| ОП, углы | (168.8; 112.9 с) 194.2 ± 24.1 с |
(211.7; 115.1 с) 219.5 ± 23.5 с |
U = 20.0, Z = –0.825, p > 0.2 |
| Различия между центром и углами, критерий Вилкоксона | Z = –2.666, p = 0.008 | Z = –2.201, p = 0.028 | |
| Количество заходов, первые 5 мин | |||
| ОП, центр | (16; 20 раз) 16 ± 4 раза |
(13; 16 раз) 14 ± 4 раза |
U = 27.0, Z = 0, p > 0.2 |
| ОП, углы | (22; 18 раз) 25 ± 4 раза |
(40; 8 раз) 39 ± 3 раза |
U = 11.5, Z = –1.828, p = 0.068 |
| Различия между центром и углами, критерий Вилкоксона | Z = –2.524, p = 0.012 | Z = –2.201, p = 0.028 | |
| Количество заходов, последующие 6 мин | |||
| ОП, центр | (11; 12 раз) 11 ± 3 раза |
(12; 12 раз) 14 ± 3 раза |
U = 17.5, Z = –1.126, p > 0.2 |
| ОП, углы | (25; 18 раз) 24 ± 4 раза |
(35; 22 раза) 36 ± 5 раз |
U = 12.0, Z = –1.768, p = 0.077 |
| Различия между центром и углами, критерий Вилкоксона | Z = –2.670, p = 0.008 | Z = –2.201, p = 0.028 | |
В тесте РНО было обнаружено, что только у 67% мышей в группе ФР и в 44% животных в экспериментальной группе уровень исследовательской активности во время сессии обучения был достаточным для оценки сохранности эпизодической памяти в последующем исследовании (медиана суммарной длительности обследования объектов у этих мышей с высоким уровнем внимания была равна 12.5 с). Различия в доле мышей с низким и высоким уровнем внимания между экспериментальными и контрольными животными были статистически незначимы (точный критерий Фишера, p > 0.2), учитывая изложенные данные, мыши с низким уровнем внимания были исключены из анализа. Экспериментальные животные с высоким уровнем внимания не отличались от контроля ни по времени исследования нового объекта (>0.2), ни по времени исследования знакомого (p > 0.2) при тестировании, ни по уровню индекса дискриминации (p > 0.2) (табл. 3).
Таблица 3.
Исследовательская активность мышей с высоким уровнем внимания при тестировании в модели “Распознавание нового объекта”
| Показатели | Нативный α-синуклеин, n = 4 | Физиологический раствор, n = 4 | Различия между группами, критерий Манна–Уитни |
|---|---|---|---|
| Длительность исследования нового объекта, с | (4.7; 3.1) 4.3 ± 0.9 |
(3.1; 7.4) 4.5 ± 2.1 |
U = 5.0, Z = –0.866, p > 0.2 |
| Длительность исследования знакомого объекта, с | (5.0; 2.4) 4.7 ± 0.7 |
(2.8; 3.2) 3.6 ± 1 |
U = 5.0, Z = –0.866, p > 0.2 |
| Индекс дискриминации | (0.47; 0.33) 0.47 ± 0.09 |
(0.5; 0.23) 0.5 ± 0.06 |
U = 8.0, Z = 0, p > 0.2 |
Таким образом, полученные в тесте РНО данные не позволяют оценить влияние нативного α‑син при хроническом интраназальном введении на обучение и эпизодическую память стареющих самцов мышей C57Bl/6 в условиях используемого экспериментального протокола. Этот результат, возможно, связан с тем, что взрослые достаточно старые самцы мышей C57Bl/6 по сравнению с другими, широко используемыми лабораторными мышами, характеризуются болей низкой способностью к обучению и сохранности памяти [21, 22].
В модели УРПИ одна мышь из группы ФР была исключена из эксперимента, поскольку не перешла в темный отсек за 2 сессии обусловливания. Между животными двух групп не было найдено достоверных различий в ЛВ перехода в темный отсек ни при формировании реакции пассивного избегания (α-син: Me = 92 с; IQR = 74.5 с, 89 ± 16 с; ФР: Me = 99 с; IQR = 49.5 с, 96 ± 13 с, U = 20.0, Z = = –0.334, p > 0.2), ни при ее тестировании через 24 ч (α-син: Me = 209 с; IQR = 210.5 с, 187 ± 40 с; ФР: Me = 180 с; IQR = 115 с, 198 ± 31 с, U = 21.0, Z = –0.205, p > 0.2). Дальнейший анализ показал, что группа нативного α-син негомогенна по ЛВ перехода в темный отсек в сессии тестирования (Me = 209 с, размах 6–300 с), поэтому она была поделена на две подгруппы: “быстрых” плохо обучившихся мышей (n = 4, ЛВ в тесте: Me = 89.5 с; IQR = 64.0 с, 69 ± 21 с) и “медленных” хорошо обучившихся (n = 5, ЛВ в тесте: Me = 300.0 с; IQR = 45.5 с, 282 ± 18 с) (U = 0.0, Z = –2.121, p = = 0.034). “Медленные” мыши из группы нативного α-син демонстрировали увеличение ЛВ перехода в сессии тестирования (ЛВ при формировании УРПИ: Me = 60.0 с; IQR = 68.5 с, 79 ± 18 с, тест Вилкоксона, Z = –2.023, р = 0.043), так же как и контрольные животные (Me = 99.0 с; IQR = 49.5 с, 96 ± 13.1 с, Z = –2.023, р = 0.04). Вместе с тем, “быстрые” животные не показали значимого увеличения ЛВ перехода в темный отсек при формировании УРПИ: Me = 104.0 с; IQR = 106.5 с, 101 ± ± 29 с, Z = –1.095, р > 0.2, что указывает на нарушение долговременной ассоциативной памяти в подгруппе “быстрых” животных, которым вводили нативный α-син.
При оценке тревожности мыши, получившие нативный α-син, не отличались по времени, проведенном в открытых и закрытых рукавах лабиринта, от мышей, которым вводили ФР (открытые рукава: α-син: Me = 15.5 с; IQR = 10.4 с, 17.2 ± 3.3 с; ФР: Me = 22.4 с; IQR = 33.1 с, 27.6 ± 7.4 с, U = 17.0, Z = –0.904, p > 0.2, закрытые рукава: α-син: Me = = 250.2 с; IQR = 26.9 с, 252.4 ± 6.5 с; ФР: Me = = 232.9 с; IQR = 54.9 с, 234.1 ± 6.5 с, U = 14.0, Z = = –1.291, p > 0.1). В открытые рукава лабиринта экспериментальные мыши заходили в 2 раза реже по сравнению с контрольными, но различия не достигали уровня статистической значимости (α‑син: Me = 6 раз; IQR = 7.7 ± 1 с; ФР: Me = 12; IQR = 6.11 ± 1 с, U = 9.0, Z = –1.949, р = 0.051). Различия в количестве заходов исследованными животными в закрытые рукава ПКЛ были также статистически незначимы (α-син: Me = 8 раз; IQR = 5.7 ± 1 с; ФР: Me = 11; IQR = 9 с, U = 13.5, 11 ± ± 2, Z = –1.363, р > 0.1).
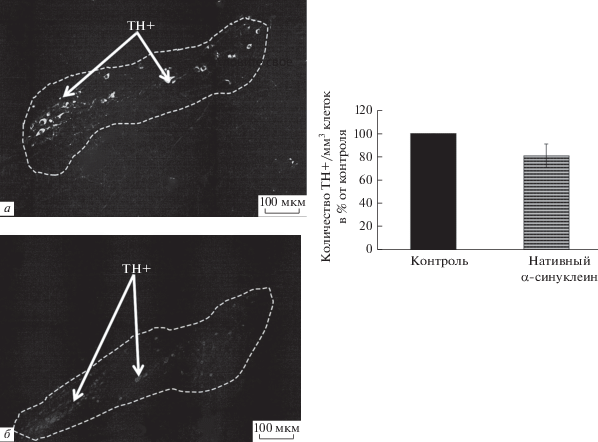
В иммуногистохимических экспериментах определяли содержание пролиферирующих клеток, меченых BrdU, нейробластов и незрелых нейронов, экспрессирующих DCX в ЗФ гиппокампа, а также количество дофаминергических нейронов, меченых по ТН, на 1 мм3 ткани КЧС. В группе животных, которым вводили нативный α‑син, документировано значительное увеличение (на 785%) количества BrDU+ клеток в ЗФ по сравнению с контрольными мышами (p < 0.01), у которых число BrdU+ клеток выявлено на уровне 166.4 ± 32.0 (рис. 1). При этом у экспериментальных мышей обнаружено достоверное снижение на 93% (p < 0.05) содержания DCX+ клеток в ЗФ гиппокампа по сравнению с контролем – 1450.0 ± 405.0 DCX-позитивных клеток (рис. 1). Обнаружено, что введение нативного α-син вызвало снижение количества TH положительных нейронов в кЧС головного мозга мышей на 20% в сравнении с животными, получавшими физиологический раствор (рис. 2).
Рис. 1.
Иммуногистохимическое выявление и количество в % от контроля бромдезоксиуридин (BrdU+) и даблкортин (DCX+)-позитивных клеток в зубчатой фасции гиппокампа у стареющих мышей C57Bl/6, получивших интраназально раствор нативного α-синуклеина. На рисунке слева: иммунохимическая визуализация BrdU+ и DCX+ клеток (отмечено стрелками), а – контроль; б – нативный α-синуклеин; справа: по оси абсцисс – группы животных, по оси ординат – количество BrdU+ и DCX+ клеток на зубчатую фасцию в % от контроля.
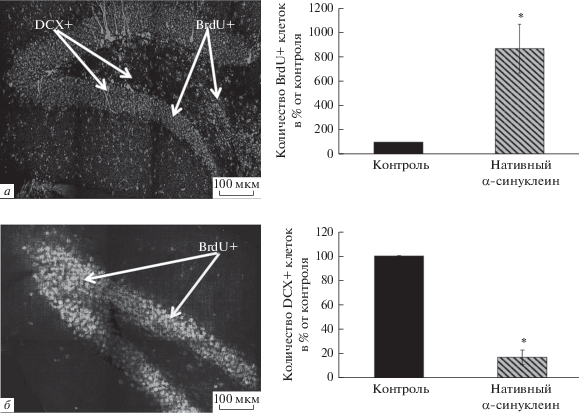
Рис. 2.
Иммуногистохимическое выявление и количество в % от контроля тирозингидроксилаза (TH+)-позитивных клеток в pars compacta черной субстанции мозга стареющих мышей C57Bl/6, получивших интраназально раствор нативного α-синуклеина. На рисунке слева: иммунохимическая визуализация TH+ клеток, а – контроль; б – нативный α-синуклеин (отмечено стрелками); справа: по оси абсцисс – группы животных, по оси ординат – количество TH+ клеток на мм3 ткани в % от контроля.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты выполненных в работе исследований демонстрируют, что нативный α-син, вводимый интраназально в течении 14-ти дней, вызывает выраженное нарушение процессов нейрогенеза в ЗФ гиппокампа и снижение количества ДА-ергических нейронов в кЧС мозга 12-месячных самцов мышей C57/bl6. Вместе с тем, у животных, получавших нативный α-син, выявлены нарушения двигательной функции, долговременной ассоциативной памяти, а также изменения тревожноподобного поведения.
Документированное в данном исследовании нарушение нейрогенеза в ЗФ гиппокампа характеризуется значительной активацией процессов пролиферации – 8-кратное увеличение количества пролиферирующих клеток, а также угнетением процессов нейрональной дифференцировки и, возможно, выживаемости вновь образованных клеток – нейрональных предшественников. Об этом свидетельствует значимое снижение числа нейробластов и незрелых нейронов на 93%. При этом следует учитывать вероятность изменения дифференцировки новых клеток по глиальному типу.
Интересны данные, полученные в экспериментах на трансгенных мышах, где было обнаружено, что сверхэкспрессия человеческого α-син дикого типа вызывает нарушение постнатального нейрогенеза в обонятельных луковицах и в ЗФ гиппокампа, которое обусловлено выраженным снижением более чем на 50% выживаемости нейрональных предшественников и незрелых нейронов на стадии дифференцировки, без заметного влияния на процесс пролиферации [3, 7, 23].
Ранее нами было показано, что олигомеры α-син, вводимые интраназально в течении 14-ти дней, активируют процессы пролиферации и дифференцировки в ЗФ гиппокампа стареющих мышей, в то время как фибриллярные структуры α-син в условиях аналогичного экспериментального протокола не оказывают значимого эффекта на пролиферацию и дифференцировку клеток в гиппокампе [17, 18]. Вместе с тем, повышенная экспрессия человеческого α-син либо его мутантных видов инициируют и ускоряют образование in vitro нейротоксических амилоидогенных структур α-син [9, 18]. Имеющиеся факты позволяют считать, что в данной работе активация пролиферации клеток в ЗФ гиппокампа при интраназальном введении нативного α-син вызвана действием олигомеров α-син, образовавшихся в ходе накопления белка в мозге. Документированное при этом угнетение выживаемости и дифференцировка нейробластов и незрелых нейронов обусловлено влиянием повышенного содержания нативного α-син.
В поведенческих экспериментах, проведенных в работе, у 60% мышей, получавших нативный α-син, были обнаружены нарушения долговременной ассоциативной памяти, что хорошо сопоставимо с клиническими данными о проявлении нарушений памяти у 30–65% больных с БП на ранних стадиях заболевания [24, 25]. При действии нативного α-син животные также демонстрировали изменения тревожноподобного поведения, проявляющегося отчетливой тенденцией в снижении как числа заходов в открытые рукава ПКЛ (в 2 раза, p = 0.05), так и количества посещений углов в ОП (в 1.5 раза, p = 0.06) (табл. 2).
Угнетение нейрогенеза в ЗФ гиппокампа и нарушение долговременной пространственной памяти документировано у сверхэкспрессирующих человеческий α-син дикого типа трансгенных мышей. При этом развитие и прогрессирование выявленных нарушений ассоциировано с уровнем экспрессии α-син [3, 9]. Известно, что нарушение постнатального нейрогенеза в гиппокампе вовлечено в развитие когнитивных дисфункций и афферентных расстройств, характерных для клинических проявлений БП и синуклеопатий [2, 4, 26].
Таким образом, имеющиеся экспериментальные результаты дают основания полагать, что обнаруженные у стареющих мышей при хроническом интраназальном введении нативного α-син нарушение долговременной памяти и изменение тревожноподобного поведения вызваны нарушением процессов нейрогенеза в ЗФ гиппокампа.
В данной работе также обнаружено, что нативный α-син при хроническом интраназальном введении вызывает достоверное снижение скорости двигательной активности и уменьшение на 20% количества ДА-енергических нервных клеток в кЧС мозга стареющих 12-месячных мышей по сравнению с контрольными животными. Полученные экспериментальные факты согласуются с результатами исследований, выполненных на трансгенных мышах со сверхэкспрессией человеческого α-син его дикого типа. Эти работы показали, что повышенная экспрессия α-син индуцирует прогрессирующее возрастание его содержания в структурах переднего и среднего мозга, которое ассоциировано с развитием двигательных нарушений, а также с нейродегенерацией и дефицитом дофамина в нигростриальной системе [3, 8, 27].
Следует отметить, что двигательные нарушения, выявленные у животных, получавших интраназально нативный α-син, документированы на 17 день эксперимента – спустя 2 дня по окончании 14-дневного интраназального введения белка. Вместе с тем, олигомеры α-син, угнетающие двигательную активность, и фибриллы α‑син, вызывающие увеличение скорости движения, инициируют указанные моторные нарушения на 15-й день исследования. Олигомеры α-син вызывают менее выраженное снижение числа ДА-ергических нейронов, локализующихся в кЧС мозга, по сравнению с нативным α-син (10–12 и 20% соответственно). Фибриллярные структуры α-син в отличие от нативного α-син и его олигомерных форм увеличивают плотность ДА-ергических нервных клеток в кЧС мозга.
Таким образом, различные конформационные структуры белка α-син, изученные нами, в условиях аналогичного экспериментального протокола, характеризуются существенными особенностями влияния на двигательную активность и содержание ДА-ергических нервных клеток в кЧС мозга стареющих мышей.
ЗАКЛЮЧЕНИЕ
В работе документировано, что нативный белок α-син, вводимый интраназально в течение 14-ти дней, вызывает у 12-месячных самцов мышей нарушение процессов нейрогенеза в ЗФ гиппокампа и снижение количества ДА-ергических нейронов в кЧС мозга. Вместе с тем, у животных выявлено нарушение долговременной ассоциативной памяти, изменение тревожноподобного поведения и снижение скорости двигательной активности. Результаты выполненных нами исследований демонстрируют, что нативный α-син, амилоидогенные олигомеры и фибриллы α-син в условиях аналогичного экспериментального протокола характеризуются избирательным, различающимся выраженностью, направленностью и временной динамикой действием на нейрогенез в ЗФ гиппокампа, плотность ДА-ергических нейронов в кЧС мозга, а также сопряженные двигательные, когнитивные и аффективные функции стареющих животных.
Полученные экспериментальные данные свидетельствуют о значимой роли нарушений нейрогенеза в развитии ряда признаков, характерных для синуклеопатий, и подтверждают концептуальное положение о том, что различные конформации α-син обуславливают формирование определенных видов нейродегенеративных заболеваний, относящихся к синуклеопатиям.
Список литературы
Horgusluoglu E., Nudelman K., Nho K., Saykin A.S. // Am. J. Med. Genet. B. Neuropsychiatr Genet. 2017. V. 174. № 1. P. 93–112. https://doi.org/10.1002/ajmg.b.32429
Winner B., Winkler J. // Cold Spring Harbor Perspect. Biol. 2015. V. 7. № 4. https://doi.org/101101/cshperspect.a021287
Nuberg S., Petrasch-Parwez E., Winner B., Winkler J., von Horsten S., Schmidt T., Boy J., Kuhn M., Nguyen H.P., Teismann P., Schulz J.B., Neumann M., Pichler B.J., Rreischl G., Holzmann C., Schmitt I., Bornemann A., Kuhn W., Zimmermann F., Servadio A., Riess O. // J. Neurosci. 2008. V. 28. № 10. P. 2471–2484. https://doi.org/10.1523/JNEUROSCI.3040-07.2008
Lamm O., Ganz J., Melamed E., Offen D. // J. Comp. Neurol. 2014. V. 522. № 12. P. 2817–2839. https://doi.org/10.1002/cne.203607
Regensburger M., Prots I., Winner B. // Neural Plast. 2014. V. 2014. P. 454696. https://doi.org/10.1155/2014/454696
La Vitola P., Balducci C., Cerovic M., Santamaria G., Brandi E., Grandi F., Caldinelli L., Colombo L., Grazia Morgese M., Trabace L., Pollegioni L., Albani D., Forloni G. // Brain Behav. Immun. 2018. V. 69. P. 591–602.https://doi.org/10.1016/j.bbi.2018.02.012
Winner B., Regensburger M., Schreglmann S., Boyer L., Prots I., Rockenstein E., Mante M., Shao C., Winkler J., Masliah E., Gage F.H. // J. Neurosci. 2012. V. 32. № 47. P. 16906–16916. https://doi.org/10.1523/JNEUROSCI.2723-12.2012
Rabl R., Breitschaedel C., Flunkert S., Duller S., Amschl D., Neddens J., Neiderkofler V., Rockenstein E., Masliah E., Roemer H., Hutter-Paier B. // BMC Neurosci. 2017. V. 18. № 1. P. 22. https://doi.org/10.1186/s12868-017-0341-8
Gomez-Benito M., Granado N., Garcia-Sanz P., Michel A., Dumoulin M., Moratalla R. // Front. Pharmacol. 2020. V. 23. № 11. P. 356. https://doi.org/10.3389/fphaz.2020.00356
Emamzadeh F.N. // J. Res. Med. Sci. 2016. V. 9. P. 21–29. https://doi.org/10.4103/1735-1995.181989
Ghosh D., Mehra S., Sahay S., Singh P.K., Maji S.K. // J. Biol. Macromol. 2017. V. 100. P. 37–54. https://doi.org/10.1016/j.ijbiomac.2016.10.021
Peng C., Gathagan R.J., Lee V.M. // Neurobiol. Dis. 2018. V. 109(Pt B). P. 209–218. https://doi.org/10.1016/j.nbd.2017.07.018
Marmolino, D., Foerch, P., Atienzar F.A., Staelens L., Michel A., Scheller D. // Mol. Cell. Neurosci. 2016. V. 71. P. 92–101. https://doi.org/10.1016/j.mcn.2015.12.012
Peelaerts W., Bousset L., Van der Perren A., Moskalyuk A., Pulizzi R., Giugliano M., Van den Haute C., Melki R., Baekelandt V. // Nature. 2015. V. 522. № 7556. P. 340–344. https://doi.org/10.1038/nature14547
Gruden M.A., Davidova T.V., Yanamandra K., Kucheryanu V.G., Morozova-Roche L.A., Sherstnev V.V., Sewell R.D. // Behav. Brain Res. 2013. № 243. P. 205–212. https://doi.org/10.1016/j.bbr.2013.01.011
Gruden M.A., Davydova T.V., Narkevich V.B., Fomina V.G., Wang C., Kudrin V.S., Morozova-Roche L.A., Sewell R.D. // Behav. Brain Res. 2014. № 263. P. 158–68. https://doi.org/10.1016/j.bbr.2014.01.017
Sherstnev V.V., Rtdrov A.V., Solovieva O.A., Gruden M.A., Konovalova E.V., Kalinin I.A., Proshim A.T. // J. Neurochem. 2017. V. 11. № 4. P. 359–365. https://doi.org/10.1134/S1819712417040092
Sherstnev V.V., Solov’eva O.A., Gruden’ M.A., Kedrov A.V., Konovalova E.V., Ratmirov A.M. // J. Neurochem. 2018. V. 12. № 4. P. 359–365. https://doi.org/10.1134/S1819712418040062
Encinas J.M., Enikolopov G. // Methods Cell Biol. 2008. V. 85. P. 243–272. https://doi.org/10.1016/S0091-679X(08)85011-X
Franklin K., Paxinos G. // The Mouse Brain in Stereotaxic Coordinates. 3rd ed. New York, London, Burlington, San Diego: Academic PRESS, 2007.
Braida D., Ponzoni L., Matteoli M., Sala M.M. // Behav. Brain Res. 2016. V. 296. P. 393–400. https://doi.org/10.1016/j.bbr.2015.08.016
Ano Y., Ohya R., Kondo K., Nakayama H. // Front. Aging Neurosci. 2019. V. 4. P. 11–16. https://doi.org/10.3389/fnagi.2019.00016
Winner B., Lie D.C., Rochenstein E., Aigner R., Aigner L., Masliah E., Kuhn H.G., Winkler J. // J. Neuropathol. Exp. Neurol. 2004. V. 63. № 11. P. 1155–1166. https://doi.org/10.1093/jnen/63.11.1155
Pfeiffer H.C., Løkkegaard A., Zoetmulder M., Friberg L., Werdelin L. // Acta Neurol. Scand. 2014. V. 129. № 5. P. 307–318. https://doi.org/10.1111/ane.12189
Rana A.Q., Ahmed U.S., Chaudry Z.M., Vasan S. // Expert Rev. Neurother. 2015 V. 15(5). P. 549–562. https://doi.org/10.1586/14737175.2015.1038244
Schoenfeld T.J., Gameron H.A. // Neuropsychopharmacology. 2015. V. 40. № 1. P. 113–128. https://doi.org/10.1038/npp.2014.230
Amschl D., Neddens J., Havas D., Flunkert S., Rabl R., Römer H., Rockenstein E., Masliah E., Windisch M., Hutter-Paier B. // BMC Neurosci. 2013. V. 14(16). https://doi.org/10.1186/1471-2202-14-6
Дополнительные материалы отсутствуют.


