Нейрохимия, 2021, T. 38, № 1, стр. 37-42
Влияние белков теплового шока на продолжительность жизни и поведенческие функции животных с FUS-протеинопатией
Е. А. Вихарева 1, М. М. Чичёва 1, М. Б. Евгеньев 2, С. Ю. Фуников 2, А. В. Дейкин 3, С. О. Бачурин 1, А. А. Устюгов 1
1 ФГБУН Институт физиологически активных веществ Российской академии наук
Черноголовка, Московская область, Россия
2 ФГБУН Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
Москва, Россия
3 ФГБУН Институт биологии гена Российской академии наук
Москва, Россия
Поступила в редакцию 18.06.2020
После доработки 03.07.2020
Принята к публикации 04.07.2020
Аннотация
Известно, что шапероны и, в частности, белки теплового шока массой 70 кДа (БТШ70) являются неотъемлимой частью клеточного протеостаза. Чтобы оценить роль БТШ70 в течении нейродегенеративного процесса мы использовали новую гибридную линию мышей с коэкспрессией аберрантного белка ΔFUS(1-359) и БТШ70 человека. Мыши новой гибридной линии характеризуются большей продолжительностью жизни, а также увеличением продолжительности симптоматической стадии по сравнению с контрольными животными. Кроме этого, по результатам физиологических тестов можно сделать вывод о положительном влиянии БТШ70 на мышечную силу на симптоматической стадии течения модельного заболевания.
ВВЕДЕНИЕ
Боковой амиотрофический склероз (БАС) это одно из самых часто встречаемых возрастных заболеваний моторного нейрона, которое затрагивает спинной и головной мозг. С БАС связано множество генетических мутаций, основные из которых затрагивают Cu/Zn супероксиддимутазу (SOD1), а также РНК-связывающие белки – TDP-43 и FUS. Большинство случаев заболевания БАС связано с накоплением неправильно свернутых белков, а также их агрегатов [1]. Деградация таких белков при помощи убиквитинпротеасомной системы или аутофагосомного пути относится к потенциальным терапевтическим мишеням, поскольку эффективность этих механизмов снижается с возрастом [2, 3].
Шапероны (белки теплового шока) и кошапероны обеспечивают внутриклеточный гомеостаз и препятствуют повреждению клеточных белков при повышении температур и других стрессирующих воздействиях внешней среды, а также при старении. Они являются неотъемлемой частью системы протеостаза в эукариотических клетках, выполняя ключевую роль в процессах сворачивания и созревания белков, а также деградации белков с неправильной конформацией и агрегатов из них. К семейству белков теплового шока с молекулярной массой 70 кДА (БТШ70) относятся одни из самых распространенных и повсеместно экспрессируемых шаперонов, которые участвуют во многих биологических процессах [4].
В исследованиях, проведенных на клеточных и животных моделях, показано, что повышенная экспрессия БТШ70 способствует снижению олигомеризации α-синуклеина [5, 6], а также ингибирует аккумуляцию полиглутамина, характерную для болезни Хантингтона [7]. Было показано, что введение рекомбинантного человеческого стресс белка (БТШ70) животным с моделью нейродегенераци типа болезни Альцгеймера, а также при сепсисе способно уменьшать клинические проявления этих патологий [8]. Уровень БТШ70 в спинном мозге пациентов со спорадической формой БАС значительно снижен [9], из чего можно предположить его роль в предотвращении развития патогенетического процесса.
Результаты этого исследования также вносят вклад в понимание роли БТШ70 в развитие процесса протеинопатии.
МАТЕРИАЛЫ И МЕТОДЫ
Животные. Для этого исследования была создана новая гибридная линия животных с коэкспрессией аберрантного белка ΔFUS(1-359) [1] и БТШ70 человека [10]. Генотип животных подтверждали при помощи ПЦР. Для определения наличия трансгенных кассет использовался метод ПЦР с использованием коммерческого набора GenPak PCR Core (ISOGENE laboratory ltd., Россия). Для детекции вставки FUS использовалась смесь праймеров: FUS_for: TCTTTGTGCAAGGCCTGGGT, FUS_rev: TAATCATGGGCTGTCCCGTT (Evrogen, Россия, C = 100 мкм) – 0.2 мкл. Для детекции вставки HSP использовалась смесь праймеров: HSP_for: AAGACCCTCCTCCTGTATGG, HSP_rev: TCAGACGCAACTCAGCAC (Evrogen, Россия, C = 100 мкм) – 0.2 мкл.
Для исследования использовали только самцов. В качестве контроля использовали геми- и гомозиготных особей по трансгенной кассете FUS(1-359), а также животных с экспрессией человеческой изоформы белка теплового шока 70 кДа (HSPhet) и животных дикого типа (CD1).
Методы оценки локомоторных функций. Оценку моторных функций трансгенных животных проводили при помощи тестов: “сила хватки”, “перевернутая сетка”, а также анализировали изменение походки при помощи установки CatWalk (Noldus, США). Животных тестировали в возрастных точках 30, 60, 90 и 120 дней, соответствующих разным стадиям развития модельного заболевания. Силу хватки передними лапами оценивали при помощи динамометра, каждое животное тестировали 3 раза. В качестве результата представлена сумма сил хватки в трех попытках.
В тесте “перевернутая сетка” животное помещали на сетку (размер ячейки 1 × 1 см), которую затем поднимали на высоту 1 м и переворачивали на 180° таким образом, чтобы мышь оказалась снизу, и выдерживали в течение 60 с. Фиксировали время проведенное на сетке в трех последовательных попытках с разницей 30 мин. В качестве результата представлено среднее время удержания на сетке в трех попытках. В данном тесте оценивается выносливость животного.
Дополнительно был проведен анализ изменения координации и походки животных на установке CatWalk. Животных помещали в темный коридор, подсвеченный снизу, и давали возможность свободно проходить в любом направлении. Каждое животное должно было совершить 3 успешных пробежки (“успешность” определяется программным обеспечением Noldus).
Протоколы экспериментального исследования на животных и методы эвтаназии согласованы с Комиссией по биоэтике ИФАВ РАН (протокол заседания Комиссии по биоэтике № 30 от 15.04.2019 г.).
Иммуногистохимия. Для иммуногистохимического анализа брали шейный отдел спинного мозга, как у животных гибридной линии FUS(1-359)Het-hHSPHet, так и у FUS(1-359)Het в качестве контроля. Ткани забирали в двух временных точках – 60 и 90 дней, каждая группа состояла из трех животных. Образцы ткани были зафиксированы раствором параформальдегида 4% и заключены в парафин. Проводили иммунофлуоресцентное окрашивание трансгенной аберрантной формы FUS(1-359), которую визуализировали с помощью антител против N-концевого фрагмента белка FUS (Abcam, Великобритания). Эндогенный FUS белок визуализирован с помощью окрашивания антителами против C-концевого фрагмента белка FUS (SantaCruzBiotech, США), который отсутствует у FUS(1-359).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Начиная с возраста 60 дней, животных ежедневно осматривали для детектирования начала симптоматической стадии болезни. Кривая выживаемости Каплан–Майера показывает, что у двойных трансгенов FUS(1-359)Het-hHSPHet средний возраст гибели был выше по сравнению с контрольными животными линии FUS(1-359)Het и FUS(1-359)Homo (рис. 1). Эти данные также коррелируют со средним возрастом начала манифестаций и продолжительности симптомов (рис. 2).
Рис. 1.
Сравнение кривых выживаемости (по Каплану-Мейеру) между группами модельных животных с двойным трансгеном FUS(1-359)Het-hHSPHet (n = 40), FUS(1-359)Het (n = 42), FUS(1-359)Homo (n = 45) и животными дикого типа линии CD1 (n = 11).
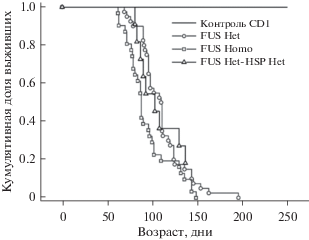
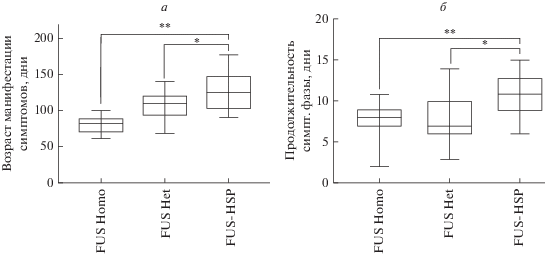
Рис. 2.
Манифестация и продолжительность клинических симптомов у трансгенных животных. Средний возраст начала (а) и продолжительности симптоматического периода (б) у животных с двойным трансгеном FUS(1-359)Het-hHSPHet (n = 39), гемизиготных FUS(1-359)Het (n = 60) и гомозиготных FUS(1-359)Homo (n = 53). Уровень достоверности оценивался согласно непараметрическому t-критерию Вилкоксона–Манна–Уитни: * p < 0.05; ** p < 0.01.
Другим важным физиологическим параметром, отражающим общую оценку здоровья, является прирост массы. Как правило, здоровые животные имеют стабильный прирост, тогда как начало патологического процесса часто коррелирует с флуктуациями в массе животных. В нашем исследовании было установлено, что прирост массы мышей двойных трансгенов FUS(1-359)Het-hHSPHet схож с приростом массы мышей дикого типа и трансгенных животных с экспрессией человеческой изоформы hHSPHet, тогда как у трансгенных гемизиготных животных FUS(1-359)Het этот показатель снижен. Было установлено, что пик падения прироста массы для двойных трансгенов (FUS(1-359)Het-hHSPHet) приходится на возраст 140 дней, тогда как у животных FUS Het – на 130 день.
Сила хватки у животных FUS(1-359)Het-hHSPHet в возрастной группе 60 дней достоверно превышала значения группы животных FUS(1-359)Het в этом же возрасте. Однако с возрастом сила хватки к 120 дню снижалась у животных FUS(1-359)Het-hHSPHet и достоверно не отличалась от животных FUS(1-359)Het, тогда как показатели в двух других контрольных группах (контрольные животные дикого типа WT и животные с экспрессией hHSPHet) неуклонно росли (рис. 3а). Такого рода данные могут свидетельствовать о потенциальном терапевтическом эффекте БТШ70 на ранних стадиях заболевания, когда в тканях трансгенных животных с развивающейся протеинопатией еще не детектируются отложения. Вероятнее всего, с возрастом накопление внутриклеточных FUS-позитивных отложений приводит к гибели мотонейронов и прогрессии протеинопатии.
Рис. 3.
Результаты теста “сила хватки” (а) и среднее время удерживания на перевернутой сетке (б) для групп FUS(1-359)Het-hHSPHet (n = 13), FUS(1-359)Het (n = 9), дикого типа CD1 (WT) (n = 7), а также hHSPHet (n = 11). Уровень достоверности оценивался согласно непараметрическому t-критерию Вилкоксона–Манна–Уитни: * p < 0.05.
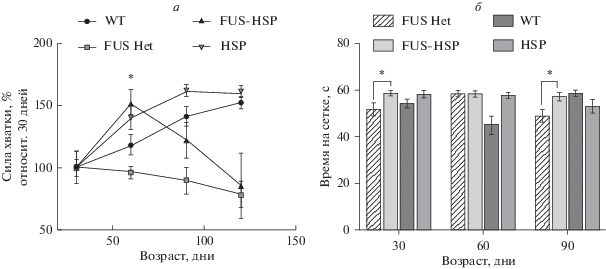
Результаты теста “перевернутая сетка” показали, что достоверные отличия были обнаружены у животных FUS(1-359)Het-hHSPHet и FUS(1-359)Het в возрастных группах 30 и 90 дней (рис. 3б), что свидетельствует о том, что животные гибридной линии с экспрессией человеческой изоформы hHSPHet были выносливее трансгенных животных линии FUS(1-359)Het.
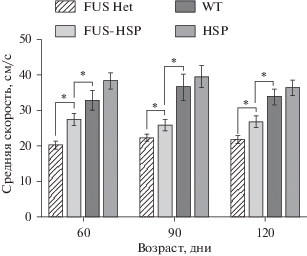
Дополнительно был проведен анализ изменения координации и походки животных на установке CatWalk. Ранее были определены критерии, которые позволяли оценить основные параметры моторной дисфункции, отличающиеся у контрольных животных дикого типа и трансгенных животных линии FUS(1-359)Het. Однако, несмотря на большое количество выявленных критериев, наиболее физиологически релевантным оказалось изменение средней скорости движения животного. Достоверные отличия скорости движения в группах FUS(1-359)Het и FUS(1-359)Het-hHSPHet наблюдались во всех возрастных группах (рис. 4). Однако стоит отметить, что показатели скорости животных в группе FUS(1-359)Het-hHSPHet достоверно отличались во всех тестируемых возрастных группах относительно контрольной группы животных дикого типа. Это может свидетельствовать о том, что нейропротекторный эффект БТШ70 был недостаточным для полного восстановления двигательных функций до значений, наблюдаемых у контрольной группы.
Рис. 4.
Результаты характеристики средней скорости движения животных в установке NoldusCatwalk у трансгенных животных в разных возрастных группах (60, 90 и 120 дней). Количество животных с двойным трансгеном FUS(1-359)Het-hHSPHet (n = 13), FUS(1-359)Het (n = 9), животных дикого типа линии CD1 (WT, n = 7) и животных с экспрессией человеческой изоформы БТШ70 (HSP, n = 11). Уровень достоверности оценивался согласно непараметрическому t‑критерию Вилкоксона–Манна–Уитни: * p < 0.05.
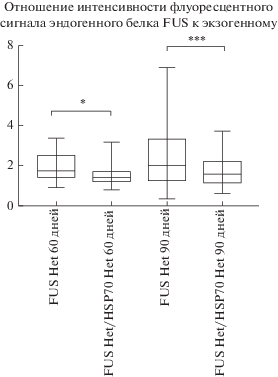
Для определения роли БТШ70 в накоплении FUS(1-359)-позитивных отложений провели иммунофлуоресцентный анализ гистопатологических отложений в спинном мозге трансгенных животных. Оказалось, что у гибридной линии трансгенных животных FUS-HSP общая плотность FUS(1-359)-позитивно окрашенных клеток ниже по сравнению с трансгенными животными линии FUS Het в обеих возрастных точках, выбранных для анализа. Для количественной оценки этого параметра использовали отношение плотности сигнала эндогенного белка FUS к экзогенному (рис. 5).
Рис. 5.
Сравнение отношения флуоресцентного сигнала эндогенного белка FUS к экзогенному у животных с двойным трансгеном FUS(1-359)Het-hHSPHet и FUS(1-359)Het. Уровень достоверности оценивался согласно непараметрическому t-критерию Вилкоксона–Манна–Уитни: * p < 0.05; *** p < 0.001.
Известно, что белки теплового шока играют важную роль в обеспечении гомеостаза организма, а также являются частью нейропротекторной системы. Возрастные изменения совпадают с нейродегенеративными процессами, связанными с накоплением в нервной системе различных белковых отложений. Поведенческая характеристика и фенотипирование новой гибридной линии животных выявили, что экспрессия белка БТШ70 человека способствует увеличению продолжительности жизни в условиях развивающейся протеинопатии. Это один из первых важных результатов, указывающих на возможность использования препаратов на основе БТШ70 в качестве лекарственного средства для лечения нейродегенеративных расстройств. Полученные результаты по оценке возраста манифестации и продолжительности симптоматической фазы (оба значения увеличивались) у FUS(1-359)Het-hHSPHet животных могут свидетельствовать о болезнь-модифицирующих свойствах привнесенного БТШ70. Это также поддерживает вывод об основной роли БТШ70 в качестве нейропротекторного агента при развивающейся FUS-протеинопатии, что подтверждается результатами иммуногистохимического окрашивания срезов спинного мозга.
Можно отметить, что биологическая роль БТШ70 при развивающейся протеинопатии на физиологическом уровне заключается в увеличении выносливости, мышечной силы и улучшении координации трансгенных животных, моделирующих нейродегенеративное заболевание.
При детальном анализе отложений было выявлено, что нейроны в передних рогах шейного отдела спинного мозга (в зоне от третьего сегмента L3 до пятого L5) у трансгенных животных линии FUS Het образуют гистопатологические включения, которые не встречаются в этих же сегментах спинного мозга у гибридной линии животных FUS-HSP. Вполне возможно, что наличие трансгенной человеческой изоформы БТШ70 может влиять на формирование сложных внутриклеточных отложений, являющихся причиной развивающейся протеинопатии. Следовательно, наличие человеческой изоформы БТШ70 в трансгенных животных может выполнять функцию шаперона, которая препятствует формированию белковых отложений, тем самым проявляя нейропротекторные свойства.
Список литературы
Shelkovnikova T.A., Peters O.M., Deykin A.V., Connor-Robson N., Robinson H., Ustyugov A.A., Bachurin S.O., Ermolkevich T.G., Goldman I.L., Sadchikova E.R., Kovrazhkina E.A., Skvortsova V.I., Ling S.C., Da Cruz S., Parone P.A., Buchman V.L., Ninkina N.N. // J. Biol. Chem. 2013. V. 288. № 35. P. 25266–25274.
Labbadia J., Morimoto R.I. // Annu. Rev. Biochem. 2015. № 84. P. 435–464.
Yerbury J.J., Ooi L., Dillin A., Saunders D.N., Hatters D.M., Beart P.M., Cashman N.R., Wilson M.R., Ecroyd H. // J. Neurochem. 2016. № 137. P. 489–505.
Lackie R.E., Maciejewski A., Ostapchenko V.G., Marques-Lopes J., Choy W.-Y., Duennwald M.L., Prado V.F., Prado M. // Front. Neurosci. 2017. P. 11–254.
Outeiro T.F., Putcha P., Tetzlaff J.E., Spoelgen R., Koker M., Carvalho F., Hyman B.T., McLean P.J. // PLoS One. 2008. № 3. P. e1867.
Putcha P., Danzer K.M., Kranich L.R., Scott A., Silinski M., Mabbett S., Hicks C.D., Veal J.M., Steed P.M., Hyman B.T., McLean P.J. // J. Pharmacol. Exp. Ther. 2010. № 332. P. 849–857.
Sittler A., Lurz R., Lueder G., Priller J., Hayer-Hartl M.K., Hartl F.U., Lehrach H., Wanker E.E. // Hum. Mol. Genet. 2001. № 10. P. 1307–1315.
Bobkova N.V., Garbuz D.G., Nesterova I., Medvinskaya N., Samokhin A., Alexandrova I., Yashin V., Karpov V., Kukharsky M.S., Ninkina N.N., Smirnov A.A., Nudler E., Evgen’ev M.E. // J. Alzheimer’s Dis. 2014. V. 2. № 38. P. 425–435.
Chen H.-J., Mitchell J.C., Novoselov S., Miller J., Nishimura A.L., Scotter E.L., Vance C.A., Cheetham M.E., Shaw C.E. // Brain J. Neurol. 2016. № 139. P. 1417–1432.
Gurskiy Y.G., Garbuz D.G., Soshnikova N.V., Krasnov A.N., Deikin A., Lazarev V.F., Sverchinskyi D., Margulis B.A., Zatsepina O.G., Karpov V.L., Belzhelarskaya S.N., Feoktistova E., Georgieva S.G., Evgen’ev M.B. // Cell Stress Chaperones. 2016. V. 21. № 6. P. 1055–1064.
Руководство по содержанию и использованию лабораторных животных. Восьмое издание. / Пер. с англ. Под ред. Белозерцевой И.В., Блинова Д.В., Красильщиковой М.С. М.: ИРБИС, 2017. 336 с.
Funikov S.Y., Rezvykh F.P., Mazin P.V., Morozov A.V., Maltsev A.V., Chicheva M.M., Vikhareva E.A., Evgen’ev M.B., Ustyugov A.A. // Neurogenetics. 2018. V. 19(3). P. 189–204.
Дополнительные материалы отсутствуют.


