Нейрохимия, 2021, T. 38, № 2, стр. 177-185
Вариабельность профилей экспрессии генов нейровоспаления в мононуклеарных клетках периферической крови при боковом амиотрофическом склерозе
М. В. Иванова 1, А. С. Воронкова 1, В. С. Сухоруков 1, М. Н. Захарова 1
1 ФГБНУ “Научный центр неврологии”
Москва, Россия
Поступила в редакцию 31.12.2020
После доработки 05.01.2021
Принята к публикации 06.01.2021
Аннотация
Боковой амиотрофический склероз (БАС) – нейродегенеративное заболевание, характеризующееся неуклонно прогрессирующей гибелью двигательных нейронов головного и спинного мозга. Заболевание является неизлечимым и неминуемо приводит к гибели больного, в среднем, в течение 3–5 лет. Механизмы инициации, прогрессирования и распространения патологического процесса до сих пор неясны. Считается, что воспалительные реакции могут иметь важное значение в прогрессировании заболевания, но их значение до конца не ясно. Нами проведен мультиплексный анализ экспрессии генов нейровоспаления в мононуклеарных клеток периферической крови у пациентов с различными темпами прогрессирования БАС (n = 22) в сравнении со здоровыми добровольцами. Выявлено 14 генов (BAX, CLN3, PLEKHM1, AKT1, LAMP1, RAC2, VAV1, MPG, TFG, BRD2, CSK, MSN, GBA, VIM), экспрессия которых различалась между пациентами с БАС и здоровыми добровольцами (p < 0.05; q < 0.05). Среди них преобладали гены, связанные с аутофагией, апоптозом, приобретенным иммунитетом и каскадами факторов роста. Существенных различий экспрессии генов между пациентами с быстрыми и медленными темпами прогрессирования БАС не определялось. Была выделена подгруппа пациентов с БАС с профилем экспрессии генов нейровоспаления, существенно отличавшимся от других пациентов с БАС (по 208 генам) и здоровых добровольцев (по 262 генам) (p < 0.05; q < 0.05). Полученные данные могут говорить о значимости не только центральных, но и периферических воспалительных реакций в развитии патологического процесса при БАС.
Боковой амиотрофический склероз (БАС) представляет собой нейродегенеративное заболевание, характеризующееся неуклонно прогрессирующей гибелью двигательных нейронов, приводящей к развитию спастико-атрофических поражений, скелетной мускулатуры. Медиана возраста дебюта БАС составляет 55 лет, растет заболеваемость и среди лиц молодого возраста [1], что, возможно, в определенной мере может объясняться ухудшением экологической обстановки. Заболевание дебютирует, как правило, на одном анатомическом уровне, после чего патологический процесс постепенно распространяется, в конечном итоге вовлекая жизненно-важную дыхательную мускулатуру и приводя на протяжении, в среднем, 3–5 лет к гибели больного [2]. Темпы прогрессирования патологического процесса при БАС очень разнородны. Длительное время отечественными и зарубежными [3] учеными ведется поиск диагностических и прогностических маркеров заболевания, однако этот вопрос остается нерешенным, что создает затруднения для принятия решений по планированию жизни пациентом. Эффективных методов лечения к настоящему моменту не разработано.
Механизмы инициации, прогрессирования и распространения патологического процесса до сих пор не выяснены. По современным представлениям, существенную роль играют генетические факторы. 5–15% случаев БАС являются семейными, остальные спорадическими, однако и при них нередко выявляются потенциально патогенные мутации [4]. Среди патофизиологических явлений, имеющих значение в развитии БАС, ведущее место занимают нарушение гомеостаза белков с накоплением патологических белковых агрегатов и нарушение процессинга РНК. Также определенную патогенетическую роль играют нарушение динамики цитоскелета, структуры и функции аксонов, эндосомального транспорта, репарации ДНК, аутофагии, эксайтотоксичность, окислительный стресс, митохондриальная дисфункция, активация микроглии и, наконец, нейровоспаление [5].
Считается, что нейровоспаление имеет важное значение в ходе прогрессирования патологического процесса при БАС. Развивающиеся на начальных этапах БАС преимущественно протективные противовоспалительные реакции по мере прогрессирования заболевания сменяются токсическими провоспалительными [6]. Тем не менее, механизмы нейровоспаления, имеющие ключевое значение при БАС на настоящий момент мало изучены.
Учитывая вышесказанное, изучение экспрессии генов нейровоспаления при БАС и их вклада в прогрессирование и распространение патологического процесса может способствовать выявлению новых диагностических и прогностических биомаркеров, а также мишеней для терапевтического воздействия. Целью настоящего исследования был мультиплексный анализ экспрессии генов, связанных с широким спектром процессов, относящихся к нейровоспалению, у пациентов с различными темпами прогрессирования БАС в сравнении со здоровыми добровольцами.
МЕТОДЫ ИССЛЕДОВАНИЯ
Пациенты. Критериями включения были: диагноз БАС согласно переработанным критериям El Escorial [7], возраст старше 20 лет, быстрые или медленные темпы прогрессирования заболевания (см. далее), бульбарная, шейно-грудная или пояснично-крестцовая формы БАС, наличие подписанного информированного согласия на участие в исследовании. Критериями исключения были: наличие хронических воспалительных заболеваний, онкологической патологии, других неврологических заболеваний, острое инфекционное заболевание в течение месяца до включения в исследование, прием препаратов, действующих на иммунную систему (кортикостероиды, цитостатики и др.). На основании критериев исключения в группу не вошли 7 пациентов, потенциально подходивших по критериям включения. Один пациент был исключен из анализа в связи с тем, что не пройден контроль качества при анализе экспрессии генов нейровоспаления. В результате в исследовании приняли участие 22 пациента с БАС и 12 здоровых добровольцев. Пациенты были набраны в 2 подгруппы, в зависимости от темпов прогрессирования заболевания в течение 12 месяцев до включения в исследования: 1. медленно прогрессирующие – снижение балла по шкале функциональной оценки при БАС ALS-FRS-R не более 2 баллов; быстро прогрессирующие – снижение балла по шкале ALS-FRS-R на 10 и более. Пациенты не страдали хроническими аутоиммунными, инфекционными и онкологическими заболеваниями, не переносили острых инфекций по крайней мере в течение месяца до включения в исследование.
Выделение РНК. РНК была выделена из мононуклеарных клеток периферической крови (PBMC). Забор крови производился в пробирки BD Vacutainer с ЭДТА (BD, USA), материал обрабатывался в течение часа после забора. PBMC выделяли с помощью градиента плотности с использованием фиколла Histopaque-1077 (Sigma-Aldrich, USA). Образцы крови были аккуратно нанесены на слой фиколла в пробирке объемом 15 мл. Пробирки были центрифугированы при 400 g в течении 30 мин при комнатной температуре. Полученный в результате центрифугирования слой PBMC переносился в стерильную пробирку и отмывался в 10 мл фосфатного буфера (1% FBS), после чего центрифугировался в течение 10 мин при 300 g. Надосадок удалялся, клетки ресуспендировались в 1 мл клеточной среды RPMI и считались. Аликвоты по 3–5 × 106 PBMC были заморожены при –80°C до изоляции РНК. РНК была изолирована из одной аликвоты с помощью набора для выделения РНК Total RNA Purification Plus Kit (Norgern Biotek, Canada) согласно инструкции производителя. Концентрация РНК измерялась с помощью NanoDrop2000C (ThermoScientific) и корректировалась до 60 нг/мкл с помощью вакуумного концентратора. Соотношение OD260/280 для всех образцов составляло 1.72–2.10. Образцы РНК хранились до использования при –80°C, но не более 1 мес.
Мультиплексный анализ экспрессии генов нейровоспаления. Анализ экспрессии генов нейровоспаления проводился с помощью методики NanoString (NanoString Technologies, WA). Технология основана на уникальном прямом баркодировании целевой РНК с помощью флуоресцентных проб. В нашем исследовании была использована стандартная панель генов нейровоспаления nCounter Human Neuroinflammation panel, состоящая из 770 генов, включая 758 сигнатурных генов и 12 конститутивных генов. Образцы анализировались на приборе nCounter Analysis System (NanoString Technologies) согласно инструкции производителя. Каждый образец содержал по меньшей мере 300 нг РНК. Первичная обработка данных проводилась с помощью программного обеспечения nSolver package (version 4.0). Нормализация первичных данных проводилась по 6 положительным контролям и 12 конститутивным генам, включенным в панель. Фон оценивался по 6 отрицательным контролям, также присутствующим в панели. Для дальнейшего анализа экспрессии использовался модуль Advanced Analysis module. Данные, полученные с помощью системы nCounter, выражены в условных единицах, отражающих концентрацию таргетных молекул РНК в образце. Образцы были заслеплены: экспериментатор не знал о принадлежности образцов пациентам определенных групп.
Статистическая обработка данных. Статистическая обработка данных проводилась с помощью IBM SPSS Statistics 23 и GraphPad Prizm 8. Данные были заслеплены: клинические характеристики и принадлежность к той или иной группе были закодированы, экспериментатор не имел доступа к данным о пациентах во время статистического анализа. Для анализа использовались Log2-данные. Проверка на нормальность распределения проводилась с помощью критерия Колмогорова–Смирнова. Поскольку проверка на нормальность подтвердила нормальное распределение данных внутри групп здоровых добровольцев (0), пациентов с медленным прогрессированием и быстрым прогрессированием БАС, а также внутри групп пациентов с профилями экспрессии 1 и 2, для выявления дифференциально экспрессируемых генов (ДЭГ) в этих группах применялся однофакторный дисперсионный анализ c проведением поправки на пол и возраст. Критерием выявления ДЭГ было значение р < 0.05. Для исключения ложноположительных результатов проводилась поправка на множественность сравнений Беньямини–Хохберга (показатель q), пороговым значением для выявления ДЭГ было значение q < 0.05. Для ДЭГ был проведен post-hoc анализ с попарными сравнениями между группами и поправкой Бонферрони. Различия между группами считались статистически значимыми при р < 0.05. Для выявления корреляций между экспрессией генов и клиническими характеристиками заболевания был использован коэффициент ранговой корреляции Спирмена. Корреляции считались значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Клиническая характеристика пациентов. В исследование были включены 22 пациента с БАС: 11 с быстрыми темпами прогрессирования за последний год (снижение по ALSFRS-R на более 10 баллов), 11 с медленными темпами прогрессирования (снижение балла по ALSFRS-R за год на 1–2 балла) и 12 здоровых добровольцев. Клиническая характеристика групп исследования представлена в табл. 1. Статистически значимых различий по полу, возрасту, частоте встречаемости различных форм заболевания, жизненной емкости легких (ЖЕЛ), индексу массы тела (ИМТ) между группами не выявлено. В группе пациентов с быстрым темпом прогрессирования была отмечена меньшая длительность заболевания (p = 0.002), ниже значение балла по шкале ALSFRS-R (p < 0.001) и большее значение стадии заболевания (p < 0.001), что говорит о худшем функциональном состоянии пациентов этой группы. В группе пациентов с быстрым темпом прогрессирования было большее количество больных с бульбарной формой и меньшее количество пациентов с пояснично-крестцовой формой, чем в группе с медленным темпом прогрессирования, что представляется логичным, поскольку дебют заболевания с бульбарных нарушений считается прогностически неблагоприятным [7]. Тем не менее, в связи с общностью патофизиологических процессов, анатомический уровень, на котором дебютировало заболевание не влияет на однородность групп и статистическую обработку результатов.
Таблица 1.
Клиническая характеристика групп
| Параметр | Все пациенты с БАС (n = 22) | Быстрое прогрессирование (n = 11) | Медленное прогрессирование (n = 11) | Здоровые добровольцы (n = 12) |
|---|---|---|---|---|
| Возраст, Me [Q1;Q3] | 52.5 [45,2; 64.5] | 57 [49; 69] | 51 [36.5; 56] | 49.5 [41.25; 56] |
| Пол, М/Ж, % | 50/50 | 63.6/36.4 | 36.4/63.6 | 42/52 |
| Длительность заболевания, Me [Q1;Q3] | 18.5 [14.2; 37.5 ] | 15 [9; 18] | 36 [19; 48.5] | – |
| Стадия заболевания (2/3/4) | 8/7/7 | 0/4/7 | 8/3/0 | – |
| Форма (Б/ШГ/ПК) | 5/12/5 | 4/6/1 | 1/6/4 | – |
| ALSFRS-R | 38 [35; 43.5 ] | 35 [24.5; 37 ] | 44 [41; 44.5 ] | – |
| ЖЕЛ (%ДЖЕЛ), Me [Q1;Q3] | 89.8 [69.4; 100.8] | 70.2 [60; 99.7] | 95 [81.6; 101] | – |
| ИМТ, Me [Q1;Q3] | 27.2 [23.5; 35.2 ] | 25.7 [21.3; 35.7 ] | 29.8 [26.3; 31.4 ] | – |
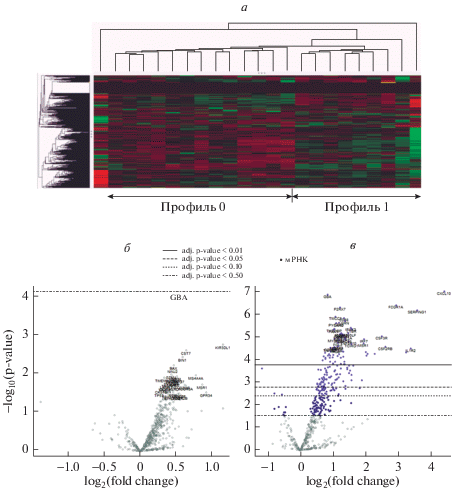
Экспрессия генов нейровоспаления у пациентов с БАС. Различия экспрессии генов нейровоспаления были визуализированы с помощью тепловой карты, согласно которой есть большой пул генов, различающихся у здоровых добровольцев и пациентов с БАС. Также видны группы генов, различающихся по экспрессии между пациентами с различными темпами прогрессирования БАС (рис. 1). Однако при проведении статистического анализа различий экспрессии генов нейровоспаления в группах пациентов с быстрым и медленным течением БАС и здоровыми добровольцами было выявлено всего 14 генов со статистически значимым различием экспрессии: BAX, CLN3, PLEKHM1, AKT1, LAMP1, RAC2, VAV1, MPG, TFG, BRD2, CSK, MSN, GBA, VIM (табл. 2). Наиболее широко представленными функциональными группами со статистически значимым различием экспрессии были гены, связанные с аутофагией (CLN3, AKT1, LAMP1, RAC2, VAV1, CSK, MSN), апоптозом (BAX, AKT1, TFG, GBA), приобретенным иммунитетом и факторами роста (AKT1, RAC2, VAV1, CSK). Попарное сравнение групп показало, что экспрессия всех указанных генов, кроме BRD2, различается между пациентами с БАС и здоровыми добровольцами, но не между пациентами с быстрым и медленным темпами прогрессирования БАС. Экспрессия гена BRD2 была повышена в группе пациентов с быстрым прогрессированием заболевания, по сравнению с пациентами с медленным прогрессированием БАС и здоровыми добровольцами. Ген BRD2 функционально относится к генам, связанным с эпигенетическим регулированием. Ранее BRD2 не был ассоциирован с БАС, его связывали с развитием нервной системы в процессе эмбриогенеза, с ювенильной миоклонической эпилепсией, ожирением и определенными гемобластозами [8–10].
Рис. 1.
Экспрессия генов нейровоспаления в группах пациентов с БАС и здоровых добровольцев. В столбцах представлены усредненные значения экспрессии генов групп пациентов: 0 – здоровые добровольцы; 1 – пациенты с медленным прогрессированием БАС в последние 12 мес.; 2 – пациенты с быстрым прогрессированием БАС в последние 12 мес. Строки представляют уровень экспрессии отдельных генов: черный – среднее значение экспрессии по общей выборке пациентов; красный – повышенный уровень экспрессии по сравнению со средним; зеленый – пониженный уровень экспрессии.

Таблица 2.
Дифференциально экспрессируемые гены у пациентов с БАС и здоровых добровольцев
| Ген | Группа | Среднее | Стандартная ошибка среднего | Fold Change | F(ANOVA) | p | q |
|---|---|---|---|---|---|---|---|
| BAX | 0 | 1065.54 | 38.03 | 1 | 20.21 | 0.0000024 | 0.001596 |
| 1 | 1357.79 | 42.59 | 1.27 | ||||
| 2 | 1449.79 | 58.98 | 1.36 | ||||
| CLN3 | 0 | 87.02 | 6.57 | 1 | 17.97 | 0.0000066 | 0.0021945 |
| 1 | 142.04 | 10.18 | 1.63 | ||||
| 2 | 141.30 | 8.66 | 1.62 | ||||
| PLEKHM1 | 0 | 265.07 | 15.49 | 1 | 16.63 | 0.0000124 | 0.0027487 |
| 1 | 364.52 | 19.43 | 1.38 | ||||
| 2 | 393.70 | 18.99 | 1.49 | ||||
| AKT1 | 0 | 363.47 | 18.59 | 1 | 12.97 | 0.0000808 | 0.0107255 |
| 1 | 508.90 | 33.61 | 1.40 | ||||
| 2 | 529.28 | 31.61 | 1.46 | ||||
| LAMP1 | 0 | 1274.60 | 57.47 | 1 | 12.74 | 0.0000917 | 0.0107255 |
| 1 | 1665.57 | 87.34 | 1.31 | ||||
| 2 | 1720.85 | 76.17 | 1.35 | ||||
| RAC2 | 0 | 1393.33 | 85.17 | 1 | 12.55 | 0.0001017 | 0.0107255 |
| 1 | 1896.25 | 122.81 | 1.36 | ||||
| 2 | 1975.77 | 82.79 | 1.42 | ||||
| VAV1 | 0 | 899.20 | 32.32 | 1 | 12.36 | 0.0001129 | 0.0107255 |
| 1 | 1085.42 | 29.45 | 1.21 | ||||
| 2 | 1072.64 | 29.86 | 1.19 | ||||
| MPG | 0 | 172.94 | 8.72 | 1 | 12.02 | 0.0001364 | 0.0113383 |
| 1 | 217.20 | 10.56 | 1.26 | ||||
| 2 | 235.33 | 9.04 | 1.36 | ||||
| TFG | 0 | 339.05 | 9.70 | 1 | 11.02 | 0.0002423 | 0.0165718 |
| 1 | 410.41 | 17.44 | 1.21 | ||||
| 2 | 425.99 | 16.53 | 1.26 | ||||
| BRD2 | 0 | 2109.94 | 94.99 | 1 | 10.97 | 0.0002492 | 0.0165718 |
| 1 | 2307.51 | 65.45 | 1.09 | ||||
| 2 | 2665.99 | 89.24 | 1.26 | ||||
| CSK | 0 | 2296.49 | 93.43 | 1 | 10.32 | 0.0003678 | 0.0222352 |
| 1 | 2799.89 | 78.46 | 1.22 | ||||
| 2 | 2763.49 | 97.28 | 1.20 | ||||
| MSN | 0 | 5692.86 | 234.16 | 1 | 9.85 | 0.0004879 | 0.0269683 |
| 1 | 6905.87 | 246.57 | 1.21 | ||||
| 2 | 6950.10 | 220.10 | 1.22 | ||||
| GBA | 0 | 514.01 | 35.32 | 1 | 9.72 | 0.0005272 | 0.0269683 |
| 1 | 696.76 | 25.83 | 1.36 | ||||
| 2 | 678.12 | 27.54 | 1.32 | ||||
| VIM | 0 | 10900.21 | 529.63 | 1 | 8.74 | 0.0009768 | 0.046398 |
| 1 | 13737.53 | 694.63 | 1.26 | ||||
| 2 | 15899.32 | 1440.21 | 1.46 |
Корреляции экспрессии генов нейровоспаления с клиническими характеристиками. В ходе корреляционного анализа были проанализированы взаимосвязи экспрессии генов нейровоспаления с клиническими характеристиками заболевания у 22 пациентов с БАС, принявших участие в исследовании. Была выявлена статистически значимая умеренная положительная (r = 0.5–0.75) корреляция экспрессии генов BRD2 (r = 0.535, p = 0.01), связанного с эпигенетической регуляцией, и FYN (r = 0.575, p = 0.005), участвующего в каскадах врожденного и приобретенного иммунитета, функционировании микроглии, факторов роста, ангиогенеза и аутофагии, со стадией заболевания. Значение балла по шкале ALSFRS-R имело умеренную отрицательную корреляцию с экспрессией генов KDM3A (r = –0.623, p = 0.002), связанного с эпигенетической регуляцией, PILRB (r = –0.512, p = = 0.015), участвующего в реакциях врожденного иммунитета, и TSPAN18 (r = –0.529, p = 0.011), связанного с функцинированием микроглии; уменьшение балла по шкале ALSFRS-R за последние 12 мес. имело положительную корреляцию с экспрессией BRD2 (r = 0.588, p = 0.004), CTSW (r = 0.526, p = 0.012), секретируемого цитотоксическими клетками, и KDM3A (r = 0.542, p = = 0.009). Наибольшее количество статистически значимых корреляций было выявлено между экспрессией генов нейровоспаления и длительностью заболевания. Экспрессия генов C6 (r = 0.547, p = 0.008), CCNG2 (r = 0.514, p = 0.014), CD47 (r = = 0.543, p = 0.009), CLDN5 (r = 0.501, p = 0.017), CLIC4 (r = 0.628, p = 0.002), COA5 (r = 0.501, p = = 0.018), COL6A3 (r = 0.527, p = 0.012), DNA2 (r = = 0.510, p = 0.015), ESAM (r = 0.525, p = 0.012), IKBKB (r = 0.516, p = 0.014), PROS1 (r = 0.651, p = = 0.001), RAB6B (r = 0.629, p = 0.002), TMEM64 (r = 0.675, p = 0.001) положительно коррелировала с длительностью заболевания. Среди них наиболее широко представлены гены, связанные с активацией микроглии и ремоделированием матрикса. Экспрессия DDB2, связанным с повреждением ДНК, имела отрицательную корреляцию с длительностью заболевания.
Воспалительный профиль экспрессии у части пациентов. При анализе тепловой карты и вулканных диаграмм экспрессии генов нейровоспаления пациентов с БАС были визуализированы два профиля экспрессии: профиль 1 (12 пациентов) и 2 (7 пациентов) (рис. 2). Был проведен статистический анализ экспрессии генов нейровоспаления у пациентов с профилем 1, профилем 2 и здоровых добровольцев, который выявил 292 дифференциально экспрессируемых гена. При попарном post-hoc сравнении групп выявлено, что наиболее выраженное отличие от остальных групп имеет профиль 2: обнаружено 208 генов, по которым профиль 2 статистически значимо различался с профилем 1, и 262 гена, различавших его с группой здоровых добровольцев. Напротив, профиль 1 различался с профилем здоровых добровольцев лишь по 49 генам. Основными функциональными группами генов, по которым профиль 2 отличался от остальных профилей экспрессии, были гены, связанные с врожденным и приобретенным иммунитетом, функционированием микроглии, апоптозом, аутофагией и факторами роста. При анализе клинических характеристик пациентов, имевших профили экспрессии 1 и 2, существенных различий выявлено не было. Темпы прогрессирования заболевания также не были связаны с профилем экспрессии.
Рис. 2.
Различные профили экспрессии генов нейровоспаления у пациентов с БАС. (а) Тепловая карта экспрессии генов нейровоспаления у пациентов с БАС. В столбцах представлены значения экспрессии генов отдельных пациентов. Строки представляют уровень экспрессии отдельных генов: черный – среднее значение экспрессии по общей выборке пациентов; красный – повышенный уровень экспрессии по сравнению со средним; зеленый – пониженный уровень экспрессии. Первый столбец представляет собой результаты пациента, который был исключен из исследования в связи тем, что образец не прошел контроль качества. (б) Вулканная диаграмма, представляющая сравнение изменение экспрессии генов, ассоциированных с нейровоспалением, в группе с профилем 1 по сравнению со здоровыми добровольцами. По оси абсцисс – кратность изменения экспрессии, по оси ординат – отрицательный десятичный логарифм уровня значимости р. (в) Вулканная диаграмма, представляющая сравнение изменение экспрессии генов, ассоциированных с нейровоспалением, в группе с профилем 2 по сравнению со здоровыми добровольцами. По оси абсцисс – кратность изменения экспрессии, по оси ординат – отрицательный десятичный логарифм уровня значимости р. Синим выделены гены, достоверно различающиеся между группами.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В нашем исследовании были выявлены гены, связанные с нейровоспалением, экспрессия которых различается в мононуклеарных клетках периферической крови у больных с БАС и здоровых людей – это были гены, связанные с аутофагией, апоптозом, реакциями приобретенного иммунитета и сигнальными каскадами факторов роста. У больных с БАС было обнаружено 2 различных профиля экспрессии генов нейровоспаления. Один из них был схож с профилем экспрессии здоровых людей, в другом отличалась экспрессия генов, связанных с врожденным и приобретенным иммунитетом, функцией микроглии, аутофагией и апоптозом, каскадами факторов роста.
В последние годы все больше исследований указывают на роль системного воспаления и иммунных реакций у пациентов с БАС [11–13]. Показано, что при БАС происходит активация микроглии и астроцитов, что имеет нейропротективное значение на ранних этапах заболевания и провоспалительное на поздних стадиях. В зонах гибели мотонейронов в ЦНС среди основных патологических изменений описывается активация микроглии и периваскулярная инфильтрация моноцитами и Т-клетками [14]. При прижизненной позитронной эмиссионной томографии головного мозга у пациентов с БАС выявляются признаки распространенной активации микроглии [15]. Активированные в результате других патологических реакций, связанных с БАС, астроциты и микроглия способствуют ускорению темпов гибели нейронов. Провоспалительные цитокины, секретируемые ими, содействуют процессам глутаматной эксайтотоксичности, связывая между собой нейровоспаление и гибель нейронов, ассоциированную с эксайтотоксичностью [16].
При БАС описаны мутации в множестве генов, экспрессируемых как в нейронах, так и в микроглии, приводящие к нарушению аутофагии, активации воспалительных путей в микроглии и астроглии и гибели двигательных нейронов [1, 17]. Но даже у пациентов со спорадическим БАС без известных генетических изменений отмечается увеличение численности провоспалительных макрофагов и дисфункциональных Т-регуляторных клеток [13, 18]. В ряде исследований отмечено снижение экспрессии основного маркера Т-регуляторных клеток фактора транскрипции FOXP3 у пациентов с БАС и их способности подавлять пролиферацию других Т-лимфоцитов, что приводило к активации провоспалительных реакций. Эти изменения были наиболее выраженными у пациентов с быстрыми темпами прогрессирования заболевания. Интересно отметить, что при культивировании Т-регуляторных клеток, полученных от пациентов с БАС, со временем их функциональные способности восстанавливались [18, 19].
При анализе транскриптома у близнецов, среди которых только один болен БАС, определялось различие экспрессии 750 генов, принадлежащих к 74 сигнальным путям. Среди них отмечалось повышение экспрессии генов принадлежащих к 25 путям, связанным с иммунными функциями и передачей сигнала в клетках [20]. Изменение экспрессии генов, связанных с нейровоспалением было обнаружено и в фибробластах, полученных от пациентов с БАС, по сравнению с фибробластами здоровых людей, – наиболее выраженными были отличия экспрессии генов, принадлежащим к сигнальным путям Toll- и NOD-подобных рецепторов [12]. При анализе экспрессии генов нейровоспаления циркулирующих моноцитов пациентов с БАС был выявлен специфический провоспалительный профиль, включающий IL1B, IL8, FOSB, CXCL1 и CXCL2. Научной группой Zhao W. и соавт. в моноцитах пациентов с быстропрогрессирующим течением БАС было выявлено большее число генов с отличающейся от здоровых добровольцев экспрессией, чем в моноцитах больных с медленно прогрессирующим течением. Подобное провоспалительное состояние врожденной иммунной системы указывает на возможную роль моноцитов/макрофагов в патогенезе БАС [13]. В нашем исследовании существенных различий между профилями экспрессии генов нейровоспаления у пациентов с быстро и медленно прогрессирующим течением БАС не обнаружено. Такое расхождение результатов может быть связано с использованием другого набора исследуемых генов и биологического материала, а также других критериев оценки темпов прогрессирования БАС. В то же время у пациентов с отличающимся профилем экспрессии генов нейровоспаления (профиль 2) в нашей работе более быстрого темпа прогрессирования заболевания отмечено не было. Клинические характеристики, связанные с провоспалительным профилем экспрессии генов в РВМС у части пациентов с БАС в нашем исследовании, еще предстоит уточнить.
Каким образом провоспалительные миелоидные клетки могут быть связаны с прогрессированием БАС пока неясно. Возможно они мигрируют в ЦНС, поскольку при БАС и в моделях БАС показано нарушение целостности гематоэнцефалического барьера (ГЭБ) [21]. Оказывая провоспалительное воздействие в ЦНС, они могут способствовать нейродегенерации. Даже если они не проникают в ЦНС они могли бы модулировать течение заболевания за счет увеличения выраженности периферического воспаления: проникая в селезенку, лимфатические узлы и контактируя с клетками периферической крови, они могут модулировать провоспалительный статус Т-клеток [22], дендритных клеток и натуральных киллеров, оказывая непрямое влияние на воспалительные процессы в ЦНС.
ВЫВОДЫ
Таким образом, полученные нами результаты свидетельствуют об активации воспалительного процесса в периферических иммунных клетках, по сравнению со здоровыми людьми. Много данных указывают на то, что реакции воспаления являются одним из механизмов, способствующих прогрессированию нейродегенерации как при БАС, так и при других нейродегенеративных заболеваниях. Считается, что развитие БАС является многоступенчатым процессом, включающим большое количество патогенетических каскадов. Каждый шаг в этом процессе привносит свои патофизиологические изменения и таким образом является неотъемлемым элементом в развитии и прогрессировании заболевания. В нашем исследовании выявлена группа пациентов с особенно выраженным изменением экспрессии генов, связанных с нейровоспалением. Может ли рассматриваться экспрессия генов, ассоциированных с нейровоспалением, в качестве потенциального прогностического биомаркера, пока непонятно. Дальнейшее изучение воспалительных реакций при БАС может стать основой для разработки новых терапевтических подходов, которые позволят снизить темпы прогрессирования заболевания.
Список литературы
Brown R.H., Al-Chalabi A. // N Engl J Med. 2017. V. 377. P. 162–172.
Васильев А.В., Елисеева Д.Д., Иванова М.В., Кочергин И.А., Закройщикова И.В., Брылев Л.В., Штабницкий В.А., Захарова М.Н. // Анналы клинической и экспериментальной неврологии. 2018. Т. 12. С. 76–85.
Guo J., Yang X., Gao L., Zang D. // Brain Behav. 2017. V. 19. e00637.
van Es M.A., Hardiman O., Chio A., Al-Chalabi A., Pasterkamp R.J., Veldink J.H. // The Lancet. 2017. V. 390. P. 2084–2098.
Hardiman O., Al-Chalabi A., Chio A., Corr E.M., Logroscino G., Robberecht W. // Nature Reviews Disease Primers. 2017. V. 3. P. 17071.
Beers D.R., Appel S.H. // The Lancet Neurology. 2019. V. 18. P. 211–220.
Brooks B.R., Miller R.G., Swash M., Munsat T.L. // Amyotroph Lateral Scler. 2000. V. 1. P. 293–299.
Pal D.K., Evgrafov O.V., Tabares P., Zhang F., Durner M., Greenberg D.A. // Am J Hum Genet. 2003. V. 73. P. 261–270.
Wang F., Liu H., Blanton W.P., Belkina A., Lebrasseur N.K., Denis G.V. // Biochem J. 2010. V. 425. P. 71–83.
Greenwald R.J., Tumang J.R., Sinha A., Currier N., Cardiff R.D., Rothstein T.L. // Blood. 2004. V. 103. P. 1475–1484.
Lu C.H., Allen K., Oei F., Leoni E., Kuhle J., Tree T. // Neurol. – Neuroimmunol Neuroinflammation. 2016. V. 3. e244.
Won Y.H., Lee M.Y., Choi Y.C., Ha Y., Kim H., Kim D.Y. // PLoS One. 2016. V. 11. e0165290.
Zhao W., Beers D.R., Hooten K.G., Sieglaff D.H., Zhang A., Kalyana–Sundaram S. // JAMA Neurol. 2017. V. 74. P. 677–685.
Zhao W., Beers D.R., Appel S.H. // J. Neuroimmune Pharmacol. 2013. V. 8. P. 888–99.
Corcia P., Tauber C., Vercoullie J., Arlicot N., Prunier C., Praline J. // PLoS One. 2012. V. 7. P. 12.
Lee J., Hyeon S.J., Im H., Ryu H., Kim Y., Ryu H. // 2016. V. 8. P. 233–40.
Renton A.E., Chiò A., Traynor B.J. // Nature Neuroscience. 2014. V. 17. P. 17–23.
Beers D.R., Zhao W., Wang J., Zhang X., Wen S., Neal D. // JCI Insight. 2017. V. 2. P. 5.
Henkel J.S., Beers D.R., Wen S., Rivera A.L., Toennis K.M., Appel J.E. // EMBO Mol Med. 2013. V. 5. P. 64–79.
Tarr I.S., McCann E.P., Benyamin B., Peters T.J., Twine N.A., Zhang K.Y. // Sci. Rep. 2019. V. 9. P. 1.
Garbuzova-Davis S., Sanberg P.R. // Front. Cell. Neurosci. 2014. V. 8. P. 21.
Stockinger B., Veldhoen M., Martin B. // Semin. Immunol. 2007. V. 17. P. 353–361
Дополнительные материалы отсутствуют.


