Нейрохимия, 2021, T. 38, № 2, стр. 168-176
Гептапептидный аналог тафтсина селанк препятствует увеличению содержания тормозных аминокислот в мозге при моделировании алкогольной абстиненции у крыс
Л. Г. Колик 1, А. В. Надорова 1, В. Г. Коньков 1, В. Б. Наркевич 1, В. С. Кудрин 1
1 ФГБНУ “НИИ фармакологии им. В.В. Закусова”
Москва, Россия
Поступила в редакцию 16.03.2020
После доработки 12.11.2020
Принята к публикации 03.12.2020
Аннотация
Хроническое действие этанола у млекопитающих вызывает нарушение баланса возбуждающих и тормозных нейромедиаторных аминокислот, к числу которых относятся снижение активности ГАМК-ергической тормозной и повышение глутаматергической возбуждающей активности. Ранее была доказана эффективность пептидного анксиолитика селанка в отношении индуцированной отменой этанола тревожной реакции и нарушений памяти. С целью изучения нейрохимического механизма действия селанка при моделировании алкогольной абстиненции проведена оценка влияния препарата на содержание нейромедиаторных аминокислот в отдельных структурах мозга у крыс. Эксперименты выполнены на беспородных крысах-самцах, потреблявших в течение 30-ти недель 10% раствор этанола в качестве единственного источника жидкости. В ходе алкоголизации была выделена подгруппа животных с высоким уровнем мотивации к потреблению алкоголя, на которых и была проведена основная часть работы. Селанк в анксиолитической дозе 0.3 мг/кг вводили в течение 7 сут внутрибрюшинно на фоне отмены этанола. Декапитацию проводили через 24 ч после последней инъекции препарата. В опытах ex vivo с помощью ВЭЖХ/ФД установлено, что селанк препятствовал индуцированному отменой этанола повышению содержания аспарагиновой кислоты, глицина и таурина в гипоталамусе, ГАМК в прилежащем ядре и аспарагиновой кислоты и глицина в стриатуме. Полученные данные свидетельствуют о том, что в условиях алкогольной депривации фармакологическое действие селанка связано со снижением уровня тормозных нейромедиаторных аминокислот.
ВВЕДЕНИЕ
В настоящее время известно, что хроническое введение алкоголя приводит к нарушению соотношения возбуждающих и тормозных нейромедиаторных аминокислот у млекопитающих. Отказ от алкоголя также вызывает дальнейший дисбаланс этих нейротрансмиттеров, среди которых основными являются снижение содержания тормозной аминокислоты ГАМК и увеличение концентрации глутамата – основной возбуждающей аминокислоты, что, по-видимому, может быть причиной возобновления потребления алкоголя (“negative reinforcement”) [1, 2].
Разработка эффективных средств фармакотерапии для снижения частоты рецидивов является одной из проблем современной фармакологии. В настоящее время к препаратам первой линии лечения алкогольной зависимости относят производные бензодиазепинов, основным механизмом действия которых является влияние на ГАМК-ергические пути [3]. Другие подходы включают блокаду ионотропных глутаматных рецепторов NMDA (N-метил-D-аспартат) подтипа [4]. К числу соединений последнего типа относится, например, акампросат, вызывающий снижение нейрональной гипервозбудимости посредством подавления активности глутаматергических медиаторных систем (особенно нейропередачи, опосредуемой N-метил-D-аспартатными рецепторами). Установлено, что этот препарат полностью блокирует этанол-индуцированное увеличение содержания глутамата в среднем мозге, наблюдаемое при моделировании острой (до 48 ч) алкогольной абстиненции [1]. По мнению ряда исследователей, молекулярной мишенью действия акампросата могут быть также глициновые рецепторы (GlyR) в прилежащем ядре [5], что согласуется с фармакологическими, молекулярными, электрофизиологическими и поведенческими данными, указывающими на ключевую роль стрихнин-чувствительных GlyR в проявлении эффектов этанола и влиянии на характер потребления через систему положительного подкрепления [6].
Выраженный когнитивный дефицит, развивающийся на фоне хронической алкоголизации, наблюдается как у людей [7], так и экспериментальных животных [8]. Когнитивные нарушения у пациентов с алкогольной зависимостью частично обратимы при длительном отказе от алкоголя, однако, восстановление функций подчинено определенной временной зависимости. Значительные изменения в отношении торможения/импульсивности у выздоравливающих пациентов с диагнозом “алкоголизм” сильнее проявляются в более поздние периоды (до 1-го года) по сравнению с ранними периодами абстиненции (до 1-го месяца) [7]. Эти наблюдения находят подтверждение и в экспериментальных работах, в которых отмечались нарушения контроля реакции торможения, которые развиваются в течение нескольких дней после алкогольной депривации [8]. По данным нейрохимических исследований, к концу 7-х суток после отказа от алкоголя не происходит полного восстановления выявленных в острой фазе алкогольной абстиненции нейромедиаторных сдвигов в коре больших полушарий у крыс [9].
Оригинальный отечественный препарат селанк, синтезированный на основе модификации структуры молекулы эндогенного регуляторного пептида тафтсина (Институт молекулярной генетики РАН), в настоящее время используется в качестве анксиолитического средства с ноотропным компонентом действия и принципиально отличается от применяемых при фармакотерапии алкоголизма бензодиазепиновых транквилизаторов [10]. Ранее в опытах in vivo была показана эффективность селанка при купировании повышенной тревожности, индуцированной отменой этанола [11], а также положительное влияние препарата на возрастные нарушения памяти, сопровождающиеся хронической алкогольной интоксикацией, у крыс [12]. В опытах ex vivo показано, что селанк в анксиолитической дозе per se вызывает увеличение содержания как возбуждающих (аспартат, глутамат), так и тормозных (ГАМК, глицин, таурин) аминокислот [13]. Однако, в настоящее время сведения о нейрохимических изменениях, вызываемых селанком на фоне отмены этанола, отсутствуют. В связи со сказанным, целью работы являлось изучение эффектов селанка на содержание нейротрансмиттерных аминокислот в коре и подкорковых структурах головного мозга этанол-предпочитающих крыс в условиях алкогольной депривации.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Животные. Эксперименты выполнены на беспородных половозрелых крысах-самцах (ФГБНУ “Научный центр биомедицинских технологий Федерального медико-биологического агентства”, филиал “Столбовая”, n = 126), которых, начиная с возраста 10 недель (средняя масса 175.6 ± 6.2 г), содержали в индивидуальных клетках (370 × 200 × × 150 мм) в стандартных условиях вивария ФГБНУ “НИИ фармакологии им. В.В. Закусова” при регулируемом световом режиме 12 ч/12 ч (свет/темнота) и постоянной температуре (21–23°С) со свободным доступом к воде и брикетированному корму.
Препараты. Селанк (Треонил-лизил-пролил-аргинил-пролил-глицин-пролина диацетат, субстанция, ИМГ РАН) в дозах 0.3 мг/кг (водный раствор, 0.1 мл/100 г массы животного, в/б), этанол (ООО “Главспирт”) в виде раствора 10 об. %.
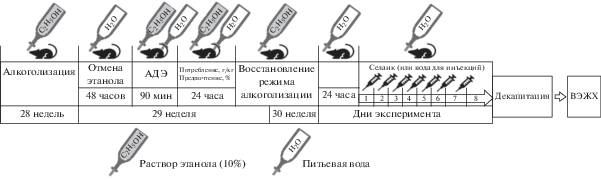
Формирование высокой алкогольной мотивации у крыс осуществляли на крысах, которые содержались в индивидуальных клетках с предоставлением 10% раствора этанола в качестве единственного источника жидкости (n = 106) в течение 30 нед. Кроме того, использовали крыс того же возраста, не имевших в течение 30 недель доступа к этанолу (n = 20), в соответствии с ранее описанной методикой [14]. Для оценки уровня сформированной алкогольной мотивации на 29-й неделе после 48-часовой алкогольной депривации измеряли: (1) алкоголь-депривационный эффект (АДЭ) (в г/кг) при предоставлении свободного выбора между водой и 10% раствором этанола в течение первых 90 мин, (2) потребление раствора этанола (в г/кг в сутки) и (3) предпочтение этанола (в %) в течение последующих 24 ч. После оценки влечения к этанолу питьевой режим был восстановлен с использованием 10% раствора этанола в качестве единственного источника жидкости у опытной группы животных до 30-й недели включительно (рис. 1). К концу 30-й недели вес животных составил 564.92 ± ± 6.76 г и количество потребляемого этанола – 5.18 ± 0.08 г/кг (n = 106). Возраст крыс к концу алкоголизации составил 40 нед.
Разделение на группы по степени влечения к этанолу проводили с помощью иерархического кластерного анализа (метод Уорда, Евклидово расстояние).
Учитывая данные литературы об отсутствии восстановления баланса нейромедиаторных аминокислот в течение 7-дневного постинтоксикационного периода [9], а также опираясь на экспериментальные данные о положительных эффектах селанка в отношении нормализации процессов, связанных с памятью и вниманием в условиях алкогольной депривации [12], была выбрана схема эксперимента, предусматривающая 7-дневную отмену этанола.
Схема эксперимента. Животные были разделены на следующие группы:
“контроль” – крысы, не имевшие доступа к этанолу в течение 30 нед., получали воду для инъекций (7 дней, в/б, раз в сутки);
“контроль селанк” – крысы, не имевшие доступа к этанолу в течение 30 нед., получали селанк в дозе 0.3 мг/кг (7 дней, в/б, раз в сутки);
“этанол” – крысы, имевшие доступ к этанолу в течение 30 нед., получали воду для инъекций (7 дней, в/б, раз в сутки) на фоне отмены этанола;
“этанол селанк” – крысы, имевшие доступ к этанолу в течение 30 нед., получали селанк в дозе 0.3 мг/кг (7 дней, в/б, раз в сутки) на фоне алкогольной депривации.
Отмена этанола происходила за сутки до 1-ой инъекции селанка (или воды для инъекций). Декапитацию проводили через 24 ч после последней инъекции препарата (рис. 1).
Нейрохимические исследования. Структуры мозга (префронтальная кора, гипоталамус, миндалевидное тело, прилежащее ядро, стриатум и гиппокамп) извлекались на льду, замораживались в жидком азоте и взвешивались. Перед экспериментами по определению содержания нейротрансмиттеров пробы размельчали в механическом гомогенизаторе (тефлон-стекло) в 1 мл 0.1 н HCIО4. Пробы центрифугировали при 10 000 g в течение 10 мин. Получившийся супернатант в дальнейшем использовали для определения содержания тормозных (ГАМК, глицин, таурин) и возбуждающих (аспартат, глутамат) нейромедиаторных аминокислот в структурах мозга методом высокоэффективной жидкостной хроматографии с флуоресцентной детекцией (ВЭЖХ/ФД) согласно модифицированной методике Pearson et al. (1991). Для деривации аминокислот к 25 мкл супернатанта добавляли 25 мкл 0.1 М боратного буфера и 10 мкл о-фтальальдегид-сульфитного реактива в 0.1 М боратном буфере (рН 9.5). ГАМК, аспартат, глутамат, таурин, глицин в начальной концентрации 0.1 мкМ/мл в 0.1 н НClО4 использовали в качестве стандартной смеси для калибровки.
Через 20 мин после инкубации при комнатной температуре 20 мкл реакционной смеси наносили на колонку Hypersil ODS 5 mkM, 4.6 × 250 мм. Регистрацию продуктов разделения проводили на флуоресцентном детекторе Agilent 1100, США, при длине волны возбуждения 230 нм и длине волны эмиссии 392 нм. Подвижная фаза для определения нейромедиаторных аминокислот состояла из 0.06 M NaH2PO4 · H2O, 0.0032 M Na2HPO4, 0.025 мМ ЭДТА, и 1.24 мM CH3OH, pH 5.6. Скорость подвижной фазы составляла 1.5 мл/мин. Регистрация образцов проводилась с применением аппаратно-программного комплекса Agilent-ChemStation. Величины концентрации нейромедиаторных аминокислот в опытных образцах рассчитывали методом “внешнего стандарта”, исходя из соотношения площади пиков в стандартной смеси и в образце.
Статистическую обработку полученных результатов проводили в ПСП Statistica v.8.0 (StatSoft, USA) при помощи двухфакторного дисперсионного анализа (анализируемые факторы: “Алкоголь” и “Селанк”) с последующим использованием критерия Дункана. Критический уровень значимости α = 0.05. Данные представлены в виде М ± SEM: М – средние значения, SEM – стандартная ошибка среднего. Для выявления различных фенотипов по степени предпочтения этанола использован иерархический кластерный анализ (метод Уорда, Евклидово расстояние).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ОБСУЖДЕНИЕ
С помощью кластерного анализа гетерогенная популяция крыс была разделена на три группы по уровню алкогольной мотивации: “Высокий” (АДЭ 0.81 ± 0.03 г/кг), “Средний” (АДЭ 0.34 ± ± 0.03 г/кг) и “Низкий” (АДЭ 0.11 ± 0.02 г/кг) (табл. 1а).
Таблица 1.
| а. Разделение гетерогенной популяции крыс по уровню алкогольной мотивации. M ± SEM | ||||
| Группы | Уровни алкогольной мотивации | |||
| высокий (n = 37) | средний (n = 22) | низкий (n = 47) | ANOVA | |
| Потребление раствора этанола (10 об %) в качестве единственного источника жидкости, г/кг в сутки | 4.94 ± 0.08 | 5.31 ± 0.16 | 5.31 ± 0.15 | F(2, 103) = 2.372, p = 0.098 |
| АДЭ, г/кг | 0.81 ± 0.03 | 0.34 ± 0.03*** | 0.11 ± 0.02*** +++ | F(2, 103) = 269.73, p = 0.000 |
| Потребление в условиях свободного выбора, г/кг в сутки | 4.35 ± 0.14 | 2.10 ± 0.11*** | 0.75 ± 0.08*** +++ | F(2, 103) = 301.31, p = 0.000 |
| Предпочтение этанола в условиях свободного выбора, % | 89.43 ± 1.84 | 38.84 ± 1.90*** | 11.68 ± 1.10*** +++ | F(2, 103) = 736.35, p = 0.000 |
| Примечание. Множественные сравнения с использованием критерия Дункана: *** p < 0.001 по отношению к соответствующей группе “Высокий”; +++p < 0.001 по отношению к соответствующей группе “Средний”. | ||||
| б. Характеристика групп алкоголизированных и неалкоголизированных крыс. M ± SEM | ||||
| Группы | Доступ к этанолу 30 недель | Без доступа к этанолу 30 недель | ||
| этанол (n = 10) | этанол селанк (n = 10) | контроль (n = 10) | контроль селанк (n = 10) | |
| Потребление раствора этанола (10 об. %) в качестве единственного источника жидкости, г/кг в сутки | 4.86 ± 0.15 | 4.99 ± 0.16 | – | – |
| АДЭ, г/кг | 0.71 ± 0.10 | 0.73 ± 0.09 | – | – |
| Потребление в условиях свободного выбора, г/кг в сутки | 3.72 ± 0.45 | 3.69 ± 0.37 | – | – |
| Предпочтение этанола в условиях свободного выбора, % | 76.74 ± 7.44 | 77.09 ± 7.53 | – | – |
| Вес, г | 568.00 ± 21.14 | 567.50 ± 13.82 | 562.00 ± 21.92 | 563.20 ± 29.27 |
Экспериментальные группы крыс “Этанол” (n = 10) и “Этанол Селанк” (n = 10) рандомизированно формировались из животных с высоким уровнем мотивации к потреблению алкоголя и не отличались по показателям, указанным в табл. 1б.
Согласно полученным данным, в префронтальной коре, гиппокампе и миндалевидном теле статистически значимых изменений содержания аминокислот у животных контрольной группы и крыс, подвергнутых хроническому действию этанола, не выявлено, что согласуется с известными из литературы данными [9].
Селанк per se при субхроническом введении не влиял на уровень возбуждающих и тормозных аминокислот (рис. 2–6), хотя ранее нами было установлено активирующее влияние этого соединения на уровень аминокислот в гипоталамусе в дозе 0.25 мг/кг при остром введении [13], что может объясняться различным дизайном исследования, в частности, временным интервалом от момента введения вещества до взятия биологического материала. Выраженные сдвиги в содержании нейромедиаторных аминокислот у этанол-предпочитающих крыс при отмене этанола зарегистрированы в гипоталамусе, стриатуме и прилежащем ядре (рис. 2–6).
Рис. 2.
Влияние селанка в дозе 0.3 мг/кг на содержание ГАМК в структурах мозга алкоголизированных и неалкоголизированных крыс. M ± SEM. Примечание: Множественные сравнения с использованием критерия Дункана: * p < 0.05 по отношению к группе “Контроль”; + p < 0.05 по отношению к группе “Этанол”; для соответствующей структуры мозга.
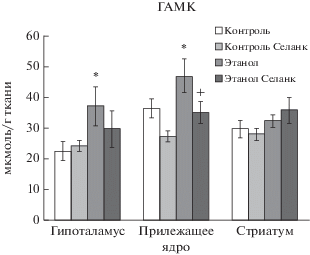
Рис. 3.
Влияние селанка в дозе 0.3 мг/кг на содержание глицина в структурах мозга алкоголизированных и неалкоголизированных крыс. M ± SEM. Примечание: Множественные сравнения с использованием критерия Дункана: * p < 0.05 по отношению к группе “Контроль”; + p < 0.05 по отношению к группе “Этанол”; для соответствующей структуры мозга.
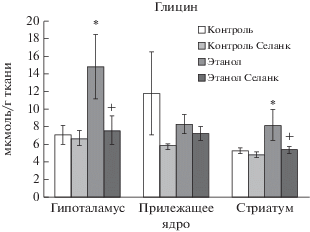
Рис. 4.
Влияние селанка в дозе 0.3 мг/кг на содержание таурина в структурах мозга алкоголизированных и неалкоголизированных крыс. M ± SEM. Примечание: Множественные сравнения с использованием критерия Дункана: * p < 0.05 по отношению к группе “Контроль”; + p < 0.05 по отношению к группе “Этанол”; для соответствующей структуры мозга.
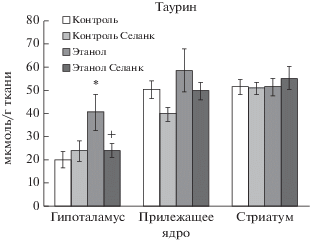
Рис. 5.
Влияние селанка в дозе 0.3 мг/кг на содержание аспартата в структурах мозга алкоголизированных и неалкоголизированных крыс. M ± SEM. Примечание: Множественные сравнения с использованием критерия Дункана: * p < 0.05, ** p < 0.01 по отношению к группе “Контроль”; + p < 0.05 по отношению к группе “Этанол”; для соответствующей структуры мозга.
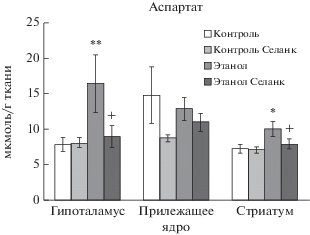
Рис. 6.
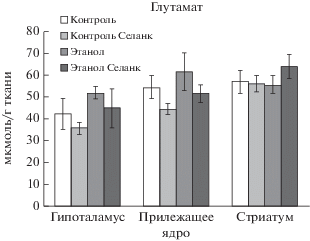
Влияние селанка в дозе 0.3 мг/кг на содержание глутамата в структурах мозга алкоголизированных и неалкоголизированных крыс. M ± SEM.
Установлено, что фактор “Алкоголь” в гипоталамусе (F(1, 28) = 5.288, p = 0.029) и в прилежащем ядре (F(1, 31) = 6.766, p = 0.014) оказывал существенное влияние на изменение содержания ГАМК в мозге крыс. Фактор “Селанк” оказывал влияние на изменение содержания ГАМК в мозге крыс в прилежащем ядре (F(1, 31) = 8.809, p = 0.006). Не установлено взаимодействие факторов “Селанка” и “Алкоголя” в гипоталамусе (F(1, 28) = 1.152, p = 0.292), в прилежащем ядре (F(1, 31) = 0.145, p = 0.706) и стриатуме (F(1, 33) = 0.773, p = 0.386). Отмечено статистически значимое увеличение содержания ГАМК в гипоталамусе и прилежащем ядре по сравнению с контрольной группой, не имевшей доступа к этанолу (p < 0.05). На фоне действия селанка у крыс, подверженных действию этанола, уровень ГАМК в прилежащем ядре не превышал значения контрольной группы (рис. 2).
Фактор “Алкоголь” в гипоталамусе (F(1, 28) = = 5.092, p = 0.032) и в стриатуме (F(1, 29) = 4.546, p = 0.042) оказывал существенное влияние на изменение содержания глицина в мозге крыс. Значения влияния фактора “Селанк” на содержание глицина составили в гипоталамусе (F(1, 28) = 3.973, p = 0.056), в прилежащем ядре (F(1, 35) = 2.015, p = 0.165) и стриатуме (F(1, 29) = 3.965, p = 0.056). Не установлено взаимодействие факторов “Селанка” и “Алкоголя” на содержание глицина в гипоталамусе (F(1, 28) = 3.225, p = 0.083), в прилежащем ядре (F(1, 35) = 0.968, p = 0.332) и стриатуме (F(1, 29) = 1.822, p = 0.188). Хроническое потребление крысами раствора этанола с последующей депривацией вызывало значительное повышение уровня глицина в гипоталамусе и стриатуме (p < 0.05). Селанк в анксиолитической дозе статистически значимо снижал (p < 0.05) величину этого показателя до значений контрольной группы (рис. 3).
С помощью двухфакторного дисперсионного анализа не выявлено влияния фактора “Алкоголь” на содержание таурина в гипоталамусе (F(1, 28) = = 4.177, p = 0.051), в прилежащем ядре (F(1, 35) = = 2.945, p = 0.095) и стриатуме (F(1, 33) = 0.347, p = 0.560), а также фактора “Селанк” в гипоталамусе (F(1, 28) = 1.562, p = 0.222), в прилежащем ядре (F(1, 35) = 3.383, p = 0.074) и стриатуме (F(1, 33) = = 0.199, p = 0.658). Также не установлено взаимодействие факторов “Селанка” и “Алкоголя” на содержание таурина в гипоталамусе (F(1, 28) = 4.077, p = 0.053), в прилежащем ядре (F(1, 35) = 0.028, p = 0.868) и стриатуме (F(1, 33) = 0.342, p = 0.563). Содержание таурина, выполняющего в ЦНС функцию тормозного нейротрансмиттера, также возрастало в гипоталамусе в условиях алкогольной депривации – p < 0.05 согласно критерию Дункана по сравнению с контролем. Селанк, как и в случае с другими тормозными аминокислотами, выполнял модулирующую роль, снижая (p < 0.05) величину данного показателя до уровня соответствующего параметра контрольной группы животных (рис. 4).
Установлено, что фактор “Алкоголь” в гипоталамусе (F(1, 28) = 5.596, p=0.025) и в стриатуме (F(1, 29) = 8.468, p = 0.007) оказывал существенное влияние на изменение содержания аспартата в мозге крыс. Фактор “Селанк” не оказывал влияние на изменение содержания аспартата в гипоталамусе, прилежащем ядре и стриатуме. Не установлено взаимодействие факторов “Селанка” и “Алкоголя” на содержание возбуждающей аминокислоты аспартата в гипоталамусе (F(1, 28) = 3.754, p = 0.063), в прилежащем ядре (F(1, 35) = 0.830, p = 0.368) и стриатуме (F(1, 29) = 2.244, p = 0.145). Отмена этанола у этанол-предпочитающих крыс вызывала резкое увеличение содержания аспартата, выполняющей роль нейромедиатора в ЦНС, в гипоталамусе и стриатуме (p < 0.01, p < 0.05 соответственно). Селанк устранял это возрастание, снижая величину показателей до контрольных значений (рис. 5).
Фактор “Алкоголь” и “Селанка” не оказывали влияния на изменения содержания глутамата в гипоталамусе, прилежащем ядре и стриатуме. Не установлено взаимодействие факторов “Селанка” и “Алкоголя” в гипоталамусе (F(1, 28) = 0.002, p = 0.966), в прилежащем ядре (F(1, 35) = 0.000, p = 0.991) и стриатуме (F(1, 33) = 0.997, p = 0.325). Характерное для алкогольной абстиненции увеличение содержания глутамата в прилежащем ядре и гипоталамусе оказалось в нашем эксперименте статистически незначимым (p > 0.05) (рис. 6).
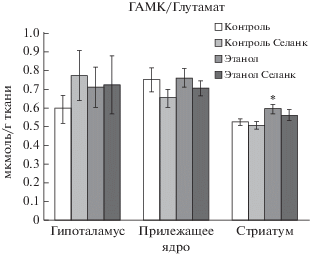
Фактор “Алкоголь” (F(1, 33) = 7.844, p = 0.009) оказывал влияние на изменение отношения ГАМК/глутамат в стриатуме. Фактор “Селанк” не оказывал влияние на изменение отношения ГАМК/глутамат в гипоталамусе, прилежащем ядре и стриатуме. Не установлено взаимодействие факторов “Селанка” и “Алкоголя” на изменение отношения ГАМК/глутамат в гипоталамусе (F(1, 28) = 0.465, p = 0.501), в прилежащем ядре (F(1, 31) = 0.163, p = 0.690) и стриатуме (F(1, 33) = = 0.111, p = 0.742) (рис. 7).
Рис. 7.
Влияние селанка в дозе 0.3 мг/кг на соотношение ГАМК/глутамата в структурах мозга алкоголизированных и неалкоголизированных крыс. M ± SEM. Примечание: Множественные сравнения с использованием критерия Дункана: * p < 0.05 по отношению к группе “Контроль” для соответствующей структуры мозга.
Таким образом, селанк при субхроническом введении в анксиолитической дозе препятствовал индуцированному отменой этанола повышению содержания тормозных нейромедиаторных аминокислот глицина и таурина в гипоталамусе, ГАМК в прилежащем ядре и глицина в стриатуме, а также снижал уровень аспартата в гипоталамусе и стриатуме.
Одной из основных целей фармакотерапии при лечении алкогольной абстиненции является восстановление нарушенного баланса между возбуждающей и тормозной нейропередачей. В настоящей работе нами было показано, что в постинтоксикационный (абстинентный) период уровень ГАМК в прилежащем ядре существенно превышает контрольные значения, тогда как содержание глутамата в изученных структурах мозга животных не отличалось от соответствующих показателей крыс, не имевших доступа к этанолу. Согласно результатам исследования, проведенного с помощью техники микродиализа, отмена потребления этанола у зависимых животных вызывала увеличение концентрации глутамата в стриатуме, прилежащем ядре и гиппокампе через 5–8 ч после прекращения вдыхания паров этанола, достигая максимального значения через 12 ч в прилежащем ядре [15]. В нашей работе не было выявлено снижения уровня глутамата в префронтальной коре и прилежащем ядре, обнаруженного в работе [16]. Различия в полученных результатах, по-видимому, объясняются более длительным периодом лишения животных этанола (7 сут) в соответствии с выбранным дизайном исследования, нейрохимические изменения при котором значительно отличаются от описанных ранее сдвигов в балансе нейромедиаторных аминокислот и моноаминов после отмены этанола. Нельзя исключить также влияния повышенного содержания тормозной аминокислоты таурина на относительно низкий уровень глутамата, поскольку, по данным литературы, в условиях отмены этанола таурин препятствует увеличению глутамата в прилежащем ядре у этанол-зависимых крыс за счет блокады его высвобождения [17].
Наряду с этим, при отмене этанола отмечалось повышение содержания другой тормозной аминокислоты – глицина. Так, отмечался рост уровня глицина в гипоталамусе и стриатуме (в 2.1 и 1.5 раза соответственно) по сравнению с интактными крысами, что согласуется с наблюдениями Griffiths и Littleton (1977) на мышах, формирование алкогольной зависимости у которых осуществлялось с помощью паров этанола [18].
Принимая во внимание отставленные по времени поведенческие проявления синдрома отмены, в настоящей работе дизайн эксперимента предусматривал субхроническое введение в течение 7 сут пептидного аналога тафтсина селанка как возможного корректора негативных проявлений алкогольной абстиненции. Селанк восстанавливал содержание глицина у крыс, получавших этанол, до значений контрольных животных в гипоталамусе и стриатуме. В работе Kotlinska и Liljequist (1996) антагонист глициновых рецепторов L-701,324 купировал спровоцированные отменой этанола аудиогенные судороги у крыс Sprague-Dawley [19], что также подтверждает роль глицина в формировании физиологических нарушений при синдроме отмены алкоголя.
Наблюдавшееся нами увеличение уровня таурина в структурах мозга алкоголизированных крыс находит косвенное подтверждение в работе Nashed, Chatterjee et al., выполненной методом микродиализа, отмечавших сходное возрастание содержания этой аминокислоты в прилежащем ядре мышей DBA/2J с низким уровнем двигательной активности после субхронического (5 дней) введения алкоголя (2.2 г/кг), 14-дневной паузы и финального введения этанола. У высокоактивных животных такого возрастания не наблюдалось [20].
Аспартат (аспарагиновая кислота) также как и глутамат выполняет в ЦНС функции возбуждающего медиатора. Несмотря на то, что по химической структуре она очень близка к глутаминовой кислоте и действует на те же рецепторы, содержание аспартата относительно невелико, и большинство авторов не упоминает каких-либо изменений содержания этого вещества в структурах мозга при моделировании алкоголизма. Известна только одна достаточно недавняя работа, в которой описано возрастание концентрации аспартата в среднем мозге в различных экспериментальных условиях [21].
Из данных литературы известно о существовании так называемого “ГАМК-шунта”, являющегося альтернативой циклу трикарбоновых кислот. При этом задействуется механизм образования глутамата из α-кетоглутарата, при декарбоксилировании которого, в свою очередь, образуется ГАМК. Подобные механизмы наиболее ярко проявляются в глутамат- и ГАМК-ергических нейронах и окружающих их астроцитах [22]. Можно предположить, что подобный вариант образования ГАМК в стриатуме животных при отмене этанола мог быть задействован в наших экспериментах.
Таким образом, нормализация селанком уровня аминокислот в разных отделах мозга может быть связана с патофизиологическими нарушениями при отмене этанола. Нейрохимические исследования у животных изменений содержания различных нейротрансмиттерных аминокислот после длительной алкоголизации, прерывающейся периодами депривации этанола разной продолжительности, могут иметь практическое значение для разработки новых стратегий лечения алкогольной зависимости.
Список литературы
De Witte P. // Addict. Behav. 2004. V. 29. № 7. P. 1325–1339.
George O., Sanders C., Freiling J., Grigoryan E., Vu S., Allen CD., Crawford E., Mandyam C.D., Koob G.F. // Proc. Natl. Acad. Sci. USA. 2012. V. 109. № 44. P. 18156–18161.
Amato L., Minozzi S., Davoli M. // The Cochrane Database of Systematic Reviews. 2011. CD008537.
Liang J., Olsen R.W. // Acta Pharmacologica Sinica. 2014. V. 35. P. 981–993.
Chau P., Höifödt-Lidö H., Löf E., Söderpalm B., Ericson M. // Alcohol Clin. Exp. Res. 2010. V. 34. № 1. P. 39–45.
Perkins D.I., Trudell J.R., Crawford D.K., Alkana R.L., Davies D.L. // Pharmacol. Ther. 2010. V. 127. № 1. P. 53–65.
Stavro K., Pelletier J., Potvin S. // Addict. Biol. 2013. V. 18. № 2. P. 203–213.
Irimia C., Wiskerke J., Natividad L.A., Polis I.Y., de Vries T.J., Pattij T., Parsons L.H. // Addict. Biol. 2015. V. 20. № 2. P. 263–274.
Лелевич С.В. // Эксперим. клин. фармакол. 2012. Т. 75. № 3. С. 26–30.
Телешова Е.С., Бочкарев В.К., Сюняков Т.С., Бугаева Т.П., Незнамов Г.Г. // Психиатрия. 2010. Т. 46. № 4. С. 26–35.
Надорова А.В., Колик Л.Г., Клодт П.М., Наркевич В.Б., Наплёкова П.Л., Козловская М.М., Кудрин В.С. // Нейрохимия. 2014. Т. 31. № 2. С. 1–7.
Колик Л.Г., Надорова А.В., Антипова Т.А., Круглов С.В., Кудрин В.С., Дурнев А.Д. // Бюлл. Экспер. биол. и мед. 2019. Т. 167. № 5. С. 581–585.
Наркевич В.Б., Клодт П.М., Кудрин В.С., Майский А.И., Раевский К.С. // Психофармакология и биологическая наркология. 2007. Т. 7. № 2. С. 1563–1567.
Колик Л.Г., Надорова А.В., Козловская М.М. // Бюлл. экспер. биол. 2014. Т. 157. № 1. С. 61–65.
Dahchour A., De Witte P. // Prog. Neurobiol. 2000. V. 60. № 4. P. 343–362.
Das S.C., Althobaiti Y.S., Alshehri F.S., Sari Y. // Behav. Brain. Res. 2016. V. 303. P. 120–125.
Dahchour A., De Witte P. // Pharmacol. Biochem. Behav. 2000. V. 65. № 2. P. 345–350.
Griffiths P.J., Littleton J.M. // Br. J. Exp. Pathol. 1977. V. 58. № 1. P. 19–27.
Kotlinska J., Liljequist S. // Psychopharmacology (Berl.). 1996. V. 127. № 3. P. 238–244.
Nashed M., Chatterjee D., Nguyen D., Oleinichenko D., Diwan M., Nobrega J.N. // Psychopharmacology (Berl.). 2019. V. 236. № 12. P. 3541–3556.
Гуща В.К., Лелевич С.В., Шейбак В.М. // Биохимия. Прил. серия Б: Биомед. Хим. 2019. Т. 13. № 2. С. 154–161.
Shelp B. // Trends in Plant. Sci. 1999. V. 4. № 11. P. 446–452.
Дополнительные материалы отсутствуют.