Нейрохимия, 2021, T. 38, № 3, стр. 257-266
Оверэкспрессия фактора роста нервов в гиппокампе вызывает поведенческие изменения у крыс с холинергическим дефицитом, индуцированным 192IgG-сапорином
Ю. В. Добрякова 1, М. И. Зайченко 1, Ю. С. Спивак 1, М. Ю. Степаничев 1, В. А. Маркевич 1, А. П. Большаков 1
1 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
Поступила в редакцию 15.02.2021
После доработки 16.02.2021
Принята к публикации 17.02.2021
Аннотация
Дегенерация септальных холинергических нейронов, вызванная иммунотоксином 192IgG-сапорином (SAP), является одной из моделей патологий, возникающих при болезни Альцгеймера. Целью этой работы было исследовать влияние оверэкспрессии фактора роста нервов (NGF) в гиппокампе на поведение крыс с вызванным холинергическим дефицитом. Лентивирусную суспензию, несущую кассету с CMV-NGF-IRES-GFP или CMV-IRES-GFP (контроль, pCSC), вводили в оба гиппокампа. Контрольные крысы вместо SAP получали эквивалентные объемы растворителя и контрольный вирус. Мы обнаружили, что оверэкспрессия NGF в гиппокампе не предотвращает гибель холинергических нейронов в медиальной септальной области, которая вызвана инъекцией иммунотоксина. В тесте “Открытое поле” как SAP-NGF, так и SAP-pCSC-инъецированные животные были гиперактивны; напротив, в Y-образном лабиринте у подопытных животных с оверэкспрессией NGF гиперактивность, вызванная введением иммунотоксина, была снижена. В тесте “Сужающаяся дорожка” подопытные животные, экспрессирующие NGF, показывали значительно меньшее количество ошибок. Анализ активности ацетилхолинэстеразы в гиппокампе, которую мы использовали в качестве маркера холинергической функции, показал, что уровень фермента был повышен в группе SAP-NGF по сравнению с SAP-pCSC. Из полученных нами данных можно сделать вывод, что оверхэкспрессия NGF в гиппокампе крыс лишь частично компенсирует некоторые нарушения, опосредованные развитием холинергического дефицита.
ВВЕДЕНИЕ
Медиальная септальная область является основным источником холинергической иннервации гиппокампа, и гибель клеток в ней, возникающая при некоторых нейродегенеративных заболеваниях, приводит к нарушению функционирования всех ацетилхолин-зависимых систем. Многие исследования показали, что фактор роста нервов (nerve growth factor, NGF) является одним из нейротрофинов, которые поддерживают холинергическую функцию и предотвращают гибель нейронов в базальном переднем мозге [1–3]. В гиппокампе NGF вырабатывается интернейронами [4, 5], поглощается аксонами холинергических нейронов базального переднего мозга и транспортируется в их тела [6, 7]. Таким образом, существующая концепция передачи сигналов NGF указывает на важную роль механизма ретроградного транспорта от проекционных областей холинергических нейронов к телам для их выживания и функционирования во взрослом мозге.
Положительные эффекты, вызываемые нейротрофином NGF, были описаны на различных экспериментальных моделях болезни Альцгеймера. Ранее мы показали, что оверэкспрессия NGF в гиппокампе может предотвращать нарушение LTP в зубчатой извилине гиппокампа, которое было индуцировано введением бета-амилоида [8, 9]. Установлено также, что жизнеспособность холинергических нейронов после разрушения свода мозга (fimbria/fornix) можно поддержать с помощью внутрижелудочкового введения NGF [2] или его оверэкспрессии в медиальной септальной области [10]. Кроме того, известно, что инъекции NGF могут улучшать некоторые аспекты поведения животных с холинергическим дефицитом [11, 12]. Повышение уровня NGF в этих исследованиях приводит к лучшему выживанию нейронов медиальной септальной области либо за счет оверэкспрессии NGF в ней [10], либо во всем мозге за счет долговременного внутрижелудочкового введения нейротрофина [2, 11, 12]. В обоих случаях NGF может действовать непосредственно на тела холинергических нейронов медиальной септальной области, обеспечивая их выживание. Один из недостатков этих подходов связан с тем, что инъекция NGF непосредственно в желудочки мозга вызывает боль у человека [13] и грызунов [14], тогда как внутрипаренхимная инъекция не оказывает такого эффекта [14, 15].
Модель разрушения свода мозга, используемая в описанных выше исследованиях, не позволяет правильно оценить степень восстановления гиппокампальных функций при введении NGF вследствие полной потери септо-гиппокампальных связей. В другой серии экспериментов [11, 12], где септо-гиппокампальные связи были сохранены, NGF вводили в желудочки, что не дает сделать однозначный вывод о том, развивался ли защитный эффект нейротрофина за счет внутригиппокампального действия, поскольку NGF вызывал изменения даже в ряде удаленных областей мозга, таких, например, как ствол мозга [11]. Остается неясным, может ли оверэкспрессия NGF в гиппокампе, не вызывающая болевых ощущений, наряду с внутрижелудочковыми инъекциями, оказывать защитное действие, и действительно ли этот эффект зависит от выживания нейронов базального переднего мозга.
Основываясь на идее о центральной роли ретроградного транспорта в выполнении защитной функции NGF в холинергических нейронах переднего мозга, здесь мы использовали хорошо известную модель дегенерации септальных холинергических нейронов, вызванную иммунотоксином 192IgG-сапорином [16], чтобы определить, может ли оверэкспрессия NGF в гиппокампе защитить нейроны медиальной септальной области от дегенерации и уменьшить последствия холинергического дефицита.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперименты проводились на половозрелых самцах крыс линии Wistar (250–350 г), полученных из питомника “Пущино” Филиала Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН. Животных содержали в условиях вивария при температуре 21 ± 1°С с 12-часовым циклом свет/темнота, пищу и воду предоставляли ad libitum. Все эксперименты проводились в соответствии с этическими принципами, изложенными в директиве 2010/63/ ЕС Европейского Парламента и Совета от 22 сентября 2010 г., и были одобрены этическим комитетом Института высшей нервной деятельности и нейрофизиологии Российской Академии наук. Перед операцией животные были случайным образом разделены на группы. Поведенческие эксперименты проводили с 10.00 до 14.00.
Синтез плазмид и получение вирусов. Мы использовали ранее описанные плазмиды для упаковки лентивирусов [8]. Лентивирусы были упакованы и сконцентрированы, как описано в наших предыдущих исследованиях [8]. Клетки HEK293T были трансфицированы с использованием кальций-фосфатного метода. Для сборки конструктов были использованы следующие плазмиды: 12 мкг pLenti, 7.8 мкг pMDL, 4.2 мкг pVSV-G и 3 мкг pRev. Плазмида pCSC-CMV-hNGF-IRES-GFP, несущая ген NGF, и плазмида pCSC-CMV-IRES-GFP, которая была использована как контроль. Супернатанты, собранные через 24 и 48 ч после трансфекции концентрировали при 50000 g в ультрацентрифуге CP80WX (Hitachi, Япония). Осадок ресуспендировали в среде OPTI-MEM, аликвотировали и хранили при температуре –80°C. Титр вируса проверяли в серийных разведениях на клетках HEK293T. Согласно нашим предыдущим данным [8], метод оверэкспрессии приводит примерно к двукратному увеличению уровня белка NGF в гиппокампе и заражению около 2.5 мм3 ткани мозга [17].
Операция и введение иммунотоксина и вирусных конструкций. Иммунотоксин 192IgG-сапорин или эквивалентный объем растворителя (фосфатно-солевой буфер PBS) вводили билатерально внутрь желудочков с использованием доз и координат, описанных ранее [18]. Одновременно с инъекциями иммунотоксина проводили билатеральные инъекции лентивируса (AP – 2.9 мм, L – 1.7 мм от брегмы). Препарат вводили с помощью микроинфузионного насоса (Stoelting Co., США) со скоростью 0.2 мкл/мин. После каждой инъекции иглу оставляли на месте на 10 мин. Были сформированы три экспериментальные группы: 11 подопытных животных получили PBS и контрольную конструкцию (группа PBS-pCSC), 14 крыс получили комбинированную инъекцию 192IgG-сапорина и контрольной вирусной конструкции (группа SAP-pCSC), 14 крысам вводили 192IgG-сапорин и вирусную суспензию, экспрессирующую NGF (группа SAP-NGF). Крысам давали восстановиться в течение 21 дня после операции. Пять животных были удалены из анализа в группе SAP-pCSC, а одно животное было удалено из группы SAP-NGF после верификации места инъекции и анализа гибели клеток.
Исследование поведения. Поведенческие тесты проводили с 21 по 40 день после введения токсина. Животных тестировали в следующих тестах: водный лабиринт Морриса (21–31 день), “открытое поле” (32 день), “сужающаяся дорожка” (33–37 дни), Y‑образный лабиринт (38 день) и пассивное избегание (39–40 дни).
Водный лабиринт Морриса (день 21–31). Оценку пространственной памяти проводили в водном лабиринте Морриса. Круглый бассейн черного цвета диаметром 1.5 м и высотой стенок 60 см (Noldus, Ltd., Нидерланды) наполняли водой до уровня 30 см. Воду в бассейне не забеливали. На стенах комнаты, где расположен бассейн, прикрепляли внешние ориентиры в виде квадрата, креста и треугольника. Бассейн условно разделяли на 4 квадранта. Точки пересечения прямых со стенками бассейна служили местами погружения подопытных животных в воду (условно – север, юг, запад, восток). В центре одного из квадрантов располагалась прозрачная круглая платформа диаметром 10 см, погруженная на 1.5–2 см под воду. Для каждой попытки крысу помещали в исходную точку бассейна мордой к стене. Обучение подопытных животных, которое проводили с 21-го по 30-й день, включало в себя две ежедневные попытки продолжительностью не более 60 с в соответствии с ранее использованным протоколом [18]. Интервал между испытаниями составлял около 30 мин для каждой крысы. Регистрировали следующие параметры: латентный период нахождения платформы, суммарная проплываемая дистанция, скорость передвижения. На 31-й день (10-й день тестирования) платформу извлекали из бассейна и в течение 60 с регистрировали время и дистанцию, проплываемую в каждом квадранте. Поведение записывали на видео и автоматически оценивали с помощью программного обеспечения Ethovision (Noldus, Wageningen, NL).
Тест “открытое поле” (32-й день). В тесте “открытое поле” изучали двигательную и исследовательскую активность. Установка представляла собой круглую арену диаметром 1 м, окруженную стенкой высотой 50 см. Арена была расчерчена на три равные концентрические зоны (центральную, среднюю и периферийную). Каждую крысу помещали в центр арены и автоматически записывали ее поведение в течение 5 мин при красном свете на видео и оценивали с помощью программного обеспечения Ethovision (Noldus, Wageningen, NL). Количественно оценивали следующие поведенческие параметры: суммарная пройденная дистанция (см), скорость (см/мин), вертикальная активность (число стоек), число и длительность реакций умывания и число входов в центр арены.
Тест “Сужающаяся дорожка” (33–37-й дни). Сенсомоторную координацию оценивали в тесте “сужающаяся дорожка”, согласно ранее использованному протоколу [19, 20]. Пластиковая планка длиной 200 см была приподнята на 80 см над полом и разделена на четыре сегмента по 50 см и оканчивалась пластиковой камерой. Планка по ширине варьировала от 1.5 см около камеры до 6 см на конце. Первые 4 дня подопытное животное обучали доходить до целевой камеры, высыживая на разное расстояние от нее. Проверку выработки навыка осуществляли на 5-й день тестирования. Для оценки применяли балльную систему подсчета. Итоговая оценка включала в себя сумму трех испытаний, причем баллы присваивались отдельно за каждый из четырех 50-см сегментов дорожки (максимальная оценка 12 баллов за 3 испытания). 0 баллов присваивали, если животное соскользнуло лапой с поверхности балки, оценку 1 балл давали, если крыса прошла сегмент без ошибок.
Тест спонтанного чередования рукавов в Y-образном лабиринте (38-й день). Кратковременную память оценивали, исследуя поведение чередования в Y-лабиринте, согласно протоколу [21]. Установка состояла из трех равных рукавов размером 42.5 × × 14.5 × 22.5 см, расходящихся из центра под углом 120°. Подопытное животное помещали в центр лабиринта и в течение 8 мин позволяли свободно перемещаться по лабиринту. Регистрировали последовательность входов в рукава. Чередование определяли как последовательные входы в рукава лабиринта без возврата в ранее посещенный рукав или рукав, из которого животное вышло в данный момент времени. Долю чередований оценивали как (число чередований/число входов – 2) × 100.
Выработка и воспроизведение условной реакции пассивного избегания (39–40-й день). Камера для выработки условной реакции пассивного избегания (УРПИ) представляла собой пластиковую коробку (OpenScience, Россия), разделенную на два равных отсека (30 см × 30 см × 30 см): один отсек с белыми стенками был ярко освещен, другой имел крышку и темные непрозрачные стенки. Двери между отсеками не было. Во время предварительного тестирования подопытное животное помещали в светлый отсек камеры на 5 мин для ознакомления. Через час после ознакомительного тестирования крысу снова помещали в светлый отсек камеры. Когда животное входило в темный отсек, оно получало электроболевую стимуляцию в течение 5 с (100 В, 100 Гц). После стимуляции животное возвращали в домашнюю клетку. Проверку сохранности УРПИ проводили через 24 ч после процедуры обучения. Во время тестирования оценивали следующие показатели: латентный период входа животного в темный отсек и общее время, проведенное животным в светлом отсеке камеры. Показателем сохранности навыка служила величина латентного периода входа в темный отсек во время теста. Критерием обученности животных считали значения ЛП больше 100 с.
Подготовка биологического материала. Через 1 сут после окончания поведенческих экспериментов (примерно 1.5 мес. после инъекций) подопытных животных анестезировали и транскардиально перфузировали ледяным 0.9% NaCl. Переднюю часть мозга, с медиальной септальной областью, помещали в 4% раствор параформальдегида (Sigma-Aldrich, США) в фосфатно-солевом буфере (PBS, Biolot, Россия) минимум на 2 дня. Оставшуюся часть мозга разрезали по средней линии, из левой половины выделяли гиппокамп и далее использовали его для оценки активности ацетилхолинэстеразы (АХЭ), правую половину дофиксировали в 4% параформальдегиде для иммуногистохимической оценки эффективности трансдукции.
Иммуногистохимия. После 48 ч фиксации из образцов мозга с помощью вибротома (Leica VT1200 S, Leica Biosystems, ФРГ) получали фронтальные срезы медиальной септальной области толщиной 50 мкм. Собранные срезы хранили в криопротекторе при –18°С. По четыре среза от каждого животного иммуногистохимически окрашивали на холинацетилтрансферазу (ХАТ) и анализировали гибель холинергических нейронов в медиальной септальной области. Для этого свободно плавающие срезы инкубировали в 0.3% Triton X-100 (SERVA, Германия) в 0.01 М PBS (PBS-T), а затем, в течение 1 ч, в блокирующем растворе (5% неиммунная сыворотка козы (Sigma-Aldrich, США) в PBS-T). После этого срезы помещали в блокирующий раствор с первичными антителами (поликлональные антитела кролика к ХАТ 1 : 500, Santa Cruz Biotechnology, США) при температуре 4°C на ночь. На следующий день срезы отмывали в PBS-T и инкубировали с вторичными антителами (1 : 800, антитела козы к IgG кролика, конъюгированные с биотином (Sigma-Aldrich, США)) в блокирующем растворе при комнатной температуре в течение 1 ч. После промывки в PBS, срезы инкубировали с комплексом авидин–биотин–HRP (АВС Elite kit, Vector Labs, США) в течение 1 ч и 3,3-диаминобензидином (Sigma-Fast Kit, Sigma-Aldrich, США), который был использован в качестве хромогена.
Из правого полушария мозга получали фронтальные срезы гиппокампа толщиной 50 мкм. Четыре среза гиппокампа, которые включали место инъекции, были окрашены антителами к зеленому флюоресцентному белку (GFP). Срезы последовательно инкубировали в 0.3% Triton X-100 (SERVA, Германия) в 0.01 М PBS, затем в течение 1 ч в блокирующем растворе и в блокирующем растворе с первичными антителами (анти-GFP 1 : : 500, Invitrogen, США) при температуре 4°C в течение ночи. На следующий день срезы промывали в PBS-T и инкубировали с вторичными антителами (антитела козы к IgG кролика-Alexa 488, 1 : 500).
Дополнительно по 4 среза гиппокампа от каждого животного были окрашены с использованием антител к нейрональному белку NeuN, как описано выше, за исключением того, что в качестве первичных антител использовали антитела кролика к NeuN (1 : 500, Millipore, США).
Все изображения исследуемых областей получали с помощью микроскопа Leica DM6000B (Leica Microsystems, Германия). Параметры визуализации были установлены таким образом, чтобы избежать насыщения сигнала.
Измерение активности ацетилхолинэстеразы. Активность ацетилхолинэстеразы (АХЭ) оценивали методом, основанным на образовании аниона 5,5'-дитиобис-2-нитробензойной кислоты (ДТНБ); оценку проводили спектрофотометрически по поглощению при 412 нм [22]. Образцы гиппокампа гомогенизировали в ледяном буфере, в состав которого входили: 100 мм Tris-HCl, рН 7.0, 1 M NaCl, 4 мM EDTA, 2% Triton X-100, 0.1% азида натрия и ингибитор протеаз (Roche, Швейцария). Гомогенаты центрифугировали (14 000 g, 30 мин) при температуре 4°C. Скорость гидролиза ацетилхолина измеряли в инкубационной среде, содержащей 0.4 мM ацетилхолин иодид, буфер для гомогенизации (рН 7.0) и 0.1 мM DTNB. В реакционную смесь добавляли 40 мкл супернатанта, инкубировали в течение 2 мин при температуре 30°С, далее в течение 3 мин отслеживали уровень гидролиза по образованию тиолатдианиона DTNB при 412 нм (интервалы 20 с) при 30°С. Все реакции проводили в дубликатах. Результаты выражали в ед./г массы ткани.
Статистическая обработка данных. Для оценки статистической значимости эффектов, вызванных введением иммунотоксина, использовали параметрические (t-тест Стьюдента) и непараметрические (U-тест Манна–Уитни, и тест Вилкоксона) критерии, а также двухфакторный дисперсионный анализ (ANOVA) с двумя межгрупповым (“введение иммунотоксина”, “введение конструкции, несущей NGF”) и одним внутригрупповым (повторные измерения в ходе тестирования) факторами.
РЕЗУЛЬТАТЫ
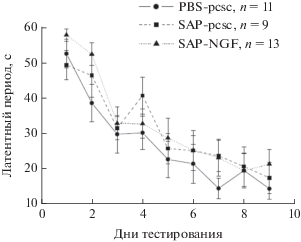
Мы оценили, может ли оверэкспрессия NGF в гиппокампе предотвратить нарушения поведения, вызванные инъекциями иммунотоксина 192IgG-сапорина. Оценка пространственной памяти в водном лабиринте Морриса существенных различий между группами не выявила. Суммарная проплываемая дистанция и скорость передвижения существенно не отличались между группами. На 10-й день во время проверки сохранности пространственной памяти групповых эффектов выявлено не было (рис. 1).
Рис. 1.
Изменения латентного периода нахождения платформы в тесте водный лабиринт Морриса в течение 9 дней обучения. Животным вводили PBS и контрольную конструкцию (PBS-pcsс, n = 11), 192IgG-saporin и контрольную конструкцию (SAP-pcsc, n = 9) и 192IgG-сапорин и NGF-несущий вирус (SAP-NGF, n = 13). 192IgG-сапорин и комбинированные инъекции иммунотоксина и лентивируса не вызывали каких-либо изменений в тесте по сравнению с контролем. Значимых изменений выявлено не было.
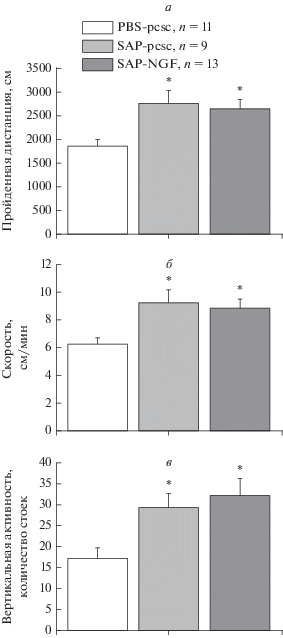
Далее мы проанализировали параметры двигательной и исследовательской активности крыс в тесте “Открытое поле”. Крысы обеих групп, которым вводили 192IgG-сапорин (контрольный вирус, SA-P-pCSC; NGF-несущий вирус, SAP-NGF), проходили большую дистанцию и демонстрировали повышенный уровень вертикальной активности во время тестирования. ANOVA выявил значимый групповой эффект для пройденной дистанции (F(2,30) = 6.22, Р < 0.01), скорости передвижения подопытных животных (F(2,30) = 6.24, Р < 0.01) и длительности стоек (F(2,30) = 4.25, Р < 0.05); все эти показатели были существенно выше в группах SAP-pCSC и SAP-NGF по сравнению с контрольной группой (рис. 2а–в).
Рис. 2.
Пройденная дистанция (а), скорость (б) и вертикальная активность (в) в тесте “Открытое поле”. Животным вводили PBS и контрольную конструкцию (PBS-pcsc, n = 11), 192IgG-сапорин и контрольную конструкцию (SAP-pcsc, n = 9), а также 192IgG-сапорин и NGF-несущий вирус (SAP-NGF, n = 13). Каждая точка представляет собой среднее значение ± ± ошибка среднего. Значимые отличия (p < 0.05) отмечены *, значимые межгрупповые различия (р < < 0.05) отмечены #.
Сенсомоторную координацию оценивали в тесте “Сужающаяся дорожка”. Введение 192IgG-сапорина приводило к нарушению координации и снижению соответствующего показателя в баллах (рис. 3а) в группе SAP-pCSC по сравнению с контрольной группой. Оверэкспрессия NGF в гиппокампе приводила к улучшению прохождения дорожки во время теста и увеличению суммарного количества баллов, полученного подопытными животными во время тестирования, до контрольного уровня. Более того, количество баллов, которое набрали животные, в группе SAP-NGF, было значимо выше по сравнению с группой SAP-pCSC. ANOVA также подтвердил наблюдавшийся эффект в тесте “Сужающаяся дорожка” (фактор “группа” (F(2,30) = 7.5, Р < 0.01) (рис. 3а).
Рис. 3.
На панели (а) показаны результаты, полученные в тесте “Сужающаяся дорожка” у крыс, которым вводили PBS и контрольную конструкцию вирус (PBS-pcsc, n = 11), 192IgG-сапорин и контрольную конструкцию (SAP-pcsc, n = 9) и 192IgG-сапорин и NGF-несущий вирус (SAP-NGF, n = 13). На панели (б) приведены результаты по количеству переходов между отсеками в ходе тестирования о время проверки выработки навыка в тесте УРПИ. Панели (в, г) представляют процент правильных чередований в тесте Y-образный лабиринт. Каждая точка представляет собой среднее значение ± ошибка среднего. Значимые отличия от контрольного уровня (p < 0.05) отмечены *, значимые межгрупповые различия (р < 0.05) отмечены #.
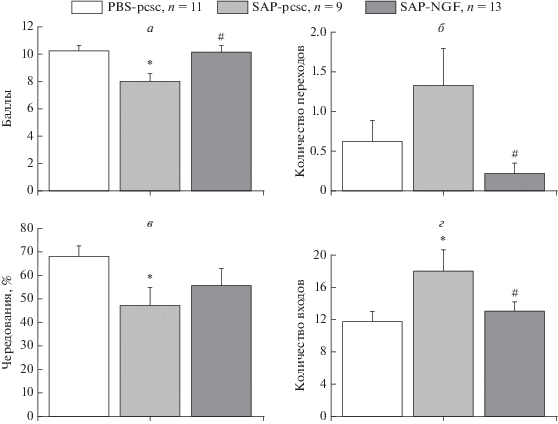
Поведение спонтанного чередования рукавов в Y-образном лабиринте позволило оценить состояние рабочей памяти. Оказалось, что животные, получавшие SAP-pCSC, демонстрировали выраженное нарушение чередования по сравнению с группой PBS-pCSC (рис. 3в; Р < 0.05). Оверэкспрессия NGF в группе SAP-NGF существенно не влияла на поведение подопытных животных в Y-образном лабиринте (рис. 3в). Интересно, что крысы, инъецированые 192IgG-сапорином, демонстрировали большее число входов в рукава лабиринта, что подтверждалось результатами ANOVA (фактор “группа” F(2,29) = 3.65, р < 0.05). У крыс группы SAP-NGF наблюдалась тенденция к нормализации двигательной активности, однако показатель не достигал уровня достоверности (р = 0.06; рис. 3г).
Анализ влияния оверэкспрессии NGF у крыс с холинергическим дефицитом, вызванным 192IgG-сапорином, на выработку УРПИ существенных межгрупповых различий не выявил (данные не приведены). Однако и в этом случае двигательная активность (суммарное число переходов между отсеками) крыс группы SAP-pCSC в ходе тестовой сессии была выше по сравнению с группой SAP-NGF (F(2,30) = 3.6, Р < 0.05; рис. 3б).
Иммуногистохимический анализ срезов мозга, проведенный после завершения всех поведенческих экспериментов, показал, что инъекции 192IgG-сапорина индуцировали гибель большинства ХАТ-содержащих нейронов в медиальной септальной области. Гибель ХАТ-содержащих клеток в этой области варьировала в пределах от 40 до 90% (рис. 4а–в). ANOVA выявил значимый эффект фактора “группа” (рис. 4з; F (2,29) = 17.1, Р < 0.01). Кроме того, активность ацетилхолинэстеразы (АХЭ) в гиппокампе крыс, которым вводили 192IgG-сапорин, была снижена по сравнению с контролем (рис. 4и), вероятно, отражая компенсаторную реакцию гиппокампа на холинергический дефицит, индуцированный иммунотоксином.
Рис. 4.
На панелях (а–в, з) представлено иммунное окрашивание на холинацетилтрансферазу (ХАТ) в медиальной септальной области у крыс с внутрисептальной инъекцией PBS (а), 192IgG-сапорина (б) или 192IgG-сапорина и NGF-несущего конструкта (SAP-NGF) (в) и число ХАТ-позитивных нейронов в медиальной септальной области (з). На панелях (г–е) показано влияние 192IgG-сапорина на выживаемость нейронов в области CA3 гиппокампа. Представлены срезы мозга крыс после внутрисептальных инъекций PBS (г), 192IgG-сапорина (д) или 192IgG-сапорина и NGF-несущего конструкта (SAP-NGF) (е) были окрашены на NeuN. На панели (ж) представлено иммуногистохимическое окрашивание среза гиппокампа на GFP у крыс с оверэкспрессией NGF. На панели (и) представлены данные по активности ацетилхолинэстеразы (АХЭ) в гиппокампе крыс, которым вводили PBS и контрольный вирус (PBS-pcsc, n = 11), 192IgG-сапорин и контрольный конструкт (SAP-pcsc, n = 9) и 192IgG-сапорин и NGF-несущий вирус (SAP-NGF, n = = 11) через 1.5 мес. после инъекции. Каждая точка представляет собой среднее значение ± ошибка среднего. *, достоверные различия по сравнению с группой PBS-pcsc, р < 0.05; #, достоверные межгрупповые различия, р < 0.05. Шкала: a–в и г–е – 500 мкм; ж – 100 мкм.
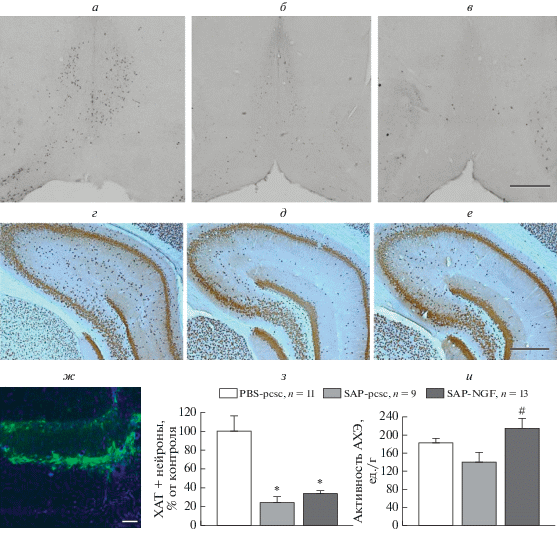
Уровень экспрессии вируса, несущего контрольную конструкцию или NGF, определяли с помощью иммунофлюоресцентной детекции GFP в срезах гиппокампа (рис. 4ж). Само по себе введение подопытным животным вирусной конструкции не вызывало существенными структурными изменениями в гиппокампе, что подтверждалось данными иммуногистохимического окрашивания на NeuN (рис. 4г–е). Несмотря на то, что оверэкспрессия NGF в гиппокампе не предотвращала гибель холинергических нейронов в медиальной септальной области, она восстанавливала активность АХЭ в гиппокампе.
Суммируя полученные данные, мы можем заключить, что в некоторых тестах 192IgG-сапорин вызывал нарушения поведения, которые в ряде случаев восстанавливались в результате оверэкспрессии NGF в гиппокампе. В отличие от почти полного отсутствия защитного эффекта в медиальной септальной области, где расположены тела холинергических нейронов, в гиппокампе оверэкспрессия NGF восстанавливала уровень активности АХЭ до контрольного уровня.
ОБСУЖДЕНИЕ
Гипотеза, положенная в основу этой работы, предполагала, что нейродегенеративные изменения в медиальной септальной области, вызванные внутрижелудочковым введением иммунотоксина 192IgG-сапорина, будут предотвращены повышенной секрецией NGF вследствии оверэкспрессии гена, кодирующего этот нейротрофин, в гиппокампе. Гиппокамп является структурой мозга, куда проецируются холинергические нейроны медиальной септальной области. Хорошо известно, что потеря холинергических нейронов базального переднего мозга является одним из ранних маркеров патогенеза ряда нейродегенеративных заболеваний, таких как болезнь Альцгеймера и болезнь Паркинсона с деменцией. Одним из предлагаемых терапевтических подходов для предотвращения этой потери является обеспечение дополнительной трофической поддержки этих нейронов [23].
Как предполагалось, внутрижелудочковая инъекция 192IgG-сапорина вызвала ярко выраженное снижение числа ХАТ-позитивных нейронов в медиальной септальной области и диагональной полоске Брока, однако оверэкспрессия NGF в гиппокампе не предотвратила гибель этих нейронов. Ранее Lee et al. показали, что введение NGF в желудочки мозга защищало холинергические нейроны медиальной перегородки и базального ядра от дегенерации, индуцированной инъекциями 192IgG-сапорина [12]. Авторы использовали очень низкую дозу токсина (20 нг против дозы 8 мкг, использованной в нашем исследовании), вызывающую лишь 30% потерю иммунореактивности. 192IgG-сапорин – вещество, токсическое действие которого основано на инактивации рибосом [24]. Низкая доза токсина, вероятно, вызывала подавление синтеза белка, а не гибель нейронов. В нашей работе была использована достаточно высокая доза токсина, что привело к 40–70% гибели ХАТ-позитивных клеток в медиальной септальной области. Это может быть одной из причин, объясняющей очевидное противоречие между настоящим исследованием и данными, полученными Lee et al. [12].
Вирусная вектор-опосредованная доставка гена NGF позволила произвести трансдукцию нейронов и, вероятно, клеток глии в относительно небольшом объеме гиппокампа. По нашим предыдущим данным [8, 9], этот метод доставки NGF приводит к тому, что концентрация суммарного NGF в гиппокампе достигает примерно 1.6 пг/мг белка. Мы предполагаем, что даже в условиях непрерывной секреции NGF этот уровень недостаточен, для предотвращения развития холинергической дегенерации. Уровень NGF, полученный в наших экспериментах, был на несколько порядков ниже, чем тот уровень белка, которого достигли Lee et al. [12] при хроническом введении нейротрофина. По-видимому, не последнюю роль играет и расположение места инъекции и/или экспрессии. NGF, синтезируемый в гиппокампе, должен достичь тел холинергических нейронов, чтобы поддержать их выживание. Для этого необходима целостность аксонов, что было продемонстрировано ранее с помощью ретроградного мечения флуоресцентными микросферами [25]. По всей видимости, доставка NGF к телам холинергических нейронов является более важным фактором для выживания клеток, чем наличие избытка NGF в клетках-мишенях. Этот вывод подтверждается данными о том, что введение в базальное ядро аденоассоциированного вируса, несущего NGF, на фоне дегенерации, вызванной разрушением свода мозга, защищает нейроны от дегенерации [26]. Следует также отметить, что в нашей работе введение вирусных конструкций в гиппокамп проводили одновременно с инъекцией иммунотоксина в боковые желудочки. По данным литературы, экспрессия целевых белков обычно начинается через 2–3 дня после инъекции, тогда как нейродегенеративные изменения, вызванные 192IgG-сапорином, начинаются только через 4 дня после инъекции и длятся, по крайней мере, 7 дней [27]. Последнее означает, что, хотя повышение уровня NGF началось еще до начала развития нейродегенеративных процессов, оно не смогло предотвратить дегенерацию ХАТ-позитивных нейронов в медиальной септальной области. В совокупности эти данные свидетельствуют о том, что экспрессии NGF в гиппокампе недостаточно для поддержания жизнеспособности холинергических нейронов в медиальной септальной области.
Отсутствие NGF-опосредованной защиты нейронов медиальной септальной области не означает, что NGF не оказывал положительного влияния на функциональную активность гиппокампа и/или других отделов мозга. Оверэкспрессия нейротрофина привела к восстановлению активности АХЭ до контрольного уровня, что указывает на то, что NGF вовлечен в функционирование холинергической системы гиппокампа. Поскольку активность АХЭ определяется уровнем секреции ацетилхолина, можно предположить, что оверэкспрессия NGF повышала холинергический тонус в гиппокампе, несмотря на дегенерацию значительной части холинергических нейронов медиальной септальной области. Этот эффект может быть результатом разрастания оставшихся холинергических волокон в гиппокампе [28–30] или усиления прорастания симпатических волокон [31] и трансдифференцировки норадренергических нейронов верхних шейных ганглиев симпатического ствола в холинергический фенотип [32].
Проведенные поведенческие эксперименты показали, что оверэкспрессия NGF на фоне холинергического дефицита не вызывала существенных изменений при обучении в водном лабиринте Морриса. Хорошо известно, что для выявления дефицита обучения и памяти в этом тесте необходимо, чтобы уровень гибели холинергических нейронов был максимальным [19, 33]. В настоящей работе уровень холинергической дегенерации был ниже (40–70% от контрольного уровня) по сравнению с нашими предыдущими результатами. Этот факт может объяснить отсутствие поведенческих нарушений в группах SAP-PCSC и SAP-NGF. Только крысы с максимальной гибелью клеток в медиальной септальной области (80–90%) демонстрируют поведенческие нарушения [33].
Крысы, получавшие 192IgG-сапорин, демонстрировали гиперактивность в тесте “открытое поле”. Эти данные согласуются с предыдущими результатами [19]. Однако механизм, лежащий в основе гиперактивности, которая сохранялась у крыс, получавших SAP-NGF, может отличаться от того, что обусловлен собственно холинергическим дефицитом. Оверэкспрессия NGF способствует восстановлению активности АХЭ в гиппокампе даже в условиях гибели значительной части холинергических нейронов, предполагая, что оверэкспрессия NGF каким-то образом компенсирует функциональные последствия потери холинергических септальных нейронов. Однако, восстановление холинергической передачи в гиппокампе не предотвращает тех изменений, которые были выявлены в тесте “открытое поле”. Отсутствие положительного эффекта NGF может быть вызвано, по крайней мере, двумя причинами: (1) NGF сам по себе может повышать двигательную активность у крыс [34] и (2) дегенерация септальных холинергических нейронов, вызванная введением 192IgG-сапорина внутрь желудочков мозга, может иметь дополнительные эффекты, не связанные с гибелью септальных нейронов, такие, например, как воспаление в гиппокампе [18, 35] и изменение состояния микроглии в неокортексе [36].
Интересным представляется то, что 192IgG-сапорин приводил к нарушению моторной координации по сравнению с контролем в тесте “cужающаяся дорожка”, а оверэкспрессия NGF в гиппокампе компенсировала это нарушение. Полученный результат частично соответствует предыдущим данным о том, что холинергический дефицит в гиппокампе приводит к нарушению активности в этом тесте [19, 20]. Эти изменения связывают либо с холинергической денервацией лобно-теменной коры [37], либо с нарушением функционирования клеток Пуркинье в мозжечке [38, 39]. Однако в нашем случае комбинированная инъекция 192IgG-сапорина с NGF-кодирующим лентивирусом значительно улучшает показатели, характеризующие поведение подопытных животных в тесте “сужающаяся дорожка”. Можно предположить, что наблюдаемые поведенческие изменения, вызванные холинергической дегенерацией, вероятно, связаны с нарушением функции гиппокампа, поскольку избыточная экспрессия NGF приводила к частичной коррекции этих дефицитов. Возможно, улучшению поведения в этом тесте способствует восстановление холинергического тона в гиппокампе, о котором упоминалось выше, и, как следствие, функций холинергической системы, важных для выполнения исследуемого поведения.
Таким образом, экспрессия NGF в клетках гиппокампа не влияла на уровень гибели нейронов в медиальной септальной области, хотя частично смягчала негативные функциональные проявления холинергического дефицита. Тот факт, что оверэкспрессия NGF не вызывала полного восстановления поведения подопытных животных, несмотря на компенсацию холинергического дефицита в гиппокампе, может быть важен для разработки терапии нейродегенеративных заболеваний, поскольку гипофункция холинергических нейронов является одним из маркеров болезни Альцгеймера. В совокупности наши данные свидетельствуют о том, что оверэкспрессия NGF в гиппокампе может лишь частично защитить от последствий дегенерации, вызванных холинергическим дефицитом, и полная компенсация может потребовать более сложных решений.
Список литературы
Hefti F. // J. Neurobiol. 1994. V. 25. P. 1418–1435.
Williams L.R., Varon S., Peterson G.M., Wictorin K., Fischer W., Bjorklund A., Gage F.H. // Proc. Natl. Acad. Sci. USA. 1986. V. 83. P. 9231–9235.
Winkler J., Thal L.J. // Exp. Neurol. 1995. V. 136. P. 234–50.
Zeisel A., Muñoz-Manchado, A.B., Codeluppi S., Lönnerberg P., La Manno G., Juréus A., Marques S., Munguba H., He L., Betsholtz C., Rolny C., Castelo-Branco G., Hjerling-Leffler J., Linnarsson S. // Science. 2015. V. 347. № 6226. P. 1138–1142.
Cembrowski M.S., Bachman J.L., Wang L., Sugino K., Shields B.C., Spruston N. // Neuron. 2016. V. 89. P. 351–368.
Seiler M., Schwab M.E. // Brain Res. 1984. V. 300. P. 33–39.
Schwab M.E., Otten U., Agid Y., Thoenen H. // Brain Res. 1979. V. 168. P. 473–483.
Ivanov A.D., Tukhbatova G.R., Salozhin S.V., Markevich V.A. // Neuroscience. 2015. V. 289. P. 114–122.
Uzakov S.S., Ivanov A.D., Salozhin S.V, Markevich V.A., Gulyaeva N.V. // Brain Res. 2015. V. 1624. P. 398–404.
Blesch A., Conner J., Pfeifer A., Gasmi M., Ramirez A., Britton W., Alfa R., Verma I., Tuszynski M.H. // Mol. Ther. 2005. V. 11. P. 916–925.
Winkler J., Ramirez G.A., Thal L.J., Waite J.J. // J. Neurosci. 2000. V. 20. P. 834–844.
Lee Y., Danandeh A., Baratta J., Lin C., Yu J., Robertson R.T. // Exp. Neurol. 2013. V. 249. P. 178–186.
Jönhagen M.E., Nordberg A., Amberla K., Bäckman L., Ebendal T., Meyerson B., Olson L., Seiger Å., Shigeta M., Theodorsson E., Viitanen M., Winblad B., Wahlund L.O. // Dement. Geriatr. Cogn. Disord. 1998. V. 9. P. 246–257.
Hao J.X., Ebendal T., Xu X.J., Wiesenfeld-Hallin Z., Eriksdotter Jönhagen, M. // Neurosci. Lett. 2000. V. 286. P. 208–212.
Pizzo D.P., Thal L.J. // Neuroscience. 2004. V. 124. P. 743–755.
Schliebs R., Roßner S., Bigl V. // Prog. Brain Res. 1996. V. 109. P. 253–264.
Tukhbatova G.R., Kuleshova E.P., Stepanichev M.Y., Ivanov A.D., Salozhin S.V. // Neurochem. J. 2011. V. 5. № 4. P. 294–300.
Dobryakova Y.V., Kasianov A., Zaichenko M.I., Stepanichev M.Y., Chesnokova E.A., Kolosov P.M., Markevich V.A., Bolshakov A.P. // Front. Mol. Neurosci. 2018. V. 10.
Lehmann O., Jeltsch H., Lazarus C., Tritschler L., Bertrand F., Cassel J.C. // Pharmacol. Biochem. Behav. 2002. V. 72. P. 899–912.
Lehmann O., Jeltsch H., Lehnardt O., Pain L., Lazarus C., Cassel J.C. // Eur. J. Neurosci. 2000. V. 12. № 1. P. 67–79.
Stepanichev M., Markov D., Pasikova N., Gulyaeva N. // Behav. Brain Res. 2016. V. 297. P. 5–14.
Ellman G.L., Courtney K.D., Andres V., Featherstone R.M. // Biochem. Pharmacol. 1961. V. 7. P. 88–95.
Appel S.H. // Ann. Neurol. 1981. V. 10. № 6. P. 499–505.
Bolshakov A.P., Stepanichev M.Y., Dobryakova Y.V., Spivak Y.S., Markevich V.A. // Toxins. 2020. V. 12.
Tuszynski M.H., Armstrong D.M., Gage F.H. // Brain Res. 1990. V. 508. P. 241–248.
Bishop K.M., Hofer E.K., Mehta A., Ramirez A., Sun L., Tuszynski M., Bartus R.T. // Exp. Neurol. 2008. V. 211. P. 574–584.
Field R.H., Gossen A., Cunningham C. // J. Neurosci. 2012. V. 32. P. 6288–6294.
Ramirez J.J., Caldwell J.L., Majure M., Wessner D.R., Klein R.L., Meyer E.M., King M.A. // J. Neurosci. 2003. V. 23. P. 2797–2803.
Tuszynski M.H. // Cell Transplant. 2000. V. 9. P. 629–636.
Heisenberg C.P., Cooper J.D., Berke J., Sofroniew M.V. // Neuroreport. 1994. V. 5. P. 413–416.
Crutcher K.A. // Auton. Neurosci. 2002. V. 96. P. 25–32.
Scheiderer C.L., McCutchen E., Thacker E.E., Kolasa K., Ward M.K., Parsons D., Harrell L.E., Dobrunz L.E., McMahon L.L. // J. Neurosci. 2006. V. 26. P. 3745–3756.
Wrenn C.C., Wiley R.G. // Int. J. Dev. Neurosci. 1998. V. 16. P. 595–602.
Kobayashi S., Ögren S.O., Ebendal T., Olson L. // Exp. Brain Res. 1997. V. 116. P. 315–325.
Dobryakova Y.V., Volobueva M.N., Manolova A.O., Medvedeva T.M., Kvichansky A.A., Gulyaeva N.V., Markevich V.A., Stepanichev M.Yu., Bolshakov A.P. // Front. Neurosci. 2019. V. 13.
Volobueva M.N., Dobryakova Y.V., Manolova A.O., Stepanichev M.Yu., Kvichansky A.A., Gulyaeva N.V., Markevich V.A., Bolshakov A.P. // Neurochem. J. 2020. V. 14. P. 37–42.
Abdulla F.A., Calaminici M.R., Raevsky V.V., Sinden J.D., Gray J.A., Stephenson J.D. // Exp. Brain Res. 1994. V. 98. № 3. P. 441–456.
Traissard N., Herbeaux K., Cosquer B., Jeltsch H., Ferry B., Galani R., Pernon A., Majchrzak M., Cassel J.C. // Neuropsychopharmacology. 2007. V. 32. № 4. P. 851–871.
Waite J.J., Chen A.D., Wardlow M.L., Wiley R.G., Lappi D.A., Thal L.J. // Neuroscience. 1995. V. 65. № 2. P. 463–476.
Дополнительные материалы отсутствуют.


