Нейрохимия, 2021, T. 38, № 3, стр. 235-241
Изучение модификации лекарственного центра I сывороточного альбумина человека гипохлоритом натрия методом разрешенной во времени флуоресцентой спектроскопии
Т. И. Сырейщикова 1, Н. В. Смолина 2, М. Г. Узбеков 2, В. И. Бриллиантова 2, Е. Д. Сыромятникова 1, Г. Е. Добрецов 3
1 Физический институт им. П.Н. Лебедева РАН
Москва, Россия
2 ФГБУ Московский научно-исследовательский институт психиатрии
Москва, Россия
3 ФГБУ ФНКЦ физико-химической медицины ФМБА
Москва, Россия
Поступила в редакцию 10.03.2021
После доработки 15.03.2021
Принята к публикации 17.03.2021
Аннотация
Проведено измерение кинетики затухания флуоресценции зонда K-35 и аминокислотного остатка триптофана (Trp) при добавлении гипохлорита натрия в альбуминовую фракцию сыворотки крови здорового донора (HSA). Флуоресцентный зонд К-35 (возбуждение 405 нм, флуоресценция 530 нм) связывается с I лекарственным центром альбумина. Во время эксперимента молярная концентрация альбумина во фракции изменялась от 0.3 до 20 мкМ. Окисление фракции гипохлоритом регистрировали по изменению флуоресценции Trp, также расположенного в I центре альбумина (возбуждение 290 нм, флуоресценция 350 нм). Было показано, что при молярной концентрации альбумина в сыворотке крови порядка 30 мкМ HSA проявляет антиоксидантную активность, позволяющую ему поддерживать свои функции даже после воздействия относительно больших количеств гипохлорита (до 50 молекул окислителя на молекулу белка). HSA сохраняет свою способность к связыванию лигандов , так как свойства зонда К-35 при окислении остались практически неизменными, зарегистрированы лишь незначительные изменения в характеристиках связывания. Добавленный гипохлорит в первую очередь расходуется на окисление аминокислот альбумина, в том числе на наблюдаемое в эксперименте окисление Trp. Для 14 сывороток доноров показано достоверное отличие флуоресценции триптофана, окисленного и нативного.
ВВЕДЕНИЕ
Сывороточный альбумин человека (human serum albumin, HSA) существует в организме человека как в нативной, так и в окисленной формах. Большинство биомолекул (липиды, белки, ДНК) являются мишенью для окислителей и страдают от окислительного стресса. Окисление белков может изменить их первичные структуры, привести к фрагментации или олигомеризации, и изменить их функциональные способности. Высказывается предположение, что повышенный уровень окисленного сывороточного альбумина человека может приводить к ряду патологических состояний. Окисление гипохлоритом натрия считается важным процессом в прогрессе некоторых болезней, включающих атеросклероз, воспалительные заболевания кишечника, гепатит, инфаркт миокарда, шизофрению, онкологические заболевания и некоторые другие патологии, вызванных окислительным стрессом [1–4]. В литературе отмечается, что в настоящее время недостаточно знаний о функциональной связи между свойствами нативного и окисленного альбумина [2], и о патофизиологическом значении окисления альбумина. Альбумин обратимо связывает многие эндогенные и экзогенные низкомолекулярные соединения, в том числе l-trp, жирные кислоты, билирубин и лекарственные соединения. Он также играет важную роль в транспортировке этих соединений к цели. Два основных связывающих центра лигандов на молекуле альбумина обозначаются как лекарственные сайты I и II [5].
Известно, что сам по себе альбумин является основным защитным белком плазмы за счет его способности перехватывать свободные радикалы. Протекторные свойства альбумина проявляются в первую очередь благодаря наличию SH-групп цистеина (Cys) [6]. Некоторый вклад в это могут вносить 6 остатков другой аминокислоты – метионина, также весьма чувствительные к окислению. Наконец, ароматические аминокислоты также обладают выраженными антиоксидантными свойствами [2]. Последний факт подкреплен нашим экспериментальным материалом по триптофану (данная статья).
В настоящей работе в качестве окислителя использовался гипохлорит натрия. Гипохлорит натрия образуется в организме человека при воспалительных процессах (в лейкоцитах, точнее в нейтрофилах) [7–10]. При инфицировании крови бактериями последние активируют лейкоциты, что сопровождается выделением сильного окислителя – гипохлорита натрия. Гипохлорит защищает организм человека от микроорганизмов. В растворе гипохлорит (NaOCl) находится в динамическом равновесии с хлорноватистой кислотой (HOCl): NaOCl + H+ → HOCl + Na+. Именно HOCl является сильнейшим окислителем и необходим для борьбы с инфектами. Гипохлорит химически взаимодействует с белком (почти мгновенно): в результате реакции HOCl c аминогруппами белка образуются долгоживущие хлорамины [2]. Получается, что гипохлорит как бы “сорбируется” на белке, превратившись при этом в хлорамины. Из хлораминов возникают радикалы, которые способствуют HOCl-индуцируемому окислению белков плазмы.
Основное внимание в нашей статье обращено на изучение связывающей способности центрами альбумина лигандов и лекарственных соединений. В литературе есть сведения, что окисление HSA не оказывает заметного влияния на связывание лекарственных соединений с сайтом I в поддомене IIA [11–13].
Цель работы состояла в изучении свойств связывающего лекарственного центра I альбумина сыворотки крови человека при его окислении гипохлоритом натрия.
МАТЕРИАЛЫ И МЕТОДЫ
Кровь доноров забирали натощак, сыворотку получали стандартным способом, все образцы хранили при –30°C. Из сывороток выделяли альбуминовую фракцию с помощью двухфазной системы полиэтиленгликоль 3000/буфер PBS (рН 7.4) [14]. Альбуминовые фракции сывороток крови доноров разбавляли в 10 раз буфером PBS (Sigma-Aldrich, CША), cодеpжавшем 0.137 М NaCl и 0.01 М фоcфата натpия, pН 7.4. В качестве окислителя использовался гипохлорит натрия с молярной концентрацией 1 мМ (примерно 50 молекул гипохлорита на 1 молекулу альбумина). Во всех фракциях были измерены концентрации альбумина с помощью метода бромкрезоловых красителей [15]. Молярная концентрация альбумина в исследованных альбуминовых фракциях сывороток крови в среднем была равна около 20 мкМ. Среднеквадратичная вариация среднего значения концентрации альбумина составляет 10%. Концентрация зонда К-35 составляла 20 мкМ.
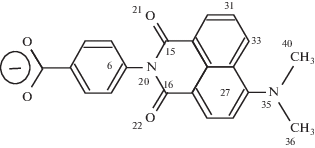
Степень окисления рассчитывалась, как и в работе [7], по изменению суммарного выхода флуоресценции триптофана. Молекула флуоресцентного зонда К-35 изображена на рис. 1.
Рис. 1.
Молекула флуоресцентного зонда К-35. Ионная форма в водном растворе при pH 7. Показана нумерация атомов.
Измерения кинетики затухания флуоресценции зонда K-35 были выполнены в Физическом институте им П.П. Лебедева РАН на установке с пульсирующим источником света (LED) фирмы Pico-Quant (длина волны излучения 459 нм, длина волны флуоресценции 530 нм) [16]. Измерения флуоресценции триптофана (Trp) проводились при длинах волн излучения и флуоресценции 290 и 350 нм (LED 290 nm Pico-Quant).
Основная работа проведена на частоте 10 MHz при максимальной оптической мощности 30 µW. В качестве детектора фотонов использовался фотоэлектронный умножитель Hamamatsu (PMA-182). Для коррелированного во времени счета одиночных фотонов флуоресценции использовался PCI-Board TimeHarp 200 (фирма Pico-Quant). Время-амплитудный конвертор содержит 4096 каналов регистрации фотонов с шириной канала в 33 пикосекунды. Длительность импульсов возбуждающего излучения около 700 пикосекунд. На базе персонального компьютера типа AMD Sempron автоматизированы как процесс измерения, так и обработка экспериментальных данных (Программы TimeHarp и FluoFit фирмы Pico-Quant) [16].
В используемой нами технике измерений экспериментально измеряемая функция затухания флуоресценции I(t) и реальная функция затухания флуоресценции F(t) связаны с помощью свертки:
где L(t) – профиль возбуждающего импульса. При решении свертки F(t) выражалась как аналитическая функция с несколькими неизвестными параметрами. Она сворачивалась с профилем возбуждающего импульса и затем сравнивалась с функцией I(t). Использовался метод наименьших квадратов и χ2 критерий. Лучшие параметры фитирования соответствовали минимуму χ2.
Флуоресценция зонда К-35 и Trp фитировалась суммой трех экспонент (программа FluoFit фирмы Pico-Quant):
(2)
$\begin{gathered} F(t) = {{{\text{A}}}_{1}}\exp \left( {{{ - t} \mathord{\left/ {\vphantom {{ - t} {{{\tau }_{1}}}}} \right. \kern-0em} {{{\tau }_{1}}}}} \right) + \\ + \,\,{{{\text{A}}}_{2}}\exp \left( {{{ - t} \mathord{\left/ {\vphantom {{ - t} {{{\tau }_{2}}}}} \right. \kern-0em} {{{\tau }_{2}}}}} \right) + {{{\text{A}}}_{3}}\exp \left( {{{ - t} \mathord{\left/ {\vphantom {{ - t} {{{\tau }_{3}}}}} \right. \kern-0em} {{{\tau }_{3}}}}} \right). \\ \end{gathered} $В уравнении 2 Ai – амплитуды, τi – времена затухания флуоресценции, соответствующие трем связывающим центрам альбумина сыворотки крови.
Для статистического анализа достоверности различия амплитуд флуоресценции триптофана в 14 сыворотках доноров, не окисленных и с окислением гипохлоритом натрия, использовалась программа Statistica версии 10. Методом непараметрической статистики проведено сравнение 2-х выборок с помощью критерия Вилкоксона.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Измерение флуоресценции Trp. Одиночный аминокислотный остаток триптофана Trp расположен в I лекарственном центре альбумина. Проведено измерение внутренней флуоресценции триптофана в альбуминовых фракциях сывороток крови 12 здоровых доноров в естественных условиях и после добавления окислителя – гипохлорита натрия. Флуоресценция триптофана в альбуминовых фракциях не является гетерогенной и фитировалась суммой трех экспонент с помощью уравнения (2). Согласно широко известной модели ротамера [17], эти три времени жизни могут быть связаны с тремя возможными конформационными состояниями триптофана в HSA.
Молярная концентрация альбумина в исследованных альбуминовых фракциях сывороток крови человека в среднем была около 20 мкМ. В пределах средне-квадратических ошибок средние значения 3-х времен затухания флуоресценции всех центров аминокислотного остатка триптофана практически не меняются с окислением и равны 6.5, 2.7 и 0.9 нс. Наибольшее изменение при окислении испытывает амплитуда долгоживущей компоненты А1.
В табл. 1 приведены средние параметры флуоресценции Trp и ошибки их средних M ± m (14).
Таблица 1.
Cредние значения параметров флуоресценции Trp и ошибки их средних для 14 исследованных сывороток доноров (M ± m (14))
| Группа | A1 | A2 | A3 | A1/A3 | A1/A2 | A2/A3 |
|---|---|---|---|---|---|---|
| Донор | 431 ± 19 | 569 ± 20 | 287 ± 17 | 1.51 ± 0.06 | 0.76 ± 0.01 | 1.99 ± 0.06 |
| Окисл. донор | 237 ± 12 | 377 ± 20 | 242 ± 15 | 1.02 ± 0.08 | 0.63 ± 0.02 | 1.60 ± 0.07 |
| Донор/окисл. донор | 1.82 ± 0.04 | 1.51 ± 0.04 | 1.19 ± 0.04 | 1.48 ± 0.04 | 1.21 ± 0.04 | 1.24 ± 0.04 |
Из табл. 1 видно, что все амплитуды закона затухания флуоресценции падают с окислением (молярная концентрация гипохлорита 1 мМ). Анализ экспериментальных данных с помощью программы Statistica-10 показал, что все амплитуды Ai во фракциях нативных доноров достоверно различаются (с уровнем р = 0.01 по критерию Вилкоксона) от амплитуд тех же фракций с добавлением гипохлорита.
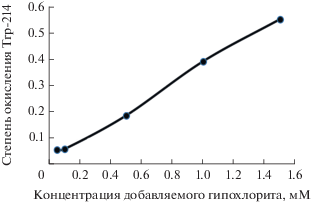
На рис. 2 приведена зависимость окисления триптофана альбуминовой фракции от концентрации добавляемого гипохлорита. Степень окисления фракции гипохлоритом рассчитывалась как: Δ = [F(0) – F(C)]/F(0), где F(C) – суммарная интенсивность флуоресценции триптофана при молярной концентрации гипохлорита (С), F(0) – интенсивность флуоресценции триптофана без гипохлорита
Было проведено титрование гипохлоритом натрия альбуминовой фракции сыворотки здорового донора с молярной концентрацией 20 мкМ (рис. 1) и показано, что даже после воздействия относительно больших количеств гипохлорита (вплоть до 50 молекул окислителя на молекулу альбумина) кривая зависимости интенсивности флуоресценции триптофана остается линейной функцией от концентрации гипохлорита.
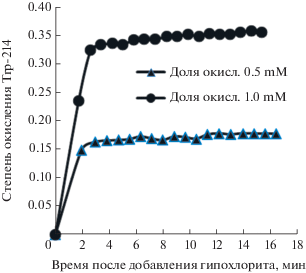
Был проведен эксперимент по измерению зависимости от времени окисления альбуминовой фракции гипохлоритом натрия с молярной концентрацией 1 и 0.5 мМ. Эксперимент показал, что окисление альбумина гипохлоритом таких концентраций происходит быстро – не больше двух–трех минут (рис. 2, 3). Реальное время, возможно, еще меньше, так как начальное минимальное время измерений определяется условиями эксперимента. Инкубация гипохлоритом в эксперименте длилась 1 ч.
Рис. 3.
Изменение доли окисления триптофана гипохлоритом со временем при двух молярных концентрациях гипохлорита.
Здесь уместно рассмотреть работу, в которой также флуоресцентными методами исследовалось влияние гипохлорита на лекарственнй центр I модельного альбумина [11]. В работе также было показано, что NaOCl почти полностью потребляется в течение несколько минут в присутствии аминокислот или белков. Несмотря на это, измерения окисления выполнялись в этой работе после 60 мин инкубации, чтобы стандартизовать вторичный ущерб из-за разложения первоначально образовавшихся хлораминов.
Измерения флуоресценции зонда К-35. Основная задача эксперимента состояла в изучении влияния окисления белка на связывающую способность его I лекарственного центра. Такая же задача ставилась и в обсуждаемой выше работе [11]. Там изучалось взаимодействие обезжиренного модельного (Sigma) альбумина и гипохлорита натрия (NaOCl). Показано, что NaOCl уменьшает количество активных сайтов. Однако, остальные сайты имеют сродство к субстрату равное или даже больше, чем те, которые присутствуют в нативном белке.
Исследуя флуоресценцию зонда К-35 (лиганда), связывающегося с лекарственным центром альбумина I, мы исследовали возможность окисления гипохлоритом и других лигандов – лекарств. Очевидно, зонд К-35, связываясь с альбумином, попадает в гетерогенное окружение, которое меняется в течение времени контакта между белком и флуоресцентным зондом. Для изучения этой гетерогенности была использована разрешенная во времени субнаносекундная флуоресцентная спектроскопия, позволяющая регистрировать малые локальные изменения и избирательно следить за состоянием связывающих центров альбумина. Измерялась кинетика затухания флуоресценции зонда К-35. В воде К-35 практически не флуоресцирует, поэтому флуоресценция исходит только от молекул зонда, связанных с HSA. Компьютерная обработка данных, передающих временной ход кривой затухания флуоресценции К-35 (программа FluoFit), показала, что наиболее точно регистрируемая кривая (интенсивность свечения зонда F(t)) может быть представлена как сумма трех экспоненциальных слагаемых (см. выше уравнение (2)).
В альбумине времена затухания зонда составляют около 9, 3 и 1 нс. В воде выход флуоресценции К-35 чрезвычайно низок, поэтому среднее время затухания намного ниже 1 нс. Данные о флуоресценции К-35 свидетельствуют в пользу предположения о том, что молекулы всех трех “базовых” типов локализуются в I лекарственном центре. После многочисленных экспериментов [18–24] было сделано предположение, что время затухания флуоресценции зонда связано со степенью сольватации его молекулы молекулами воды. По-видимому, вода нужна для флуоресценции, но не как сплошная водная фаза, а как ограниченное количество полярных молекул, сольватирующих определенные места молекулы зонда (скорее всего это два карбонильных атома кислорода и аминогруппа). Вероятно, в альбумине зонд образует 3 типа сольватных комплексов, поскольку при разных условиях мы видим 3 устойчивых времени затухания с амплитудами Ai и соответствующими временами затухания. При возбуждении зонда возникают три различных дискретных состояния молекул зонда, связанных с тушащим действием воды. Первое τ1 около 9 нс, вероятно, получается при локализации зонда в глубине молекулы альбумина, в которой существует глубокий гидрофобный карман. Меньшие времена затухания могут соответствовать более поверхностному размещению зондов К-35 в альбумине и наличию молекул воды.
Поведение альбумина крови как антиоксиданта хорошо видно при измерении кинетики затухания флуоресценции зонда К-35 при добавлении окислителя – гипохлорита натрия во фракции сыворотки донора при различной концентрации альбумина Измерения проводились в естественном состоянии сыворотки и при добавлении 1 мМ гипохлорита натрия. Получено, что при малой молярной концентрации альбумина (до 0.7 мкМ) в связывающих центрах альбумина происходят изменения как времен затухания, так и амплитуд. При концентрациях альбумина менее 0.7 мкМ самое большое время затухания уменьшается почти в 2 раза (от 8.5 до 4.5 нс). Среднее время почти не изменяется, а третье (меньшее время) – практически исчезает. При увеличении молярной концентрации альбумина свыше 1 мкМ окислитель начинает перехватываться альбумином. Все времена практически скачком возвращаются к своим значениям до окисления. Появляется и самое маленькое время – порядка 1 нс.
Вероятно, при малых концентрациях альбумина в центрах связывания лигандов с альбумином мы наблюдаем химическую реакцию между гирохлоритом и альбумином. В конкуренции между центрами связывания лигандов и аминокислотами здесь в рачале побеждает свзывание зонда К-35 с центрами альбумина. При дальнейшем увеличении молярной концентрации альбумина гипохлорит переходит к окислению аминокислот и не трогает центры связывания лигандов.
Из рис. 4–6 видно,что при увеличениии молярной концентрации альбумина во фракциях крови доноров амплитуды при наличии гипохлорита натрия начинают приближаться к амплитудам в естестенном состоянии. Наши результаты показали, что альбумин при его естественной концентрации в плазме крови способен защищать транспортируемые молекулы от гипохлорита. Антиоксидантная активность HSA позволяет белку поддерживать свои функции в естественных условиях. Добавленный гипохлорит в первую очередь расходуется на обширное окисление аминокислот, о чем в нашем эксперименте свидетельствует потеря флуоресценции Trp.
Рис. 4.
Изменение времен затухания флуоресценции К-35 при окислении гипохлоритом натрия в зависимости от концентрации альбумина во фракции донора.
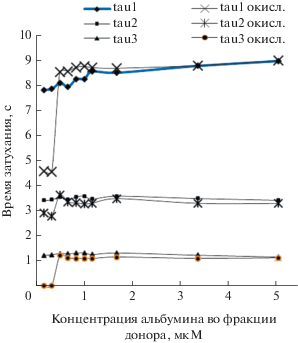
Рис. 5.
Изменение амплитуд А1 и А2 функции затухания флуоресценции зонда К-35 в альбуминовой фракции сыворотки донора при окислении гипохлоритом натрия в зависимости от концентрации альбумина во фракции донора.
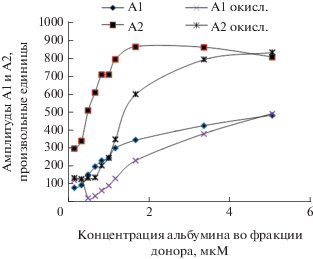
Рис. 6.
Изменение амплитуды А3 функции затухания флуоресценции зонда К-35 в альбуминовой фракции сыворотки донора при окислении гипохлоритом натрия в зависимости от концентрации альбумина во фракции донора.
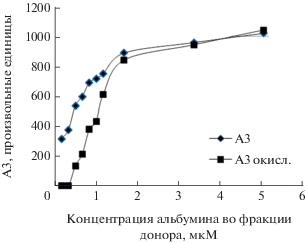
Изменения амплитуд флуоресценции К-35 при окислении гипохлоритом молярной концентрации 1 мМ и молярной концентрации альбумина во фракции донора 20 мкМ составляют: 1.065 ± 0.04, 1.063 ± 0.06, 0.907 ± 0.06.
Из этого следует, что изменения свойств связывающего лекарственного центра I при окислении гипохлоритом натрия практически не происходит.
Исследуя окисление зонда К-35 (лиганда), связывающегося с I лекарственным центром альбумина, мы исследовали окисление гипохлоритом и других лигандов – лекарственных соединений. Наши результаты показали, что альбумин способен защищать транспортируемые молекулы от модификации гипохлоритом, добавленным в концентрациях, сопоставимых с концентрациями гипохлорита, вырабатываемого организмом человека в очаге воспаления. Это согласуется с приводимым в литературе утверждением, что альбумин сыворотки крови человека (HSA) является “жертвенным” антиоксидантом, нейтрализующим оксиданты своими химически активными группами (различными аминокислотными остатками, прежде всего тиоловой группой остатка Cys С); при этом сам HSA подвергается необратимой химической модификации.
Изучение кинетики затухания флуоресценции триптофана показало, что взаимодействие этого аминокислотного остатка с окислителем приводит к сильному уменьшению флуоресценции триптофана. Его флуоресценция в долгоживущем центре (амплитуда А1) изменяется в 1.8 раза.
ВЫВОДЫ
Результаты эксперимента показали, что свойства зонда, связанного с I лекарственным центром, практически не изменились при окислении гипохлоритом натрия. Гипохлорит натрия не изменяет связывающую способность зонда К-35 в молекулах альбумина в сыворотках здоровых людей и, следовательно, свою способность связывать лекарственные вещества, также являющиеся лигандами. Наши наблюдения подтверждают, что альбумин способен выполнить свою транспортную роль даже после прогрессивного окисления в течение всего срока службы молекулы альбумина. Если лиганд типа лекарства связывается с лекарственным центром I, то HSA может защитить такой лиганд от оксиданта – гипохлорита натрия.
Список литературы
Colombo G., Clerici M., Giustarini D., Rossi R., Milzani A., Dalle_Donne // Antioxid. Redox Signal. 2012. V. 17. P. 1515–1527.
Sozarukova M.M., Proskurnina E.V., Vladimirov Yu.A. // Bull. RSMU. 2016. № 1. P. 56–61.
Pattison D.I., Davies M.J. // Curr. Med. Chem. 2006. V. 13. P. 3271–3290.
Anraku M., Yamasaki K., Maruyama T., Kragh-Hansen U., Otagiri M. // Pharm. Res. 2001. V. 18. P. 632–639.
Sudlow G., Birkett D.J., Wade D.N. // Mol. Pharmacol. 1975. V. 11. P. 824–832.
Graziano Colombo, Marco Clerici, Alessandra Altomare, Francesco Rusconi, … Aldo Milzani // J. Proteomics. 2017. V. 152. P. 22–32.
Clare L. Hawkins, Michael J. Davies // Biochem. J. 1999. V. 340. P. 539–548 (Printed in Great Britain).
Robaszkiewicz A., Bartosz G., Soszynki M. // Free Rad. Res. 2008. V. 42. P. 30–39.
Chekanov A.V., Panasenko O.M., Osipov A.N., Matveeva N.S., Kazarinov K.D., Vladimirov Iu.A., Sergienko V.I. // Biophysics. 2005. V. 50. № 1. P. 13–19.
Arnhold J., Hammerschmidt S., Wagner M., Mueller S., Arnold K., Grimm E. // Biomed. Biochim. Acta. 1990. V. 49. P. 991–997.
Eduardo Lissi, M. Alicia Biasutti, Elsa Abuin, Luis Leyn // J. Photochemistry and Photobiology B: Biology. 2009. V. 94. P. 77–81.
Asami Kawakami, Kazuyuki Kubota, Naoyuki Yamada, Uno Tagami, Kenju Takehana, Kenji Takehana, Ichiro Sonaka, Eiichiro Suzuki, Kazuo Hirayama // FEBS. 2006. V. 273. P. 3346–3357.
Mohammad Reza, Ashrafi Kooshka, Reza Khodarahmi, Seyyed Arash Karimib, Mohammad Reza Nikbakhtc // J. Reports in Pharmaceutical Sciences. 2012. V. 1. № 2. P. 94–106.
Gorinstein Sh., Goshev I., Moncheva S., Caspi A. // J. Protein Chem. 2000. V. 19. № 8. P. 637–642.
Doumas B.T., Watsonand W.A., Biggs H.G. // Clin. Chim. Acta. 1971. V. 31. P. 87–96.
Syrejshchikova T.I., Gryzunov Y.A., Smolina N.V., Komar A.A., Uzbekov M.G., Misionzhnik E.J., Maksimova N.M. // Laser Physics. 2010. V. 20. № 5. P. 1074–1078.
Szabo A.G., Rayner D.M. // J. Am. Chem. Soc. 1980. V. 102. P. 2–4.
Dobretsov G.E., Syrejshchikova T.I., Smolina N.V., Uzbekov M.G. // Nova Publishes. 2015. P. 129–173.
Smolina N.V., Syrejshchikova T.I., Uzbekov M.G., Dobretsov G.E. // Eds.: Grigoriev A.I. and Vladimirov Yu.A. Moscow, MAKS Press. 2015. V. 2. P. 293–327.
Добрецов Г.Е., Сырейщикова Т.И., Грызунов Ю.А., Смолина Н.В., Комар А.А. // Биофизика. 2010. Т. 55. № 2. С. 213–219.
Добpецов Г.Е., Гpызунов Ю.А., Cыpейщикова Т.И., Смолина Н.В., Cветличный В.Ю., Поляк Б.М. // Биофизика. 2012. Т. 57. № 3. С. 405–409.
Добрецов Г.Е., Сырейщикова Т.И., Смолина Н.В. // Биофизика. 2011. Т. 56. № 3. С. 403–406.
Смолина Н.В., Добрецов Г.Е., Сырейщикова Т.И., Гамбург Ю.Д., Калинина В.В., Грызунов Ю.А // Эфферентная и физико-химическая медицина. 2012. № 3. С. 16–21.
Dobretsov G., Polyak B., Smolina N., Babushkina T., Syrejshchikova T., Klimova T., Sverbil V., Peregudov A., Gryzunov Y., Sarkisov O. // J. Photochemistry and Photobiology, A: Chemistry. 2013. V. 251. P. 134–140.
Дополнительные материалы отсутствуют.