Нейрохимия, 2021, T. 38, № 3, стр. 242-248
Субхроническое введение пептидных препаратов ноопепт и семакс увеличивает плотность ГАМКА-рецепторов в мозге мышей BALB/c
Е. В. Васильева 1, А. А. Абдуллина 1, Г. И. Ковалёв 1
1 Федеральное государственное бюджетное научное учреждение
“НИИ фармакологии им. В.В. Закусова”
Москва, Россия
Поступила в редакцию 22.01.2021
После доработки 11.03.2021
Принята к публикации 16.03.2021
Аннотация
В экспериментах на инбредных мышах BALB/c и C57BL/6 изучено влияние 5-кратного внутрибрюшинного и интраназального введений ноопепта (1 мг/кг/день) и семакса (0.6 мг/кг/день), проявляющих ноотропный и анксиолитический эффекты только у мышей BALB/c, на специфическое связывание [3H]-Мусцимола с ГАМКА-рецепторами префронтальной коры мозга в условиях ex vivo. Установлено, что у мышей обеих линий исходное содержание мест связывания (Вmax) и константы диссоциации (Kd) не различаются существенно. Однако в результате субхронического в/б введения Ноопепта и Семакса мышам BALB/c, отмечено достоверное возрастание плотности ГАМКА-рецепторов на 38 и 68% относительно контрольной группы, а после назального введения – на 18 (ноопепт) и 37% (семакс), что соответствует преобладанию анксиолитического эффекта этих препаратов при внутрибрюшинном введении у мышей этой линии. В группе мышей С57BL/6 не было обнаружено значимых изменений характеристик ГАМКА-рецепторов в префронтальной коре, кроме снижения плотности рецепторов под влиянием в/б введения ноопепта (–20%). Однонаправленное влияние ноопепта и семакса на плотность ГАМКА-рецепторов при обоих путях введения, а также соответствие выраженности этих изменений степени проявления анксиолитического эффекта в зависимости от способа введения могут указывать на участие этих рецепторов в механизме формирования анксиолитического компонента этих пептидов.
ВВЕДЕНИЕ
Вещества пептидной природы ноопепт и семакс принадлежат к клинико-фармакологической группе “Ноотропный препарат”, улучшая высшие интегративные функции мозга – память и способность к обучению. В экспериментальных условиях это выражается в препятствии развитию у животных моделируемой амнезии различного генеза (электрошок, блокада центральных холин- и глутаматергических структур, лишение парадоксальной фазы сна) [1], а также в избирательном повышении эффективности исследовательского поведения (ЭИП) в неинвазивном тесте “закрытый крестообразный лабиринт” (ЗКЛ) у мышей с исходным фенотипическим или генотипическим дефицитом когнитивной функции [2, 3]. При этом в радиорецепторных исследованиях ex vivo показано, что этот эффект развивается лишь в результате неоднократного введения ноотропов [4, 5] и сопровождается изменениями рецепторных характеристик NMDA-рецепторов в гиппокампе и н-холинорецепторов в префронтальной коре мозга [6, 7]. Предпосылками для проведения данного исследования стали следующие экспериментальные факты: (а) инбредная линия мышей BALB/c обладает исходно повышенной тревожностью и меньшей ЭИП в сравнении с линией C57BL/6 в условиях теста ЗКЛ [8]; (б) оба пути введения семакса и ноопепта мышам BALB/c приводят к снижению тревожности и увеличению эффективности исследовательского поведения, однако первый эффект более выражен при внутрибрюшинном, а второй – при интраназальном пути введения [9]; (в) в электрофизиологических экспериментах на изолированных нейронах оба пептида усиливают ГАМК-активируемые ионные токи [10, 11]. Вместе с тем, до настоящего времени отсутствовали свидетельства о непосредственном вовлечении ГАМКА-рецепторов в механизм действия ноопепта и семакса. Обнаружилось также, что другим общим свойством обоих пептидов является зависимость спектров их психофармакологического действия от пути введения: ноотропное действие преобладает над анксиолитическим при интраназальном введении, тогда как при внутрибрюшинном более ярко проявляется последнее [9]. Учитывая, что в клинических условиях семакс применяется интраназально, а ноопепт перорально, а также что анксиолитический эффект связан с функцией центральных ГАМКА-рецепторов [12, 13], целью работы стало сопоставление эффектов внутрибрюшинного и интраназального введений двух пептидов на специфическое связывание [3H]-Мусцимола мембранами префронтальной коры мозга мышей BALB/c и C57BL/6.
МАТЕРИАЛЫ И МЕТОДЫ
Животные. Исследования проводили на самцах мышей линий BALB/c и С57BL/6 массой 25–30 г (питомник “Столбовая”), которых содержали в виварии ФГБНУ “НИИ фармакологии им. В.В. Закусова” в стандартных условиях со свободным доступом к воде и корму ad libitum, по 15 особей в клетке в течение 1-й недели до начала эксперимента, на стандартной диете при 12-ти часовом световом режиме. Содержание животных соответствовало правилам лабораторной практики при проведении доклинических исследований в РФ (ГОСТ 351.000.3-96 и 51000.4-96), приказу Минздрава России № 199 от 01 апреля 2016 г. “Об утверждении правил надлежащей лабораторной практики”. Проведение экспериментов одобрено Комиссией по биомедицинской этике ФГБНУ “НИИ фармакологии им. В.В. Закусова”.
Животным посредством в/б и и/н (10 мкл, с использованием микропипетки фирмы Eppendorf) инъекций в течение 5 дней (субхроническое введение) ежедневно один раз в сутки вводили физиологический раствор (контрольная группа – NaCl, 0.9%), либо препараты, растворенные в физрастворе (опытные группы). Мышей декапитировали сразу после испытания в тесте “закрытый крестообразный лабиринт”, подробно описанном ранее [9], головной мозг извлекали на льду, выделяли префронтальную кору по общепринятой схеме [14] и сохраняли при –80°С для последующего проведения радиолигандного анализа.
Вещества. В экспериментах применяли в/б и и/н пути введения Ноопепта (ФГБНУ “НИИ фармакологии им. В.В. Закусова”, 1 мг/кг/день), Семакса (ОХФАВ ИМГ РАН, 0.6 мг/кг/день), при которых проявляются как ноотропный, так и анксиолитический эффекты [15, 16]. Для изучения рецепторного связывания использовали [3H]-Мусцимол (PerkinElmer). Остальные реактивы приобретены в коммерческих источниках.
Выделение плазматических мембран с ГАМКА-рецепторами коры мозга. Приготовление мембранных препаратов, содержащих ГАМКА-рецепторы коры мозга проводили по модифицированным методам [17, 18]. После декапитации ткань немедленно замораживали в жидком азоте и хранили в низкотемпературном холодильнике при –80°С. В день эксперимента префронтальную кору размельчали в гомогенизаторе Поттера “тефлон–стекло” в 20 объемах ледяного буфера (0.32 M Сахароза; pH 7.1). Гомогенат центрифугировали в ультрацентрифуге Optima L-70K (Beckman Coulter) в течение 10 мин при 1000 g. Супернатант повторно центрифугировали при 20 000 g в течение 20 мин. Осадок ресуспендировали в 20 мл холодной дистиллированной воды и центрифугировали 8000 g 20 мин. Супернатант и желтый надосадочный слой повторно центрифугировали при 48 000 g 20 мин. Осадок суспендировали в 0.05 М Tris-citrate буфере (pH 7.1) и центрифугировали 48 000 g 20 мин. Полученную мембранную фракцию замораживали и хранили при –80°С. В день эксперимента мембраны суспендировали в 40 объемах 0.05 М Tris-citrate буфера (pH 7.1) и центрифугировали при 48 000 g 20 мин. Полученный осадок суспендировали в 40 объемах 0.05 М Tris-citrate буфера (pH 7.1) и инкубировали при 24°С в течение 30 мин. и снова центрифугировали при 48 000 g 20 мин. Конечный осадок ресуспендировали в свежем буфере.
Радиолигандный анализ ГАМКА-рецепторов. Инкубационная смесь (конечный объем 0.5 мл) содержала 50 мкл [3H]-Мусцимола (удельная активность 30.2 Кюри/ммоль), 250 мкл буфера и 200 мкл белковой суспензии мембран, для неспецифического связывания добавляли 50 мкл немеченного лиганда. Реакционную смесь инкубировали при 4°С в течение 1 ч.
Жидкостно-сцинтилляционная спектрометрия. По окончании инкубации пробы фильтровали через стекловолокнистые фильтры GF/С (Whatman), предварительно выдержанные в 0.3% полиэтиленимине в течение 2 ч при комнатной температуре. Каждую пробирку промывали два раза холодным буфером, затем фильтры промывали два раза тем же объемом буфера. Фильтры просушивали на воздухе и переносили в сцинтилляционные флаконы. Фильтры заливали 5 мл сцинтилляционной жидкости на основе толуола (4 г PPO, 0.2 г POPOP на 1 л толуола). Радиоактивность проб определяли на счетчике Tri-Carb 2900TR (Perkin Elmer) с эффективностью счета 42–46%. Концентрацию белка измеряли по стандартной методике Лоури (1951).
Для обработки результатов радиолигандного связывания использовали программу GraphPad Prism 4 Demo и Statistica 6.0. Результаты представлены в виде “mean ± S.E.M”.
Обработка и представление результатов. В экспериментах in vitro величину IС50 по отношению к связыванию меченых лигандов определяли при добавлении в инкубационную среду 50 мкл исследуемого соединения в конечных концентрациях в диапазоне 10–9–10–4 М. Объем инкубационной смеси составлял 500 мкл. Результаты экспериментов по радиорецепторному связыванию ex vivo оценивали с помощью рассчитанных величин Kd и Bmax, которые отражают степень сродства рецептора к лиганду (нМ) и количество мест связывания лиганда (фмоль/мг белка) соответственно. Для анализа насыщения и получения характеристик связывания Bmax и Kd, измеряли специфическое связывание для ГАМКА-рецепторов – от 5 до 40 нМ. Специфическое связывание рассчитывали как разницу между общим и неспецифическим связыванием. Для построения кривых вытеснения и насыщения радиоактивных лигандов каждая концентрация исследуемого вещества была взята в 3-х повторностях.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В данном исследовании были использованы образцы ткани префронтальной коры мозга мышей BALB/c и C57BL/6, которым ранее были 5-кратно введены внутрибрюшинно и интраназально семакс и ноопепт с последующим тестированием в закрытом крестообразном лабиринте (ЗКЛ) [9].
В первой серии экспериментов было изучено влияние семакса и ноопепта на рецепторное связывание методом вытеснения специфического лиганда ГАМКА-рецепторов [3H]-Мусцимола в условиях in vitro. Ни один из пептидов не конкурировал за места связывания лиганда в диапазоне концентраций 10–4–10–9 М, что свидетельствует об отсутствии у них структурного сродства к ортостерическим местам связывания ГАМКА-рецептора, величины IC50 составили >100 мкмоль/л.
Как было показано нами ранее на мембранах коры мозга крыс Вистар в условиях in vitro, семакс демонстрировал умеренную степень взаимодействия с mGluII-рецепторами (IC50 = 33 ± 2 мкМ), а ноопепт – с АМПА-рецепторами глутамата с IC50 = 0 ± 6 мкМ [19].
Для оценки возможности функционального вовлечения ГАМКА-рецепторной системы в механизм фармакологического действия ноопепта и семакса в радиорецепторном анализе связывания [3H]-Мусцимола был использован метод насыщения, результаты которого представлены на рис. 1 и 2 соответственно. Во всех вариантах опытов в связывании изменений в величине константы диссоциации Kd не наблюдалось, однако наблюдались различия в величинах Вmах, характеризующих плотность мест специфического связывания [3H]-Мусцимола.
Рис. 1.
Влияние внутрибрюшинного (а) и интраназального (б) введения ноопепта на связывание специфического лиганда с ГАМКА-рецепторами коры мозга мышей BALB/c и C57BL/6, кривые насыщения и график Скетчарда. Примечание: * – статистически значимые отличия от контроля по t-тесту Стьюдента, p < 0.05.
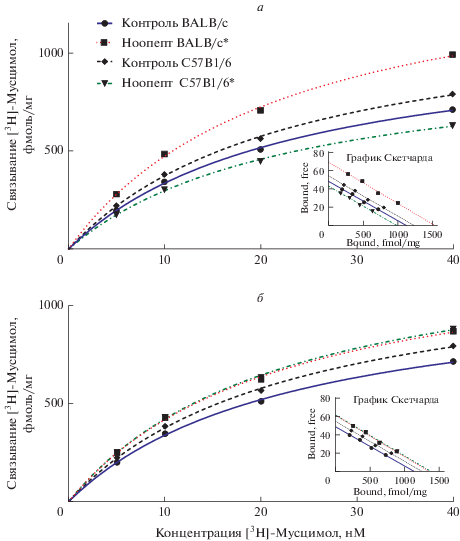
Рис. 2.
Влияние внутрибрюшинного (а) и интраназального (б) введения семакса на связывание специфического лиганда с ГАМКА-рецепторами коры мозга мышей BALB/c и C57BL/6, кривые насыщения и график Скетчарда. Примечание: * – статистически значимые отличия от контроля по t-тесту Стьюдента, p < 0.05.
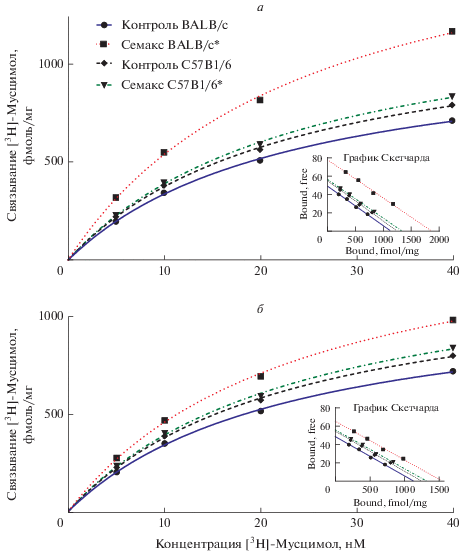
В группах контроля (0.9% NaCl) величины Вmах не различались ни между линиями мышей, ни в зависимости от пути введения (табл. 1). Это свидетельствует о том, что используемые инбредные линии мышей не различаются по исходному ГАМКА-рецепторному статусу.
Таблица 1.
Влияние внутрибрюшинного и интраназального субхронических введений ноопепта и семакса на плотность ГАМКА-рецепторов мозга мышей BALB/c и С57BL/6 в условиях ex vivo (m ± S.E.M.)
| Линия мышей, путь введения |
Лиганд, [3H]-Мусцимол | |||
|---|---|---|---|---|
| Величина Bmax (фмоль/мг белка) (% к контролю) |
||||
| контроль | ноопепт | семакс | ||
| BALB/c | в/б | 1125 ± 37 (100) |
1547 ± 61* (+38) |
1890 ± 85* (+68) |
| и/н | 1136 ± 49 (100) |
1344 ± 50* (+18) |
1561 ± 61* (+37) |
|
| С57BL/6 | в/б | 1249 ± 43 (100) |
997 ± 36* (–20) |
1341 ± 47 (+7) |
| и/н | 1274 ± 68 (100) |
1371 ± 45 (+8) |
1330 ± 56 (+4) |
|
Однако, пятикратное в/б введение ноопепта в дозе 1 мг/кг мышам BALB/c сопровождалось возрастанием Bmax с 1125 ± 37 фмоль/мг белка в контроле (физраствор) до 1547 ± 61 фмоль/мг белка (р < 0.05, t-тест). И/н путь введения приводил к увеличению плотности рецепторов с 1136 ± ± 49 фмоль/мг белка до 1344 ± 50 (р < 0.05, t-тест). В группе сравнения (мыши С57BL/6) при в/б введении происходило снижение Вmах со 1249 ± ± 43 фмоль/мг белка в контроле до 997 ± 36 фмоль/мг белка (р < 0.05, t-тест), а и/н введение показало себя неэффективным: 1371 ± 45 фмоль/мг белка против 1274 ± 68 фмоль/мг белка в контроле (р > > 0.05, t-тест) (рис. 1, табл. 1).
Субхроническое введение семакса (0.6 мг/кг/ день) мышам BALB/c приводило к увеличению Bmax до 1890 ± 85 фмоль/мг белка после в/б введения (р < 0.05, t-тест) и до 1561 ± 61 фмоль/мг белка после и/н введения (р < 0.05, t-тест). У мышей С57BL/6 значимых изменений Bmax не отмечено ни при одном из путей введения (рис. 2, табл. 1).
Таким образом, существенное увеличение плотности ГАМКА-рецепторов наблюдается у мышей BALB/c как под влиянием ноопепта, так и семакса. При этом у обоих пептидов эффект более выражен при внутрибрюшинном (+38 и +68% относительно контроля соответственно), чем при интраназальном пути введения (+18 и +37% соответственно).
В недавно опубликованных результатах о поведении этих мышей в тесте ЗКЛ [9] было показано, что у мышей BALB/c, исходно характеризующихся меньшей эффективностью исследовательского поведения и большей тревожностью, ноопепт и семакс вызывают как улучшение исследовательского поведения, так и снижение тревожности. Причем, показатели эффективности обследования лабиринта (ноотропный эффект) были выше при интраназальном пути введения (+29 и +36% соответственно), чем при внутрибрюшинном (+2 и +16%). Наоборот, анксиолитическая активность (уменьшение латентного времени первого захода в боковой отсек) была выражена ярче после внутрибрюшинного введения: +57 и +53% относительно контроля соответственно. У мышей линии сравнения С57BL/6 плотность мест специфического связывания практически не изменялась, снижаясь на 20% лишь при в/б введении ноопепта (табл. 1).
Таким образом, при сопоставлении результатов поведенческих и радиорецепторных исследований можно сделать предположение, что анксиолитический (противотревожный) компонент действия ноопепта и семакса сопровождается возрастанием количества ГАМКА-рецепторов в префронтальной коре мозга мышей BALB/c. Причем присутствует количественное соответствие анксиолитического эффекта и увеличения ГАМКА-рецепторов в зависимости от способа введения (в бóльшей степени выражено при в/б введении). Действительно, в ряде фармакологических, фармакогенетических и электрофизиологических экспериментов показано, что ГАМК-рецепторный комплекс вовлечен в процесс регуляции эмоционального состояния [13, 20, 21].
Ранее было показано, что облегчение ГАМК-ергической нейропередачи обеспечивает анксиолитический эффект, а ее ослабление ведет к нарастанию тревожности. В частности, с помощью генетических и фармакологических подходов установлено, что если положительная модуляция альфа2-содержащих ГАМК-рецепторов у мышей дикого типа дает бензодиазепин-индуцированный анксиолиз, то отрицательная модуляция, или нокаут этого подтипа рецепторов, может привести к противоположным поведенческим эффектам, например, повышенной тревожности [22]. В этом смысле полученные нами результаты комбинированного применения фармакологического и радиорецепторного подходов на инбредных мышах подтверждают функциональное участие ГАМКА-рецепторов префронтальной коры мозга в механизме анксиолитического компонента действия пептидных препаратов ноопепт и семакс.
ВЫВОДЫ
1. Пептидные препараты ноопепт и семакс не конкурируют за специфические места связывания агониста ГАМКА-рецепторов [3H]-Мусцимола в условиях in vitro.
2. После субхронического внутрибрюшинного и интраназального введения пептидов инбредным мышам BALB/c и С57BL/6 плотность мест специфического связывания [3H]-Мусцимола (Bmax) на мембранах префронтальной коры мозга возрастает только у первых.
3. Увеличение величины Bmax в результате внутрибрюшинного введения обоих пептидов мышам BALB/c вдвое превосходит таковое после интраназального, что соответствует преобладанию анксиолитического эффекта этих препаратов при внутрибрюшинном введении.
4. Полученные результаты могут говорить о функциональном участии ГАМКА-рецепторов префронтальной коры мозга в механизме анксиолитического компонента действия пептидных препаратов ноопепт и семакс.
Список литературы
Миронов А.Н. // Руководство по проведению доклинических исследований лекарственных средств. Часть первая. М.: Гриф и К, 2012. 944 с.
Ковалев Г.И., Фирстова Ю.Ю., Салимов Р.М., Кондрахин Е.А. // Психиатрия. 2010. Т. 45. № 3. С. 23–27.
Васильева Е.В., Салимов Р.М., Ковалёв Г.И. // Эксперим. и клин. фармакол. 2012. Т. 75. № 7. С. 32–37.
Ковалёв Г.И., Кондрахин Е.А., Салимов Р.М., Незнамов Г.Г. // Эксперим. и клин. фармакол. 2013. Т. 76. № 9. С. 3–10.
Ковалёв Г.И., Кондрахин Е.А., Салимов Р.М., Незнамов Г.Г. // Эксперим. и клин. фармакол. 2014. Т. 77. № 12. С. 49–55.
Ковалев Г.И., Фирстова Ю.Ю., Салимов Р.М. // Эксперим. и клин. фармакол. 2007. Т. 71. № 12. С. 12–17.
Ковалёв Г.И., Фирстова Ю.Ю. // Клин. фармакол. тер. 2010. Т. 19. № 6. С. 72–73.
Ковалёв Г.И., Васильева Е.В., Салимов Р.М. // Журн. ВНД. 2019. Т. 69. № 1. С. 123–130.
Vasileva E.V., Kondrakhin E.A., Abdullina A.A., Salimov R.M., Kovalev G.I. // Neurochem. J. 2020. V. 14. № 3. P. 268–278.
Kondratenko R.V., Derevyagin V.I., Skrebitsky V.G. // Neurisci. Lett. 2010. V. 476. P. 70–73.
Sharonova I.N., Bukanova Yu.V., Myasoedov N.F., Skrebitskii V.G. // Bull. Exp. Biol. Med. 2018. V. 164. № 5. P. 612–616.
Haefely W., Kulcsár A., Möhler H. // Psychopharmacol. Bull. 1975. V. 11. P. 58–59.
Smith K.S., Engin E., Meloni E.G., Rudolph U. // Neuropharmacology. 2012. V. 63. P. 250–258.
Glowinski L.L., Iversen J. // J. Neurochem. 1966. V. 13. № 8. P. 655–669.
Васильева Е.В., Кондрахин Е.А., Салимов Р.М., Ковалёв Г.И. // Эксперим. и клин. фармакол. 2016. Т. 79. № 9. С. 3–11.
Васильева Е.В., Салимов Р.М., Ковалёв Г.И. // Фармакокинетика и фармакодинамика. 2016. № 2. С. 31–36.
Ito Y., Lim D.K., Hayase Y., Murakoshi Y., Ho I.K. // Neurochemical Research. 1992. V. 17. № 4. P. 307–313.
Hawkinson J., Acosta-Burruel M., Kimbrough C.L., Goodnough D.B., Wood P.L. // Eur. J. Pharmacol. 1996. V. 304. № 1–3. P. 141–146.
Фирстова Ю.Ю., Васильева Е.В., Ковалёв Г.И. // Эксперим. и клин. фармакол. 2010. Т. 74. № 1. С. 6–10.
Середенин С.Б., Воронина T.A., Незнамов Г.Г., Бледнов Ю.А., Бадыштов Б.А., Виглинская И.В., Козловская М.М., Колотилинская Н.В., Яркова М.А., Савельев В.Л., Гарибова Т.Л., Вальдман Е.А. // Вестн. РАМН. 1998. Т. 11. С. 3–9.
Воронина T.A., Середенин С.Б. // Эксперим. и клин. фармакол. 2002. Т. 65. № 5. С. 4–17.
Rudolph U., Mohler H. // ARPTDI. 2004. V. 44. P. 475–498.
Дополнительные материалы отсутствуют.


