Нейрохимия, 2022, T. 39, № 2, стр. 168-175
Особенности показателей свободнорадикального баланса крови при стимуляции центральных нейромедиаторных систем
Е. В. Курьянова 1, А. В. Трясучев 1, В. О. Ступин 1
1 ФГБОУ ВО Астраханский государственный университет
Астрахань, Россия
Поступила в редакцию 27.09.2021
После доработки 23.01.2022
Принята к публикации 28.01.2022
- EDN: FIJZDI
- DOI: 10.31857/S102781332202011X
Аннотация
Активация нейромедиаторных систем мозга может изменять интенсивность свободнорадикальных процессов в периферических тканях и органах. В работе исследовали параметры свободнорадикального баланса крови у половозрелых самцов крыс в условиях стимуляции центральных нейромедиаторных систем (норадренергической – НАС, серотонинергической – СРС, дофаминергической – ДФС). Определяли уровень продуктов, реагирующих с тиобарбитуровой кислотой, каталазную активность в плазме и гемолизате эритроцитов общепринятыми методами у животных со стимуляцией НАС (мапротилин, 10 мг/кг), СРС (5-гидрокситриптофан, 50 мг/кг и флуоксетин, 3 мг/кг), ДФС (L-Dopa и амантадин, по 20 мг/кг). У половины животных каждой группы показатели определяли после однократного введения блокатора β-адренорецепторов анаприлина (2 мг/кг). Четырехкратное введение препаратов, активирующих НАС, СРС и ДФС, сопровождается снижением концентрации продуктов свободнорадикального окисления и повышением каталазной активности эритроцитов и плазмы крови. Введение блокатора β-адренорецепторов на фоне стимуляции нейромедиаторных систем в меньшей мере повышает концентрацию продуктов свободнорадикального окисления, но потенцирует каталазную активность эритроцитов. На фоне стимуляции ДФС общие сдвиги свободнорадикального баланса крови выражены в большей мере, при стимуляции НАС в меньшей мере, только при активации СРС направленность изменений некоторых показателей отклоняется от общих тенденций. Таким образом, введение препаратов, активирующих НАС, СРС, ДФС, сопровождается адаптивными изменениями свободнорадикального баланса крови и преимущественно ослабляет его реакцию на введение блокатора β-адренорецепторов.
ВВЕДЕНИЕ
Центральные нейромедиаторные системы – ЦНМС (норадренергическая, серотонинергическая и дофаминергическая) играют важную роль в формировании поведения, в реализации когнитивных функций, эмоций, от изменения их активности зависят и такие негативные проявления как депрессия, тревога, страх, дискинезии [1–4]. Для лечения нейродегенеративных заболеваний, депрессивных и иных расстройств нервной системы применяются препараты, влияющие на обмен и рецепцию нейромедиаторов [1–5]. Нередко по рекомендации врачей или по собственной инициативе люди решаются на прием подобных препаратов в целях повышения умственной и физической работоспособности. Во всех случаях важно понимать, что препараты, воздействующие на обмен нейромедиаторов способны повлиять не только на когнитивные процессы и эмоциональное состояние, но и на висцеральные функции и общий обмен веществ, с учетом данных [7–11]. Следствием изменения обмена нейромедиаторов может стать интенсификация свободнорадикального окисления (СРО), которое является универсальным механизмом повреждения мембранных структур [12], и ускоряет старение, приводит к развитию разнообразных, в том числе церебральных, патологий, согласно [3, 12, 13]. Несмотря на значительное количество работ по изучению свободнорадикального окисления в нервной ткани и его роли в патогенезе нервных расстройств, это продолжает быть предметом дискуссий. Причиной тому является противоречивость имеющихся данных. С одной стороны, показана способность нейротрансмиттеров – биогенных аминов быть источниками активных форм кислорода [14, 15], влиять на активность фосфолипаз и стимулировать деградацию мембранных фосфолипидов. Возникающая при этом модификация состава и физико-химических свойств мембран отражается на клеточной рецепции моноаминов и активации сигнальных каскадов в клетках [12, 16]. С другой стороны, есть данные, что нейромедиаторы – моноамины проявляют антирадикальную активность, выступая первой линией антиоксидантной защиты при окислительном стрессе [17, 18]. Дискуссионность поддерживается и тем, что фармакологические препараты, применяемые для лечения депрессий и нейродегенеративных расстройств, также могут проявлять как прооксидантные [4], так и антиоксидантные свойства [19, 20].
Известно, что фармакологическая стимуляция ЦНМС вызывает изменения уровня моноаминов как в соответствующих структурах ЦНС, так и в крови [4–6, 21]. При этом могут изменяться некоторые свойства форменных элементов крови [7, 9, 10], активность их ферментных систем, в том числе, задействованных в антиоксидантной защите [4, 20].
В связи с противоречивостью данных об общих и специфических изменениях свободнорадикальных процессов при введении препаратов, возбуждающих ЦНМС, остается актуальным изучение связи между нейромедиаторным обменом в ЦНС и свободнорадикальным процессами в крови. Исследования в этом направлении могут дополнить представления о влиянии регуляторных моноаминов на свободнорадикальные процессы, о связи центрального аппарата регуляции и процессов на уровне периферических органов и тканей, а также позволят разработать доступные методы контроля за изменениями в организме при приеме препаратов, активирующих ЦНМС.
Цель настоящей работы состоит в анализе изменений некоторых показателей свободнорадикального баланса крови самцов крыс при стимуляции центральных нейромедиаторных систем (ЦНМС) и введении бета-адреноблокатора.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа проведена на 54 самцах нелинейных белых крыс, массой 220–270 г (виварий ФБГУ НИИ по изучению лепры Минздрава России), содержавшихся в условиях лабораторного вивария Астраханского государственного университета при 12-часовом световом режиме, в пластиковых клетках с мелкой древесной стружкой, на стандартном рационе в виде гранулированного комбикорма для лабораторных животных ПК-120 ГОСТ 50258-92 (ООО “Лабораторкорм”) со свободным доступом к воде и пище. Эксперименты выполняли в соответствии с Национальным стандартом РФ ГОСТ Р-53434-2009 “Принципы надлежащей лабораторной практики”, Приказом Минздрава РФ от 01.04.2016 г. № 199н “Об утверждении правил надлежащей лабораторной практики” и Европейской конвенции Directive 2010/63/EU of 22 September 2010. Исследования проводились в осенне-зимний период.
Из животных были сформированы 3 экспериментальные группы: 1) группа со стимуляцией норадренергической системы (НАС, n = 12), которую вызывали введением ингибитора обратного захвата норадреналина – мапротилина (Maprotiline, 10 мг/кг) [5]; 2) группа со стимуляцией серотонинергической системы (СРС, n = 12), которую создавали введением 5-гидрокситриптофана (5-НТР, 50 мг/кг) [6] в комбинации с флуоксетином (Fluoxetine, 3 мг/кг) [1, 5], 3) группа с активацией дофаминергической системы (ДФС, n = 12), в этом случае использовали введение предшественника дофамина, L-дигидроксифенил-серин – (L-Dopa, 20 мг/кг) [4, 6, 21] в сочетании с амантадином (Amantadine, 20 мг/кг), который стимулирует выброс и тормозит обратный захват дофамина в синапсах [1]. Выбор препаратов (мапротилин, флуоксетин, 5-гидрокситриптофан, L-допа) и доз основывался на данных литературы об их способности повышать уровень основных нейротрансмиттеров (норадреналина, серотонина, дофамина) в отделах ЦНС, а также в плазме крови при однократном и длительном введении [1, 4–6, 20, 21]. В работе применили схему введения препаратов, разработанную нами при изучении волновых характеристик сердечного ритма (проект № 14-04-00912, поддержанный РФФИ) и приведенную в предыдущих публикациях [9, 10]. В соответствии с этой схемой препараты производства Sigma Aldrich вводились внутрибрюшинно, 4 дня ежедневно в утренние часы (8.00–10.00). В течение последующих 1.5–2 ч у животных наблюдали характерные изменения поведения и вариабельности сердечного ритма, что свидетельствовало о развитии центральных и периферических эффектов препаратов и достаточно стабильном изменении нейромедиаторного обмена [9, 10]. Поскольку изменения сердечного ритма указывали на повышение в той или иной мере адренергических влияний, в условиях этой экспериментальной модели было решено оценить изменения показателей свободнорадикального баланса крови. На четвертые сутки через 1.5–2 ч после введения препаратов животных выводили из эксперимента путем декапитации под нембуталовым наркозом (40 мг/кг) и забирали кровь для последующего исследования. Для оценки возможной роли β-адреноцепции в развитии изменений свободнорадикального баланса при стимуляции ЦНМС по 6 животных из каждой группы получали однократную инъекцию неселективного β-адреноблокатора анаприлина (Anapriline, 2 мг/кг) [22] за 30 мин до декапитации. Животные контрольной группы (К, n = 18) получали инъекции физиологического раствора (1 мл/кг) в том же режиме, что экспериментальные животные – препараты для стимуляции центральных нейромедиаторных систем (ЦНМС).
Для получения плазмы цельную кровь собирали в пробирки с антикоагулянтом (гепарин), перемешивали и центрифугировали 15 мин при 2000 об./мин. Плазму крови отбирали в чистые сухие пробирки, а эритроциты дважды отмывали холодным физиологическим раствором с последующим центрифугированием. Полученную эритроцитарную массу использовали для получения гемолизата (0.2 мл дистиллированной воды + 0.1 мл отмытых эритроцитов).
Интенсивность перекисного окисления липидов (ПОЛ) оценивали по содержанию продуктов, взаимодействующих с 2-тиобарбитуровой кислотой – ТБК-реактивных продуктов (ТБК-РП), в плазме крови (в нмоль/л) [13] и гемолизате эритроцитов (нмоль/мл эритроцитарной массы) [23]. Определение каталазной активности в плазме и гемолизате эритроцитов проводили по традиционному методу [24]. Измерение оптической плотности проб выполняли на UV-спектрофотометре PD-303UV Apel (Япония).
Статистический анализ результатов осуществляли с помощью программы Statistica 12.0. Достоверность различий рассчитана по U-критерию Манна–Уитни. Различия считали статистически значимыми при р < 0.05. Данные в табл. 1 представлены как средние значения и стандартные погрешности измерения (M ± m или M ± SEM), на рис. 1 приведена степень изменения (в %) показателей, рассчитанная на основе средних значений.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
По нашим данным (табл. 1), у животных контрольной группы средние значения концентрации ТБК-РП и каталазной активности в гемолизате эритроцитов и плазме крови соответствовали результатам более ранних исследований [25].
Таблица 1.
Влияние стимуляции центральных нейромедиаторных систем и β-адреноблокатора на показатели свободнорадикального баланса крови крыс, M ± m
| Показатели | Группы | На фоне стимуляции ЦНМС |
После введения β-адреноблокатора |
|---|---|---|---|
| ТБК-РП в эритроцитах, нмоль/мл эр.массы | Контроль | 4.0 ± 0.4 | 7.4 ± 1.4* |
| НАС | 1.6 ± 0.1^^^ | 2.9 ± 0.4 (р < 0.1*), ^ | |
| СРС | 3.3 ± 0.3 | 1.7 ± 0.2***, ^^ | |
| ДФС | 1.2 ± 0.3^^^ | 2.2 ± 0.3^ | |
| ТБК-РП в плазме крови, нмоль/л | Контроль | 1.4 ± 0.3 | 2.9 ± 0.4* |
| НАС | 0.6 ± 0.1 | 0.6 ± 0.1^^^ | |
| СРС | 0.4 ± 0.1^ | 1.0 ± 0.1***, ^^ | |
| ДФС | 0.5 ± 0.1^ | 0.7 ± 0.1*, ^^^ | |
| Каталазная активность эритроцитов, мккат/мл эр.массы | Контроль | 240.0 ± 8.0 | 278.1 ± 6.8* |
| НАС | 249.0 ± 1.3 | 293.9 ± 3.9*** | |
| СРС | 335.1 ± 1.0^^^ | 311.6 ± 6.9**, ^^ | |
| ДФС | 308.3 ± 4.3^^^ | 327.7 ± 3.3**, ^^^ | |
| Каталазная активность плазмы, мккат/л | Контроль | 51.7 ± 4.0 | 73.2 ± 3.7** |
| НАС | 49.7 ± 1.0 | 30.6 ± 6.6^^^ | |
| СРС | 60.6 ± 10.0 | 85.9 ± 10.0 | |
| ДФС | 101.7 ± 6.9^^^ | 61.4 ± 6.4** |
У животных со стимуляцией НАС (табл. 1) уровень ТБК-РП в эритроцитах оказался ниже в 2.5 раза (р < 0.001), а в плазме крови – в 2 раза (р < 0.1) по сравнению с контролем. При этом каталазная активность эритроцитов и плазмы крови не отличалась от контрольной.
В серии со стимуляцией СРС был снижен уровень ТБК-РП только в плазме крови, почти в 3.5 раза (р < 0.001) в сравнении с контролем. Наряду с этим каталазная активность в эритроцитах превышала контрольную на 30% (р < 0.001).
На фоне активации ДФС концентрация ТБК-РП в эритроцитах была меньше контрольной в 3.3 раза (p < 0.001), в плазме крови – в 2.8 раза (p < < 0.001). При этом каталазная активность оказалась повышенной как в эритроцитах (на 28%, р < < 0.001), так и плазме крови (в 2 раза, р < 0.001).
Таким образом, при моделировании повышенной активности ЦНМС прослеживался общий тренд к снижению уровня ТБК-РП и повышению каталазной активности как в эритроцитах, так и в плазме крови. Разница с контролем в сторону снижения по уровню ТБК-РП в эритроцитарной массе колебалась от 18 до 70%, в плазме крови – от 58 до 71%, прирост каталазной активности эритроцитов составил от 4 до 40%, плазмы крови – от 0 до 96%. В наибольшей мере показатели свободнорадикального баланса крови изменились при стимуляции ДФС, в наименьшей мере – при стимуляции НАС.
Как следует из табл. 1 и рис. 1, введение β-адреноблокатора у крыс контрольной группы привело к росту концентрации ТБК-РП в эритроцитах и плазме крови (на 85% и на 107% соответственно, p < < 0.05). При этом каталазная активность увеличилась в эритроцитах – на 16% (p < 0.05), в плазме крови – на 42% (p < 0.01). Последнее может указывать на повышение лабильности мембран эритроцитов в результате интенсификации СРО.
Рис. 1.
Изменения показателей свободнорадикального баланса крови у животных контрольной и экспериментальных групп после однократного введения β-адреноблокатора. По оси абсцисс – изменения показателей в контрольной и экспериментальных группах, по оси ординат – % отклонения показателей от величин, за которые приняты в контрольной серии – значения показателей после введения физиологического раствора, в экспериментальных группах – значения показателей на фоне стимуляции НАС, СРС, ДФС. Достоверность различий рассчитана по критерию Манна–Уитни. р < 0.05, р < 0.01, р < 0.001. *, **, *** достоверность изменений в связи с введением β-адреноблокатора.
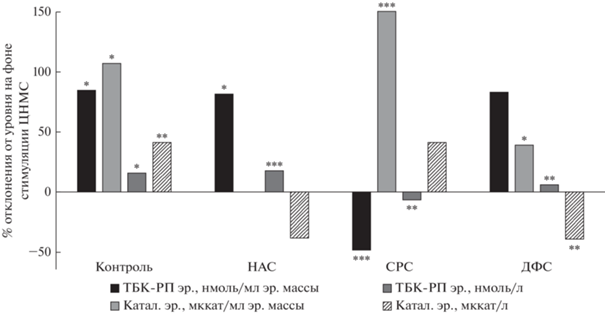
На фоне стимуляции НАС введение анаприлина вызвало тренд к увеличению концентрация ТБК-РП в эритроцитах (на 81%, р < 0.1), но в плазме крови изменений не отмечено (табл. 1, рис. 1). Каталазная активность в этой серии увеличилась только в эритроцитах (на 18%, р < 0.01).
У крыс со стимуляцией СРС при введении β‑адреноблокатора уровень ТБК-РП в эритроцитах снизился почти на 50% (р < 0.001), а в плазме крови – повысился на 150% (р < 0.001). Аналогичным образом, но в меньшей мере, изменилась каталазная активность: в эритроцитах она снизилась на 7% (р < 0.01), в плазме крови – на 42% (р < 0.2) (табл. 1, рис. 1).
Наконец, в серии с активацией ДФС после введения анаприлина также обнаружен подъем концентрации ТБК-РП в гемолизате эритроцитов на 83% (р < 0.1) и в плазме – на 40% (р < 0.05). Каталазная активность эритроцитов, будучи довольно высокой на фоне стимуляции ДФС, повысилась еще на 6% (р < 0.01) и оказалась наибольшей среди всех серий эксперимента. Но каталазная активность в плазме крови, напротив, стала ниже на 40% (р < 0.01).
В целом, при введении β-адреноблокатора и в контроле, и в экспериментальных сериях концентрация ТБК-РП в эритроцитах и плазме крови повышалась, тем не менее на фоне стимуляции ЦНМС абсолютные величины оставались существенно ниже, чем в контроле: в гемолизате эритроцитов разница достигала 60–77% (р < 0.01), в плазме – 66–79% (р < 0.01). Каталазная активность эритроцитов в основном возрастала, и во всех сериях с активацией ЦНМС превышала контрольные значения на 6–16% (р < 0.1–0.001). Но каталазная активность в плазме крови после введения β-адреноблокатора изменялась разнонаправлено, а разница с контрольной серией в сторону снижения (на 58%, р < 0.001) выявилась только в серии со стимуляцией НАС. Следовательно, в результате активации ЦНМС изменилась реакция компонентов крови на вещества, комплементарные адренорецепторам, затронувшая процессы свободнорадикального окисления и антиоксидантной защиты.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Согласно данным литературы, препараты, примененные для фармакологической активации нейромедиаторных систем (мапротилин, флуоксетин, 5-гидрокситриптофан, L-допа), вводимые в сопоставимых дозах, вызывают повышение концентрации соответствующих биогенных моноаминов как в ЦНС, так и в крови в течение нескольких часов после введения и более [4–6, 21]. Собственные наблюдения за изменением поведения, вариабельности сердечного ритма, адренореактивности эритроцитов экспериментальных животных подтверждали, что сдвиги в уровне биогенных аминов в ЦНС и периферическом кровотоке действительно имели место [9, 10].
На этом фоне у животных обнаружено снижение уровня продуктов СРО и повышение каталазной активности в эритроцитах и плазме крови. Эти изменения можно рассматривать как следствие: 1) проявления антирадикальных свойств самих биогенных аминов, которые обладают способностью гасить свободные радикалы по механизму последовательного переноса электронов с потерей протона [17, 18]; 2) проявления антиоксидантной активности препаратов, примененных для стимуляции ЦНМС (флуоксетина, [19], L-допа [20]). 3) адаптации на молекулярно-клеточном уровне к повышенному уровню биогенных аминов, поскольку они аналогичны адаптивным изменениям СРО и антиоксидантной защиты нервной ткани, выявленным ранее при стрессах и церебральных патологиях [12, 16].
Важно отметить, что сдвиги в интенсивности СРО и каталазной активности произошли не только в плазме крови, в которой эти показатели могут определяться изменениями в различных органах и тканях, но и в эритроцитах, причем в относительно короткие сроки (до 4 сут). Это согласуются с данными об изменении свойств эритроцитов и рецепции ими регуляторных веществ при воздействии на ЦНМС организма [7, 9, 10]. Повышение каталазной активности эритроцитов в этих условиях может говорить о модулирующем влиянии биогенных аминов на деятельность фермента антиоксидантной защиты через внутриклеточные сигнальные молекулы.
Вместе с тем, общие изменения уровня продуктов СРО и каталазной активности в эритроцитах и плазме крови имели некоторые особенности в каждой экспериментальной серии. Так, они оказались наиболее существенными в условиях стимуляции ДФС, что могло стать результатом комбинации антирадикальных эффектов дофамина и L-допа [20]. С другой стороны, не исключено, что такой результат стал следствием более быстрых адаптивных изменений мембранных структур и ферментных систем в результате значительной интенсификацией СРО при активации ДФС, с учетом данных [3, 4]. В условиях стимуляции НАС и СРС значимо изменялись лишь некоторые из исследованных параметров при наличии общих тенденций. В серии с СРС возможной причиной могли стать более выраженные антиоксидантные свойства серотонина [8, 26], а также флуоксетина [19]. Кроме того, для повышения каталазной активности эритроцитов могло иметь значение заметное повышение адренореактивности эритроцитов при стимуляции СРС, как показано ранее [9]. По-видимому, специфические свойства соответствующих моноаминов определяют степень выраженности и темпы развития общих сдвигов показателей свободнорадикального баланса крови в условиях стимуляции каждой из нейромедиаторных систем.
Что касается эффектов β-адреноблокатора, оказалось, что его однократное введение вызвало рост интенсивности СРО, следствием которого, вероятно, стало повышение каталазной активности эритроцитов и плазмы крови. Эти изменения, очевидно, следует рассматривать как срочную реакцию на блокаду β-адренорецепторов, которая приводит к росту уровня свободных катехоламинов в крови из-за ограничения их связывания с рецепторами на мембране эритроцитов [9] и клеток других тканей. Свободные катехоламины, вероятно, при достижении некоторой критической концентрации, при аутоокислении могут становиться источниками активных форм кислорода и вызывать окислительный стресс [14]. Очевидно, в норме связывание катехоламинов с β-адренорецепторами эритроцитов и других форменных элементов снижает риск окислительного стресса и является важным механизмом поддержания свободнорадикального баланса крови.
С учетом этого в условиях стимуляции ЦНМС, на фоне которой повышается концентрация моноаминов в крови [4–6, 21], можно было ожидать значительного усиления СРО при блокаде β-адренорецепторов. Действительно, повышение уровня ТБК-РП в крови произошло, но во всех экспериментальных сериях он был намного ниже, чем у контрольных животных: СРС ≤ ДФС < НАС $ \ll $ Контроль. Наименьшие изменения отмечены при стимуляции НАС, разнонаправленные – при активации СРС, умеренное однонаправленное увеличение – при стимуляции ДФС. Также повысилась или сохранилась на высоком уровне каталазная активности эритроцитов, причем на фоне стимуляции ЦНМС показатель оставался выше, чем в контроле: Контроль < < НАС < СРС < ДФС. Эти результаты мы склонны расценивать в пользу того, что основной причиной снижения интенсивности СРО и повышения каталазной активности эритроцитов в условиях стимуляции ЦНМС является формирование адаптивной устойчивости мембран к высокому уровню биогенных аминов [12, 13, 16], а также изменение чувствительности и реактивности эритроцитов к лигандам, с учетом ранее полученных данных [9, 10]. Роль антиоксиданых свойств флуоксетина и L-допа [19, 20] могла иметь значения для поддержания низкой интенсивности СРО, но в данном случае она представляется менее значимой, поскольку на фоне активации СРС и ДФС сдвиги оказались значительнее, чем на фоне стимуляции НАС, при том, что указаний на антиоксидантные свойства мапротилина в литературе не обнаружено.
Относительно каталазной активности плазмы, то при введении β-адреноблокатора она изменялась разнонаправлено: повышалась в контроле и на фоне активации СРС, снижалась – при стимуляции НАС и ДФС, в экспериментальных сериях соответствовала или была ниже, чем в контроле, особенно при стимуляции НАС: НАС < ДФС ≤ Контроль < СРС. По-видимому, в сериях с активацией НАС и ДФС четко проявилась способность β-адреноблокатора повышать устойчивость мембран эритроцитов, как отмечено ранее [25]. Но на фоне стимуляции СРС каталазная активность плазмы после введения анаприлина повышалась и была самой высокой среди всех групп, что могло указывать на лабилизацию мембран и некоторое истощения антиоксидантной зашиты эритроцитов. Возможность таких изменений подтверждается данными [9] о значительном повышении адренореактивности эритроцитов на фоне стимуляции СРС.
ЗАКЛЮЧЕНИЕ
Результаты проведенного исследования позволяют заключить, фармакологическое моделирование повышенной активности норадренергической, серотонинергической и дофаминергической систем сопровождается снижением концентрации продуктов СРО и повышением каталазной активности эритроцитов и плазмы крови. Однократное введение блокатора β-адренорецепторов, способное вызывать рост концентрации продуктов СРО и каталазной активности в эритроцитах, на фоне стимуляции ЦНМС не вызывает резкого повышения уровня продуктов СРО, который остается достаточно низким, а каталазная активность эритроцитов еще более прирастает. Это дает основание считать изменения свободнорадикального баланса крови при стимуляции ЦНМС проявлением адаптивных процессов на уровне мембран и ферментных систем, которые сопряжены с изменениями рецепции и реактивности форменных элементов крови к моноаминам. В наибольшей степени изменения проявляются на фоне активации ДФС и слабее – при стимуляции НАС, в условиях стимуляции СРС изменения разнонаправленные, что может определяться особенностями антирадикальных свойств конкретных моноаминов, а также препаратов, стимулирующих их обмен. Результаты работы подтверждают участие биогенных аминов – нейротрансмиттеров в модуляции свободнорадикального баланса крови, но более точную роль каждого из них можно оценить с применением специфических агонистов и антагонистов подтипов адрено-, серотонино- и дофаминовых рецепторов.
Список литературы
Katzung B.G., Masters S.B., Trevor A.J. // Basic and Clinical Pharmacology. McGraw-Hill Companies, Inc. 2012. 1245 p.
Белова Е.И. // Основы нейрофармакологии. М.: Аспект Пресс. 2006. 176 с.
Либин Л.Я, Дагаев С.Г., Кубарская Л.Г., Ещенко Н.Д. // Вестник СПбГУ. 2012. Сер. 3. Вып. 3. С. 98–105.
Colamartino M., Padua L., Meneghini C., Leone S., Cornetta T., Testa A., Cozzi R. // DNA Cell Bio. 2012. V. 31. № 11. P. 1572–1579. https://doi.org/10.1089/dna.2011.1546
Spasojevic, N., Gavrilovic L., Kovacevic I., Dronjak S. // Auton. Neurosci. 2009. V. 145. № 1–2. P. 104–107.
Tronci E., Lisci C., Stancampiano R., Fidalgo C., Collu M., Devoto P., Carta M. // Neurobiol. Dis. 2013. V. 60. P. 108–114.
Дыгай А.М., Скурихин Е.Г. // Бюлл. эксп. биол. и мед. 2011. Т. 151. № 2. С. 132–139.
Зилов В.Г., Хадарцев А.А., Морозов В.Н., Хадарцева К.А. // Бюлл. эксп. биол. и мед. 2014. Т. 158. № 12. С. 665–668.
Курьянова Е.В., Трясучев А.В., Ступин В.О., Теплый Д.Л. // Бюлл. эксп. биол. и мед. 2017. Т. 163. № 1. С. 40–45.
Курьянова Е.В., Трясучев А.В., Ступин В.О., Теплый Д.Л. // Бюлл. эксп. биол. и мед. 2018. Т. 165. № 5. С. 536–540.
Свешников Д.С., Кучук А.В., Смирнов В.М., Черепанова Г.В. // Казанский медицинский журн. 2016. Т. 97. № 1. С. 89–95.
Ерин А.Н., Гуляева Н.В., Никушкин Е.В. // Бюлл. эксп. биол. и мед. 1994. № 10. С. 343–348.
Меньщикова Е.Б., Ланкин В.З., Зенков Н.К., Бондарь И.А., Круговых Н.Ф., Труфакин В.А. // Окислительный стресс. Прооксиданты и антиоксиданты. М.: Слово, 2006. 556 с.
Fu Y., Han J., Ishola T., Scerbo M., Adwanikar H., Ramsey C., Neugebauer V. // Mol. Pain. 2008. V. 26. № 4. P. 26–46.
Costa V.M., Silva R., Ferreira R., Amado F., Carvalho F., Bastos M.L., Carvalho R.A., Carvalho M., Remiao F. // Toxicology. 2009. V. 257. № 1–2. P. 70–79.
Пшенникова М.Г. // Феномен стресса. Эмоциональный стресс и его роль в патологии. В кн.: Актуальные проблемы патофизиологии. Под ред. Мороза Б.Б. М.: Медицина, 2001. С. 220–353.
Dimić D., Milenković D., Dimitrić Marković J., Marković Z. // Phys. Chem. Chem. Phys. 2017. V. 19. № 20. P. 12970–12980.
Lončar A., Negrojević L., Dimitrić-Marković J., Dimić D. // Comput. Biol. Chem. 2021. V. 95. P. 107573.
Caiaffo V., Oliveira B.D.R., de Sá F.B., Evêncio Neto J. // Pharmacol. Res. Perspect. 2016. V. 4. № 3. P. e00231.
Colamartino M., Duranti G., Ceci R., Sabatini S., Testa A., Cozzi R. // Toxicol. In Vitro. 2018. V. 47. P. 1–7.
Napolitano A., Bellini G., Borroni E., Zürcher G., Bonuccelli U. // Parkinsonism Relat. Disord. 2003. V. 9. № 3. P. 145–150.
Сергеева О.В., Акимова И.А., Антонов И.С., Лузина Л.С., Алипов Н.Н., Кузнецова Т.Е. // Бюлл. эксп. биол. и мед. 2014. Т. 157. № 3. С. 268–271.
Камышников В.С. // Справочник по клинико-биохимическим исследованиям и лабораторной диагностике. М.: МЕДпресс–информ., 2004. С. 549–550.
Королюк М.А., Иванова Л.И., Майорова И.Г., Токарев В.Е. // Лабораторное дело. 1988. № 1. С. 16–18.
Курьянова Е.В., Трясучев А.В., Ступин В.О. // Естественные науки. 2015. Т. 51. № 2. С. 56–63.
Cornetta T., Palma S., Aprile I., Padua L., Tonali P., Testa A., Cozzi R. // Cell Biol. Toxicol. 2009. V. 25. P. 321.
Дополнительные материалы отсутствуют.


