Нейрохимия, 2022, T. 39, № 4, стр. 367-376
От мотонейрона к мышце – исследования школы Е.Е. Никольского
Э. А. Бухараева
Казанский институт биохимии и биофизики Федерального исследовательского центра
“Казанский научный центр Российской академии наук”
Казань, Россия
Поступила в редакцию 30.06.2022
После доработки 03.07.2022
Принята к публикации 21.07.2022
- EDN: DFKCMM
- DOI: 10.31857/S1027813322040045
Аннотация
Казанская школа нейробиологии, зародившаяся еще в 19 веке, славится своими выдающимися учителями и учениками. Один из ярких представителей этой школы – академик РАН Евгений Евгеньевич Никольский. Излюбленным объектом его исследований являлся контакт между окончанием аксона, исходящим от мотонейрона, и скелетной мышцей, а главным направлением работы был анализ молекулярных механизмов передачи возбуждения в этой системе. Результаты изучения модуляции эффективности работы нервно-мышечного контакта, проведенного Е.Е. Никольским и его учениками, позволили раскрыть новые способы обеспечения надежности синаптической передачи в физиологических и экстремальных условиях, а также при некоторых патологических состояниях и предложить новые потенциальные лекарственные препараты для преодоления некоторых патологий, в основе которых лежит синаптический дефект.
ЕВГЕНИЙ НИКОЛЬСКИЙ – УЧЕНИК И ПОСЛЕДОВАТЕЛЬ ИЗВЕСТНЫХ КАЗАНСКИХ НЕЙРОБИОЛОГОВ
Евгений Евгеньевич Никольский (рис. 1) после окончания Казанского государственного медицинского института, будучи аспирантом и учеником профессоров-нейрофизиологов Ирины Николаевны Волковой и Германа Ивановича Полетаева, одним из первых в Казани создал микроэлектродную установку для проведения электрофизиологических исследований на изолированном нервно-мышечном препарате скелетной мышцы. Он стал продолжателем работ по изучению механизмов передачи информации от мотонейрона к скелетной мышце и участии в этом процессе нейромедиатора ацетилхолина (АХ), которые были начаты в Казани еще в конце 19-го и в начале 20‑го веков профессором А.Ф. Самойловым и позднее были развиты член-корр. РАН А.В. Кибяковым. При выполнении кандидатской диссертации уже на новом более высоко технологичном уровне Е. Никольский установил, что в механизме мионеврального блока при непрямом низкочастотном раздражении скелетной мышцы принимает участие АХ, выделяющийся из двигательных нервных окончаний. В этой работе впервые было показано, что в основе блока проведения возбуждения с двигательного нерва на скелетную мышцу в условиях длительного низкочастотного раздражения нерва (“феномен утомления” мышцы) лежит нарушение механизма выделения квантов медиатора, а не истощение его запасов в двигательном нервном окончании или снижение чувствительности постсинаптической мембраны к АХ [1].
Рис. 1.
Евгений Евгеньевич Никольский за установкой в лаборатории биофизики синаптических процессов (2015 г.).

Синаптический контакт между окончанием аксона мотонейрона и скелетным мышечным волокном позвоночных в дальнейшем стал основным предметом исследований Е.Е. Никольского и его учеников. В одном из своих многочисленных докладов он так говорил о тематике исследований возглавляемой им лаборатории биофизики синаптических процессов: “В области нейробиологических исследований на молекулярном уровне чрезвычайно актуальной является расшифровка тонких механизмов синаптической передачи как на пре-, так и на постсинаптическом уровне, поскольку синаптический контакт представляет собой один из ключевых элементов нервной системы, и его нормальное функционирование определяет работу всей нервной системы. Тем не менее, существует целый ряд проблем, касающихся работы синаптических образований, решение которых необходимо как в фундаментальном, так и прикладном аспектах. В частности, до конца неясен сам молекулярный процесс и способы модуляции секреции медиаторов, а также особенности их взаимодействия с рецепторными структурами как на пре-, так и на постсинаптической мембране, не определена роль различных систем вторичных посредников в реализации процессов обмена информацией между клетками; не выяснены механизмы развития нервно-мышечных заболеваний, в основе которых лежат синаптические дефекты. Исследование механизмов обеспечения синаптической пластичности является одним из необходимых и перспективных подходов для понимания молекулярной природы процесса проведения возбуждения и принципов организации таких фундаментальных физиологических процессов как управление движением, обучение, память, а также патогенеза ряда заболеваний центральной и периферической нервной системы, создания фармакологических препаратов, избирательно действующих на разные этапы процесса передачи информации в синапсе”.
ПРЕСИНАПТИЧЕСКИЕ АЦЕТИЛХОЛИНОВЫЕ АУТОРЕЦЕПТОРЫ, ВЗАИМОДЕЙСТВИЕ РАЗНЫХ РЕЦЕПТОРНЫХ СИСТЕМ И МОДУЛЯЦИЯ СЕКРЕЦИИ НЕЙРОМЕДИАТОРА
Вопрос о модулирующем синаптическую передачу действии эндогенного АХ, выделяющегося из аксона мотонейрона, и его экзогенных аналогов посредством активации ауторецепторов стал наиболее активно разрабатываемым в исследованиях школы Е.Е. Никольского. Одним из первых его учеников, и впоследствии ставшим крупным специалистом-нейрофизиологом, Рашидом Гиниатуллиным было установлено, что активация пресинаптических никотиновых ауторецепторов может угнетать процесс секреции самого нейромедиатора по механизму “отрицательной обратной связи” [2]. АХ, выделяющийся из холинергических нервных окончаний, способен взаимодействовать с пресинаптическими никотиновыми и мускариновыми холинорецепторами, реализуя “петлю” обратной связи, обусловливающую в дальнейшем изменение интенсивности секреции медиатора (рис. 2). Оказалось, что и другие рецепторные системы, такие как пуринергическая, ГАМК-ергическая и адренергическая могут взаимодействовать с АХ рецепторами, влияя на параметры нейросекреторного процесса в нервно-мышечных контактах позвоночных [3–5]. Было показано, что активация пресинаптических АХ и пуриновых рецепторов угнетала процесс спонтанной квантовой секреции медиатора из двигательных нервных окончаний, а предварительная активация аденозиновых рецепторов вызывала окклюзию метаболических путей, реализующих пресинаптический эффект холиномиметиков [3].
Рис. 2.
Схема процессов в синаптическом контакте нервно-мышечного препарата. α3β2АХР – нейрональный никотиновый рецептор на нервном окончании; (α1)2β1εδАХР – мышечный никотиновый рецептор на постсинаптической мембране; ЭПР – эндоплазматический ретикулум; АХЭ – ацетилхолинэстераза; БуХЭ – бутирилхолинэстераза; Знак “+” указывает на стимулирующее действие; знак “–” указывает на ингибирующее действие, знак “?” указывает на неизвестный фактор, выделяющийся из мышечного волокна, участвующий в реализации пресинаптической гомеостатической пластичности.
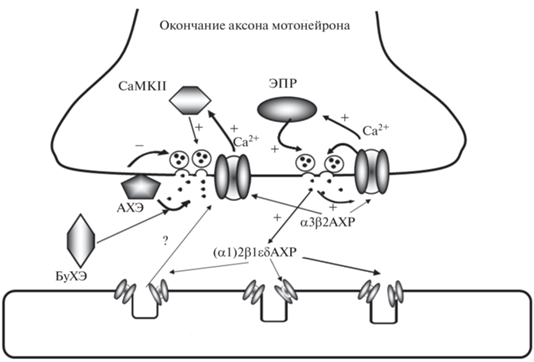
Поскольку ионы кальция играют ведущую роль в инициации нейросекреторного процесса, не раз поднимался вопрос о том, не связано ли действие нейромедиатора с изменением входа ионов кальция в нервное окончание. Разработанная учеником Е.Е. Никольского Дмитрием Самигуллиным методика загрузки двигательного нервного окончания в нервно-мышечном синапсе кальций-чувствительными флуоресцентными красителями и оценка изменения параметров кальциевого отклика на нервный стимул позволила получить ответ на этот вопрос. Как экзогенный АХ, так и другие специфические никотиновые и мускариновые агонисты, снижали вход ионов кальция в нервное окончание лягушки в ответ на нервный стимул путем активации пресинаптических мускариновых рецепторов М2 подтипа и тубокурарин-чувствительных никотиновых рецепторов. Эффект АХ и его миметиков на кальциевый транзиент был опосредован снижением входа ионов кальция в цитоплазму нервных окончаний через потенциал-зависимые кальциевые каналы N-типа, что в свою очередь приводило к снижению уровня секреции нейромедиатора. Таким образом формировалась “петля” отрицательной обратной связи, участвующая в модуляции эффективности работы холинергического синапса [6, 7].
Результаты последних исследований, проведенных на нервно-мышечных контактах мыши, и уже, к сожалению, без участия Е.Е. Никольского показали, что в отличие от синапсов лягушки, у теплокровных активация никотиновых холинорецепторов, приводящая к снижению интенсивности квантовой секреции АХ, не сопровождалась уменьшением амплитуды кальциевого сигнала в аксоплазме. Это может указывать на разные механизмы, обеспечивающие модуляцию квантовой секреции АХ и кальциевую сигнализацию в нервных окончаниях теплокровных, опосредованные холинергическими ауторецепторами [8].
В последние годы исследования ученицы Е. Никольского Ирины Ковязиной выявили вклад мускариновых рецепторов разных подтипов в регуляцию нервно-мышечной передачи, их взаимодействие с калиевыми и кальциевыми ионными каналами разных типов. Показано снижение секреции АХ при активации М3 типа мускариновых холинорецепторов, опосредованное увеличением продукции оксида азота и нарушением метаболизма фосфолипидов сарколеммы. Кроме того, выявлено участие G-белок управляемых К+ каналов в регуляции секреции АХ в синапсах лягушки и мыши, а также показано, что мускариновые рецепторы М2 типа взаимодействуют с потенциал-зависимыми кальциевыми каналами L-типа [9].
Описанные выше результаты работы Е.Е. Никольского и его учеников показывают, что механизмы регуляции секреции АХ из двигательных нервных окончаний при активации пресинаптических ауторецепторов как никотинового, так и мускаринового типов, а также взаимодействия этих рецепторов с другими рецепторными системами эффективно обеспечивают формирование пластических свойств контакта между мотонейроном и скелетной мышцей.
В связи с получением множества экспериментальных данных о механизмах контроля освобождения медиатора АХ, связанных с активацией ауторецепторов, важно было выяснить, синтезируются ли эти рецепторы в перикарионе и транспортируются в нервное окончание аксотоком или их образование происходит in situ. В ходе проведенных исследований в лаборатории Е.Е. Никольского впервые было показано наличие рибосомных белков в терминальных отделах двигательного нервного окончания, что свидетельствует о существовании в них белок-синтезирующего аппарата. Установлено, что в терминальной части двигательного нервного окончания, где реализуется процесс секреции нейромедиатора, происходит локальный синтез белка SNAP25, входящего в состав комплекса белков SNARE, а также деградация мРНК SNAP25. Интенсивность этих процессов влияет на уровень квантового выделения медиатора, что доказывает “компартментную” модель, согласно которой белки “машины экзоцитоза” синтезируются de novo и разрушаются в непосредственной близости от тех отделов терминали, где выполняется их основная функция [10]. Локализация аппарата синтеза белков, участвующих в реализации секреторного процесса, в непосредственной близости от активных зон освобождения АХ объясняет высокую надежность и пластичность синаптической передачи возбуждения при физиологическом уровне ритмической активности нервно-мышечного синапса.
КИНЕТИКА КВАНТОВОГО ОСВОБОЖДЕНИЯ АЦЕТИЛХОЛИНА В НЕРВНО-МЫШЕЧНОМ КОНТАКТЕ – ОДИН ИЗ ВАЖНЫХ ФАКТОРОВ ОБЕСПЕЧЕНИЯ ПЛАСТИЧНОСТИ СИНАПТИЧЕСКОЙ ПЕРЕДАЧИ
Одной из значимых и интересных проблем регуляции эффективности системы “мотонейрон-скелетная мышца”, в которой Е.Е. Никольский и его ученики практически стали “пионерами”, является анализ изменения временных параметров нейросекреторного процесса при действии различных физиологически активных соединений. Освобождение медиатора в нервно-мышечном соединении в ответ на каждый нервный импульс, осуществляемое в отдельных активных зонах пресинаптической мембраны, не происходит одномоментно из-за протяженности терминали (у холоднокровных) и из-за разветвленности нервной терминали (у теплокровных) вследствие низкой скорости проведения возбуждения по ним, а также благодаря колебаниям вероятности срабатывания каждой отдельной активной зоны секреции, о чем свидетельствует существенный разброс величин истинной синаптической задержки одноквантовых постсинаптических ответов. Как показали наши исследования с помощью методов математического моделирования, временной ход вызванного квантового освобождения АХ (или кинетика секреции), наряду с величиной квантового состава и чувствительностью рецепторно-канальных комплексов на постсинаптической мембране, является фактором, определяющим амплитудно-временные параметры постсинаптического ответа, и поэтому вносит вклад в обеспечение надежности синаптической передачи [11]. Учеником Е.Е. Никольского Робертом Гайнуловым был разработан метод “последовательного вычитания” для оценки временного хода освобождения квантов, формирующих многоквантовый ток концевой пластинки. Было установлено, что при физиологическом уровне освобождения медиатора в условиях нормальной ионной среды в ответ на однократное раздражение двигательного нерва кванты АХ выделяются несинхронно, и это проявляется в асимметричном характере распределения латентных периодов одноквантовых ответов, входящих в состав полноквантового сигнала [12]. При исследовании влияния физиологически активных соединений на временной ход секреции квантов установлено, что негидролизуемый аналог АХ – карбахолин, угнетающий синаптическую передачу, помимо влияния на квантовый состав тока концевой пластинки изменял кинетику освобождения квантов, приводя к увеличению асинхронности их выделения [13]. Норадреналин, который, напротив, относится к веществам, облегчающим проведение возбуждения от нерва к мышце, вызывал синхронизацию освобождения квантов, причем без выраженного влияния на количество освобождаемых квантов [5]. В ходе этих исследований была впервые установлена последовательность внутриклеточных событий, происходящих после активации норадреналином пресинаптических β1-адренорецепторов, включающая в себя активацию аденилатциклазы, повышение внутриклеточного уровня цАМФ, активацию протеинкиназы А и фосфорилирирование синаптических белков, приводящее к ускорению экзоцитоза содержимого синаптических везикул и, вследствие этого, синхронизирующее освобождение квантов медиатора (рис. 3). [14]. При этом оказалось, что синхронизирующее действие норадреналина приводило к возрастанию амплитуды многоквантового тока концевой пластинки в “утомленном” при длительной стимуляции нервно-мышечном препарате и может объяснять известный феномен Орбели-Гинецинского. Вывод о том, что для обеспечения пластичности синаптической передачи существенное значение имеет кинетика процесса выделения квантов медиатора, изменение которой при различных физиологических состояниях синапса оказывает влияние на амплитудно-временные параметры постсинаптического ответа, был высоко оценен в ведущем английском журнале Королевского Физиологического общества [15] в 1999 г. и включен в перечень основных достижений РАН в 2002 г.
Рис. 3.
Синхронизация выделения отдельных квантов ацетилхолина при активации адренорецепторов (а) и схема процессов в синаптическом контакте при действии катехоламинов, выделяющихся из близко расположенных симпатических варикозов (б).

Последующие исследования показали, что повышение концентрации ионов кальция в среде приводило к синхронизации выделения квантов, освобождающихся в ответ на нервный импульс. Разный характер зависимости изменения количества освобождаемых квантов и временных параметров секреции от концентрации ионов кальция подтвердил ранее высказанное нами предположение о различиях механизмов, принимающих участие в регуляции количества выделившихся квантов и времени их освобождения [16]. При этом внутриклеточные кальциевые буферы, имеющие быструю кинетику связывания с кальцием и не влияющие эффективно на квантовый состав постсинаптического ответа, обеспечивали синхронизацию процесса освобождения квантов медиатора, которая зависит от таких свойств буферных систем, как их мобильность и насыщаемость кальцием [17].
Полученные данные о влиянии физиологически активных веществ на кинетику освобождения квантов, которое приводит к изменению амплитудно-временных параметров многоквантового постсинаптического ответа, могут служить основанием для целенаправленного поиска и синтеза лекарственных препаратов, преимущественно действующих на временные параметры освобождения квантов и, таким образом, способных регулировать нервно-мышечную передачу, повышая или снижая ее эффективность.
НЕКВАНТОВАЯ СЕКРЕЦИЯ АЦЕТИЛХОЛИНА В НЕРВНО-МЫШЕЧНОМ СИНАПСЕ
Одной из признанных мировым научным сообществом заслуг Е.Е. Никольского и его школы является существенный вклад в исследование и установление молекулярных механизмов неквантовой секреции АХ из двигательных нервных окончаний теплокровных. Совместно с проф. Франтишеком Выскочилом из Института физиологии АН Чехии Е.Е. Никольский был в первых рядах исследователей в мире, которые занимались изучением механизмов и физиологической роли неквантового освобождения АХ [18]. Ученики Е.Е. Никольского: Вячеслав Воронин, Татьяна Оранская, Артем Маломуж установили, что неквантовая секреция медиатора не является простой “утечкой” АХ из нервного окончания, а есть активный процесс, имеющий свои особенные зависимости от ионного содержания внеклеточной среды, а также иные параметры восстановления после денервации синапса [20]. Оказалось, что неквантовая секреция АХ зависима от наличия в нервно-мышечном контакте нейропептида N‑ацетиласпартилглутамата – источника глутамата, который играет ключевую роль в снижении интенсивности неквантовой секреции АХ, активируя глутаматные рецепторы и обеспечивая повышение синтеза молекул оксида азота (рис. 4). В этих исследованиях впервые был установлен факт вовлечения мускариновых холинорецепторов и глутаматных NMDA-рецепторов в регуляцию неквантовой секреции АХ из двигательных нервных окончаний [21]. В обоих случаях механизм регуляции реализуется посредством кальций-зависимого усиления синтеза молекул оксида азота в мышечном волокне и их ретроградным действием на гуанилатциклазу нервного окончания, регулирующую процесс неквантового выделения АХ [22]. За циклы работы по анализу неквантовой секреции АХ Е.Е. Никольский был награжден в 1993 г. медалью им. Й. Главки, а в 1995 г. им. Я. Пуркинье Чешской Академии наук (рис. 5).
Рис. 4.
Регуляция неквантового выделения ацетилхолина в нервно-мышечном синапсе. АХ выделяется (пунктирные стрелки) из нервного окончания не только из везикул, но и непосредственно из цитоплазмы посредством работы транспортера (это либо везикулярный транспортер ацетилхолина, оказавшийся после экзоцитоза синаптической везикулы в плазматической мембране, либо система холина высокого сродства, способная выкачивать медиатор во внеклеточное пространство). В регуляции неквантовой секреции АХ могут участвовать: АТФ; глутамат; ацетилхолин через активацию постсинаптических мускариновых метаботропных М1 холинорецепторов.
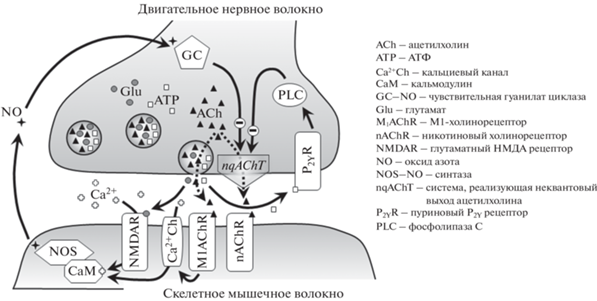
Рис. 5.
Вручение Е.Е. Никольскому медали им. Я. Пуркинье в Академии наук Чехии за цикл работ по изучению молекулярных механизмов неквантовой секреции. Прага, 1995 г.

Поскольку АХ “неквантового происхождения” рассматривается как один из факторов нейротрофического контроля скелетной мышцы, то есть основания полагать, что выявленные механизмы регуляции неквантовой секреции медиатора позволят глубже понять принципы функционирования мионеврального синапса не только в физиологических условиях, но и при развитии разных форм нервно-мышечной патологии.
НЕРВНО-МЫШЕЧНЫЙ СИНАПС В ЭКСТРЕМАЛЬНЫХ ФИЗИОЛОГИЧЕСКИХ И ПАТОЛОГИЧЕСКИХ СОСТОЯНИЯХ
В исследованиях школы Е. Никольского значительное внимание уделялось изучению особенностей работы системы “мотонейрон-синапс- скелетная мышца” в условиях, отличающихся от физиологических и близких к экстремальным. Так было установлено, что снижение парциального напряжения кислорода, т.е. гипоксия, приводило к увеличению интенсивности спонтанной квантовой секреции нейромедиатора и возрастанию неквантового выхода АХ, при этом, повышение парциального напряжения кислорода – гипероксия – не вызывала изменения спонтанной квантовой секреции нейромедиатора [23].
Одним из неблагоприятных и экстремальных факторов, действующих на человека в космосе, является невесомость. Негативное действие невесомости особенно ярко проявляется в нарушении функции опорно-двигательного аппарата: снижаются сила и выносливость мышц, изменяются строение и свойства костей, нарушается работа систем, ответственных за построение движений – развивается патологическое состояние, которое называется гипогравитационным двигательным синдромом (ГДС). В ближайшем будущем успех длительных межпланетных полетов в значительной степени будет определяться достижениями в изучении патогенеза ГДС на молекулярном, клеточном и тканевом уровнях и разработкой на этом фундаментальном базисе эффективных методов его профилактики и терапии. В результате совместных исследований лаборатории биофизики синаптических процессов Казанского института биофизики и биохимии ФИЦ КазНЦ РАН под руководством Е.Е. Никольского, Института медико-биологических проблем РАН и Казанского государственного медицинского университета установлено, что в условиях моделирования последствий гипогравитации на Земле одним из факторов, приводящих к изменениям в скелетных мышцах, является демиелинизация нервных волокон спинного мозга и периферических нервов. Проведенное изучение спинного мозга мышей, находившихся в условиях реальной невесомости, подтвердило наш вывод, о том, что важную роль в патогенезе ГДС играет нейрогенный компонент. Установлено, что у мышей после 30-суточного космического полета на биоспутнике БИОН-М1 в центральной нервной системе также развиваются процессы демиелинизации, проявляющиеся в уменьшении средней толщины миелиновых оболочек двигательных и чувствительных аксонов проводящих путей и уменьшение в спинном мозге количества предшественников (Krox24-позитивных) и зрелых (OSP-позитивных) миелинобразующих клеток. В научном сообществе признано, что результаты исследований механизмов развития ГДС школы Е.Е. Никольского внесли значимый вклад в исследования в области космической медицины и физиологии [24–26].
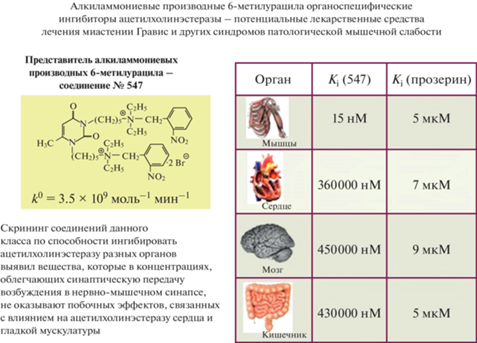
Нервно-мышечные синапсы непосредственно вовлечены в важные жизненные процессы дыхания и локомоции. При патологических состояниях, таких как миастения и врожденные миастенические синдромы, нарушается процесс передачи возбуждения через синапсы вследствие снижения числа активных АХ рецепторов на мембране мышечного волокна. Препараты, используемые для кратковременной симптоматической терапии этих патологических состояний, вызывают частичное ингибирование фермента ацетилхолинэхолинэстеразы (АХЭ), увеличивая таким образом количество нейромедиатора АХ в синаптической щели. Повышение времени жизни молекул АХ компенсирует уменьшение числа мышечных АХ рецепторов, предотвращая мышечную слабость. Под руководством Е.Е. Никольского в Казанском институте органической и физической химии им. А.Е. Арбузова ФИЦ КазНЦ РАН был создан и до сих пор работает Международный научно-инновационный центр нейрохимии и фармакологии, одной из задач которого является разработка новых анти-АХЭ препаратов для преодоления синаптических дефектов. В ходе работы этого центра, ныне возглавляемого учеником Е.Е. Никольского Константином Петровым, синтезированы новые ингибиторы АХЭ – алкиламмониевые производные 6-метилурацила, один из представителей, которых обладает высокой специфичностью по отношению к ферменту в области синапса и действует существенно более длительное время по сравнению с используемыми в клинике ингибиторами. Это соединение более эффективно снижает проявления мышечной слабости и не вызывает побочного действия на фермент гладкой мускулатуры мочевого пузыря животных и человека (рис. 6). Полученные данные позволили рекомендовать новое алкиламмониевое производное 6-метилурацила как перспективное для дальнейших исследований в качестве потенциального лекарственного средства, предназначенного для лечения миастении Гравис и миастенических синдромов [27–31].
Рис. 6.
Сопоставление констант ингибирования ацетилхолинэстеразы вновь синтезированным представителем алкилламмониевых производных метилурацила и классического ингибитора прозерина на препаратах тканей разных органов.
Синапсы химического типа, к каковым относятся контакты между мотонейронами и скелетными мышцами – ключевые структурно-функциональные элементы периферической нервной системы, характеризующиеся высокой степенью надежности передачи информации, которая обеспечивается пластичностью всех этапов синаптического процесса. Исследование механизмов реализации синаптической пластичности является одним из перспективных подходов для понимания молекулярной природы процесса проведения возбуждения и принципов организации таких фундаментальных физиологических процессов как двигательная и дыхательная активность, патогенез многих заболеваний периферической нервной системы и создания фармакологических препаратов, избирательно действующих на разные этапы процесса передачи информации в синапсе. Поэтому результаты исследований Е.Е. Никольского и его учеников высоко оценены как мировой, так и отечественной научной общественностью.
В апреле 2022 г. исполнилось 75 лет со дня рождения Евгения Евгеньевича Никольского. В честь этого события на здании Казанского института биохимии и биофизики ФИЦ КазНЦ РАН была торжественно открыта мемориальная доска (рис. 7). Лаборатория биофизики синаптических процессов, которую Е.Е. Никольский создал в этом институте более 20 лет назад, официально стала носить имя академика РАН Евгения Евгеньевича Никольского.
Список литературы
Никольский Е.Е., Полетаев Г.И. // Нейрофизиол. 1977. Т. 9. № 1. С. 78–85.
Никольский Е.Е., Гиниатуллин Р.А. // Бюл. экс. биол. и мед. 1979. Т. 87. № 2. С. 171–174.
Shakirzyanova A., Bukharaeva E., Nikolsky E., Giniatullin R. // Eur. J. Neurosci. 2006. V. 24. P. 105–115.
Tsentsevitsky A., Nurullin L., Nikolsky E., Malomouzh A. // J. Neurosci. Res. 2017. V. 95. 1. P. 1391–1401.
Bukcharaeva E., Kim K., Moravec J., Nikolsky E., Vyskocil F. // J. Physiol. 1999. V. 517. P. 1469–7793.
Khaziev E., Samigullin D., Zhilyakov N., Fatikhov N., Bukharaeva E., Verkhratsky A., Nikolsky E. // Front. Physiol. 2016. V. 12. № 7. P. 621.
Samigullin D., Fatikhov N., Khaziev E., Skorinkin A., Nikolsky E., Bukharaeva E. // Front. Synap. Neurosci. 2015. № 6. P. 29.
Zhilyakov N., Arkhipov A., Malomouzh A., Samigullin D. // Int. J. Mol. Sci. 2021. V. 22. P. 9031.
Tsentsevitsky A.N., Petrov A.M. // Cell. Mol. Neurobiol. 2021. https://doi.org/10.1007/s10571-021-01152-w
Islamov R., Samigullin D., Rizvanov A., Bondarenko N., Nikolskiy E.E. // Dok. Biochem. Biophys. 2015. V. 464. P. 272–274.
Nikolsky E., Vyskocil F., Bukharaeva E., Samigullin D., Magazanik L. // J. Physiol. 2004. V. 560. P. 77–88.
Gainulov R., Bukharaeva E., Nikolsky E.E. // Neurosci. Behav. Physiol. 2002. V.32. P. 613–616.
Samigullin D., Bukharaeva E.A., Nikolsky E.E., Adámek S., Vyskocil F. // Physiol. Res. 2003. V. 52. P. 475–480.
Bukharaeva E., Samigullin D., Nikolsky E., Vyskocil F. // J. Physiol. 2002. V. 538. P. 837–848.
Parnas I., Parnas H. // J. Physiol. 1999. V. 517. P. 629.
Bukharaeva E.A., Samigullin D., Nikolsky E.E., Magazanik L.G. // J. Neurochem. 2007. V. 100. P. 939–949.
Samigullin D., Fatikhov N., Khaziev E., Skorinkin A., Nikolsky E., Bukharaeva E. // Front. Synaptic Neurosci. 2015. V. 6. P. 29. https://doi.org/10.3389/fnsyn.2014.00029
Vyskocil F., Nikolsky E., Edwards C. // Neuroscie. 1983. V. 9. P. 429–435.
Vyskocil F., Malomouzh A.I., Nikolsky E.E. // Physiol Res. 2009. V. 58. № 6. P. 763–784.https://doi.org/10.33549/physiolres.93186520059289
Vyskocil F., Malomouzh A.I., Nikolsky E.E. // Physiol. Res. 2009. V. 58. P. 763–784.
Malomouzh A.I., Mukhtarov M.R., Nikolsky E.E., Vyskocil F., Lieberman E.M., Urazaev A.K. // J. Neurochem. 2003. V. 85. P. 206–213.
Mukhtarov M.R., Urazaev A.K., Nikolsky E.E., Vyskocil F. // Eur. J. Neurosci. 2000. V. 12. P. 980–986.
Bukharaeva E., Salakhutdinov R., Vyskočil F., Nikolsky E. // Physiol. Res. 2005. V. 54. P. 251–255.
Islamov R., Gusev O., Tanabe A., Terada M., Tyapkina O., Petrov K., Rizvanov A., Kozlovskaya I., Nikolskiy E., Grigoriev A. // Acta Astronautica. 2016. V. 122. P. 231–236.
Тяпкина О.В., Резвяков П.Н., Нуруллин Л.Ф., Петров К.А., Никольский Е.Е., Исламов Р.Р. // Гены & клетки. 2016. Т. XI. № 3. С. 1–4.
Повышева Т.В., Резвяков П.Н., Шаймарданова Г.Ф., Никольский Е.Е., Исламов Р.Р., Челышев Ю.А., Григорьев А.И. // Докл. Aкад. наук. 2016. Т. 469. № 6. С. 756–759.
Petrov K.A., Kovyazina I.V., Zobov V.V., Bukharaeva E.A., Nikolsky E.E., Vyskocil F. // Physiol. Research. 2006. V. 55. P. 585–589.
Kharlamova A.D., Lushchekina S.V., Petrov K.A., Kots E.D., Nachon F., Villard-Wandhammer M., Zueva I., Krejci E., Reznik V., Zobov V.V., Nikolsky E.E., Masson P. // Biochem. J. 2016. V. 473. P. 1225–1236.
Petrov K., Zueva I., Kovyazina I., Sedov I., Lushchekina S., Kharlamova A., Lenina O., Koshkin S., Shtyrlin Y., Nikolsky E., Masson P. // Neuropharmacol. 2018. V. 131. P. 304–315.
Petrov K.A., Nikolsky E.E., Masson P. // Front. Pharmacol. 2018. V. 9. P. 766.
Petrov K., Kharlamova A., Lenina O., Nurtdinov A., Sitdykova M., Ilyin V., Zueva I., Nikolsky E. // Scien. Reports. 2018. V. 8. № 1. P. 304.
Дополнительные материалы отсутствуют.



