Нейрохимия, 2022, T. 39, № 4, стр. 401-410
Антиагрегантные и антиоксидантные свойства нового производного ацетилсалициловой кислоты и карнозина
О. И. Куликова 1, Т. Н. Федорова 1, А. А. Шабалина 1, Д. С. Бережной 1, С. Л. Стволинский 1, А. В. Лопачев 1, О. А. Музычук 1, М. М. Танашян 1
1 ФГБНУ “Научный центр неврологии”
Москва, Россия
Поступила в редакцию 27.07.2022
После доработки 28.07.2022
Принята к публикации 29.07.2022
- EDN: SNZFAC
- DOI: 10.31857/S1027813322040148
Аннотация
Поиск эффективных препаратов антиагрегантного и антиоксидантного действия, с высокой степенью биологической активности и меньшим количеством побочных эффектов является актуальной задачей. Для решения этой задачи из ацетилсалициловой кислоты и природного антиоксиданта и карнозина нами было синтезировано новое конъюгированное соединение салицил-β-аланил-L-гистидин (салицил-карнозин, СцК). Целью работы явилась оценка антиагрегантного действия СцК в присутствии физиологического индуктора агрегации тромбоцитов человека (аденозинфосфата, АДФ) и антиоксидантного действия в модели Fe2+-индуцированной хемилюминесценции липопротеинов низкой и очень низкой плотности, полученных из сыворотки крови пациентов с хроническими цереброваскулярными заболеваниями in vitro. Полученные результаты свидетельствуют о способности СцК значимо снижать агрегацию тромбоцитов, индуцированную АДФ in vitro, что сопоставимо с эффективностью ацетилсалициловой кислоты; в то же время карнозин и салициловая кислота не выявили антиагрегационной способности в данных условиях. Все исследованные соединения обладали сходной эффективностью в отношении снижения уровня липидных гидроперекисей в диапазоне концентраций от 50 до 500 мкМ. Увеличение длительность латентного периода хемилюминесценции липопротеинов сыворотки крови, характеризующего антиоксидантную активность исследуемых соединений, также происходило пропорционально их концентрации в пробе. Результаты проведенного исследования продемонстрировали, что СцК сохраняет свойства антиагреганта и антиоксиданта, регистрируемые в крови пациентов с хроническими цереброваскулярными заболеваниями in vitro. В целом, новое соединение может стать эффективным препаратом в лечении пациентов с цереброваскулярными заболеваниями.
ВВЕДЕНИЕ
Цереброваскулярные заболевания (ЦВЗ) занимают ведущее место в структуре общей заболеваемости, инвалидизации и смертности работоспособного населения. Ишемический инсульт является многофакторным заболеванием, однако практически все нарушения мозгового кровообращения, независимо от их патогенетической гетерогенности, происходят на фоне нарушений гемореологии и системы гемостаза, дисфункции эндотелия и активации системного воспалительного ответа [1]. Гиперагрегация тромбоцитов является значимым фактором повреждения эндотелия сосудов, риска атеросклероза, артериального тромбоза и одной из основных причин развития острого ишемического инсульта (ИИ), транзиторных ишемических атак (ТИА) и инфаркта миокарда [2, 3]. В связи с этим, ингибирование гиперагрегации тромбоцитов представляется важной мерой не только профилактики, но и лечения ЦВЗ, что имеет жизненно важное значение для здоровья человека [4]. В настоящее время антиагрегантная терапия является ключевым фармакологическим подходом к первичной и вторичной профилактике острого ИИ или ТИА [5–8]. При этом наиболее широко используемым антиагрегантным препаратом является аспирин (ацетилсалициловая кислота, АСК), эффективность которого при назначении в острый период ИИ подкреплена данными доказательной медицины [8]. Мета-анализ 287 исследований, включающих более 200 тысяч пациентов показал, что назначение антитромбоцитарной терапии сократило число случаев нефатального инсульта на 25%, а смертности от ЦВЗ – на 23%; кроме того, аспирин на 50% снижает риск развития инсульта [9]. Эффективность аспирина обусловлена блокированием опосредованного тромбоксаном (TXA2) пути агрегации тромбоцитов [10]. Тем не менее, 25–40% пациентов могут быть устойчивыми к его эффектам [11, 12]. Аспиринорезистентность может быть связана с тяжестью заболевания, дозой препарата, генетическими факторами, воспалением, сахарным диабетом, гиперлипидемией, курением и приемом наркотиков [13–18]. Невосприимчивость тромбоцитов к стимуляции ex vivo после инсульта (или повторных острых сосудистых эпизодов) может быть обусловлена их функциональным истощением [19] и может стать причиной повторного ИИ [20–22]. Кроме того, антитромбоцитарные препараты имеют ряд побочных эффектов, включая внутреннее и длительное кровотечение, желудочно-кишечное раздражение и внутричерепное кровоизлияние в более серьезных случаях [23].
Аспирин быстро всасывается из желудочно-кишечного тракта и в течение 20 мин путем деацетилирования эстеразами преобразуется в салициловую кислоту (СК), при этом период полураспада СК в плазме крови зависит от дозы и составляет от 2 до 30 часов [24]. Таким образом, большая часть биологической активности аспирина может быть отнесена к его первичному метаболиту, СК [25].
Известно, что нарушение кровоснабжения головного мозга при ИИ инициирует каскад патофизиологических событий, приводящих к гибели нервной ткани в очаге повреждения. Основным молекулярным механизмом, приводящим к дестабилизации нейрональных мембран и развитию окислительных повреждений мембраносвязанных липидов и белков, является окислительный стресс (ОС) [26]. В этих условиях целесообразно использование нейропротекторных препаратов антиоксидантного действия. Однако на сегодняшний день нет препаратов с доказанной клинической эффективностью [27].
Известно, что АСК может ингибировать провоспалительный каскад и ОС, которые приводят к повреждению эндотелия сосудов [28]. Эти эффекты обусловлены способностью салицилатов проявлять антиоксидантное действие, характеризующееся нейтрализацией ОН-радикала, ингибированием “окислительного взрыва” нейтрофилов, хелатированием переходных металлов и активированием синтеза оксида азота [29].
Среди перспективных нейропротекторов представляет интерес природный дипептид карнозин (β-аланил-L-гистидин), характеризующийся высокой антиоксидантной активностью. Прямое нейропротекторное действие карнозина показано как на нейрональных культурах в условиях глюкозо-кислородной депривации, так и на различных моделях ишемии головного мозга у экспериментальных животных [30]. Однако, для достижения стабильного протекторного эффекта карнозина у человека требуется введение избыточных доз, чтобы компенсировать его гидролиз под действием специфической дипептидазы – сывороточной карнозиназы. Повысить эффективность карнозина можно путем связывания в структуру, недоступную для фермента.
Следовательно, поиск эффективных препаратов антиагрегантного и антиоксидантного действия с, с высокой степенью биологической активности и меньшим количеством побочных эффектов является актуальной задачей. Для решения этой задачи из АСК и карнозина нами было синтезировано новое конъюгированное соединение салицил-β-аланил-L-гистидин (салицил-карнозин, СцК) [31, 32], устойчивое к действию сывороточной и тканевой карнозиназ. При моделировании ацетатной язвы слизистой оболочки желудка у крыс полученное соединение проявляет высокую противоязвенную активность, обеспечивая уменьшение размеров очага повреждения и ускорение его заживления [33].
Исходя из вышеизложенного, целью работы явилась оценка антиагрегантного действия СцК в присутствии физиологического индуктора агрегации тромбоцитов человека (аденозинфосфата, АДФ) и антиоксидантного действия в модели Fe2+-индуцированной хемилюминесценции липопротеинов низкой и очень низкой плотности, полученных из сыворотки крови пациентов с хроническими ЦВЗ in vitro.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследуемые соединения. Ацетилсалициловая и салициловая кислота (Хэбэй Цзихэн Групп Фармасьютикал Ко. Лтд, Китай), карнозин (Hamari Сhemicals, Япония) и салицил-карнозин, синтезированный в отделе химии физиологически активных веществ ФГБУН Институт молекулярной генетики РАН (Москва). В качестве индуктора агрегации тромбоцитов (АТ) использовали АДФ (РЕНАМ, Россия).
С целью исследования влияния вышеуказанных соединений на агрегационные свойства тромбоцитов in vitro были использованы образцы крови 71 человека (34 мужчин и 37 женщин): 30 молодых здоровых добровольцев со средним возрастом 34.5 ± 8 лет и 41 пациент со средним возрастом 57.7 ± 7 лет с проявлениями хронической цереброваскулярной патологии (ХЦВП), находившихся на лечении в ФГБНУ Научный центр неврологии и не принимавших препаратов с антиагрегантным механизмом действия в течение как минимум последних 2 нед. У всех пациентов было получено информированное согласие.
Образцы крови были получены при кубитальной венопункции в утренние часы, натощак, с использованием вакуумных пробирок с 3.8% цитратом натрия, предназначенных для исследования плазмы крови в клинической лаборатории. Исследование биоматериала проводили в лаборатории гемореологии, гемостаза и фармакокинетики с клинической лабораторной диагностикой и в лаборатории клинической и экспериментальной нейрохимии ФГБНУ “Научный центр неврологии” (Москва).
Исследование агрегации тромбоцитов. Для исследования антиагрегационных свойств CцК в качестве соединений сравнения были взяты карнозин, салициловая кислота (СК) и ацетилсалициловая кислота (АСК), которая широко применяется в качестве антиагреганта [34, 35].
Обогащенную тромбоцитами плазму (ОТП) получали центрифугированием цитратной крови в течение 10 мин при 800 об./мин, бедную тромбоцитами плазму (БТП) – центрифугированием при 3000 об./мин в течение 10 мин.
Образцы ОТП каждого пациента аликвотировали на 5 частей:
1. АДФ-АТ/контроль (базовый уровень)
2. АДФ-АТ+ СцК (AДФ-АТ/СцК)
3. АДФ-АТ+ АСК (AДФ-АТ/АСК)
4. АДФ-АТ+ карнозин (АДФ-АТ/Карн)
5. АДФ-АТ+ СК (АДФ-АТ/СК).
АТ определяли по стандартной схеме на лазерном агрегометре “Биола” турбодиметрическим методом по методу Born G. [35–38]. Для исследования базового уровня АТ в измерительную кювету с образцом добавляли индуктор – АДФ в конечной концентрации 10–6 М (АДФ-АТ)
Результаты АТ (в %) показывают степень светопропускания плазмы после добавления к ней индуктора агрегации. Светопропускание в БТП принимается за 100%, ОТП – за 0%. Для оценки эффективности влияния соединений на АТ, базовые растворы исследуемых соединений вносили в кювету с ОТП до конечной концентрации 2.5 мМ и инкубировали 10 мин при 37°С, после чего добавляли индуктор (АДФ) и проводили измерение АТ. Измерение проводили при 37°С и перемешивании магнитной мешалкой со скоростью 900 об/мин. Время регистрации АТ составляло 10 мин. Добавляемое количество соединений in vitro к исследуемому образцу ОТП рассчитано, исходя из применяемых дозировок in vivo для АСК – 75 мг/кг.
Эффективным ингибированием АТ под действием соединения принимали снижение АТ относительно базового уровня на 30% и более. Снижение АТ относительно базового уровня менее чем на 30% или ее увеличение (инвертная реакция) принимали за отсутствие или недостаточность эффекта соединения, что свидетельствовало о наличии лабораторной фармакорезистентности.
Снижение агрегации тромбоцитов рассчитывалось относительно базового уровня, принятого за 100% по формуле: (Basic Level-AT Sub) × 100)/Basic Level)
Антиоксидантная активность. Оценку антиоксидантной активности исследуемых соединений проводили на модели Fe2+-индуцированного окисления суммарной фракции липопротеинов низкой и очень низкой плотности (ЛПНП) [39]. Из крови 41 пациента с ХЦВП выделяли ЛПНП в системе хлористого кальция с гепарином следующим образом: к 200 мкл сыворотки добавляли 2000 мкл 0.28% CaCl2 и 40 мкл 1% гепарина, оставляли при комнатной температуре на 5 мин и затем центрифугировали при 3000 об./мин, в течение 15 мин. После центрифугирования надосадочную жидкость отбрасывали, а к осадку ЛПНП добавляли 800 мкл фосфатного буфера, рН 7.45 (60 мМ КН2РО4, содержащего 105 мМ КСl) и осторожно перемешивали. Кювету с суспензией ЛПНП помещали в измерительную камеру хемилюминометра “Luminometer-1251” (LKB, Швеция). Для инициирования хемилюминесцентной реакции в кювету, содержащую 100 мкл суспензии ЛПНП вносили 100 мкл раствора FeSO4 в конечной концентрации 2.5 мМ и измеряли следующие параметры ХЛ:
• амплитуда быстрой вспышки ХЛ (h, мВ), характеризующая уровень предобразованных продуктов ПОЛ (преимущественно гидроперекисей липидов) во фракции ЛПНП;
• латентный период (τ, c) в развитии ХЛ между быстрой вспышкой и максимальной интенсивностью ХЛ, свидетельствующая о резистентности субстрата к дальнейшему окислению. Длительность τ зависит от соотношения про- и антиоксидантов в изучаемой системе и характеризует ее антиоксидантный потенциал [40].
Статистический анализ. Анализ полученных данных проведен с помощью пакета STATISTICA 12. (StatSoft). Предварительный анализ нормальности распределения данных проводился по критерию Колмогорова–Смирнова при уровне значимости 0.05. Для анализа данных использовали дисперсионный анализ ANOVA, В случае данных по агрегации тромбоцитов с ненормальным распределением, для сравнения различий между группами использовали медиану (Mе) и значения 25% нижнего и 75% верхнего квартилей (Q1–Q3). Для сравнения групп использовали критерий Краскела–Уоллиса с последующим попарным сравнением по Манну–Уитни. Для анализа данных антиоксидантной активности использовали аналогичные непараметрические тесты: тест Краскела–Уоллеса для дисперсионного анализа и тест Манна–Уитни для последующих парных сравнений. Все значения в тексте и на рисунках представлены в виде среднего со стандартным отклонением m ± SEM, уровень значимости составляет p < 0.05.
РЕЗУЛЬТАТЫ
Эффективность антиагрегантного действия исследуемых соединений на АДФ-индуцированную агрегацию тромбоцитов в исследовании in vitro. Предварительный факторный анализ значений АДФ-АТ выявил различия уровня агрегации тромбоцитов между исследованными группами: ANOVA F(4, 355) = 14.79, p < 0.001. Полученные данные указывают на наличие антиагрегантного эффекта в системе АДФ-АТ у исследованных соединений (рис. 1а). АТ в среднем по группе без введения исследуемых препаратов составила 44.71 ± 1.45%; при введении СцК и АСК АТ составила 33.68 ± 1.51% и 30.67 ± 1.63%, соответственно; а при введении Карн и СК – 41.39 ± 1.39 и 41.06 ± ± 1.64%, соответственно. Полученные результаты свидетельствуют о способности СцК значимо снижать АТ, индуцированную АДФ in vitro, что сопоставимо с эффективностью стандартного препарата АСК; в то же время Кар и СК не выявили антиагрегационной способности в данных условиях.
Рис. 1.
Влияние СцК, АСК, Карнозин и СК на АДФ-индуцированную АТ: а – абсолютные значения АДФ-АТ в среднем по группе, %; б – средний по группе процент снижения АДФ-АТ под действием СцК, ASA, Карнозин и СК относительно базового уровня; ** p < 0.001 относительно базового уровня (Баз. ур.).

Далее для каждого соединения мы выделили группы, в которых АТ снижалась под действием изучаемых соединений (рис. 1б). Наиболее эффективное снижение АТ относительно базового уровня наблюдалось под действием АСК – на 49.64 ± 2.42% (n = 58, p < 0.001), а также под действием СцК – на 42.83 ± 2.02% (n = 61, p < 0.001). Внесение в пробу СК и Карн не приводило к значимому снижению АТ и составило в среднем 9.03 ± ± 2.06% (n = 52, р = 0.08) и 17.14 ± 2.31% (n = 50, р = 0.051) соответственно.
Также для изучения и анализа зависимости антиагрегантного эффекта соединений от исходного уровня АТ все исследованные образцы были дополнительно разделены на группы: в общей выборке было выделено 17 образцов от пациентов с пониженным базовым уровнем АТ (5–35%), и 54 образца с нормальным и повышенным уровнем АТ (более 36%).
В группе пациентов с повышенным и нормальным базовым уровнем АТ (n = 54) эффективное ингибирование АДФ-АТ выявлено под действием АСК и СцК, при этом эффект СцК (в 65% случаев) оказался сопоставим с эффектом АСК (в 69% случаев) и составил 47.15% [ДИ: 25.10; 55.23] и 52.26 [ДИ: 28.16; 61.38]%, соответственно (р < 0.001 относительно базового уровня). Напротив, для карнозина и салициловой кислоты в образцах этой группы пациентов выявлялось отсутствие эффекта ингибирования АДФ-АТ (эффективное ингибирование наблюдалось в 13 и 9% случаев соответственно), а процент ингибирования составил в среднем 17.82% [ДИ: 10.54; 24.37] и 14.64% [ДИ: 5.90; 20.50] (табл. 1).
Таблица 1.
Сравнительный анализ эффективности антиагрегационных свойств исследуемых соединений на АДФ-АТ в группе пациентов с повышенным и нормальным базовым уровнем АТ (n = 54)
| Соединение | % ингибирования АДФ-АТ | Частота случаев эффективного ингибирования, % | ДИ –95% | ДИ +95% |
|---|---|---|---|---|
| СцК | 47.15 | 65 | 25.10 | 55.23 |
| АСК | 52.26 | 69 | 28.16 | 61.38 |
| СК | 14.64 | 9 | 5.90 | 20.50 |
| Карнозин | 17.82 | 13 | 10.54 | 24.37 |
В образцах пациентов со сниженной базовой АТ (n = 17) в большинстве случаев преобладало отсутствие индивидуальной чувствительности тромбоцитов ко всем исследуемым соединениям и/или инвертный ответ: в 89% случаев для карнозина, в 92% – для СцК, в 95% –для Аск, в 86% – для СК.
Оценка антиоксидантного действия исследуемых соединений на модели Fe2+-индуцированной ХЛ липопротеинов сыворотки крови человека in vitro. Был проведен статистический анализ представленных данных по двум параметрам (уровень липидных гидроперекисей, h и латентный период ХЛ, t) для контрольной группы, группы с СцК, АСК, СК и карнозином в диапазоне концентраций всех исследуемых соединений от 50 до 1000 мкМ. Поскольку по обоим параметрам распределение оказалось не нормальным, для дисперсионного и апостериорного анализа использовали непараметрические тесты – тест Краскела–Уоллеса и критерий Манна–Уитни.
Оценка влияния исследуемых соединений на уровень липидных гидроперекисей. Проведенный дисперсионный анализ значений уровня липидных гидроперекисей для каждой концентрации не показал наличие значимых различий между исследуемыми веществами в концентрациях 50–500 мкМ. В концентрации 1000 мкМ выявлены значимые различия: Kruskal–Wallis H (4, 124) = = 13.73 p = 0.0033.
Как видно из рис. 2, все исследуемые соединения снижали уровень липидных гидроперекисей пропорционально их концентрации. Дальнейший post–hoc анализ показал наличие достоверных различий между карнозином и остальными исследуемыми веществами, карнозин наиболее эффективно снижал уровень гидроперекисей в концентрации 1000 мкМ (на 48.2 ± 2.1%), в то время как СцК, АСК и СК достигали максимума своей эффективности в 500 мкМ (СцК снижал на 35.5 ± 1.9%; АСК 40.1 ± 1.8%; СК на 35.5 ± 1.7%) и дальнейшее увеличение концентрации не приводило к снижению уровня гидроперекисей.
Рис. 2.
Оценка влияния исследуемых соединений в диапазоне концентраций 50–1000 µM на уровень предобразованных липидных гидроперекисей (h); *p < 0.01, **p < 0.001 относительно контрольных образцов.

Таким образом, по результатам данного анализа можно заключить, что все исследованные вещества обладали сходной эффективностью в отношении снижения уровня липидных гидроперекисей в концентрациях от 50 до 500 мкМ.
Оценка влияния исследуемых соединений на уровень антиоксидантной активности. Проведенный дисперсионный анализ значений длительности латентного периода ХЛ (τ, c), отражающего уровень антиоксидантную активность соединений, для каждой концентрации не показал наличие значимых различий между исследуемыми веществами во всех изученных концентрациях.
Дальнейший анализ данных показал, что все вещества увеличивали длительность латентного периода пропорционально концентрации в пробе. При этом значимое увеличение латентного периода относительно контроля для салицилат-карнозина (на 41.3 ± 6.8%) и АСК (на 30.1 ± 9.1%) наблюдалось начиная с концентрации 250 мкМ, а для карнозина (на 31.7 ± 5.6%) и СК (на 31.6 ± ± 7.6%) – начиная с 50 мкМ (рис. 3). При внесении исследуемых веществ в максимальной изученной концентрации (1000 мкМ) повышение длительности латентного периода не отличалось и составило в среднем 74.8%.
Рис. 3.
Оценка влияния исследуемых соединений в диапазоне концентраций 50–1000 мкM на уровень антиоксидантной активности; *p < 0.01, **p < 0.001 относительно контрольных образцов.
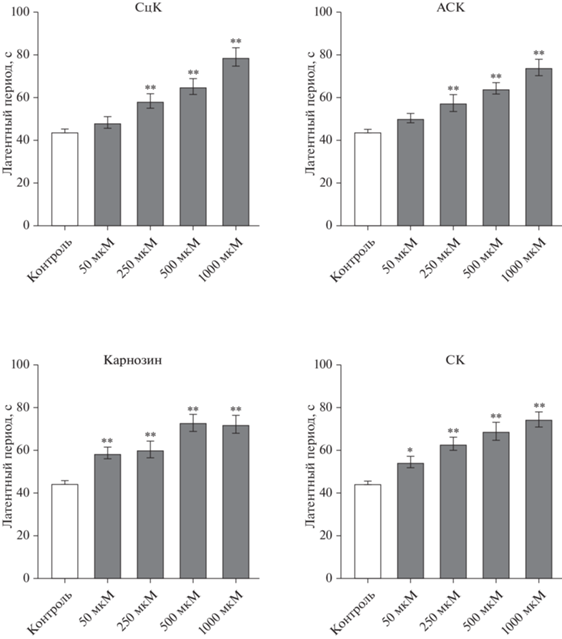
По результатам данного анализа можно заключить, что все исследованные вещества обладают сходной антиоксидантной активностью.
ОБСУЖДЕНИЕ
Данное исследование посвящено оценке антиагрегантного и антиоксидантного действия нового соединения – СцК, синтезированного из ацетилсалициловой кислоты (АСК) и антиоксиданта карнозина. Актуальность работы обусловлена как поиском нейропротекторных препаратов, способных эффективно препятствовать развитию окислительных повреждений ткани головного мозга, развивающихся в условиях ишемии; так и предотвращению побочных эффектов АСК, которая является единственным антиагрегантным препаратом, эффективность которого при назначении в острый период ИИ подкреплена данными доказательной медицины. На основании международных многоцентровых исследований сделано заключение о том, что АСК является наиболее востребованным и перспективным антитромбоцитарным препаратом в профилактике и лечении ЦВЗ. Таким образом, создание новых форм препаратов с высокой биологической активностью, сочетающих антиагрегантную и антиоксидантную эффективность, не выявляющих побочных эффектов, является новым патогенетически значимым подходом к лечению пациентов с ЦВЗ.
Синтез и физико-химические свойства СцК описаны в работе Kulikova et al., в которой продемонстрирована высокая устойчивость СцК к гидролизу тканевыми и сывороточными карнозиназами, а также способность защищать слизистую оболочку желудка крыс от язвенных поражений и способствовать их эпителизации, тем самым преодолевая нежелательные побочные эффекты, присущие АСК [32].
В данном исследовании влияние СцК на агрегационные свойства тромбоцитов пациентов с ХЦВЗ оценивали с помощью стандартного индуктора агрегации АДФ в сопоставительном аспекте с АСК, СК и карнозином в модели in vitro.
При оценке эффективности исследуемых соединений в условиях АДФ-индуцированной АТ было показано, что АТ эффективно предотвращают два препарата – АСК и СцК, в то время как СК и карнозин не оказывают влияния на этот процесс. Следовательно, нами показано наличие выраженного антиагрегантного эффекта у нового соединения АцК, сопоставимого с эталонным антиагрегантом – АСК. Полученные данные согласуются с пилотными исследованиями, описанными в нашей предыдущей работе [32], в которой антиагрегантная активность СцК, оцениваемая в тромбоцитах крови здоровых лиц, была также сопоставима с АСК.
Важным аспектом данного исследования явилась оценка влияния исследуемых веществ на АТ с учетом базового уровня АТ каждого пациента, после выделения двух групп: с исходно низким (<35%) АТ и нормальным и повышенным (>36) уровнем АТ. Результаты этого фрагмента исследования также указывают на высокое антиагрегантное действие АцК (снижение АТ в 65% случаев), сопоставимое с АСК (снижение АТ в 69% случаев) у пациентов с нормальным и повышенным уровнем АТ. При этом эффективность СК (снижение АТ в 9% случаев) и карнозина (снижение АТ в 13% случаев) была значимо ниже относительно АСК и СцК.
Для оценки влияния исследуемых соединений на активность процессов ПОЛ и антиоксидантный статус пациентов с ХЦВЗ применялся метод Fe2+-индуцированной хемилюминесценции (ХЛ) липопротеинов сыворотки крови, специфичность и информативность которого была показана в предыдущих исследованиях [39]. Полученные нами результаты свидетельствуют о том, что все исследуемые препараты (СцК, АСК, СК и карнозин) снижают уровень гидроперекисей липидов и увеличивают антиоксидантную активность. Показано, что все исследованные вещества обладали сходным по эффективности антиоксидантным действием.
Результаты данного исследования согласуются с проведенным нами ранее, в котором на ЛПНП, выделенных из сыворотки крови здоровых лиц, выявлена высокая антиоксидантная активность 500 мкМ СцК, сопоставимая со стандартным антиоксидантом Тролоксом [32]. Показанное нами антиоксидантное действие АСК и СК подкрепляется литературными данными о способности АСК ингибировать провоспалительный каскад и препятствовать развитию окислительного стресса [28]. Механизмы антиоксидантного действия салицилатов (ацетилсалициловой кислоты и главным образом ее метаболита СК) описаны в ряде исследований [29, 41, 42]. В клиническом исследовании, выполненном при участии здоровых добровольцев [43] показано, что прием 300 мг аспирина в день в течение двух недель, защищает ЛПНП от окислительной модификации, вызванной 90 мин ультрафиолетовым облучением. В этих условиях аспирин предотвращал повышение содержания малонового диальдегида в ЛПНП и повышал их электрофоретическую подвижность.
Салицилаты вызывают ингибирующий эффект на экспрессию лектин-подобных рецепторов на эндотелиальных клетках, которые способствуют раннему развитию атеросклероза, внутриклеточных сигнальных процессов, ведущих к запуску проапоптотических, прооксидантных и провоспалительных путей, вызывающих клеточную дисфункцию, связанную с атеросклерозом, и повышение риска сердечно-сосудистых заболеваний [29], что открывает перспективу для дальнейшего изучения биологических свойств СцК.
ЗАКЛЮЧЕНИЕ
Таким образом, результаты проведенного исследования продемонстрировали, что салицилат–карнозин – СцК сохраняет свойства антиагреганта и антиоксиданта, регистрируемые в крови пациентов с ХЦВЗ in vitro. В то же время, данная работа открывает перспективу дальнейших экспериментальных исследований с целью оценки его эффективности на моделях ишемии головного мозга. В целом, новое соединение может стать эффективным препаратом в лечении пациентов с сосудистыми заболеваниями головного мозга.
Список литературы
Суслина З.А., Танашян М.М., Домашенко М.А. // Анналы клин. и эксперим. неврологии. 2007. Т. 1. № 1. С. 10–16.
Haybar H., Khodadi E., Zibara K., Saki N. // Cardiovasc. Hematol. Disord. Drug Targets. 2018. V. 18. № 2. P. 153–161.
Raber I., McCarthy C.P., Vaduganathan M., Bhatt D.L., Wood D.A., Cleland J.G.F., Blumenthal R.S., McEvoy J.W. // Lancet. 2019. V. 393 № 10186. P. 2155–2167.
Gu Y., Sheng R., Wu J., Zhou Y., Qin Z.-H. // Thromb. Res. 2018. № 171. P. 121–129.
Donnan G.A., Fisher M., Macleod M., Davis S.M. // Lancet. 2008. № 371. P. 1612–1623.
Kiernan T.J., Yan B.P., Jaff M.R. // J Vasc Surg. 2009. № 50. P. 431–439.
Танашян М.М., Раскуражев А.А., Кузнецова П.И. // Проф. мед. 2018. Т. 21. № 5. С. 124–129.
Fiolaki A., Katsanos A.H., Kyritsis A.P., Papadaki S., Kosmidou M., Moschonas I.C., Tselepis A.D., Giannopoulos S. // J. Neurol. Sci. 2017. № 376. P. 112–116.
Antithrombotic Trialists’ Collaboration // BMJ. 2002. V. 324. № 7329. P. 71—86.
Meade E.A., Smith W.L., DeWitt D.L. // J. Biol. Chem. 1993. V. 268. № 9. P. 6610–6614.
Hankey G.J., Eikelboom J.W. // Lancet. 2006. Vol. 367. № 9510. P. 606–617.
Hovens M.M.C., Snoep J.D., Eikenboom J.C.J., van der Bom J.G., Mertens B.J., Huisman M.V. // Am. Heart J. 2007. V. 153. № 2. P. 175–181.
Fitzgerald R., Pirmohamed M. // Pharmacol. Ther. 2011. V. 130. № 2. P. 213–225.
Hovens M.M.C., Snoep J.D., Groeneveld Y., Tamsma J.T., Eikenboom J.C., Huisman M.V. // J. Thromb. Haemost. 2007. V. 5. № 7. P. 1562–1564.
Cattaneo M. // J. Thromb. Haemost. 2007. № 5. P. 230–237.
Jeon S.B., Song H.S., Kim B.J., Kim H.J., Kang D.W., Kim J.S. // Eur. Neurol. 2010. № 64. P. 51–57.
Ozben S., Ozben B., Tanrikulu A.M., Ozer F., Ozben T. // J. Neurol. 2011. № 258. P. 1979–1986.
Танашян М.М., Домашенко М.А., Раскуражев А.А. // Анналы клин. и эксперим. неврол. 2016. Т. 10. № 1. С. 41–46.
Alberts M.J., Bergman D.L., Molner E., Jovanovic B.D., Ushiwata I., Teruya J. // Stroke. 2004. V. 35 № 1. P. 175–8.
Yi X., Zhou Q., Lin J., Chi L. // Int. J. Stroke. 2013. № 8. P. 535–539.
Zheng A.S.Y., Churilow L., Colley R.E., Goh C., Davis S.M., Yan B. // JAMA Neurol. 2013. № 70. P. 208–213.
Kim J.T., Suk-Hee H., Lee J.S., Choi M.J., Choi K.H., Nam T.S. // PLoS One. 2015. № 10. e0120743.
Adam F., Khatib A.M., Lopez J.J., Vatier C., Turpin S., Muscat A., Soulet F., Aries A., Jardin I., Bobe R., Stepanian A., de Prost D., Dray C., Rosado J.A., Valet P., Feve B., Siegfried G. // Blood. 2016. № 127. P. 908–920.
Needs C.J., Brooks P.M. // Clin. Pharmacokinet. 1985. V. 10. № 2. P. 164–77.
Choi H.W., Tian M., Song F., Venereau E., Preti A., Park S.W., Hamilton K., Swapna G.V., Manohar M., Moreau M., Agresti A., Gorzanelli A., De Marchis F., Wang H., Antonyak M., Micikas R.J., Gentile D.R., Cerione R.A., Schroeder F.C., Montelione G.T., Bianchi M.E., Klessig D.F. // Mol. Med. 2015. V. 21. № 1. P. 526–535.
Pisoschi A.M., Pop A. // Eur. J. Med. Chem. 2015. V. 5. № 97. P. 55–74.
Пирадов М.А., Танашян М.М., Домашенко М.А., Сергеев Д.В., Максимова М.Ю. // Анналы клин. и эксперим. неврол. 2015. Т. 9. № 1. С. 41–50.
Fuster V., Dyken M. L., Vokonas P.S., Hennekens C. // Circulation. 1993. V. 87. № 2. P. 659–675.
Baltazar M.T., Dinis-Oliveira R.J., Duarte J.A., Bastos M.L., Carvalho F. // Curr. Med. Chem. 2011. V. 18. № 21. P. 3252–3264.
Berezhnoy D.S., Stvolinsky S.L., Lopachev A.V., Devyatov A.A., Lopacheva O.M., Kulikova O.I., Abaimov D.A., Fedorova T.N. // Amino Acids. 2019. № 51. P. 139–150.
Танашян М.М., Федорова Т.Н., Стволинский С.Л., Андреева Л.А., Нагаев И.Ю., Мигулин В.А., Шабалина А.А., Трубицына И.Е., Лопачев А.В., Куликова О.И., Абаимов Д.А. Средство, обладающее антиагрегантной, цитопротекторной и антиоксидантной активностью. Патент РФ № 2694061 от 09.07.2019 г.
Kulikova O.I., Stvolinsky S.L., Migulin V.A., Andreeva L.A., Nagaev I.Y., Lopacheva O.M., Kulichenkova K.N., Lopachev A.V., Trubitsina I.E., Fedorova T.N. // Daru. 2020. V. 28. № 1. P. 119–130.
Трубицына И.Е., Стволинский С.Л., Куликова О.И., Федорова Т.Н., Тарасова Т.В., Ефремов Л.И., Михайлова С.Ф., Варванина Г.Г. // Эксперим. и клин. гастроэнтерол. 2019. Т. 163. № 3. 58–64.
Dressman J.B., Nair A., Abrahamsson B., Barends D.M., Groot D.W., Kopp S., Langguth P., Polli J.E., Shah V.P., Zimmer M. // J. Pharm. Sci. 2012. № 101. P. 2653–2667.
Танашян M.M., Хамидова 3.M., Ионова В.Г., Костырева М.В., Шабалина А.А. Способ выявления резистентности к антиагрегантным препаратам у больных с прогрессирующим церебральным атеросклерозом. Патент РФ № 2012106483/15 (009859) от 10.04.2013.
Born G.V. // Nature. 1962. V. 194. № 37. P. 927–929.
Shabalina A.A., Tanashyan M.M., Kuznetsova P.I., Khamidova Z.M., Roitman E.V. // Thromb. Res. 2021. V. 200. № 1. S78.
Мирзоян Р.С., Шабалина А.А., Ганьшина Т.С., Курдюмов И.Н., Турилова А.И., Косточка Л.М., Козлов А.В., Аннушкин В.А., Корнилова А.А., Танашян М.М. // Анналы клин. и эксперим. неврол. 2020. Т. 14. № 3. С. 53–59.
Stvolinsky S.L., Bulygina E.R, Fedorova T.N., Meguro K., Sato T., Tyulina O.V., Abe H., Boldyrev A.A. // Cell. Mol. Neurobiol. 2010. № 30. P. 395–404.
Fedorova T.N., Logvinenko A.A., Poleshchuk V.V., Illarioshkin S.N. // Neurochemical J. 2017. V. 11. № 4. P. 340–345.
Grootveld M., Halliwell B. // Biochem J. 1986. V. 237. № 2. P. 499–504.
Shi X., Ding M., Dong Z., Chen F., Ye J., Wang S., Leonard S. S.,Castranova V., Vallyathan V. // Mol. Cell. Biochem. 1999. V. 199. № 1–2. P. 93–102.
Steer K.A., Wallace T.M., Bolton C.H., Hartog M. // Heart. 1997. V. 77. № 4. 333–337.
Дополнительные материалы отсутствуют.


