Нейрохимия, 2023, T. 40, № 1, стр. 35-47
О сходстве механизмов обработки обонятельной, слуховой и зрительной информации в ЦНС (гипотеза)
И. Г. Силькис
Федеральное государственное бюджетное учреждение науки Институт высшей
нервной деятельности и нейрофизиологии Российской академии наук
Москва, Россия
Поступила в редакцию 07.11.2022
После доработки 08.11.2022
Принята к публикации 09.11.2022
- EDN: ERMMSU
- DOI: 10.31857/S1027813323010193
Аннотация
Предложен возможный механизм обработки запахов в нейронной сети, которая включает обонятельную луковицу, пириформную кору, обонятельный бугорок, являющийся частью вентрального стриатума, вентральный паллидум, медиодорзальное таламическое ядро и орбитофронтальную кору. Согласно этому механизму, дофамин, выделяющийся нейронами среднего мозга в ответ на запах и на подкрепление, как и антагонисты аденозиновых рецепторов, определенным образом модулируют эффективность возбудительных синаптических входов к шипиковым клеткам обонятельного бугорка, проецирующихся в вентральный паллидум. В результате происходит растормаживание со стороны вентрального паллидума нейронов обонятельной луковицы, которое способствует формированию на них, а также на их клетках-мишенях в пириформной коре контрастных отображений запахов. Одновременно происходит растормаживание нейронов медиодорзального ядра и увеличение активности их клеток-мишеней в орбитофронтальной коре, которая возбуждает нейроны пириформной коры. Это способствует индукции длительной потенциации на входах из обонятельной луковицы в пириформную кору и запоминанию отображений запахов. Впервые указано на то, что механизм обработки запахов аналогичен предложенному автором ранее механизму обработки слуховой и зрительной информации в топографически организованных цепях кора–базальные ганглии–таламус–кора, которые включают первичные и высшие области слуховой и зрительной коры, а также префронтальную кору. Предположено, что механизм обработки обонятельной информации аналогичен у позвоночных, находящихся на разных стадиях эволюции, включая миног, вследствие сходства функциональной организации базальных ганглиев и их связей с другими структурами. Из предлагаемого механизма следует, что в тех случаях, когда дофаминовые препараты не эффективны для восстановления обоняния, желательно использовать антагонисты аденозиновых А2А рецепторов. В пользу этого предсказания свидетельствуют данные об улучшении обоняния у пациентов с COVID-19 при их лечении антагонистами А2А рецепторов.
ВВЕДЕНИЕ
Различение запахов возникает уже на ранних стадиях эволюции и является одним из необходимых условий выживания и адекватного поведения. Обонятельная система млекопитающих сравнительно хорошо изучена и обладает способностью к пластичности на разных уровнях обработки, включая обонятельную луковицу (ОЛ) и пириформную кору (ПК). Как и в других сенсорных системах, на пластичность в обонятельной системе могут влиять нисходящие воздействия из областей мозга, участвующих в процессах внимания и обучения [1]. В обработке обонятельной информации, поступающей в ОЛ от обонятельных сенсорных нейронов, участвует также обонятельный бугорок (ОБ), являющийся частью вентрального стриатума, который называют прилежащим ядром (ПЯ). Стриатум является входной структурой базальных ганглиев (БГ), получающей возбуждение из коры и таламуса. В ОБ поступают сигналы из ОЛ и ПК (рис. 1). Нейрохимический состав ОБ сходен с нейрохимическим составом стриатума и ПЯ, а на шипиковых клетках ОБ, как и на шипиковых клетках стриатума и ПЯ, имеются дофаминовые и аденозиновые рецепторы [2–5].
Рис. 1.
Схема организации межнейронных связей в нейронной сети, включающей обонятельные структуры. ВП – вентральный паллидум; ВПП – вентральное поле покрышки; ОБ – обонятельный бугорок; ОЛ – обонятельная луковица; ОфК – орбитофронтальная кора; ПК – пириформная кора; ПОЯ – переднее обонятельное ядро; С–Н и С–П – стрионигральные и стриопаллидарные шипиковые клетки соответственно; ЧВк и ЧВр – компактная и ретикулярная части черного вещества соответственно. ЭПЯ – энтопедункулярное ядро. Маленькие треугольник и квадрат – потенциированный и депрессированный возбудительный вход соответственно. Линии, заканчивающиеся стрелками и ромбами – возбудительные и тормозные входы соответственно. Штрихпунктирные линии с открытыми стрелками – дофаминергические входы.
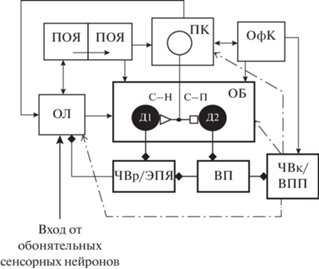
Ранее нами был предложен гипотетический механизм обработки зрительных и слуховых стимулов, базирующийся на дофамин-зависимой реорганизации активности в топографически организованных нейронных цепях кора–базальные ганглии–таламус–кора (К–БГ–Т–К) [6, 7]. В результате этой реорганизации в соответствующих областях новой коры формируются контрастные нейронные отображения сенсорных стимулов. Этот механизм отличается от широко известного гипотетического механизма функционирования цепей К–БГ–Т–К, но к настоящему времени получено его экспериментальное подтверждение [8].
В работе [9] выдвинуто предположение, что ОЛ, хотя и не является точным гомологом таламического ядра, но обладает сходными свойствами и играет ту же роль, что и таламус, поскольку функции этих структур очень похожи. Как и таламус, ОЛ является последней стадией сенсорной обработки перед достижением первичных областей коры. Ее расположение позволяет эффективно контролировать поток информации до того, как произойдет ее обработка в коре [9]. Нейронная цепь, состоящая из ОЛ, ПК и ОБ, в которой происходит обработка обонятельной информации (рис. 1), имеет определенное сходство с функциональной организацией нейронных цепей К–БГ–Т–К, в которых обрабатывается зрительная и слуховая информация. На то, что обоняние и другие сенсорные модальностями могут обрабатываться сходным образом, а специфические психофизические характеристики обоняния следует отнести скорее к раннему вовлечению лимбической системы, чем к концептуально другому способу обработки, указано в работе [10]. Нами не найдено исследований, объясняющих причины сходства механизмов обработки разномодальной сенсорной информации.
Целью настоящей работы являлось обоснование выдвигаемой гипотезы о сходстве механизмов обработки обонятельных, слуховых и зрительных стимулов. При решении поставленной задачи использованы известные из литературы результаты экспериментальных исследований функциональной организации обонятельной системы и особенностей восприятия запахов.
ОСОБЕННОСТИ ФУНКЦИОНАЛЬНОЙ ОРГАНИЗАЦИИ МЕЖНЕЙРОННЫХ ВЗАИМОДЕЙСТВИЙ В НЕЙРОННОЙ СЕТИ, ВКЛЮЧАЮЩЕЙ ОБОНЯТЕЛЬНУЮ ЛУКОВИЦУ И ОБОНЯТЕЛЬНЫЕ ОБЛАСТИ КОРЫ
Запахи воспринимают расположенные в обонятельном эпителии рецепторы обонятельных сенсорных нейронов, чьи аксоны оканчиваются в ОЛ, формируя гломерулы (клубочки) [11]. Примечательно, что количество клубочков в ОЛ и количество конвергирующих на них аксонов обонятельных сенсорных нейронов у человека (16 : 1) значительно отличается, например, от мыши (2 : 1) [12]. Вследствие этого у них должен быть различным и характер кодирования информации в активности нейронов ОЛ.
Гломерулы представляют собой функциональные единицы со сложной сетью синаптических связей [13]. На поверхности ОЛ млекопитающих расположено несколько тысяч гломерул, каждая из которых реагирует на определенное свойство запаха [12]. В слое гломерул, активируемых с разной амплитудой, запах преобразуется в специфическую топографическую карту [14, 15]. Обучение приводит к длительным пластическим перестройкам активности реагирующих на запахи выходных митральных/пучковых клеток ОЛ [16]. На возбудительных входах в ОЛ индуцируется НМДА-зависимая длительная потенциация [17]. Паттерны активности проекционных нейронов ОЛ представляют собой первичные отображения запахов в мозге [13], тогда как их восприятие требует интеграции с высшими корковыми областями [18].
От выходных митральных клеток ОЛ сигналы поступают в переднее обонятельное ядро (ПОЯ), а от него в ПК [19] (рис. 1). Нейроны ПОЯ отвечают на запах возбуждением, торможением и отставленным возбуждением [20]. В ПОЯ, реципрокно связанном с ОЛ и с ПК, имеются две области, которые реагируют на запахи различным образом. Во внешней части ПОЯ, как и в ОЛ, запахи отображаются топографически. В другой части ПОЯ отображение запахов является распределенным, как и в ПК [21]. Полагают, что поскольку в ПОЯ имеются пирамидные нейроны, по свойствам сходные с нейронами коры, его правильней считать корой [22]. Вход из ПОЯ может приводить к значительному усилению активности нейронов ПК, так как он активирует на этих клетках НМДА-рецепторы и оказывает на них лишь слабое дисинаптическое торможение [23]. Об эффективности передачи сигналов в цепи ОЛ–ПОЯ–ПК свидетельствуют данные о том, что стимуляция ОЛ с частотой 100 Гц приводит к появлению сравнительно сильных ответов в ПОЯ и ПК [19]. Спонтанная активность нейронов ОЛ приводит к спонтанной активности нейронов ПК. Появление запаха вызывает ответ нейронов во втором слое ПК, при этом примерно у 15% клеток спонтанная активность увеличивается, а примерно у 15% – ингибируется [24].
Обонятельная кора имеет определенное сходство с неокортексом [25]. Например, в первичных сенсорных областях неокортекса дендриты пирамидных клеток ветвятся меньше, чем в высших. Аналогично, в той части обонятельной коры, которая ближе к ОЛ (в одной из частей ПОЯ), нейроны имеют меньшие пространственные размеры и более короткие дендриты, по сравнению с нейронами в задней части ПК (зПК) [25], где, по-видимому, осуществляется более высокая степень обработки. Каждый нейрон ПК через ПОЯ получает конвергентные входы от гломерул ОЛ. Показано, что при поступлении возбуждения от одного обонятельного сенсорного нейрона активируется небольшая хорошо очерченная область (пятно) в передней части ПК (пПК), но эта область много больше, чем область в ОЛ [26]. Рецептивные поля запахов в пПК сравнимы с рецептивными полями митральных/пучковых клеток ОЛ, причем рецептивные поля нейронов в ПК высоко динамичны [15]. Отдельные пирамидные клетки ПК соединены между собой тысячами возбудительных синаптических связей, которые распространяются в ПК, в основном, без ослабления, образуя большую возбужденную сеть. На активность нейронов ПК влияет и возвратное торможение. Вызванное запахом ингибирование пирамидных нейронов ПК было распространено гораздо более широко, чем возбуждение [18]. Поскольку в пПК имеются 6 типов тормозных интернейронов [27], не исключено, что может иметь место не только ингибирование, но и растормаживание. Благодаря наличию рекуррентной сети, афферентный вход может усиливаться или подавляться, способствуя формированию в ПК ансамблей клеток, кодирующих запах [28]. При передаче сигналов от митральных/пучковых клеток ОЛ в обонятельную кору в ней формируется карта объектов запаха [29].
В отличие от ОЛ, в ПК нет разделения на определенные группы клеток, реагирующих на определенный запах, а образуется распределенная сеть, в которой разные запахи активируют уникальные, но рассредоточенные ансамбли корковых нейронов, причем у нейронов ПК могут быть перекрывающиеся рецептивные поля [30]. Таким образом, ПК отличается от других сенсорных областей новой коры, в которой клетки, отвечающие на сходные свойства стимула, образуют кластеры [30]. У большинства позвоночных обонятельная система имеет большое представительство в старой коре, а у млекопитающих обонятельные представительства есть и в неокортексе, включая каудальную часть орбитофронтальной коры (ОФК) [31, 32]. Вход из ПК в ОфК организован топографически, при этом аксоны выходных нейронов ПК группируются в параллельные пучки, которые передают обонятельную информацию в области коры более высокого порядка [33]. Этот корковый компонент вносит значительный вклад в восприятие запахов. В свою очередь, каудальная часть медиальной ОфК влияет на активность нейронов вентрального поля покрышки (ВПП), регулируя концентрацию дофамина в вентральном стриатуме и определяя характер целенаправленного поведения [34].
Из-за большого числа функций, приписываемых ПК, полагают, что это не простая первичная сенсорная область коры, а ассоциативная, которая способна интегрировать входящую обонятельную информацию с нисходящей, поступающей из ассоциативных областей более высокого порядка, таких как ОФК [35, 36]. Динамическое взаимодействие ПК с другими обонятельными и не обонятельными областями имеет решающее значение для формирования обонятельного восприятия и поведенческих реакций [36]. У человека в ответ на запах паттерны активности обнаружены как в ПОЯ и ОБ, так и во фронтальной и височной областях коры [37].
Аксоны нейронов ПОЯ и ПК проецируются обратно в ОЛ [38] (рис. 1). При этом центрофугальные нейроны ПК, иннервирующие клетки зернистого слоя ОЛ мыши, группировались в кластеры [39]. Поскольку в отдельные гломерулы ОЛ поступает иннервация от клеток коры, настроенных на различные запахи, кора может модулировать ранние отображения запахов в ОЛ, диффузно передавая сенсорную информацию в ее пространственно упорядоченную сеть [40]. Возбуждение из ПК поступает как на основные клетки ОЛ, так и на ГАМКергические гранулярные клетки, являющиеся основным источником торможения выходных нейронов, причем этот вход является пластичным [18, 41]. Ингибирование основных клеток ОЛ позволяет “очерчивать” их активность и способствует дискриминации запахов. Кроме того, на митральные клетки ОЛ влияют дофаминергические интернейроны [42, 43]. Полагают, что прямые и обратные проекции ОЛ и ПК играют разную функциональную роль в кодировании информации о запахах [39].
Обоняние является единственной сенсорной системой без прямых таламических проекций. Было предположено, что ОЛ и ПОЯ фактически являются таламическими суррогатами [44]. Авторы работы [45] полагают, что ОЛ выполняет роль, сравнимую с таламусом и первичным зрительным полем V1 в зрительной системе. Согласно гипотезе, выдвинутой авторами работы [9], ОЛ играет ту же роль, что и таламус. Нейроны таламических ядер разделяют на нейроны сердцевины и матрикса. Именно нейроны матрикса проецируются в пространственно распределенные области верхних слоев коры диффузным образом. Нейроны матрикса таламуса иннервируют также БГ, причем один нейрон иннервирует обе структуры [46]. Поскольку аксоны нейронов каждой из гломерул ОЛ диффузно проецируются в ПК [47], они по свойствам схожи с клетками матрикса таламуса. Например, центромедианное ядро таламуса содержит только клетки матрикса [48]. Следует отметить, что нейроны срединных ядер таламуса иннервируют и стриатум, и те области коры, которые обеспечивают кортикальные входы к тем же самым компартментом в стриатуме [49]. Таким образом, цепи К–БГ–Т–К являются замкнутыми. Хотя не исключено, что нейроны одной и той же гломерулы ОЛ иннервируют как ОБ, так и ПК, нейроны которой проецируются в ту же область ОБ, что и нейроны этой гломерулы, таких данных нами не найдено.
ОСОБЕННОСТИ ФУНКЦИОНАЛЬНОЙ ОРГАНИЗАЦИИ И МЕЖНЕЙРОННЫХ ВЗАИМОДЕЙСТВИЙ В СЕТИ, ВКЛЮЧАЮЩЕЙ ОБОНЯТЕЛЬНЫЙ БУГОРОК
Обонятельный бугорок является вентральным продолжением раковины ПЯ и представляет собой узел в мезолимбическом дофаминергическом пути [5, 50, 51]. Между ОБ и ПЯ имеется функциональное сходство [51]. В ОБ, как и в ПЯ, проецируются дофаминергические нейроны из ВПП и компактной части черного вещества (ЧВк) [2, 4] (рис. 1 и 2) и в нем высокая концентрация дофамина [52]. Проекции из разных частей ВПП в ОБ и ПЯ организованы определенным образом. Дофаминергические клетки задней медиальной части ВПП проецируются в вентромедиальный стриатум (ОБ и раковину медиальной части ПЯ), а клетки латеральной части ВПП проецируются в вентролатеральный стриатум (латеральную часть ОБ, сердцевину ПЯ и латеральную часть раковины ПЯ) [50]. Дофаминергические клетки ЧВк, по-видимому, иннервируют латеральную часть ОБ, так как у мутантных мышей с уменьшенным числом дофаминергических клеток в ЧВк именно в этой части ОБ наблюдали дефицит дофамина [53]. У таких мышей концентрация дофамина в ОБ была снижена на 27%, а в стриатуме на 75% [54]. По-видимому, различие связано с тем, что большая часть проекций из ЧВк поступает в дорзальную моторную часть стриатума. Приведенные данные указывают на разный характер влияния дофамина на функционирование нейронных цепей, включающих разные участки стриатума.
Рис. 2.
Схема организации межнейронных связей в нейронной сети, в которой обрабатывается обонятельная информация. МДЯ – медиодорзальное ядро таламуса; ВПвл и ВПмд – вентролатеральная и медиодорзальная части вентрального паллидума; ПфК – префронтальная кора; ПЯ – прилежащее ядро. Остальные обозначения как на рис. 1.

Наиболее распространенным типом клеток в ОБ, как и в ПЯ и дорзальном стриатуме, являются шипиковые клетки среднего размера [55]. Они составляют 90–95% от всего числа нейронов [56]. Как и в других частях стриатума, на шипиковых клетках ОБ располагаются дофаминовые Д1 и Д2 рецепторы [3, 5] (рис. 1). Эти рецепторы в основном постсинаптические и располагаются на дендритах и головках шипиков [57]. В ОБ Д1 рецепторы преимущественно располагаются на клетках, экспрессирующих динорфин и вещество Р, а Д2 рецепторы – на клетках, экспрессирующих энкефалин [58]. Примечательно, что в ОБ 51% клеток экспрессируют препродинорфин, а 19% клеток – препроэнкефалин, причем эти клетки располагаются в плотном клеточном слое ОБ (т.е. в слое, где оканчиваются афференты из ПК), тогда как клетки, экспрессирующие динорфин и энкефалин найдены во всех частях ПЯ [59]. Если учесть, что динорфин выделяется из аксонных окончаний стрионигральных клеток, на которых располагаются Д1 рецепторы, а энкефалин – из аксонных стриопаллидарных, на которых располагаются Д2 рецепторы, результаты работы [59] указывают на то, что ПК возбуждает в ОБ больше стрионигральных клеток.
Стрионигральные шипиковые нейроны проецируются в ретикулярную часть черного вещества (ЧВр) – одного из выходных ядер БГ [60]. В другую выходную структуру БГ – вентральный паллидум (ВП) проецируются нейроны ОБ, экспрессирующие как энкефалин, так и вещество Р [61], т.е. и стриопаллидарные, и стрионигральные. То, что нейроны ОБ проецируются как в ЧВр, так и в ВП, показано в работе [2]. Множественные эфферентные окончания проекционных шипиковых нейронов латеральной части ОБ, формирующие вентральный стриопаллидарный путь, поступают в основном в вентролатеральную часть ВП, но некоторые поступают в вентромедиальную часть ВП, тогда как шипиковые клетки ПЯ проецируются в более медиодорзальные части ВП [62, 63] (рис. 2). В ВП проецируются шипиковые клетки ПЯ, на которых располагаются как Д1, так и Д2 рецепторы [64]. Из приведенных данных следует, что связи ОБ с выходными структурами БГ аналогичны связям ПЯ с этими структурами.
В ОБ поступает возбуждение от нейронов ОЛ, ПОЯ, ПК и орбитальной коры [2]. В отличие от ПЯ, в котором нет послойной организации, в ОБ имеется три клеточных слоя [65, 66]. В молекулярный плексиформный слой 1 поступают афференты из ОЛ [67]. В плотном слое 2 располагаются тела шипиковых клеток [68]. В наиболее глубокий и заполненный слой 3 поступают многочисленные афференты из ПК [69]. В ОБ особенно много афферентов из вентрокаудальной части пПК [70]. В ОБ проецируются как митральные, так и пучковые клетки ОЛ, причем пучковые клетки, проецирующиеся в слой 1 антеролатеральной части ОБ, являются основным источником иннервации ОБ [63]. Те клетки ПК, которые получают возбуждение от пучковых клеток ОЛ, проецируются в слои 2 и 3 антеролатеральной части ОБ [63]. Таким образом обонятельная информация из ОЛ поступает в эту часть ОБ моно- и дисинаптически. Кроме того, нейроны ОБ получают иннервацию от пирамидных клеток ПК, возбуждаемых в основном митральными клетками ОЛ.
Эти данные не исключают возможности того, что, как и в других сенсорных цепях, связывающих таламус, кору и стриатум, нейроны одной гломерулы ОЛ иннервируют те нейроны ПК, которые проецируются в ту же область ОБ, что и нейроны этой гломерулы. Полагают, что в ОБ в значительной степени отсутствует топография [71]. Такую особенность объясняют диффузностью проекций нейронов отдельных гломерул ОЛ в ПК [47], нейроны которой, в свою очередь, возбуждают ОБ. Следует отметить, что ответы на запах нейронов в ОБ и ПК сходны по амплитуде, латентному периоду и ширине полосы настройки [72].
В латеральные части ОБ и ПЯ, а также в ПОЯ поступает возбуждение из медиодорзального ядра (МДЯ) таламуса [73] (рис. 2). Это таламическое ядро возбуждает медиальную префронтальную кору (ПфК) и ОфК, которая реципрокно связана с ПК [31, 74], Найдены проекции из ПК в центральную и медиальную части МДЯ и в латеральную орбитальную кору [75]. В свою очередь, МДЯ, а также ПОЯ и ПК получают возбуждение из медиальной ПфК, которая также иннервирует ОБ [76, 77]. Обращает на себя внимание то обстоятельство, что входы из ОЛ и ПК поступают в разные слои ОБ, тогда как на нейронах ПЯ входы из ПфК конвергируют с входами от таламических ядер средней линии, с которыми ПфК реципрокно связана [78]. Нейроны ОБ и ПЯ проецируются соответственно в вентролатеральную и вентромедиальную части ВП [79] (рис. 2). Эти данные указывают на разную функциональную роль нейронных цепей, включающих ОБ и ВП. Из общего числа исследованных нейронов вентральной паллидарной области 30% проецировались в ЧВр, 43% – в субталамическое ядро и 6% – в МДЯ [80]. Нейроны вентромедиальной части ВП, которую иннервируют шипиковые клетки раковины ПЯ, также проецируются в МДЯ и ВПП [81] (рис. 2). Кроме того, в МДЯ поступают афференты из ЧВр [82]. Нейроны ВП иннервируют все отделы центрального и медиального сегментов МДЯ, перекрываясь с волокнами из ПК, тогда как волокна из других частей паллидума и ЧВр заканчиваются в латеральной и вентральной частях МДЯ, где они перекрываются с входами от верхнего двухолмия и других структур ствола мозга [72]. Из этих данных следует, что только определенные части МДЯ вовлечены в обонятельные цепи. Те нейроны ВП, которые получают иннервацию от шипиковых клеток ОБ и проецируются в МДЯ, имеют удивительное сходство с проекционными клетками энтопедункулярного ядра (аналога внутренней части бледного шара млекопитающих), которое, как и ЧВр, является выходным ядром БГ [83]. Существующие данные позволили авторам работы [80] прийти к заключению, что ВП по существу участвует во внутренних цепях БГ и потому его нельзя рассматривать как основную выходную структуру.
На последовательность распространения сигналов в обонятельной цепи указывают данные о том, что искусственно вызванная в ОЛ судорожная активность распространяется вначале в ПОЯ, потом в ПЯ, ВП и бледный шар, затем в ЧВр и энтопедункулярное ядро, а потом в МДЯ и другие таламические ядра [84]. По аналогии с организацией цепей К–БГ–Т–К, участвующих в обработке зрительных, слуховых и соматосенсорных стимулов [6, 7, 85], и с учетом того, что ОЛ может выполнять функцию таламуса [9], можно ожидать, что в ОЛ поступает иннервация от ГАМКергических нейронов выходных ядер БГ, в которые проецируются шипиковые нейроны ОБ. Наличие ГАМКергических проекций из ВП в ОЛ продемонстрировано в работе [86]. Судя по результатам работы [87], в ОЛ имеются входы из ЧВ.
ГИПОТЕТИЧЕСКИЙ МЕХАНИЗМ ОБРАБОТКИ ОБОНЯТЕЛЬНОЙ ИНФОРМАЦИИ
В предшествующих работах [6, 7] был предложен механизм обработка зрительной и слуховой информации, который базируется на дофамин-зависимой реорганизации активности в топографически организованных нейронных цепях К–БГ–Т–К. Дофамин способствует индукции длительной потенциации (ДП) на возбудительных входах к стрионигральным клеткам, на которых преимущественно располагаются Д1 рецепторы и которые дают начало прямому растормаживающему пути через БГ. Одновременно дофамин способствует индукции длительной депрессии (ДД) на возбудительных входах к стриопаллидарным клеткам, на которых преимущественно располагаются Д2 рецепторы и которые дают начало непрямому ингибирующему пути через БГ (рис. 1). В результате этого, синергично ослабляется ингибирование со стороны выходных ядер БГ тех нейронов таламуса, которые первоначально были сильно активированы сенсорным стимулом, так что их активность увеличивается и возрастает активность топографически связанных с ними нейронов новой коры [7, 85]. Поскольку правила модификации сильных и слабых возбудительных входов в стриатум противоположны по знаку, дофамин-зависимая реорганизация активности в цепи К–БГ–Т–К одновременно приводит к ослаблению активности нейронов таламуса и коры, первоначально слабо активированных сенсорным стимулом [7, 85].
С учетом этого механизма, а также с учетом изложенных выше особенностей взаимосвязей в нейронной сети, включающей ОЛ, ПОЯ, ПК, ОБ и ВП, в настоящей работе предложен следующий гипотетический механизм обработки информации в обонятельной цепи. При поступлении сигналов о некоем запахе в ОЛ сильнее всего активируются нейроны, рецептивные поля которых настроены на этот запах и которые сгруппированы в определенной гломеруле. Затем сигнал передается в ближайшую к ОЛ часть ПОЯ, где также активируется компактно расположенная группа клеток со сходными рецептивными полями. От нее сигналы распространяются в другую часть ПОЯ, а затем в прилегающую к ней ПК, где наиболее сильно активируются распределенные группы нейронов с рецептивными полями, настроенными на этот запах. Сигналы от них и от нейронов из соответствующей гломерулы ОЛ иннервируют шипиковые клетки ОБ. Как появление запаха, так и его подкрепление во время обучения, должны вызывать реакции дофаминергических клеток ВПП и ЧВк. Воздействие дофамина на стрионигральные и стриопаллидарные шипиковые клетки ОБ должно приводить к индукции соответственно ДП и ДД на их сильных возбудительных входах. Важно подчеркнуть, что моносинаптическую иннервацию от глутаматергических нейронов пПК получают популяции шипиковых нейронов ОБ и с Д1, и с Д2 рецепторами [70]. Поэтому, одновременно активируются прямой и непрямой пути через обонятельную часть БГ. Дофамин-зависимая модуляция эффективности синапсов в ОБ приводит к определенной реорганизации активности в нейронной цепи, связывающей ОЛ, ПОЯ, ПК, ОБ, ВП и ЧВр (рис. 2). Через прямой путь в БГ, начало которому дают стрионигральные клетки ОБ, проецирующиеся в ЧВр и часть ВП, усиливается растормаживание нейронов в той гломеруле ОЛ, которая первоначально была сильно активирована поступившим запахом. Одновременно усилится их растормаживание через непрямой путь в БГ, начало которому дают стриопаллидарные клетки ОБ, проецирующиеся в другую часть ВП. В результате увеличится активность нейронов этой гломерулы ОЛ и их клеток-мишеней в ПОЯ и ПК.
К слабым возбудительным входам к шипиковым клеткам ОБ относятся те, которые не приводят к открыванию НМДА каналов. Под действием дофамина на слабых возбудительных входах к стрионигральным и стриопаллидарным шипиковым клеткам индуцируются соответственно ДД и ДП. Поэтому, после прохождения активности через ОБ и ВП должно усилиться ингибирование нейронов в тех гломерулах ОЛ, нейроны которых первоначально были слабо возбуждены поступившим запахом. В результате должна уменьшиться активность этих нейронов и их клеток-мишеней в ПОЯ и ПК. Таким образом, вызванная дофамином реорганизация активности в цепи ПК–ОБ–ВП–ОЛ–ПОЯ–ПК должна приводить к формированию контрастного отображения подкрепляемого запаха в активности нейронов ОЛ и ПК.
В ОБ, как и в ПЯ, велика плотность аденозиновых А2А рецепторов [88]. Эти рецепторы в основном постсинаптические и располагаются на дендритах и дендритных шипиках стриопаллидарных клеток в области окончаний глутаматергических терминалей [89]. Нейроны ОБ, на которых располагаются А2А рецепторы, проецируются в ВП [90]. Ранее нами был проведен анализ возможных причин предпочтительного использования антагонистов А2А рецепторов для улучшения функционирования цепей К–БГ–Т–К [91]. В применении к моторным цепям К–БГ–Т–К этот анализ позволил объяснить, почему антагонисты А2А рецепторов позволяют ослабить двигательные нарушения при болезни Паркинсона и заменить дофаминергические препараты, которые вызывают привыкание и могут приводить к нежелательным побочным эффектам [91]. Поскольку в ОБ, как и в дорзальном стриатуме, связанные с Gs-белками аденозиновые А2А рецепторы [92] располагаются на стриопаллидарных клетках, на которых имеются и связанные с Gi/0 белками Д2 рецепторы, по аналогии с механизмом функционирования моторной цепи К–БГ–Т–К можно полагать, что антагонисты А2А рецепторов будут оказывать на функционирование цепи ПК–ОБ–ВП–ОЛ–ПК такое же действие, как и агонисты дофаминовых Д2 рецепторов, т.е. способствовать растормаживанию сильно активированных нейронов ОЛ и МДЯ со стороны ВП. Это приведет к увеличению их активности, а также активности связанных с ними нейронов ПК и ОфК. В результате обоняние должно улучшиться. В пользу важности вклада непрямого пути через БГ в обработку запахов могут служить данные о том, что генно-модифицированным мышам с отсутствием Д2 рецепторов требовалось гораздо больше обучающих проб для распознавания подкрепляемого запаха [93].
При анализе влияния дофамина на функционирование обонятельной сети следует учитывать то обстоятельство, что дофаминергические нейроны ВПП и ЧВк проецируются и в ОЛ [87], а также что в обнаружении и дискриминации запахов важную роль играют дофаминергические интернейроны ОЛ [94]. В ОЛ дофамин воздействует на разные типы клеток, на которых имеются Д1 и Д2 рецепторы. Например, активация Д1 рецепторов уменьшала ток через ГАМКа рецепторы на тормозных интернейронах ОЛ за счет их фосфорилирования протеинкиназой А [95]. Это согласуется с предложенными нами правилами модуляции эффективности ГАМКергической передачи [96, 97]. В результате активность интернейронов должна увеличиться, что приведет к усилению ингибирования основных клеток. Снижению активности митральных/пучковых клеток ОЛ способствовало и воздействие дофамина на расположенные на этих клетках Д2 рецепторы [95]. Этот эффект, по-видимому, являлся следствием индукции ДД эффективности возбуждения указанных клеток при активации Д2 рецепторов. С другой стороны, дофамин способствовал усилению активности выходных клеток ОЛ за счет воздействия на Д1 рецепторы [98]. Поскольку на выходных клетках ОЛ имеются и Д1, и Д2 рецепторы, у которых разное сродство с дофамином, результирующий модулирующий эффект должен зависеть от его концентрации. Если дофамин воздействует на Д1 рецепторы и на основных клетках, и на интернейронах, активность основных клеток ОЛ должна зависеть от соотношения сил возбуждения и торможения (см. [96]).
Следует отметить, что в синапсах, образованных аксонами нейронов ОЛ в пПК индуцируются только кратковременные формы синаптической пластичности, а ДП индуцируется за счет дополнительной активации входов в ПК из ОфК [19]. Стимуляция ОфК способствовала индукции в ПК ДП, длящейся более 4 часов [99]. Поэтому, в анализируемую обонятельную сеть включена также нейронная цепь, содержащая ОфК и МДЯ (рис. 2). Имеются данные о том, что связанная с МДЯ орбитальная кора проецируется в ПЯ, нейроны которого иннервируют дорсомедиальную область ЧВр [100]. Как уже указывалось, экспериментально показано влияние ОБ через ВП на активность нейронов МДЯ [83]. По-видимому, оно реализуется через вентролатеральную часть ВП (рис. 2). Из предлагаемого механизма следует, что при выделении дофамина в ОБ и ПЯ в ответ на подкрепляемый запах активность нейронов МДЯ должна увеличиться в результате ослабления их ингибирования со стороны ВП. Вследствие этого должна увеличиться активность клеток-мишеней МДЯ в ОфК, которая возбуждает нейроны ПК. В свою очередь, это будет способствовать усилению возбуждения нейронов ПК со стороны ОфК, проецирующихся в ПК. Как указано выше, это облегчит индукцию ДП на входах из ОЛ в ПК, что должно способствовать запоминанию отображений запахов на нейронах ПК. Как отмечено нами ранее, в обработке и восприятии слуховой и зрительной информации существенную роль играет цепь К–БГ–Т–К, включающая ПфК [6]. Поэтому, вовлечение цепей, включающих фронтальные области коры в обработку запахов (рис. 2), дополнительно указывает на сходство механизмов обработки обонятельной информации и других видов сенсорной информации.
СОПОСТАВЛЕНИЕ ПРЕДПОЛАГАЕМОГО ХАРАКТЕРА ИЗМЕНЕНИЙ АКТИВНОСТИ НЕЙРОНОВ В ОБОНЯТЕЛЬНОЙ СЕТИ ПРИ ОБУЧЕНИИ С ЭКСПЕРИМЕНТАЛЬНО НАБЛЮДАЕМЫМИ ИЗМЕНЕНИЯМИ
Согласно предлагаемому механизму, дофамин, выделяющийся в ответ на подкрепление, должен способствовать увеличению активности тех нейронов ОЛ, ПОЯ и ПК, которые реагируют на подкрепляемый запах и ослаблением реакций на запах, который не подкрепляли. Этот эффект связан с растормаживанием со стороны ВП только тех клеток ОЛ, которые первоначально реагировали на условный запах. Такому же эффекту должны способствовать агонисты дофаминовых Д1 и Д2 рецепторов. Действительно, когда два запаха предъявляли в задании, в котором один из них поощряли, а другой нет, то популяция митральных/пучковых клеток ОЛ реагировала на два запаха по-разному, причем реакции на запах, который не подкрепляли, устойчиво снижались [101]. При обучении, в котором сигнальным стимулом являлся запах, менялась активность шипиковых нейронов ОБ, на которых располагались и Д1, и Д2 рецепторы [55, 102, 103]. Одновременное функционирование стрионигральных и стриопаллидарных клеток является важным условием предлагаемого механизма. Экспериментальные исследования продемонстрировали особенности вовлечения нейронов этих двух типов. При положительном подкреплении преимущественно активировались шипиковые клетки антеромедиальной части ОБ, на которых располагались Д1 рецепторы. Если запах ассоциировали с электрическим раздражением лапы, преимущественно активировались клетки антеромедиальной части ОБ, на которых располагались Д2 рецепторы, а также клетки латеральной части ОБ, на которых располагались Д1 рецепторы [103]. Эти данные могут быть связаны с существованием отдельных мезолимбических дофаминовых подсистем. Например, показано, что влияние дофаминергических клеток ВПП на активность нейронов разных участков вентральной части ПЯ зависит от того, являлся ли безусловный стимул положительным или аверзивным [104]. Не исключено, что при негативном подкреплении уровень дофамина в ОБ был низким и Д2 рецепторы не активировались, поскольку их сродство с дофамином меньше, чем у Д1 рецепторов [105]. В таком случае на возбудительных входах к стриопаллидарным клеткам не индуцировалась ДД, что и отразилось в их преимущественной активации, наблюдавшейся в работе [103].
На мышах показано, что нейроны ОБ и с Д1, и с Д2 рецепторами реагируют как на запахи, сигнализирующие положительное подкрепление, так и на запахи, ассоциируемые с аверзивным стимулом [106]. При этом в активности нейронов с Д1 рецепторами хорошо отображалась значимость запаха. Они сходным образом отвечали на условные запахи, за которыми следовало сходное действие, независимо от типа запаха. По контрасту, отображение запахов нейронами с Д2 рецепторами слабее зависело от последующего результата, и эти нейроны были более избирательны к типу запаха, чем к его значимости [106]. Эти данные указывают на разную функциональную роль прямого и непрямого пути через ОБ. Это может быть связано с разным числом стрионигральных и стриопаллидарных клеток в ОБ [59], а также с различной организацией локальных цепей, в которые они включены.
Имеются экспериментальные данные об участии нейронов ПК в определении типа и интенсивности запаха [107, 108]. При обучении нейроны ПК реагируют на предпочтительный запах, участвуют в запоминании запаха, связанного с опасностью, а также в обработке информации об объектах, связанных с запахом [109–111]. Согласно предлагаемому механизму, при обучении должна усилиться активность тех групп пирамидных нейронов ПК, чьи рецептивные поля настроены на подкрепляемый запах, поскольку увеличивается их возбуждение со стороны ОЛ и ОфК, что должно способствовать индукции ДП на их возбудительных входах. Действительно, ДП в обонятельном пути в ПК наблюдали именно при ассоциации запаха с подкреплением, тогда как при псевдо обусловливании ДП не индуцировалась [112]. На крысах показано, что НМДА-зависимое усиление эффективности синаптической передачи в ПК положительно коррелирует с улучшением обучения [113].
Примечательно, что ассоциации запах–вознаграждение отображаются в активности нейронов зПК и ОБ сходным образом [102]. Оказалось, что по мере продвижения сигналов от ОЛ к ПК отображения запахов в активности пирамидных нейронов зависят от характера задачи только в зПК, но не в пПК [101]. По-видимому, это связано с разной организацией проекций в зПК и пПК. В частности, показано, что в зПК поступает более сильная иннервация из базолатеральной миндалины, так что избирательные к запахам популяции нейронов зПК разряжались различным образом в зависимости от значимости запаха [35]. Во время ассоциативного обучения в пПК крыс также обнаружена значительная пластичность ответов нейронов на запах. Дискриминация и категоризация запахов в пПК поддерживаются нисходящим влиянием на ПК со стороны ОфК [99]. Полагают, что в пПК лучше отображаются свойства запаха, а в зПК – значимость запаха [15]. Из предлагаемого механизма следует, что ослабление ингибирования МДЯ со стороны выходных ядер БГ должно способствовать усилению его активности и активности его клеток-мишеней в ПК и ОфК. Однако поскольку ПК и ОФК вовлечены в разные цепи, характер усиления их активности может быть различным. Оказалось, что связь МДЯ и ПК особенно сильно увеличивается при распознавании запаха, а во время принятия решения о том, к какому запаху приблизиться, увеличивается связь МДЯ с ОфК [114].
Из предлагаемого механизма следует также, что повреждение каждого из звеньев в обонятельной цепи, включающей ОЛ, ПОЯ, ПК, ОБ и ВП, а также связанных с ними МДЯ, ПфК и ОфК, должно препятствовать формированию нейронных отображений запахов и ухудшению их восприятия. Действительно, в проведенных на крысах экспериментах, в которых инактивировали разные структуры, показано, что в выполнении задач на различение запахов участвует обонятельная нейронная сеть, а также соответствующие области таламуса и ПфК, включая ОфК [115]. У человека повреждение таламуса практически не влияло на обнаружение запаха, но существенно нарушало возможность его идентификации [116]. Результаты этого эксперимента указывают на существенный вклад в идентификацию запахов связей МДЯ с фронтальными областями коры, а также на то, что для обнаружения запаха достаточно связи оставшейся интактной ОЛ с ПК.
В согласии с предлагаемым механизмом показано, что обработка информации о запахе чувствительна к концентрации выделяемого дофамина. У пациентов с болезнью Паркинсона, в основе которой лежит гибель дофаминергических клеток ЧВк, гипосмия наблюдается в 80–90% случаев [117]. При этом ухудшение обнаружения и дискриминации запахов коррелирует с тяжестью заболевания [118]. На модели болезни Паркинсона у мышей также продемонстрировано ухудшение дискриминации подкрепляемого запаха. Полагают, что это связано с дофаминергической денервацией ОБ и ПЯ [117]. Ухудшение обоняния при болезни Паркинсона свидетельствует в пользу того, что в обработке обонятельной информации принимает участие дофаминергическая иннервация ОБ не только из ВПП, но и из ЧВк. Примечательно, что при болезни Паркинсона снижение обонятельной чувствительности наблюдается еще до появления заметных двигательных нарушений [4]. Из этого следует, что характер функционирования обонятельных цепей более чувствителен к дефициту дофамина, чем характер функционирования моторной цепи К–БГ–Т–К.
Из предлагаемого механизма следует, что улучшению обнаружения и дискриминации запахов могут способствовать антагонисты аденозиновых рецепторов, причем предпочтительно использовать антагонисты А2А рецепторов, плотность которых в ОБ высока. Действительно, на крысах показано, что распознавание запахов значительно улучшал неспецифический антагонист аденозиновых рецепторов кофеин, а также избирательный антагонист А2А рецепторов, но не А1 рецепторов [119]. Антагонисты А2А рецепторов улучшают обоняние и при старении [120]. Более того, антагонисты А2А рецепторов улучшали обоняние у пациентов с болезнью Паркинсона в тех случаях, когда дофаминергические препараты не оказывали заметного влияния [121]. При этом они не вызывали дискинезии, которую вызывает использование больших доз дофаминергических препаратов [122]. Наш предшествующий анализ [91] позволил объяснить, почему системное использование антагонистов А2А рецепторов может ослабить двигательные нарушения и при этом не приводить к побочным эффектам. Из вышеизложенного следует, что характер изменений активности нейронов в обонятельной сети при обучении, вытекающий из предлагаемого механизма обработки обонятельной информации, согласуется с известными экспериментальными данными.
ОБСУЖДЕНИЕ
Известно, что БГ являются очень древней структурой. Сравнение функциональных характеристик БГ древнейшей группы ныне живущих позвоночных миног и БГ млекопитающих показало практическую идентичность их общей организации, межнейронных связей, набора нейропередатчиков и их рецепторов, нейропептидов и экспрессии ионных каналов [123, 124]. Средний мозг также устроен практически одинаково у миног и грызунов [123]. Дорсальный паллиум (кора) миноги имеет ретинотопическую зрительную область, соматосенсорную и моторную области, а вентральная часть паллиума содержит обонятельную область, похожую на ПК [124]. Как и в ПК млекопитающих, в вентральной части паллиума миноги три слоя, а дендритные ветви нейронов имеют шипики и охватывают все слои [125]. У миноги обонятельная кора имеет вход из ОЛ и активируется с небольшим латентным периодом при стимуляции обонятельного нерва [124]. Примитивная трехслойная ПК не организована топографически, но ее ассоциативная природа способствует синтетической обработке информации, в отличие от аналитической обработки отдельных признаков сложных сигналов, характерной для классических иерархических топографически организованных цепей в новой коре [126].
Мы полагаем, что предлагаемый в настоящей работе механизм обработки обонятельной информации аналогичен у позвоночных, находящихся на разных стадиях эволюции, включая такие древние, как миноги, вследствие сходства функциональной организации БГ в этих стадиях. В отсутствие неокортекса контрастное отображение запахов может формироваться на нейронах ОЛ за счет выделения дофамина в ОБ, длительной модификации эффективности возбудительных входов от ОЛ к шипиковым нейронам ОБ и последующего растормаживания нейронов ОЛ со стороны ВП. Полагают, что сильные долго длящиеся ассоциации подкрепления с запахом являются следствием выделения дофамина в ОБ, куда поступает возбуждение из ОЛ [106]. С точки зрения предлагаемого механизма, в основе этого эффекта лежат длительные дофамин-зависимые перестройки эффективности возбудительных входов в ОБ из ОЛ и ПК и последующая перестройка активности нейронов во всей обонятельной сети.
Существует мнение, что деление таламических ядер на ядра первого и высших порядков устарело. Необходима классификация, основанная на том, что структура таламо-кортикальных взаимодействий естественным образом определяет их функцию [48]. С учетом такой классификации, ОЛ выполняет ту же роль, что и таламус [9]. Мы полагаем, что функционирование ОЛ, как и функционирование разных ядер таламуса, зависит от их взаимодействий не только с корой, но и с БГ. Ранее предполагали, что МДЯ является первичной областью представления запахов в таламусе [127], но в настоящее время его относят к ядрам высокого порядка, тогда как первичной областью отображения запахов является ОЛ. В предлагаемом механизме МДЯ также играет роль таламического ядра высокого порядка, поскольку оно получает информацию из ПК [75] и может переносить ее в ОфК и ПфК, тогда как проекций из МДЯ в ПК не обнаружено [128].
Хотя одни экспериментальные данные указывают только на релейные сенсорные свойства нейронов ОЛ, другие данные подчеркивают способность этих нейронов интегрировать поступающую обонятельную информацию с мотивацией, вниманием и предыдущим опытом [129]. С точки зрения предлагаемого механизма, способность нейронов ОЛ к интеграции обусловлена, с одной стороны, с входами в нее из ПК, связанной с ОфК, а с другой стороны, с влиянием на ОЛ со стороны ВП, чья активность зависит от конвергирующих на ОБ входах из ПК, ОфК, миндалины и гиппокампа. В работе [130] идентичность запаха и его значимость также связали не только с периферическими, но и с нисходящими входами в ОЛ. При этом предположено, что нисходящие входы в OБ потенциально представляют разные значения запаха. Примечательно, что повреждение ОЛ приводило к патологии лобной коры, поразительно сходной с изменениями в этой области коры у пациентов с нейродегенеративными заболеваниями [131]. Дисфункция обонятельных областей коры характерна для таких неврологических заболеваний, как болезнь Паркинсона, болезнь Альцгеймера и аутизм [32]. В частности, дисфункцию ПК наблюдали при гипосмии у пациентов с болезнью Паркинсона [132]. При болезни Альцгеймера атрофируется путь от ПК к энторинальной коре [133].
Имеются данные о том, что обоняние можно усилить с помощью дофамина. Например, к улучшению обонятельной чувствительности приводило использование в течение двух месяцев ментилфенидата, который увеличивает концентрацию дофамина в мозге [134]. Распознавание и дискриминацию запахов улучшала также активация Д1 рецепторов [98]. Однако по другим данным, дофаминовые препараты оказывают слабое влияние на обонятельный дефицит при болезни Паркинсона [135]. С нашей точки зрения, отсутствие улучшения обоняния при системном введении дофамина могло быть вызвано тем обстоятельством, что на обоняние влияет и дегенерация дофаминергических нейронов в ОЛ, хотя они не так подвержены гибели, как клетки ЧВк [136]. Примечательно, что при моделировании болезни Паркинсона число дофаминергических клеток уменьшалось и в ЧВк, и в ОЛ, но использование l-DOPA увеличивало их число в ОЛ [137]. Однако неизвестно, достаточно ли этого увеличения для нормализации концентрации дофамина в ОЛ. Как указано выше, с точки зрения предлагаемого механизма, действие дофамина на активность нейронов ОЛ существенно зависит от его концентрации. Поскольку при системном введении дофаминергических препаратов их влияние на обоняние зависит от многих факторов, подбор необходимой дозы, по-видимому, затруднен, а чрезмерное ее увеличение приводит к побочным эффектам.
Длительное нарушение обоняния является распространенным последствием черепно-мозговых травм. У некоторых пациентов тренировки в течение 24 недель после травмы приводили к улучшению идентификации запаха и восприятия его интенсивности [138]. Однако тренировки помогали лишь небольшой группе пациентов с болезнью Паркинсона [139]. По-видимому, тренировки не всегда могут компенсировать те изменения межнейронных взаимодействий в обонятельной сети, которые были вызваны дефицитом дофамина.
ЗАКЛЮЧЕНИЕ
Необходимость иметь хорошее обоняние вызвана его участием в таких жизненно важных функциях, как предупреждение и защита от опасностей окружающей среды, пищевое поведение, а также социальное общение [140]. Опасным для жизни может быть, например, невозможность обнаружить запах дыма или испорченных продуктов [141]. Судя по известным данным, хроническая потеря обоняния (аносмия) или искаженное восприятие запахов (паросмия) наблюдаются у 1.4% американцев [142], а по данным работы [143] аносмией в целом страдают около 5% населения. Обонятельная дисфункция сильно коррелирует с нейродегенерацией [131]. Например, у пациентов с болезнью Паркинсона ухудшение обоняния наблюдается в 95% случаев [136].
С начала пандемии COVID-19 описано множество случаев внезапной потери обоняния, причем аносмия часто является первым, а иногда и единственным признаком заболевания у бессимптомных носителей вируса [144]. В течение первой недели после заболевания COVID-19 паросмия, приводящая к снижению качества жизни, появлялась у 25.4% респондентов, а после первого месяца – у 43.4% [145]. Хотя аносмию при инфекции коронавирусом связывают с нарушением обонятельного эпителия и ослаблением нейрогенеза в ОЛ, но она может быть связана также с потерей дофаминергических клеток и изменением функционирования всей дофаминергической системы [146]. С нарушением этой системы связывают и появление двигательных нарушений при COVID-19 [147]. По-видимому, COVID-19 приводит к потере дофаминергических клеток и в ОЛ, и в ЧВк, поскольку у пациентов с COVID-19 двигательные нарушения наблюдали даже если у них не было болезни Паркинсона [148].
Показано, что при инфицировании коронавирусом из поврежденных клеток высвобождается большое количество аденозинтрифосфата, который способствует развитию воспалительного процесса [149]. Авторы указанной работы выдвинули гипотезу о том, что использование антагонистов А2А рецепторов может быть полезным для лечения COVID-19 за счет повышения эффективности врожденной и адаптивной иммунной системы. Из предлагаемого нами механизма следует, что повышение концентрации аденозина в мозге при инфицировании коронавирусом должно привести к ухудшению обоняния за счет воздействия на А2А рецепторы на нейронах ОБ, и к двигательным нарушениям за счет воздействия на А2А рецепторы на нейронах дорзальной моторной части стриатума. В таком случае использование антагонистов А2А рецепторов при лечении пациентов с COVID-19 должно не только улучшить обоняние, но и ослабить двигательные нарушения. Понимание механизмов функционирования обонятельной нейронной сети, чему посвящена настоящая работа, может быть полезным для поиска методов улучшения обоняния при различных заболеваниях.
Список литературы
Fletcher M.L., Chen W.R. // Learn. Mem. 2010. V. 17. № 11. P. 561–570.
Newman R., Winans S.S. // J. Comp. Neurol. 1980. V. 191. № 2. P. 193–212.
Wamsley J.K., Gehlert D.R., Filloux F.M., Dawson T.M. // J. Chem. Neuroanat. 1989. V. 2. № 3. P. 119–137.
Zhang W., Sun C., Shao Y., Zhou Z., Hou Y., Li A. // Sci. Rep. 2019. V. 9. № 1. P. 254.
Zhang Z., Wei S., Du H., Su Z., Wen Y., Shang Z., Song X., Xu Z., You Y., Yang Z. // Exp. Neurol. 2019. V. 322. P. 113055.
Силькис И.Г. // Успехи физиол. наук 2015. Т. 46. № 3. С. 76–92.
Silkis I. // Biosystems, 2007. V. 89. № 1–3. P. 227–235.
Силькис И.Г. // Нейрохимия. 2013. Т. 30. № 4. С. 305–313.
Kay L.M., Sherman S.M. // Trends Neurosci. 2007. V. 30. № 2. P. 47–53.
Savic I. // Curr. Opin. Neurobiol. 2002. V. 12. № 4. P. 455–461.
Takeuchi H., Sakano H. // Cell Mol. Life Sci. 2014. V. 71. № 16. P. 3049–3057.
Mori K., Takahashi Y.K., Igarashi K.M., Yamaguchi M. // Physiol Rev. 2006. V. 86. № 2. P. 409–433.
Wachowiak M., Shipley M.T. // Semin. Cell Dev. Biol. 2006. V. 17. № 4. P. 411–423.
Mori K., Sakano H. // Annu. Rev. Neurosci. 2011. V. 34. P. 467–499.
Wilson D.A. // Chem. Senses. 2001. V. 26. № 5. P. 577–584.
Chu M.W., Li W.L., Komiyama T. // Neuron. 2016. V. 92. № 1. P. 174–186.
Mandairon N., Stack C., Kiselycznyk C., Linster C. // Proc. Natl. Acad. Sci. USA. 2006. V. 103. № 36. P. 13543–13548.
Isaacson J.S. // Curr. Opin. Neurobiol. 2010. V. 20. № 3. P. 328–331.
Strauch C., Hoang T.H., Angenstein F., Manahan-Vaughan D. // Cereb. Cortex. 2022. V. 32. № 4. P. 689–708.
Tsuji T., Tsuji C., Lozic M., Ludwig M., Leng G. // Physiol. Rep. 2019. V. 7. № 22. P. e14284.
Kay R.B., Meyer E.A., Illig K.R., Brunjes P.C. // J. Comp. Neurol. 2011. V. 519. № 2. P. 277–289.
McGinley M.J., Westbrook G.L. // J. Neurophysiol. 2011. V. 105. № 4. P. 1444–1453.
Russo M.J., Franks K.M., Oghaz R., Axel R., Siegelbaum S.A. // J. Neurosci. 2020. V. 40. № 49. P. 9414–9425.
Tantirigama M.L.S., Huang H.H-Y., Bekkers J.M. // Proc. Natl. Acad. Sci. USA. 2017. V. 114. № 9. P. 2407–2412.
Brunjes P.C. // Chem. Senses. 2021. V. 46. P. bjab002.
Illig K.R., Haberly L.B. // J. Comp. Neurol. 2003. V. 457. № 4. P. 361–373.
Suzuki N., Bekkers J.M. // J. Comp. Neurol. 2010. V. 518. № 10. P. 1670–1687.
Franks K.M., Russo M.J., Sosulski D.L., Mulligan A.A., Siegelbaum S.A., Axel R. //. Neuron. 2011. V. 72. № 1. P. 49–56.
Mori K., Sakano H. // Annu. Rev. Physiol. 2021. V. 83. P. 231–256.
Stettler D.D., Axel R. // Neuron. 2009. V. 63. № 6. P. 854–864.
Cavada C., Compañy T., Tejedor J., Cruz-Rizzolo R.J., Reinoso-Suárez F. // Cereb. Cortex. 2000. V. 10. № 3. P. 220–242.
Wilson D.A., Xu W., Sadrian B., Courtiol E., Cohen Y., Barnes D.C. // Prog. Brain Res. 2014. V. 208. P. 275–305.
Chen C.F., Zou D-J., Altomare C.G., Xu L., Greer C.A., Firestein S.J. // Proc. Natl. Acad. Sci. USA. 2014. V. 111. № 47. P. 16931–16936.
Münster A., Votteler A., Sommer S., Hauber W. // Cereb. Cortex Commun. 2020. V. 1. № 1. P. tgaa086.
Calu D.J., Roesch M.R., Stalnaker T.A., Schoenbaum G. // Cereb. Cortex. 2007. V. 17. № 6. P. 1342–1349.
Courtiol E., Wilson D.A. // Perception. 2017. V. 46. № 3–4. P. 320–332.
Zhou G., Lane G., Cooper S.L., Kahnt T., Zelano C. // Elife. 2019. V. 8. P. e47177.
Watanabe K., Kawana E. // Brain Res. 1984. V. 296. № 1. P. 148–151.
Padmanabhan K., Osakada F., Tarabrina A., Kizer E., Callaway E.M., Gage F.H., Sejnowski T.J. // J. Neurosci. 2016. V. 36. № 28. P. 7535–7545.
Boyd A.M., Kato H.K., Komiyama T., Isaacson J.S. // Cell Rep. 2015. V. 10. № 7. P. 1032–1039.
Zhou F.W., Puche A.C., Shipley M.T. // Front. Cell Neurosci. 2018. V. 12. P. 387.
Burton S.D. // J. Neurophysiol. 2017. V. 118. № 4. P. 2034–2051.
Vaaga C.E., Yorgason J.T., Williams J.T., Westbrook G.L. // J. Neurophysiol. 2017. V. 117. № 3. P. 1163–1170.
Sarnat H.B., Flores-Sarnat L. // Handb. Clin. Neurol. 2019. V. 164. P. 29–45.
Iravani B., Arshamian A., Ohla K., Wilson D.A., Lundström J.N. // Nat. Commun. 2020. V. 11. № 1. P. 648.
Jones E.G. // Trends Neurosci. 2001. V. 24. № 10. P. 595–601.
Sosulski D.L., Bloom M.L., Cutforth T., Axel R., Datta S.R. // Nature. 2011. V. 472. № 7342. P. 213–216.
Halassa M.M., Sherman S.M. // Neuron. 2019. V. 103. № 5. P. 762–770.
Unzai T., Kuramoto E., Kaneko T., Fujiyama F. // Cereb. Cortex. 2017. V. 27. № 2. P. 1164–1181.
Ikemoto S. // Brain Res. Rev. 2007. V. 56. № 1. P. 27–78.
Murata K. // Front. Neural Circuits. 2020. V. 14. P. 577880.
Suarez-Roca H., Lovenberg T., Cubeddu L.X. // J. Pharmacol. Exp. Ther. 1987. V. 243. № 3. P. 840–851.
Graybiel A.M., Ohta K., Roffler-Tarlov S. // J. Neurosci. 1990. V. 10. № 3. P. 720–733.
Schmidt M.J., Sawyer B.D., Perry K.W., Fuller R.W., Foreman M.M., Ghetti B. // J. Neurosci. 1982. V. 2. № 3. P. 376–380.
Murata K., Kanno M., Ieki N., Mori K., Yamaguchi M. // J. Neurosci. 2015. V. 35. № 29. P. 10581–10599.
Soares-Cunha C., Coimbra B., Sousa N., Rodrigues A.J. // Neurosci. Biobehav. Rev. 2016. V. 68. P. 370–386.
Levey A.I., Hersch S.M., Rye D.B., Sunahara R.K., Niznik H.B., Kitt C.A., Price D.L., Maggio R., Brann M.R., Ciliax B.J. // Proc. Natl. Acad. Sci. USA. 1993. V. 90. № 19. P. 8861–8865.
Le Moine C., Bloch B. // J. Comp. Neurol. 1995. V. 355. № 3. P. 418–426.
Furuta T., Zhou L., Kaneko T. // Neuroscience. 2002. V. 114. № 3. P. 611–627.
Altar C.A., Hauser K. // Brain Res. 1987. V. 410. № 1. P. 1–11.
Haber S.N., Nauta W.J. // Neuroscience. 1983. V. 9. № 2. P. 245–260.
Heimer L., Zaborszky L., Zahm D.S., Alheid G.F. // J. Comp. Neurol. 1987. V. 255. № 4. P. 571–591.
Xiong A., Wesson D.W. // Chem. Senses. 2016. V. 41. № 7. P. 549–555.
Pardo-Garcia T.R., Garcia-Keller C., Penaloza T., Richie C.T., Pickel J., Hope B.T., Harvey B.K., Kalivas P.W., Heinsbroek J.A. // J. Neurosci. 2019. V. 39. № 11. P. 2041–2051.
Cansler H.L., Wright K.N., Stetzik L.A., Wesson D.W. // J. Neurochem. 2020. V. 152. № 4. P. 425–448.
Carlson K.S., Dillione M.R., Wesson D.W. // J. Neurophysiol. 2014. V. 111. № 10. P. 2109–2123.
Scott J.W., McBride R.L., Schneider S.P. // J. Comp. Neurol. 1980. V. 194. № 3. P. 519–534.
Wahle P., Meyer G. // Exp. Brain Res. 1986. V. 62. № 3. P. 528–540.
Schwob J.E., Price J.L. // J. Comp. Neurol. 1984. V. 223. № 2. P. 203–222.
White K.A., Zhang Y.F., Zhang Z., Bhattarai J.P., Moberly A.H., In't Zandt. E.E., Pena-Bravo J.I., Mi H., Jia X., Fuccillo M.V., Xu F., Ma M., Wesson D.W. // J. Neurosci. 2019. V. 39. № 48. P. 9546–9559.
Giessel A.J., Datta S.R. // Curr. Opin. Neurobiol. 2014. V. 24. № 1. P. 120–132.
Payton C.A., Wilson D.A., Wesson D.W. // PLoS One. 2012. V. 7. № 4. P. e34926.
Dermon C.R., Barbas H. // J. Comp. Neurol . 1994. V. 344. № 4. P. 508–531.
Morecraft R.J., Geula C., Mesulam M.M. // J. Comp. Neurol. 1992. V. 323. № 3. P. 341–358.
Ray J.P., Price J.L. // J. Comp. Neurol. 1992. V. 323. № 2. P. 167–197.
Cansler H.L., In 't Zandt E.E., Carlson K.S., Khan W.T., Ma M., Wesson D.W. // Cereb. Cortex. 2022. bhac153. Online ahead of print.
Takagishi M., Chiba T. // Brain Res. 1991. V. 566. № 1–2. P. 26–39.
Berendse H.W., Galis-de Graaf Y., Groenewegen H.J. // J. Comp. Neurol. 1992. V. 316. № 3. P. 314–347.
Groenewegen H.J., Berendse H.W., Haber S.N. // Neuroscience. 1993. V. 57. № 1. P. 113–142.
Maurice N., Deniau J.M., Menetrey A., Glowinski J., Thierry A.M. // Neuroscience. 1997. V. 80. № 2. P. 523–534.
Root D.H., Melendez R.I., Zaborszky L., Napier T.C. // Prog. Neurobiol. 2015. V. 130. P. 29–70.
Gulcebi M.I., Ketenci S., Linke R., Hacıoğlu H., Yanalı H., Veliskova J., Moshé S.L., Onat F., Çavdar S. // Brain Res. Bull. 2012. V. 87. № 2–3. P. 312–318.
Zahm D.S., Zaborszky L., Alheid G.F., Heimer L. // J. Comp. Neurol. 1987. V. 255. № 4. P. 592–605.
Araki T., Kato M., Kobayashi T. // Brain Res. 1995. V. 693. № 1–2. P. 207–216.
Silkis I. // Biosystems. 2001. V. 59. № 1. P. 7–14.
Záborszky L., Carlsen J., Brashear H.R., Heimer L. // J. Comp. Neurol. 1986. V. 243. № 4. P. 488–509.
Lévy F., Meurisse M., Ferreira G., Thibault J., Tillet Y. // J. Chem. Neuroanat. 1999. V. 16. № 4. P. 245–2263.
DeMet E.M., Chicz-DeMet A. // Arch. Pharmacol. 2002. V. 366. № 5. P. 478–481.
Rosin D.L., Hettinger B.D., Lee A., Linden J. // Neurology. 2003. V. 61. № 11. (Suppl 6). P. S12–S18.
Li R., Wang Y.Q., Liu W.Y., Zhang M.Q., Li L., Cherasse Y., Schiffmann S.N., de Kerchove d’Exaerde A., Lazarus M., Qu W.M., Huang Z.L. // Neuropharmacology. 2020. V. 168. P. 107923.
Силькис И.Г. // Нейрохимия. 2014. Т. 31. № 4. С. 287–299.
Ballesteros-Yáñez I., Castillo C.A., Merighi S., Gessi S. // Front. Pharmacol. 2018. V. 8. P. 985.
Kruzich P.J., Grandy D.K. // BMC Neurosci. 2004. V. 5. P.12.
Wilson D.A., Sullivan R.M. // J. Neurosci. 1995. V. 15. № 8. P. 5574–5581.
Brünig I., Sommer M., Hatt H., Bormann J. // Proc. Natl. Acad. Sci. USA. 1999. V. 96. № 5. P. 2456–2460.
Силькис И.Г.// Журн. высш. нерв. деят. им. И.П. Павлова. 2002. Т. 52. № 4. С. 392–405.
Silkis I.G. // Biosystems. 1998. V. 48. № 1–3. P. 205–213.
Liu S. // Front. Cell Neurosci. 2020. V. 14. P. 172.
Strauch C., Manahan-Vaughan D. // Cereb. Cortex. 2018. V. 28. № 2. P. 764–776.
Montaron M.F., Deniau J.M., Menetrey A., Glowinski J., Thierry A.M. // Neuroscience. 1996. V. 71. № 2. P. 371–382.
Wang D., Liu P., Mao X., Zhou Z., Cao T., Xu J., Sun C., Li A. // J. Neurosci. 2019. V. 39. № 50. P. 10002–10018.
Gadziola M.A., Stetzik L.A., Wright K.N., Milton A.J., Arakawa K., Del Mar Cortijo M., Wesson D.W. // Cell Rep. 2020. V. 32. № 3. P. 107919.
Murata K., Kinoshita T., Fukazawa Y., Kobayashi K., Yamanaka A., Hikida T., Manabe H., Yamaguchi M. // Front. Behav. Neurosci. 2019. V. 13. P. 50.
de Jong J.W., Afjei S.A., Dorocic I.P., Peck J.R., Liu C., Kim C.K., Tian L., Deisseroth K., Lammel S. // Neuron. 2019. V. 101. № 1. P. 133–151. e7.
Xu T.X., Ma Q., Spealman R.D., Yao W.D. // J. Neurochem. 2010. V. 115. № 6. P. 1643–1654.
Martiros N., Kapoor V., Kim S.E., Murthy V.N. // Elife. 2022. V. 11. P. e75463.
Bolding K.A., Franks K.M. // Elife. 2017. V. 6. P. e22630.
Jiang H., Schuele S., Rosenow J., Zelano C., Parvizi J., Tao J.X., Wu S., Gottfried J.A. // Neuron. 2017. V. 94. № 1. P. 207-219.e4.
Meissner-Bernard C., Dembitskaya Y., Venance L., Fleischmann A. // Curr. Biol. 2019. V. 29. № 3. P. 367–380.e4.
Schaffer E.S., Stettler D.D., Kato D., Choi G.B., Axel R., Abbott L.F. // Neuron. 2018. V. 98. № 4. P. 736–742.e3.
Wilson D.A., Sullivan R.M. // Neuron. 2011. V. 72. № 4. P. 506–519.
Chaillan F.A., Roman F.S., Soumireu-Mourat B. // J. Physiol. Paris. 1996. V. 90. № 5–6. P. 343–347.
Barkai E., Saar D. // Rev. Neurosci. 2001. V. 12. № 2. P. 111–120.
Courtiol E., Wilson D.A. // J. Neurosci. 2016. V. 36. № 22. P. 5946–5960.
Ferry A.T., Lu X.C., Price J.L. // Exp. Brain Res. 2000. V. 131. № 3. P. 320–335.
Sela L., Sacher Y., Serfaty C., Yeshurun Y., Soroker N., Sobel N. // J. Neurosci. 2009. V. 29. № 39. P. 12059–12069.
Valle-Leija P., Drucker-Colín R. // Neuroreport. 2014. V. 25. № 12. P. 948–953.
Tissingh G., Berendse H.W., Bergmans P., DeWaard R., Drukarch B., Stoof J.C., Wolters E.C. // Mov. Disord. 2001. V. 16. № 1. P. 41–46.
Prediger R.D., Batista L.C., Takahashi R.N. // Neurobiol. Aging. 2005. V. 26. № 6. P. 957–964.
Sun X., Li L., Zhang H.Y., He W., Wang D.R., Huang Z.L., Wang Y.Q. // Brain Res. 2021. V. 1768. P. 147590.
Prediger R.D. // J. Alzheimers Dis. 2010. V. 20. Suppl 1. P. S205–S220.
Jenner P. // Neurology. 2003. V. 61. № 11. (Suppl 6). P. S32–S38.
Grillner S. // Curr. Opin. Neurobiol. 2021. V. 71. P. 11–18.
Suryanarayana S.M., Pérez-Fernández J., Robertson B., Grillner S. // Brain Behav. Evol. 2022. V. 96. № 4–6. P. 318–333.
Suryanarayana S.M., Robertson B., Wallén P., Grillner S. // Curr. Biol. 2017. V. 27. № 21. P. 3264–3277.e5
Wilson D.A., Rennaker R.L. // In: Menini A, editor. The Neurobiology of Olfaction. Boca Raton (FL): CRC Press/Taylor & Francis; 2010. Chapter 14. Frontiers in Neuroscience.
Price J.L., Slotnick B.M. // J. Comp. Neurol. 1983. V. 215. № 1. P. 63–77.
Motokizawa F., Yasuda N., Shimomura F. // Neurosci. Lett. 1988. V. 84. № 1. P. 41–55.
Gervais R., Buonviso N., Martin C., Ravel N. // J. Physiol. Paris. 2007. V. 101. № 1–3. P. 40–45.
Yamaguchi M. // Front. Neuroanat. 2017. V. 11. P. 33.
Bhatia-Dey N., Heinbockel T. // Int. J. Environ. Res. Public Health. 2021. V. 18. № 13. P. 6976.
Baba T., Takeda A., Kikuchi A., Nishio Y., Hosokai Y., Hirayama K., Hasegawa T., Sugeno N., Suzuki K., Mori E., Takahashi S., Fukuda H., Itoyama Y. // Mov. Disord. 2011. V. 26. № 4. P. 621–628.
Daulatzai M.A. // J. Neural Transm. (Vienna). 2015. V. 122. № 10. P. 1475–1497.
El Amine F., Heidinger B., Cameron J.D., Hafizi K., BaniFatemi S., Robaey P., Vaillancourt R., Goldfield G.S., Doucet É. // Can. J. Physiol. Pharmacol. 2022. V. 100. № 5. P. 432–440.
Bang Y., Lim J., Choi H.J. // Arch. Pharm. Res. 2021. V. 44. № 6. P. 588–604.
Pas T., Asfalg M., Tolve M., Blaess S., Rothermel M., Wiesner R.J., Ricke K.M. // Mol. Neurobiol. 2020. V. 57. № 9. P. 3646–3657.
Chiu W.H., Carlsson T., Depboylu C., Höglinger G.U., Oertel W.H., Ries V. // Neuropharmacology. 2014. V. 79. P. 212–221.
Pellegrino R., Han P., Reither N., Hummel T. // Laryngoscope. 2019. V. 129. № 8. P. 1737–1743.
Knudsen K., Flensborg Damholdt M., Mouridsen K., Borghammer P. // Acta Neurol. Scand. 2015. V. 132. № 6. P. 395–400.
Boesveldt S., Parma V. // Cell Tissue Res. 2021. V. 383. № 1. P. 559–567.
White T.L., Sadikot A.F., Djordjevic J. // Brain Cogn. 2016. V. 104. P. 1–6.
Scangas G.A., Bleier B.S. // Am. J. Rhinol. Allergy. 2017. V. 31. № 1. P. 3–7.
Hüttenbrink K.B., Hummel T., Berg D., Gasser T., Hähner A. // Dtsch. Arztebl. Int. 2013. V. 110. № 1–2. P. 1–7. e1.
Ahmed A.K., Sayad. R., Mahmoud I.A., El-Monem A.M.A., Badry S.H., Ibrahim I.H., Hafez M.H., El-Mokhtar M.A., Sayed I.M. // J. Neurovirol. 2022. V. 28. № 2. P. 189–200.
Lerner D.K., Garvey K.L., Arrighi-Allisan A.E., Filimonov A., Filip P., Shah J., Tweel B., Del Signore A., Schaberg M., Colley P., Govindaraj S., Iloreta A.M. // Laryngoscope. 2022. V. 132. № 3. P. 633–639.
Rethinavel H.S., Ravichandran S., Radhakrishnan R.K., Kandasamy M. // J. Chem. Neuroanat. 2021. V. 115. P. 101965.
Ghosh R., Biswas U., Roy D., Pandit A., Lahiri D., Ray B.K., Benito-León J. // Mov. Disord. Clin. Pract. 2021. V. 8. № 5. P. 669–680.
Salari M., Harofteh B.Z., Etemadifar M., Sedaghat N., Nouri H. // Parkinsons Dis. 2021. V. 2021. P. 3227753.
Abouelkhair M.A. // Med. Hypotheses. 2020. V. 144. P. 110012.
Дополнительные материалы отсутствуют.


