Нейрохимия, 2023, T. 40, № 3, стр. 234-244
Длительный опыт агрессии изменяет экспрессию генов в гипоталамусе самцов мышей двух линий
А. А. Сапронова 1, П. Э. Кисаретова 1, 2, Р. Салман 1, 2, Н. П. Бондарь 1, 2
1 Институт цитологии и генетики СО РАН
Новосибирск, Россия
2 Новосибирский государственный исследовательский университет
Новосибирск, Россия
Поступила в редакцию 16.02.2023
После доработки 06.03.2023
Принята к публикации 07.03.2023
- EDN: YVELFX
- DOI: 10.31857/S1027813323030160
Аннотация
Повторный опыт агрессии может приводить к изменению нейрофизиологии и поведения животных и к формированию паталогической агрессии. Важную роль в механизмах адаптации к повторной агрессии играет гипоталамус и активируемая им ГГНС-ось. В данной работе исследовали влияние длительного (30 дней) опыта агрессии на экспрессию генов в гипоталамусе у самцов мышей двух линий – C57BL/6J и CD1. Мы оценили уровень экспрессии генов ГГНС-оси (Сrh, Crhr1, Crhbp, Fkbp5, Nr3c1), гена раннего ответа Fos и гена D1 рецептора дофамина Drd1. Длительный опыт агрессии привел к более продолжительной активации Fos у самцов линии С57BL/6J, хотя экспрессия других исследованных генов практически не изменилась. Агрессоры линии СD1 характеризуются снижением уровня экспрессии генов Crhr1 и Crhbp, продукты которых ингибируют секрецию кортикотропин-рилизинг гормона. Для большинства исследованных генов показаны межлинейные различия в уровне экспрессии, которые, вероятно, связаны с разным уровнем двигательной активности и тревожности мышей данных линий. Базальный уровень экспрессии гена Сrh был выше у мышей линии C57BL/6J, а генов Crhr1, Crhbp, Fkbp5, Fos и Drd1 – у мышей линии CD1. Таким образом, повторный опыт агрессии приводит к изменению уровня экспрессии генов в гипоталамусе самцов мышей в зависимости от генетических особенностей линии и связанных с этим психофизиологических характеристик особей.
ВВЕДЕНИЕ
Агрессивное поведение – это нападение или угроза нападения на особей своего же вида [1, 2]. Она может быть реактивной или проактивной, нормальной или патологической, преднамеренной или импульсивной [3, 4]. Предварительный опыт агрессии усиливает вероятность победы в последующих агонистических столкновениях. Подобный эффект, который еще называют “эффектом победителя” (winner effect) [5], был показан у разных видов животных [6, 7]. Дальнейшее приобретение опыта агрессии приводит к значительным изменениям в поведении, физиологии и нейрохимии животных [8–10]. Было показано, что повторный опыт агрессии приводит к повышению уровня тестостерона [7, 11], кортикостерона [12], а также к повышению уровня тревожности у самцов мышей [13]. Кроме того, длительный опыт агрессии приводит к активации дофаминергической системы головного мозга [14, 15]. У части животных длительный опыт агрессии может приводить к патологическим формам агрессии – например, нанесении увечий уже подчинившемуся самцу, согласному со своей ролью в иерархии или агрессии самцов против самок своего вида и детенышей [16, 17].
Была выдвинута гипотеза [18], что зависимость агрессивности от реактивности ГГНС-оси имеет U-образный вид, то есть низкая агрессивность коррелирует со средним уровнем реактивности ГГНС-оси, а при аномально низкой или высокой реактивности ГГНС агрессия будет повышена. Так, было показано, что у трех линий мышей, селектированных на повышенную агрессивность (SAL, NC900, ТА), реактивность ГГНС-оси была понижена [19, 20]. А линии крыс с контрастным уровнем активности ГГНС и контрастным уровнем тревожности имели одинаково высокий уровень агрессивности [21, 22], что подтверждает выдвинутую гипотезу.
Одним из центров контроля поведения, в котором сходятся нейронные пути, обрабатывающие внешние и внутренние сигналы, является гипоталамус [23]. В гипоталамусе находится один из центров принятия решения об атаке [24, 25], и одновременно гипоталамус является ключевым звеном в развитии гормональной стрессовой реакции [26].
Как активность ГГНС, так и проявление спонтанной агрессивности контролируются генетическими факторами, в связи с этим хорошо показаны межлинейные различия в агрессивности мышей [27, 28]. Показано что для мышей линии CD1 характерна высокая агрессивность относительно C57BL [29, 30]. Однако мыши линии CD1 более устойчивы к стрессу и демонстрируют сравнительно низкую тревожность в приподнятом крестообразном лабиринте по сравнению с мышами других линий [29, 31], и длительный опыт агрессии не приводит у них к повышению уровня тревожности, в отличии от мышей линии C57BL [32].
Целью нашей работы было оценить влияние длительного опыта агрессии на экспрессию генов гипоталамуса у линий мышей, отличающихся по тревожности и агрессивности (инбредная линия C57BL и аутбредная линия CD1). Для исследования нами были выбраны гены ГГНС-оси: ген кортикотропин-рилизинг гормона (КРГ) Сrh, ген рецептора КРГ Crhr1, ген белка, связывающего КРГ Crhbp, гены глюкокортикоидного рецептора (ГР) Nr3c1 и его ко-шаперона Fkbp5. Рецептор CRHR1 в гипоталамусе является частью петли обратной связи ГГНС, а белок СRHBP связывает КРГ, уменьшая количество КРГ, поступающее в гипофиз для активации ГГНС. Глюкокортикоидный рецептор в гипоталамусе, реагирующий на кортикостерон, необходим для окончания стрессовой реакции, а ко-шаперон FKBP51 снижает чувствительность ГР к стимуляции гормоном, увеличивая тем самым продолжительность стрессовой реакции. Также мы оценили экспрессию гена раннего ответа Fos, продукт которого является транскрипционным фактором, и экспрессия которого коррелирует с общей активностью экспрессии генов в нейронах, и экспрессию гена D1 рецептора дофамина Drd1, наиболее распространенного рецептора дофамина в мозге, так как дофамин связан с нейронным контуром агрессии
МЕТОДЫ
Животные. Эксперименты проводили на самцах мышей линий C57BL/6J и СD1 в возрасте 2.5–3 мес. Мыши содержались в стандартных условиях вивария Института цитологии и генетики СО РАН (RFMEFI62119X0023) (12:12 ч света/темноты, рассвет в 19:00, вода и корм ad libitum). После отсаживания от матерей в возрасте 1 мес. мышей содержали в группах по 8–10 особей в клетках 36 × 23 × 12 см до использования в эксперименте.
Формирование агрессивного типа поведения у самцов мышей. Для формирования агрессивного типа поведения у самцов мышей использовали модель сенсорного контакта [33]. Животных попарно помещали в экспериментальные клетки, разделенные пополам прозрачной перегородкой с отверстиями, позволявшей мышам видеть, слышать, воспринимать запахи друг друга, но предотвращавшей физическое взаимодействие. В течение 30 дней ежедневно во второй половине дня (15.00–17.00 ч) убирали перегородку на 10 мин, что приводило к межсамцовым конфронтациям. При проведении первых 2–3 дней тестов выявляли победителей (агрессоров), и особей, терпящих поражения (“жертв”) при взаимодействии с одним и тем же партнером. В дальнейшем к агрессору подсаживали незнакомую “жертву”. Взаимодействие самцов прекращали, если интенсивные атаки со стороны нападающей особи во время агрессивных столкновений длились более 2 мин, вновь устанавливая между ними перегородку. В качестве жертв использовались самцы линии C57BL/6J.
В качестве контроля использовали животных без опыта агрессивных взаимодействий, рассаженных в индивидуальные клетки за 5 дней до взятия материала. Контрольные мыши не подвергались никаким тестированиям. В группах было по 9–11 животных.
Анализ агрессивного поведения. Исследование поведения проводилось в экспериментальной клетке, где предварительно животные получали опыт агонистических столкновений. Из клетки убирали перегородку, разделяющую мышей, и у агрессивных самцов за 3 мин теста регистрировали следующие формы поведения: 1. прямая агрессия (атаки, укусы и преследование партнера); 2. агрессивный груминг: покусывание морды, загривка или спины побежденного партнера в течение продолжительного времени; побежденное животное при этом замирает и не сопротивляется; 3. неагрессивный контакт с партнером (обнюхивание, касание тела лапами); 4. нахождение в непосредственной близости от партнера (не более 2 см); 5. разбрасывание чужой подстилки на территории партнера (нарушение его гнезда и туалетного места); 6. вставание на задние лапы, отражает вертикальную двигательную активность и исследовательское поведение; 7. чистка тела – действия, направленные на поддержание чистоты тела (умывание, почeсывание); 8. вращение: быстрый резкий поворот на 180°; 9. враждебное поведение – сумма общего времени атак, агрессивного груминга и разбрасывания чужой подстилки, то есть поведения в той или иной мере наносящего вред партнеру; 10. суммарное время контакта с партнером – сумма общего времени, проведенного в контакте с партнером (атаки, агрессивный груминг, неагрессивный контакт с партнером).
Для каждой формы поведения фиксировали латентное время первого действия; общее время действия; число действий. Если животное не демонстрировало какое-либо поведение, то латентное время считалось равным 180 с (длительность теста) и все остальные параметры приравнивались к нулю.
Сбор тканей. На следующий день после последней агонистической конфронтации между 10 и 13 ч утра животные были забиты быстрой декапитацией, после чего были выделены и взвешены надпочечники. Для выделения гипоталамуса мозг целиком извлекали из черепной коробки, переворачивали на дорзальную сторону и с помощью лопатки и скальпеля отделяли гипоталамус, который визуально и структурно отличается от других тканей мозга. Далее гипоталамус помещали в пробирку и замораживали при –70°С.
Выделение РНК и ПЦР в реальном времени. Из замороженных образцов ткани в дальнейшем выделяли РНК с использованием PureZOL RNA Isolation Reagent (Bio-Rad, США) согласно протоколу производителя. Образцы были обработаны ДНКазой DNase I (Thermo Fisher Scientific, США) и затем очищены с помощью парамагнитных частиц RNAClean XP beads (Beckman Coulter, США). Измерение качества и количества выделенной РНК проводили с использованием спектрофотометра NanoDrop 2000. Для синтеза комплементарной ДНК использовали набор RevertAid (Thermo Fisher Scientific, США) со случайными гексаолигонуклеотидами, для ПЦР использовали наборы БиоМастер HS-qПЦР (ВioLabMix, Россия). В реакцию брали 0.5 мкг РНК, все процедуры проводили согласно протоколам производителя.
Для оценки экспрессии генов использовали ПЦР с детекцией в режиме реального времени с использованием флуоресцентно-меченых зондов. Мы оценили экспрессию генов Сrh, Crhr1, Crhbp, Fkbp5, Nr3c1, Drd1, Fos. Праймеры и зонды для каждого гена подбирали с использованием программы Primer-BLAST (NCBI). Последовательности праймеров и зондов представлены в табл. 1. Результаты по каждому целевому гену нормализовали на геометрическое среднее относительного количества референсных генов Hk1 и Gpm6b и анализировали с помощью ΔΔCt метода с использованием програмногообеспечения CFX Manager (Bio-Rad, США). Каждую реакцию проводили в двух повторах. Поскольку для референсных и таргетных генов использовали зонды с разными флюорофорами (Hk1 – Cy5, Gpm6b – HEX, таргетные гены – ROX), то измерение экспрессии таргетных и референсных генов проводили в одной лунке. Эффективность амплификации каждой пары праймеров составляла от 80 до 110%. Стабильность референсных генов между и внутри групп проверяли с помощью программного обеспечения Bio-Rad CFX Manager (Bio-Rad, США): стабильность экспрессии (М) была менее 0.5 и коэффициент вариации (CV) был менее 0.25.
Таблица 1.
Последовательности праймеров и зондов, использованных в работе
| Ген | Последовательность нуклеотидов | Последовательность 5' → 3' |
|---|---|---|
| Crh | Прямая (праймер) | GGAGAAGAGAGCGCCCCTAA |
| Обратная (праймер) | AAGAAATTCAAGGGCTGCGG | |
| Зонд | ROX-ATGCTGCTGGTGGCTCTGTCGTCC-BHQ2 | |
| Crhr1 | Прямая (праймер) | GGTCCTGCTGATCAACTTTA |
| Обратная (праймер) | ACATGTAGGTGATGCCCA | |
| Зонд | ROX-CTGGGGTGCCTTTCCC-BHQ2 | |
| Crhbp | Прямая (праймер) | TCCATACCAGCACCAAAACTG |
| Обратная (праймер) | CAGCTCCACAAAGTCACCAG | |
| Зонд | ROX-ACTGAAGGCCATGCAAGTGTCCGA-BHQ2 | |
| Fkbp5 | Прямая (праймер) | AGAATCAAACGGAAAGGCGAG |
| Обратная (праймер) | CTCGGCAATCAAATGTCCTTC | |
| Зонд | ROX-CCAAACGAAGGAGCAACGG-BHQ2 | |
| Nr3с1 | Прямая (праймер) | ATGTATGACCAATGTAAACACA |
| Обратная (праймер) | GCTCTTCAGACCTTCCTTAG | |
| Зонд | ROX-TGCAGGTATCCTATGAAGAG-BHQ2 | |
| Drd1a | Прямая (праймер) | GGAGAGCAGAGCGAGCG |
| Обратная (праймер) | GGTTCAGTGCTCCAGGTCG | |
| Зонд | ROX-AGCGTGGTCTCCCAGATC-BHQ2 | |
| Fos | Прямая (праймер) | CGGGTTTCAACGCCGACTA |
| Обратная (праймер) | TTGGCACTAGAGACGGACAGA | |
| Зонд | ROX-AGTCCTGTGTGTTGACAGG-BHQ2 | |
| Hk1 | Прямая (праймер) | ACATTGTCTCCTGCATCTCC |
| Обратная (праймер) | GCTTTGAATCCCTTTGTCCAC | |
| Зонд | Cy5-CCTTCTCGTTTCCCTGCAAG-BHQ2 | |
| Gpm6b | Прямая (праймер) | CAAGTGCAGTGAAAGAGCTG |
| Обратная (праймер) | TGTAGAACATAAACACTGGCAC | |
| Зонд | HEX-ACCTATGTGCTGGGAGTGGCCT-BHQ2 |
Статистическая обработка данных. Статистическую обработку данных по экспрессии проводили, используя двухфакторный дисперсионный анализ и Fisher’s LSD в качестве post hoc анализа. Параметры поведения анализировались с помощью Mann–Whitney U критерия. Различия между экспериментальными группами считались статистически значимыми при p < 0.05. Анализ данных производился с помощью пакета программ Statistica 8.0.
РЕЗУЛЬТАТЫ
Относительная масса надпочечников. Двухфакторный дисперсионный анализ ANOVA выявил достоверное влияние факторов линии [F(1.36) = 14.9, p = 0.0004] и опыта агрессии [F(1.36) = 8.8, p = = 0.005] на относительную массу надпочечников у мышей. Попарные сравнения между группами показали, что у мышей линии CD1 относительная масса надпочечников была ниже, чем у мышей линии C57BL (р = 0.007) (рис. 1).
Рис. 1.
Относительная масса надпочечников. Данные представлены как среднее ± ошибка среднего. Двухфакторный дисперсионный анализ с последующим сравнением с использованием критерия Fisher’s LSD, * p < 0.05. К – контрольная группа, А30 – мыши с опытом агрессии в течение 30 дней.
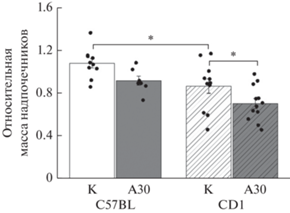
Длительный опыт агрессии привел к снижению относительной массы надпочечников по сравнению с контролем как у линии CD1 (р = 0.028), так и у линии C57BL, но на уровне тенденции (р = 0.06).
Параметры поведения агрессивных животных. Поведение агрессивных животных оценивалось по взаимодействию с подчиненным самцом линии С57BL, имеющим опыт длительный опыт поражения. Параметры поведения при агрессивном взаимодействии и в тесте “Перегородка” представлены в табл. 2. По большинству исследуемых параметров поведение агрессоров двух линий не различалось. Тест Манна–Уитни (Mann–Whitney U test) выявил повышенное число (p = 0.0012) и длительность (p = 0.031) разбрасывания чужой подстилки, а также число (p = 0.011) и длительность (p = 0.021) вставаний на задние лапы у агрессоров линии CD1 по сравнению с линией С57BL.
Таблица 2.
Поведение агрессоров двух линий в агрессивной конфронтации и в тесте “Перегородка”
| Параметры поведения | C57BL | CD1 | |
|---|---|---|---|
| Прямые атаки | Число | 3.6 ± 1.0 | 5.8 ± 1.8 |
| Время, с | 39.1 ± 12.1 | 28.2 ± 5.9 | |
| Лат. время, с | 85.7 ± 24.1 | 68.8 ± 21.1 | |
| % животных | 75 | 83 | |
| Агрессивный груминг | Число | 0.6 ± 0.4 | 0.3 ± 0.2 |
| Время, с | 6.2 ± 4.2 | 1.6 ± 1.2 | |
| % животных | 25 | 17 | |
| Контакт с партнером | Число | 5.9 ± 1.3 | 8.9 ± 1.6 |
| Время, с | 23.3 ± 9.2 | 17.4 ± 4.0 | |
| Нахождение рядом с партнером | Число | 13.3 ± 1.7 | 18.7 ± 1.7 |
| Время, с | 24.5 ± 4.1 | 27.9 ± 3.7 | |
| Разбрасывание чужой подстилки | Число | 2.6 ± 0.9 | 8.9 ± 1.0** |
| Время, с | 10.2 ± 4.1 | 22.9 ± 3.0* | |
| Вставание на задние лапы | Число | 5.8 ± 1.1 | 13.3 ± 1.9* |
| Время, с | 6.1 ± 2.0 | 13.6 ± 2.2* | |
| Чистка тела | Число | 2.0 ± 1.2 | 0.2 ± 0.1 |
| Время, с | 1.8 ± 1.1 | 0.4 ± 0.3 | |
| Вращения | Число | 0.4 ± 0.3 | 1.2 ± 0.3 |
| % животных | 25 | 67 | |
| Враждебное поведение | Время, с | 55.5 ± 8.8 | 52.7 ± 6.0 |
| Суммарное время контакта с партнером | Время, с | 93.2 ± 5.0 | 75.2 ± 7.8 |
| Перегородка | Число | 15.0 ± 0.9 | 16.1 ± 1.9 |
| Время, с | 112.8 ± 8.4 | 98.7 ± 11.6 | |
| Число животных | 8 | 12 | |
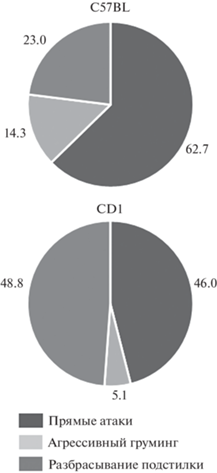
Несмотря на схожий уровень враждебного поведения, который включает в себя поведение, направленное на причинение вреда другой особи (прямые атаки, агрессивный груминг, разбрасывание чужой подстилки), структура враждебного поведения у агрессоров двух линий значительно отличается (рис. 2). Доля непрямой агрессии (разбрасывания чужой подстилки) преобладает в структуре враждебного поведения у агрессоров линии CD1, тогда как у линии C57BL преобладающей формой являются прямые атаки.
Рис. 2.
Структура враждебного поведения агрессоров линии C57BL и CD1. Данные представлены в процентах от общего времени враждебного поведения каждой линии мышей.
Уровень экспрессии генов в гипоталамусе. В данной работе мы оценили экспрессию семи генов в гипоталамусе у двух линий мышей (рис. 3). Двухфакторный дисперсионный анализ ANOVA выявил достоверное влияние линии мышей на экспрессию пяти генов: Crh [F(1.39) = 11.5, р = = 0.002], Crhr1 [F(1.39) = 12.9, р = 0.001], Crhbp [F(1.39) = 110.0, р < 0.001], Fkbp5 (F(1.39) = 10.3, р = 0.003], Drd1 [F(1.38) = 243.5, р < 0.001], и влияние на уровень экспрессии гена Nr3c1 на уровне тенденции [F(1.38) = 3.9, р = 0.057]. У мышей линии C57BL была ниже экспрессия генов Crhr1 (p < 0.001), Crhbp (p < 0.001), Fkbp5 (p = 0.005), Drd1 (p < 0.001) и выше экспрессия гена Crh (p = 0.047).
Рис. 3.
Относительный уровень экспрессии генов в гипоталамусе. Данные представлены как среднее ± ошибка среднего. Двухфакторный дисперсионный анализ с последующим сравнением с использованием критерия Fisher’s LSD, * p < 0.05. К – контрольная группа, А30 – мыши с опытом агрессии в течение 30 дней.
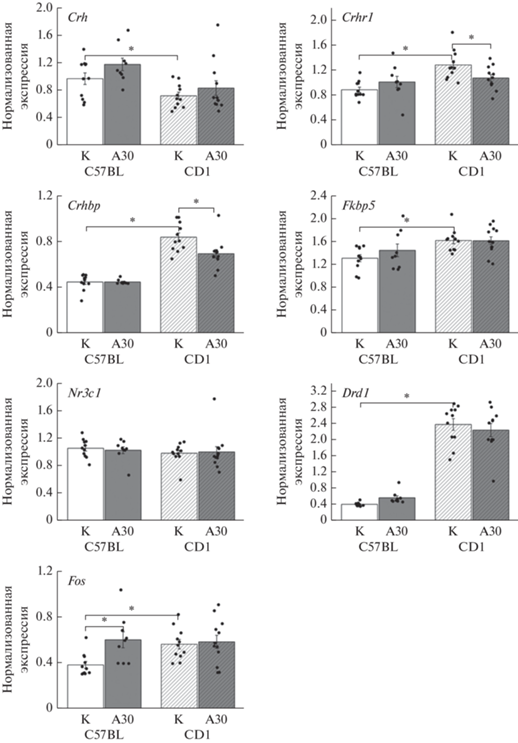
Двухфакторный дисперсионный анализ ANOVA выявил выраженное влияние длительного опыта агрессии на экспрессию только двух генов – Crhbp [F(1.39) = 5.6, р = 0.023] и Fos [F(1.39) = 5.6, р = = 0.023]. А для экспрессии генов Crhr1 [F(1.39) = 6.8, р = 0.013], Crhbp [F(1.39) = 5.6, р = 0.023] и на уровне тенденции для Fos [F(1.39) = 3.8, р = 0.057] было найдено взаимодействие факторов “линия” и “опыт агрессии”. Экспрессия гена Crhbp под влияние опыта агрессии снижалась у мышей линии CD1 (p = 0.002), и не изменялась у мышей линии C57BL. В таком же направлении было найдены изменения и для экспрессии гена Crhr1: снижение под влиянием опыта агрессии у мышей линии CD1 (p = 0.021), и отсутствие изменений у мышей линии C57BL. Экспрессия гена Fos, наоборот, была повышена только у агрессоров линии C57BL (p = 0.005) по сравнению с контролем, тогда как у мышей линии CD1 под влиянием опыта агрессии она не менялась.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Длительный повторный опыт агрессии значительно изменяет поведение, нейрохимию и физиологию особей [9, 10]. Ранее было показано, что для разных линий мышей последствия такого опыта могут быть различными. Так, для самцов мышей линии С57BL [8] и СВА/Lac [13] было показано формирование так называемой обученной агрессии, т.е. агрессии, которая проявляется без соответствующей провокации и характеризуется замещением прямых форм агрессии на непрямые. Уровень прямых атак снижается, хотя они полностью не прекращаются, а агрессоры в большей степени переключаются на проявление других форм враждебного поведения – агрессивный груминг, разбрасывание подстилки на территории партнера. Такие формы поведения сохраняются у обученных агрессоров даже при подсадке активного партнера [34]. При этом у других линий мышей длительный опыт агрессии может приводить к специфическими стереотипиям (гиперкинезам) (линия DBA/2) [35] или к гиперактивности и повышению исследовательской активности (линия CD1) [32].
Наше исследование показало, что при более продолжительном, чем ранее исследовали, опыте агрессии (в течение 30 дней) самцы мышей линий С57BL и CD1 продолжают проявлять прямые атаки на партнера, несмотря на проявление жертвами форм пассивной защиты (замирание при подходе агрессора и полная неподвижность), которые в норме подавляют проявление агрессии. Уровень прямых атак у агрессоров данных линий не отличается, также, как и общий уровень враждебного поведения (атаки, агрессивный груминг и разбрасывание чужой подстилки). Однако в структуре враждебного поведения можно видеть различия между линиями – у C57BL преобладают атаки (70%), тогда как у линии CD1 атаки и разбрасывание чужой подстилки составляет примерно равную долю (54 и 43% соответственно). Это может говорить о патологическом характере агрессии у линии C57BL, которая не подавляется ингибирующими стимулами и в меньшей мере, чем у линии CD1, замещается обученными формами поведения. Для самцов линии CD1, как и было показано ранее, характерны также более высокая исследовательская активность (вертикальные стойки) и общая гиперактивность.
В нашей работе у агрессоров обеих линий наблюдалось достоверное снижение относительной массы надпочечников. По данным литературы опыт агрессии в течение 21 дня приводит к повышению уровня кортикостерона [12]. Увеличение синтеза кортикостероидов при хроническом стрессе обычно приводит к гипертрофии надпочечников [36], однако у агрессивных животных было показано и отсутствие изменений в размере надпочечников при хроническом повышении уровня гормона в крови [9]. Причины снижения относительной массы надпочечников, выявленные в нашем эксперименте, требуют дополнительных исследований.
В нашей работе мы показали специфичные для каждой линии изменения экспрессии генов, связанные с длительным опытом агрессии, а также межлинейные различия в уровне экспрессии генов глюкокортикоидной системы в гипоталамусе.
Гипоталамус является важным звеном в проявлении агрессивного поведения, поскольку в нем расположена зона принятия решения об атаке (ЗПРА, hypothalamic attack area) [24], а кроме того, здесь же расположены паравентрикулярные ядра, которые являются ключевым звеном регуляции ответа на стресс, синтезируя КРГ. Показано, что электростимуляция ЗПРА, приводящая к проявлению атак, вызывает активацию и других зон гипоталамуса, в том числе и паравентрикулярных ядер [37]. Однако любое хроническое воздействие, как стресс, так и агрессия, часто приводит к патологическим изменениям ответа.
При агрессии активируется дофаминергическая система [14, 38], и длительный повторный опыт агрессии приводит к ее хронической активации [10, 15, 38]. Показано, что количество дофамина в гипоталамусе значительно повышается у крыс при агрессии [39]. Результаты исследований позволяют предположить, что дофамин провоцирует агрессию в том числе с помощью воздействия на ЗПРА [40].
Рецепторы дофамина делятся на две группы, в первую из которых попадают рецепторы D1 и D5, а во вторую D2, D3, D4. Наиболее распространенными являются рецепторы D1 подтипа. Рецепторы D1, в зависимости от региона мозга и функции несущих их нейронов, могут как снижать, так и повышать агрессию. Было показано, что активация рецепторов D1 в NAc связана с более агрессивным поведением [40], а у склонных к спонтанной агрессии мышей количество D1 рецепторов в коре уменьшается [41]. Часть серотонинергических нейронов дорсального ядра шва экспрессируют D1 рецепторы, и деактивация этих нейронов приводит к увеличению агрессии. Именно серотонинергические нейроны с D1 рецепторами являются частью нейронного контура агрессии и ведут в NAc, гиппокамп и ЗПРА [40]. Для мышей линии C57BL показано снижение чувствительности к блокатору D1 рецепторов при длительном опыте агрессии [42], то есть, вероятно, развивается десенситизация этих рецепторов при повышенной активности дофаминергической системы у агрессоров. Однако, несмотря на важную роль D1 рецептора в проявлении агрессии, в нашем эксперименте мы не выявили изменений в уровне экспрессии гена D1 рецептора Drd1 у обеих линий мышей. Интересно, что в аналогичной модели у агрессоров линии C57BL с опытом агрессии в течение 20 дней также не находят изменений в уровне экспрессии D1 рецепторов в гиппокампе, стриатуме и вентральной области покрышки [43, 44]. Это говорит о сложной роли D1 рецепторов и неоднозначной регуляции экспрессии данного гена в проявлении агрессивного поведения.
В нашей работе мы показали, что опыт агрессии повышает (на уровне тенденции) уровень экспрессии Crh, причем у обоих линий мышей направление изменений одинаковое, хоть и не достигает статистической значимости. Количество секретируемого КРГ, поступающего дальше в гипофиз, модулируется продуктами генов Crhr1 и Crhbp: в гипоталамусе рецепторы CRHR1 являются частью петли отрицательной обратной связи [45], а белок CRHBP связывает КРГ, снижая этим количество поступающего в гипофиз гормона [46]. Мы показали, что уровень экспрессии генов Crhr1 и Crhbp снижается при длительном опыте агрессии, однако только у агрессоров линии CD1. Таким образом, это может указывать на адаптацию мышей линии CD1 к повторяющейся агрессии: некоторое увеличение уровня КРГ в совокупности со снижением уровня ингибиторов секреции КРГ может приводить к увеличению уровня доступности КРГ и усилению вызываемых им реакций.
Уровень экспрессии гена глюкокортикоидного рецептора (ГР), Nr3c1, главного регулятора отрицательной обратной связи в гипоталамусе, не изменялся у агрессоров обеих линий. Можно предположить, что основные изменения при агрессии, влияющие на активность ГР, происходят не на транскрипционном уровне, а на уровне посттрансляционных механизмов, изменяющих его функциональное состояние [47]. Еще одним вариантом может быть развивающаяся у агрессоров резистентность к повышенному уровню активации ГГНС, что не приводит к ее подавлению через активацию системы отрицательной обратной связи. В пользу последнего свидетельствует и отсутствие изменений в уровне экспрессии гена Fkbp5, кодирующего ко-шаперон ГР, белок FKBP51, который участвует в удержании ГР в цитоплазме, и регулирует, соответственно, уровень неактивного рецептора [48, 49]. В других работах по оценке уровня ГР у агрессивных животных также не находят изменения на уровне экспрессии гена ни в гипоталамусе у крыс с повышенной агрессией [50], ни в гиппокампе у крыс, селектированных на повышенную агрессивность [20], ни даже в уровне белка ГР в разных структурах мозга [51].
Для мышей линии C57BL мы показали увеличение уровня экспрессии гена Fos у агрессивных животных. Продукт гена раннего ответа Fos является транскрипционным фактором, который коррелирует с активностью экспрессии генов в нейронах и используется как маркер активности нейронов, в том числе при исследовании агрессивного поведения [40]. Было показано, что через 2 ч после однократного агрессивного взаимодействия у крыс происходит активация Fos практически во всех структурах мозга [52]. У агрессоров линии CD1 с опытом агрессии в течении 10 дней было показано увеличение уровня Fos в прилежащих ядрах через час после агрессивного взаимодействия [53]. В нашей работе через 24 ч после последней агрессивной конфронтации уровень экспрессии гена Fos в гипоталамусе остается повышенным только у агрессоров линии C57BL, тогда как у линии CD1 он снижается до уровня контроля, что свидетельствует о более длительной активации гипоталамуса у мышей линии C57BL.
Таким образом, несмотря на схожий уровень проявления агрессии, последствия такого длительного опыта на уровне активации экспрессии генов в гипоталамусе для двух линий различаются. Для C57BL характерна более продолжительная активация Fos, хотя экспрессия других исследованных генов практически не изменена. Агрессоры линии CD1 характеризуются повышением уровня биодоступного КРГ через снижение синтеза ингибиторов его секреции.
В нашей работе были показаны межлинейные различия в уровне экспрессии генов в гипоталамусе. Такие различия были найдены для большинства из исследованных генов (5 из 7). Линия CD1 характеризуется более высоким уровнем экспрессии Crhr1, Crhbp, Fkbp5, Drd1 и более низким – гена Crh. Самым выраженным различием между линиями является втрое увеличенная экспрессия гена Drd1. Согласно результатам нашего исследования, экспрессия гена Drd1 не связана с агрессией. Однако в гипоталамусе существуют популяции дофаминергических нейронов, связанных не только с агрессией, но и с другими физиологическими функциями. Нейроны высвобождают дофамин за пределы гипоталамуса и регулируют секрецию пролактина [54], пищевое поведение [55], циркадианные ритмы [56]. Поэтому повышенная экспрессия D1 рецепторов у линии CD1 может быть связана и с различиями в других физиологических функциях. Кроме того, известно, что более высокая активность дофаминергической системы связана с повышенной двигательной активностью [57]. Хотя нет достоверных данных о участии гипоталамуса в регуляции спонтанной двигательной активности, повышенное количество D1 рецепторов может быть связано с общей повышенной активностью дофаминергической системы у линии CD1. Двигательная активность у мышей линии CD1 выше, чем у линии C57BL, что показано как в тесте открытого поля [32], так и в нашем эксперименте, по более частым вертикальным стойкам и числу вращений.
Кроме уровня экспрессии D1 рецептора, между линиями значимо различалась активность КРГ – более низкая экспрессия Crh у мышей линии CD1 сопровождалась более высокой экспрессией Crhr1 и Crhbp, что суммарно должно приводить к снижению доступного КРГ и, соответственно, снижению реактивности ГГНС. Эти данные подтверждаются более низким уровнем тревожности у мышей линии CD1 по сравнению с линией C57BL [58, 59].
ЗАКЛЮЧЕНИЕ
Наши данные показывают, что, несмотря на схожий уровень прямой агрессии, структура враждебного поведения у самцов мышей линии С57BL и линии СD1 различается. Проявление агрессивного поведения у мышей линии С57BL носит больше патологический характер. Возможно с этим связана и разница в последствиях длительного опыта агрессии на уровень экспрессии генов в гипоталамусе. Для агрессоров линии С57BL характерна более продолжительная активация Fos, хотя экспрессия других исследованных генов практически не изменена. Агрессоры линии СD1 характеризуются повышением уровня биодоступного КРГ, через снижение синтеза ингибиторов его секреции. Для большинства исследованных генов показаны межлинейные различия в уровне экспрессии, которые, вероятно, связаны с разным уровнем двигательной активности и тревожности. Таким образом, последствия длительного опыта агрессии на структуру агрессивного поведения и уровень активности генов в гипоталамусе зависит от генетических особенностей линии и связанных с этим психофизиологических характеристик особей.
Список литературы
Лоренц К. // Агрессия (так называемое “зло”). СПб: Амфора, 2001. P. 349 p.
Moyer K.E. // Violence and Aggression. N.Y.: Paragon House, 1987. P. 237 p.
Barratt E.S., Stanford M.S., Kent T.A.,Felthous A. // Biol. Psychiatry. 1997. V. 41. № 10. P. 1045–1061.
Bushman B.J., Anderson C.A. // Psychological Review. 2001. V. 108. N. 1. P. 273–279.
Dugatkin L.A. // Behavioral Ecology. 1997. V. 8. № 6. P. 583–587.
Hsu Y., Wolf L.L. // Anim. Behav. 1999. V. 57. № 4. P. 903–910.
Oyegbile T.O., Marler C.A. // Horm. Behav. 2005. V. 48. № 3. P. 259–267.
Kudryavtseva N.N., Bondar N.P., Alekseyenko O.V. // Aggressive Behavior. 2000. V. 26. № 5. P. 386–400.
Bartolomucci A., Pederzani T., Sacerdote P., Panerai A.E., Parmigiani S., Palanza P. // Psychoneuroendocrinology. 2004. V. 29. № 7. P. 899–910.
Kudryavtseva N.N. // Aggress. Violent Behav. 2020. V. 52. № P. 101403.
Chase I.D., Bartolomeo C., Dugatkin L.A. // Anim. Behav. 1994. V. 48. № P. 393–400.
Bartolomucci A., Palanza P., Gaspani L., Limiroli E., Panerai A.E., Ceresini G., Poli M.D., Parmigiani S. // Physiol. Behav. 2001. V. 73. № 3. P. 401–410.
Kudryavtseva N.N., Bondar N.P., Avgustinovich D.F. // Behav. Brain Res. 2002. V. 133. № 1. P. 83–93.
Van Erp A.M., Miczek K.A. // J. Neurosci. 2000. V. 20. № 24. P. 9320–9325.
Bondar N.P., Boyarskikh U.A., Kovalenko I.L., Filipenko M.L., Kudryavtseva N.N. // PLoS One. 2009. V. 4. № 1. P. e4190.
Haller J., Kruk M.R. // Neurosci. Biobehav. Rev. 2006. V. 30. № 3. P. 292–303.
Natarajan D., de Vries H., Saaltink D.J., de Boer S.F., Koolhaas J.M. // Behav. Genet. 2009. V. 39. № 1. P. 73–90.
Walker S.E., Papilloud A., Huzard D.,Sandi C. // Neurosci. Biobehav. Rev. 2018. V. 91. № P. 138–152.
Caramaschi D., de Boer S.F., de Vries H.,Koolhaas J.M. // Behav. Brain Res. 2008. V. 189. № 2. P. 263–272.
Veenema A.H., Meijer O.C., De Kloet E.R., Koolhaas J.M., Bohus B.G. // Horm. Behav. 2003. V. 43. № 1. P. 197–204.
Beiderbeck D.I., Reber S.O., Havasi A., Bredewold R., Veenema A.H., Neumann I.D. // Psychoneuroendocrinology. 2012. V. 37. № 12. P. 1969–1980.
Neumann I.D., Veenema A.H., Beiderbeck D.I. // Front. Behav. Neurosci. 2010. V. 4. № P. 12.
Toth M., Fuzesi T., Halasz J., Tulogdi A., Haller J. // Behav. Brain Res. 2010. V. 215. № 1. P. 7–20.
Lin D., Boyle M.P., Dollar P., Lee H., Lein E.S., Perona P., Anderson D.J. // Nature. 2011. V. 470. № 7333. P. 221–226.
Hrabovszky E., Halasz J., Meelis W., Kruk M.R., Liposits Z., Haller J. // Neuroscience. 2005. V. 133. № 3. P. 657–666.
Inda C., Armando N.G., Dos Santos Claro P.A., Silberstein S. // Endocrine Connections. 2017. V. 6. № 6. P. R99–R120.
de Boer S.F., van der Vegt B.J., Koolhaas J.M. // Behav. Genet. 2003. V. 33. № 5. P. 485–501.
Miczek K.A., Maxson S.C., Fish E.W., Faccidomo S. // Behav. Brain Res. 2001. V. 125. № 1–2. P. 167–181.
Parmigiani S., Palanza P., Rogers J., Ferrari P.F. // Neurosci. Biobehav. Rev. 1999. V. 23. № 7. P. 957–969.
Hsieh L.S., Wen J.H., Miyares L., Lombroso P.J., Bordey A. // Neurosci. Lett. 2017. V. 637. P. 142–147.
Ducottet C., Belzung C. // Behav. Brain Res. 2005. V. 156. № 1. P. 153–162.
Kovalenko I.L., Smagin D.A., Galyamina A.G., Kudryavtseva N.N. // Journal of Behavioral and Brain Science. 2015. V. 5. № 11. P. 478–490
Kudryavtseva N.N., Smagin D.A., Kovalenko I.L., Vishnivetskaya G.B. // Nat. Protoc. 2014. V. 9. № 11. P. 2705–2717.
Бондарь Н.П., Кудрявцева Н.Н. // Журн. высш. нерв. деят. им. И.П. Павлова. 2005. V. 55. № 3. P. 378–384.
Вишнивецкая Г.Б., Августинович Д.Ф., Кудрявцева Н.Н. // Журн. высш. нерв. деят. им. И.П. Павлова. 2013. V. 63. № 2. P. 235–245.
Herman J.P., Adams D., Prewitt C. // Neuroendocrino-logy. 1995. V. 61. № 2. P. 180–190.
Halasz J., Liposits Z., Meelis W., Kruk M.R., Haller J. // Neuroreport. 2002. V. 13. № 10. P. 1267–1270.
Ferrari P.F., van Erp A.M., Tornatzky W.,Miczek K.A. // Eur. J. Neurosci. 2003. V. 17. № 2. P. 371–378.
Barr G.A., Sharpless N.S., Gibbons J.L. // Brain Res. 1979. V. 166. № 1. P. 211–216.
Aleyasin H., Flanigan M.E., Russo S.J. // Curr. Opin. Neurobiol. 2018. V. 49. № P. 184–191.
Felippe R.M., Oliveira G.M., Barbosa R.S., Esteves B.D., Gonzaga B.M.S., Horita S.I.M., Garzoni L.R., Beghini D.G., Araujo-Jorge T.C., Fragoso V.M.S. // Frontiers in Cellular Neuroscience. 2021. V. 15. P. 696834.
Бондарь Н.П., Кудрявцева Н.Н. // Рос. физиол. журн. им. И.М. Сеченова. 2003. V. 89. № 8. P. 992–1000.
Смагин Д.А., Галямина А.Г., Коваленко И.Л., Бабенко В.Н., Тамкович Н.В., Борисов С.А., Толстикова Т.Г., Кудрявцева Н.Н. // Журн. высш. нерв. деят. им. И.П. Павлова. 2018. V. 68. № 2. P. 227–249.
Babenko V.N., Galyamina A.G., Rogozin I.B., Smagin D.A., Kudryavtseva N.N. // BMC Neurosci. 2020. V. 21. № 1. P. 12.
Preil J., Muller M.B., Gesing A., Reul J.M., Sillaber I., van Gaalen M.M., Landgrebe J., Holsboer F., Stenzel-Poore M., Wurst W. // Endocrinology. 2001. V. 142. № 11. P. 4946–4955.
Ketchesin K.D., Stinnett G.S., Seasholtz A.F. // Stress. 2017. V. 20. № 5. P. 449–464.
Merkulov V.M., Merkulova T.I., Bondar N.P. // Biochemistry (Mosc.). 2017. V. 82. № 3. P. 351–365.
Меркулов В.М., Климова Н.В., Меркулова Т.И. // Вавиловский журнал генетики и селекции. 2015. V. 19. № 3. P. 255–263
Pratt W.B., Galigniana M.D., Morishima Y., Murphy P.J. // Essays in Biochemistry. 2004. V. 40. № P. 41–58.
Walker S.E., Zanoletti O., Guillot de Suduiraut I., Sandi C. // Psychoneuroendocrinology. 2017. V. 84. № P. 1–10.
Scotti M.A., Rendon N.M., Greives T.J., Romeo R.D., Demas G.E. // Journal of Experimental Zoology. Part A, Ecological Genetics and Physiology. 2015. V. 323. № 5. P. 331–341.
Halasz J., Liposits Z., Kruk M.R.,Haller J. // Eur. J. Neurosci. 2002. V. 15. № 3. P. 561–569.
Golden S.A., Jin M., Heins C., Venniro M., Michaelides M., Shaham Y. // J. Neurosci. 2019. V. 39. № 13. P. 2482–2496.
Stagkourakis S., Kim H., Lyons D.J.,Broberger C. // Cell Rep. 2016. V. 15. № 4. P. 735–747.
Chadwick S.R., Guler A.D. // iScience. 2022. V. 25. № 7. P. 104605.
Romanov R.A., Zeisel A., Bakker J., Girach F., Hellysaz A., Tomer R., Alpar A., Mulder J., Clotman F., Keimpema E., Hsueh B., Crow A.K., Martens H., Schwindling C., Calvigioni D., Bains J.S., Mate Z., Szabo G., Yanagawa Y., Zhang M.D., Rendeiro A., Farlik M., Uhlen M., Wulff P., Bock C., Broberger C., Deisseroth K., Hokfelt T., Linnarsson S., Horvath T.L., Harkany T. // Nat. Neurosci. 2017. V. 20. № 2. P. 176–188.
Beninger R.J. // Brain Res. 1983. V. 287. № 2. P. 173–196.
Michalikova S., van Rensburg R., Chazot P.L., Ennaceur A. // Behav. Brain Res. 2010. V. 207. № 2. P. 402–417.
Benatti C., Alboni S., Montanari C., Caggia F., Tascedda F., Brunello N., Blom J.M. // Behav. Brain Res. 2011. V. 224. № 1. P. 23–34.
Дополнительные материалы отсутствуют.


