Нейрохимия, 2023, T. 40, № 3, стр. 257-264
Различия в изменениях активности системы глутамат/ГАМК в сетчатке крыс при старении и развитии ретинопатии в ночное время и днем
Д. В. Телегина 1, А. К. Антоненко 1, Н. Г. Колосова 1
1 Институт цитологии и генетики СО РАН
Новосибирск, Россия
Поступила в редакцию 27.01.2023
После доработки 16.03.2023
Принята к публикации 20.03.2023
- EDN: YVFQVJ
- DOI: 10.31857/S1027813323030172
Аннотация
Возраст – ведущий фактор риска развития возрастной макулярной дегенерации (ВМД), которая становится основной причиной потери зрения людьми старше 60 лет. Эффективных способов терапии этого комплексного нейродегенеративного заболевания нет, что обусловлено неполнотой знаний его этиологии и патогенеза. Предполагается, что изменения в сетчатке с возрастом баланса нейромедиаторных систем – глутамата и ГАМК, их десинхроноз, могут быть предпосылкой развития и вносить вклад в прогрессию ВМД. Однако информация об их состоянии в сетчатке при старении, и тем более при развитии ВМД, крайне ограничена. Ранее мы оценили в сетчатке крыс Wistar и преждевременно стареющих крыс OXYS, у которых развивается ВМД-подобная патология, изменения с возрастом в системе глутамат/ГАМК в дневное время. В настоящей работе мы оценили изменения уровней ферментов синтеза и распада, субъединиц рецепторов и транспортеров этих нейромедиаторов с возрастом в ночное время и сравнили их с выявленными ранее в дневные часы. Выявлены различия в изменениях с возрастом экспрессии компонентов глутамат и ГАМК-ергической систем в ночное время и днем при “здоровом” старении крыс Wistar и при преждевременном – крыс OXYS, связанные, можно полагать, с нарушениями у последних циркадного ритма. Установлено, что прогрессия ВМД-подобной ретинопатии у крыс OXYS происходит на фоне изменений глутаматергической системы в ночное время – повышения уровня глутаминсентатазы, r1 субъединицы рецептора NMDA и снижения уровня транспортера глутамата GLAST, – которые могут способствовать развитию нейродегенеративных изменений в сетчатке. Выраженных изменений ГАМК-ергической системы, которые могли бы вносить заметный вклад в развитие патологического процесса в сетчатке, не выявлено.
ПРИНЯТЫЕ СОКРАЩЕНИЯ
ВМД – возрастная макулярная дегенерация
РПЭ – ретинальный пигментный эпителий
СХЯ – супрахиазматическое ядро
AMPA – рецептор α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты
GABAAr1 – субъединица r1 ГАМК-рецептора, также известная как GluA1
GABA-T – ГАМК-трансаминаза
GAD67 – изоформа глутамат декарбоксилазы
GAPDH – глицеральдегид-3-фосфатдегидрогеназа
GAT1 – транспортер ГАМК 1
GLAST – глутамат-аспартатный транспортер
NMDAr1– субъединица r1 N-метил-D-аспартатного рецептора
ВВЕДЕНИЕ
Возрастная макулярная дегенерация (ВМД) – комплексное нейродегенеративное заболевание сетчатки, которое становится основной причиной потери зрения людьми в возрасте старше 60 лет [1]. Ожидается, что на фоне увеличения продолжительности жизни и постарения населения планеты, к 2040 г. число людей, страдающих ВМД, достигнет 300 млн человек, что приведет к существенными социально-экономическими последствиями [2]. Возраст – основной фактор риска ВМД, в основе патогенеза которой лежат связанные со старением структурно-функциональные изменения сетчатки. Молекулярно-генетические предпосылки и механизмы их перехода в патологический процесс остаются неясными, что приводит к тому, что эффективных методов профилактики и лечения ВМД не существует. Предполагается, что изменения в сетчатке с возрастом баланса нейромедиаторных систем – глутамата и ГАМК, их десинхроноз, могут быть предпосылкой развития ВМД и вносить существенный вклад в ее прогрессию [3]. Однако информация об изменениях этих нейромедиаторных систем в сетчатке при старении, и тем более на разных стадиях развития ВМД, крайне ограничена.
Одной из важнейших функций сетчатки является регуляция цикла сна-бодрствования. Сетчатке принадлежит роль ключевого сенсора циркадной системы организма – она опосредует синхронизацию с 24-часовым циклом (фоторегулировку), активируя светочувствительные клетки. Соответственно, для сетчатки характерен ярко выраженный циркадный ритм многих систем, в том числе – нейромедиаторных. В сетчатке, как и в других регионах ЦНС, глутамат – наиболее распространенный возбуждающий нейротрансмиттер. При этом он является биохимическим предшественником наиболее распространенного тормозного нейромедиатора – гамма-аминомасляной кислоты (ГАМК) [4]. В сетчатке глутамат и ГАМК не только регулируют зрительный цикл [5], но и опосредуют фоторегулировку и передачу сигнала в вышележащие отделы мозга. Большинство исследований циркадных ритмов этих нейромедиаторов сосредоточено в основном на изучении супрахиазматического ядра гипоталамуса – главного генератора циркадных ритмов у млекопитающих, в то время как данные об изменениях системы ГАМК/глутамат в сетчатке в течение суток при старении практически отсутствуют. Ранее мы провели сравнение изменений с возрастом дневного уровня компонентов системы ГАМК/глутамат в сетчатке крыс Wistar и преждевременно стареющих крыс OXYS, у которых развивается ретинопатия, по клиническим и морфологическим признакам аналогичная “сухой”, или атрофической форме ВМД у людей [6]. Как показали наши исследования, у крыс OXYS патологическим изменениям подвержены все структурные компоненты сетчатки: сосуды (хориоидальные и интраретинальные) [7], мембрана Бруха, фоторецепторы, ганглионарные нейроны [8], интернейроны и РПЭ [9]. Уже к возрасту ~3–4 мес. у 100% крыс OXYS развиваются клинические проявления ретинопатии [10]. С возрастом патологические изменения нарастают и сопровождаются гибелью фоторецепторов, нарушением аутофагии и активным глиозом [7, 9, 11 ]. В настоящем исследовании мы оценили в сетчатке крыс Wistar и OXYS изменения глутаматергической и ГАМК-ергической системы с возрастом и при развитии ВМД-подобной патологии в ночное время и сравнили их с выявленными ранее в дневной период.
МАТЕРИАЛЫ И МЕТОДЫ
Животные. В работе использовались крысы-самцы линий Wistar (контроль) и OXYS возрастов 20 дней, 3 и 18 мес. (всего 36 животных), соответственно, в период, когда клинические проявления ретинопатии у крыс OXYS отсутствуют, в период их активной манифестации и прогрессии. Животные были получены из центра коллективного пользования “Генофонды лабораторных животных” Института цитологии и генетики СО РАН. Крыс содержали в стандартных условиях вивария (4–5 самцов в одной пластиковой клетке, наполнитель – опилки) в фиксированном режиме освещенности (цикл 10 ч свет/14 ч темнота, свет включался в 8 ч утра). Животные имели свободный доступ к стандартному гранулированному корму (ПК-120-1; ООО “Лабораторснаб”, Москва, Россия) и воде.
Забор и хранение образцов. Забор образцов проводили с 2 до 4 ч ночи при обязательном условии – отсутствии световых волн короче 650–660 нм (красный спектр). Крыс усыпляли смесью углекислого газа, декапитировали, а затем извлекали глаза и помещали их на охлажденную чашку Петри. Глаза очищали от всех посторонних тканей, затем разрезали стерильными инструментами по линии лимба. После удаления передней части глаза и стекловидного тела с внутренней поверхности задней части склеры забирали сетчатку вместе с сосудистой оболочкой и пигментным эпителием. Ткань помещали в пластиковые пробирки и замораживали в жидком азоте. Образцы хранили при температуре –70°C до момента использования.
Вестерн-блот анализ. Все стадии Вестерн-блот анализа проводили по стандартному протоколу. Белки (30 мкг на дорожку) разделяли с помощью электрофореза на 8%-ном ДСН-ПААГ в Трис-глициновом буфере с pH 8.3 при комнатной температуре, затем переносили на нитроцеллюлозные мембраны. После блокирования в течение 2 ч раствором 5% БСА (№ SLBJ8588V; Sigma-Aldrich, США) в PBS, содержащем 0.1% Твин 20 (PBST), каждую мембрану инкубировали в течение 16 часов с первичными антителами (концентрация 1 : 1000) при температуре 4°C. В работе использованы следующие антитела: против глутаминазы (A0A0G2K1T0, UniProt), глутаминсинтетазы (P15104, UniProt), NMDAr1 (P35439, UniProt), AMPA (P19490, UniProt), GAD67 (Q99259-1, UniProt), GABA-T (P80404, UniProt), GABAAr1 (P62813, UniProt), GAT1 (P23978, UniProt ), GAPDH (P46406, UniProt) и GLAST (P24942, UniProt) (антитела № ab93434, ab64613, ab109182, ab183797, ab26116, ab152134, ab33299, ab426, ab8245, Abcam, США и № PA5-19709, ThermoFisher, США, соответственно).
Далее проводили инкубацию мембран с соответствующими вторичными антителами (ab97051 и ab6808, Abcam, США) в растворе PBST (1 : 5000) в течение 1 ч при комнатной температуре, после чего мембрану обрабатывали SuperSignal West Femto Maximum Sensitivity Substrate (Thermo Fisher Scientific Inc., США) в соответствии с инструкциями производителя.
Детекцию флуоресценции проводили с помощью системы ChemiDoc (ChemiDoc™ MP Imaging System (12003154), Bio-Rad, США). Интенсивность свечения оценивалась с помощью программы ImageJ (NIH, США). Полученные относительные значения концентраций исследуемых белков нормировались на относительные значения концентраций белка GAPDH.
Статистический анализ. Статистический анализ результатов проводили с помощью программы Statistica 13.0. Нормальность распределения проверяли по критерию Шапиро–Уилка. Использовали дисперсионный ANOVA-анализ с последующим сравнением групповых средних по критерию Ньюмана–Кейлса. Как независимые факторы рассматривали “генотип” и “возраст”. Данные представлены как “среднее ± стандартное отклонение”. Результаты считали статистически значимыми при р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изменения ферментов, транспортеров и рецепторов глутамата в ночное время. Глутаматергическая передача сигналов имеет решающее значение для восприятия света и регуляции циркадных ритмов. Глутамат является основным возбуждающим нейротрансмиттером ретино-гипоталамического тракта, с помощью которого световые сигналы от сетчатки передаются главным циркадным часам в супрахиазматических ядрах гипоталамуса [12]. Показано, что эндогенная секреция глутамата в сетчатке подвержена выраженным суточным колебаниям – она возрастает в дневное время и снижается в ночное [13]. В ЦНС суточным колебаниям подвержены также рецепторы, ферменты и транспортеры глутамата [14, 15]. Ранее мы показали, что в дневное время на поздней стадии ВМД-подобной ретинопатии в сетчатке 18-месячных крыс OXYS уровень белка глутаминазы (катализирует превращение глутамина в глутамат) выше, а уровень глутаминсинтетазы (катализирует обратную реакцию, превращение глутамата в глутамин) ниже, чем у одновозрастных крыс Wistar. Такие изменения указывают на то, что в сетчатке крыс OXYS на стадии активной прогрессии ретинопатии соотношение глутамин/глутамат смещено в пользу глутамата [6].
В настоящей работе мы оценили уровень белков глутаминазы и глутаминсинтетазы в сетчатке крыс в ночное время. Как показал ANOVA анализ, ночной уровень белка глутаминсинтетазы, зависел от возраста (F2,28 = 4.41, p < 0.05), и на него не влиял генотип животных (F1,28 = 2.00, р = 0.17). При этом только у крыс OXYS уровень глутаминсинтетазы в возрасте 18 мес. был достоверно выше, чем в 3 мес. (p < 0.05), и достоверно не изменялся с возрастом у крыс Wistar. На ночной уровень белка глутаминазы не влияли ни возраст, не генотип крыс (рис. 1).
Рис. 1.
Уровни белков глутаминазы, глутаминсинтетазы, GLAST, NMDAr1 и GluA1 в сетчатке крыс OXYS и Wistar в ночное время. Данные представлены как среднее ± стандартное отклонение; * р < 0.05 для межлинейных и межвозрастных различий. n = 4–6 животных в группе. Условные обозначения: W – Wistar, OX – OXYS.
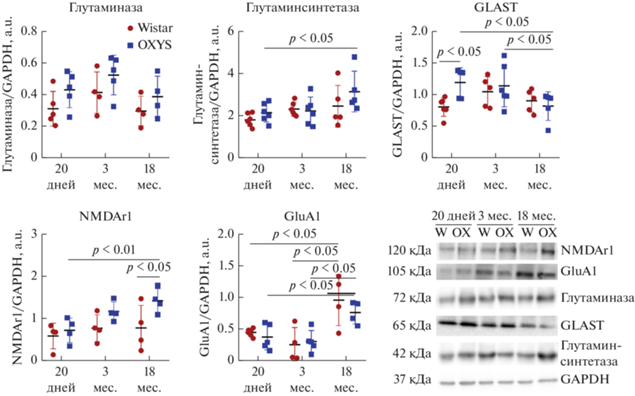
Таким образом, в ночное время, в отличие от дневного, в сетчатке крыс OXYS уровень глутаминсинтетазы повышался с возраста 3 до 18 мес. При этом уровень глутаминазы с возрастом достоверно не изменялся у крыс обеих линий.
Далее мы исследовали в сетчатке крыс Wistar и OXYS разного возраста ночной уровень ионотропных рецепторов глутамата NMDA и AMPA-типа, ответственных за быструю нейротрансмиссию. Известно, что NMDA рецепторам принадлежит ключевая роль в регуляцию циркадных ритмов [16], а рецепторы AMPA также вносят вклад в световые и циркадные реакции организма [17]. Так, у мышей с нокаутом гена GluA1 (Gria1–/–) проявлялись различные циркадные аномалии, в том числе смещенные, фрагментированные и более изменчивые паттерны отдыха–активности [18].
В настоящем исследовании мы проанализировали содержание в сетчатке животных разного возраста субъединицу GluA1 рецептора AMPA и субъединицу NR1 рецептора NMDA (NMDAr1; также известна как GluN1). Как показал факторный ANOVA анализ, на ночной уровень белка NMDAr1 влияли факторы “генотип” (F1,24 = 7.82, p < 0.05) и “возраст” (F2,24 = 3.59, p < 0.05). Однако с возрастом уровень NMDAr1 изменялся только у крыс OXYS – в возрасте 18 мес. он был достоверно выше, чем в 20 дней (p < 0.01). Достоверные различия между линиями обнаружены в возрасте 18 мес.: уровень NMDAr1 у крыс OXYS в ночное время был достоверно выше, чем у крыс Wistar (рис. 2). Уровень белка GluA1 в ночное время не зависел от генотипа животных (F1,28 = 0.7285, p > > 0.05), но на него влиял возраст (F2,28 = 15.44, p < < 0.001): к 18 мес. уровень GluA1 увеличивался в сетчатке у крыс обеих линий (p < 0.05) (рис. 1).
Рис. 2.
Уровни белков GAD67, GABA-T, GAT1 и GABAAr1 в сетчатке крыс OXYS и Wistar в ночное время. Данные представлены как среднее ± стандартное отклонение; * р < 0.05 для межлинейных и межвозрастных различий. n = 4–6 животных в группе. Условные обозначения: W – Wistar, OX – OXYS.
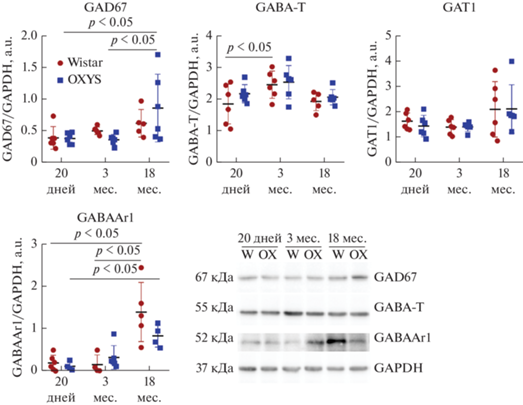
Таким образом, тенденция изменений уровня рецептора NMDAr1 у крыс OXYS в ночное время отличается от выявленной в дневное: как мы показали ранее, дневной уровень белка NMDAr1 в сетчатке крыс OXYS был таким же, как у крыс Wistar, и не изменялся с возрастом [6]. Ранее было показано, что экспрессия рецептора NMDA в различных отделах мозга подвержена суточным колебаниям [14]. Выявленное нами увеличение с возрастом ночного уровня NMDAr1 у крыс OXYS, можно полагать, указывает на сглаживание суточной динамики экспрессии этого белка на поздних стадиях ВМД-подобной патологии. Характер изменений с возрастом уровня GluA1 в ночное время в сетчатке крыс обеих линий отличался от такового в дневные часы [6]. Повышение уровня GluA1 скорее всего связано с возрастзависимым изменением циркадных ритмов [19, 20].
Важно отметить, что сигнальный каскад рецепторов NMDA способен опосредовать как эксайтотоксические эффекты глутамата [21], так и запускать нейропротекторные механизмы [3]. Важную роль в определении направленности эффектов глутамата играет локализация и субъединичный состав рецепторов. Так, активация внесинаптических рецепторов NMDA может инициировать дегенеративные каскады, тогда как активация синаптических рецепторов NMDA приводит к запуску нейропротекторных механизмов [22]. Таким образом, увеличение уровня белка NMDAr1 в сетчатке крыс OXYS с возрастом в ночное время может быть связано как с запуском эксайтотоксичности, так и с активацией компенсаторных механизмов в сетчатке.
Важным фактором, определяющим доступность глутамата для сигнальных процессов, является система его обратного захвата и рециркуляции, которая необходима для поддержания низких, нетоксичных концентраций этого нейромедиатора. Клетки Мюллера регулируют концентрацию внеклеточного глутамата в сетчатке с помощью высокоаффинных электрогенных транспортеров, основным из них является переносчик глутамата-аспартата GLAST [23], который также подвержен суточным ритмам [15].
В этой работе анализ результатов исследования уровня транспортера GLAST в сетчатке в ночное время выявил некоторое влияние на него фактора “возраст” – на уровне тенденции (F2,32 = = 2.57, p = 0.09). Также на уровне тенденции факторы “возраст” и “генотип” взаимодействовали (F2,32 = 2.72, p = 0.08). К возрасту 18 мес. в сетчатке крыс OXYS наблюдалось достоверное снижение уровня белка GLAST (p < 0.05 по сравнению с возрастами 20 дней и 3 мес.). В сетчатке крыс Wistar этот показатель с возрастом не менялся. Достоверные межлинейные различия выявлены только в сетчатке 20-дневных животных – у крыс OXYS уровень белка GLAST был выше, чем у крыс Wistar (p < 0.05) (рис. 2). Примечательно, что в дневное время уровень транспортера глутамата GLAST в сетчатке крыс OXYS снижался по мере развития ВМД-подобной ретинопатии [6]. Мы полагаем, что различия в тенденциях изменений уровня GLAST в дневное и ночное время указывают на нарушение суточных колебаний экспрессии этого транспортера у крыс OXYS на стадии активной прогрессии ретинопатии и связаны с развитием реактивного глиоза, характерного для поздних стадий ВМД [9]. Глиоз приводит к рестрикции отростков, которая, в свою очередь, также влияет на обратный захват глутамата астроцитами [24, 25]. Так, показано, что при рестрикции отростков астроцитов обратный захват глутамата из синатический щели менее эффективен из-за увеличения расстояния между окончаниями астроцитов и нейронов, что приводит к повышению внеклеточной концентрации глутамата [26].
Исследование возрастных изменений ГАМК-ергической системы в сетчатке крыс Wistar и OXYS в ночное время. ГАМК является основным тормозным нейромедиатором в ЦНС, уровень которого, как и глутамата, подвержен циркадным колебаниям во всех исследованных отдела мозга. Так, в исследовании на крысах показано, что для ГАМК и некоторых компонентов ГАМК-ергической системы характерно повышение в ночное время и снижение в дневное в СХЯ, гипоталамусе и мосте [14]. В сетчатке хомячков Jaliffa и соавторы [27] также выявили достоверное увеличение уровня ГАМК ночью и снижение днем, тогда как у крыс, по данным [13], при наличии аналогичных суточных колебаний достоверных различий уровня ГАМК выявлено не было. Ранее при оценке уровня белков ГАМК-ергической системы (GAD67, GABA-T и GAT1) в сетчатке крыс OXYS и Wistar разного возраста в дневное время мы выявили их повышение к возрасту 3 мес. и снижение – к возрасту 18 мес. [6]. При этом содержание белка рецептора ГАМК A альфа 1 (GABAAr1) было у крыс OXYS ниже, чем у Wistar, наиболее существенными различия были выявлены в сетчатке 18-месячных крыс OXYS с выраженными проявлениями ретинопатии [6].
В настоящей работе проведено исследование этих параметров в ночное время суток, которое выявило сходную тенденцию изменений с возрастом ферментов, катализирующих синтез (GAD67) и распад (GABA-T) ГАМК: анализ ANOVA выявил влияние фактора “возраст” (F2,35 = 6.55, p < 0.01 для 16GAD67 и F2,35 = 5.24, p < 0.05 для GABA-T), при этом фактор “генотип” не влиял на уровень этих белков. Уровень фермента GAD67 повышался к возрасту 18 мес. у крыс обеих линий, но только у крыс OXYS различия между его уровнем в возрасте 3 и 18 мес. были достоверными (p < 0.05). Уровень фермента GABA-T в ночное время достоверно изменялся с возрастом только в сетчатке крыс Wistar – повышался к возрасту 3 мес. (p < 0.05) и оставался на этом уровне в 18 мес. Содержание транспортера GAT1 (удаляет ГАМК из синаптической щели) в ночное время с возрастом не изменялось и не зависело от генотипа животных. Содержание в ночное время в сетчатке белка GABAAr1 – ионотропного рецептора и лиганд-управляемого ионного канала – изменялось с возрастом (F2,28 = 20.33, p < 0.001) – к 18 мес. его уровень достоверно увеличивался у крыс обеих линий (p < 0.05). При этом межлинейных различий в содержании GABAAr1 выявлено не было (рис. 2).
Таким образом, как и в случае с компонентами глутаматергической системы, мы наблюдаем различия в тенденциях изменений с возрастом дневного и ночного уровней компонентов ГАМК-ергической системы в сетчатке крыс, что, скорее всего, связано с суточной динамикой изменения экспрессии и активности. Стоит также отметить, что в ночное время не обнаружено достоверных различий уровня исследуемых белков между линиями, а в дневное время выявлены достоверные различия лишь в уровне рецептора GABAAr1. Результаты подтверждают гипотезу о том, что развитие ВМД-подобной ретинопатии сопровождается изменениями компонентов в основном в глутаматергической системе и эти изменения связаны с нарушением циркадного ритма, характерного для крыс OXYS (табл. 1).
Таблица 1.
Сравнение изменений с возрастом уровня исследованных белков системы ГАМК/глутамат в сетчатке крыс Wistar и OXYS в дневное из [6] и ночное время. Условные обозначения: NA – нет различий, UP – повышение уровня; DOWN – понижение уровня
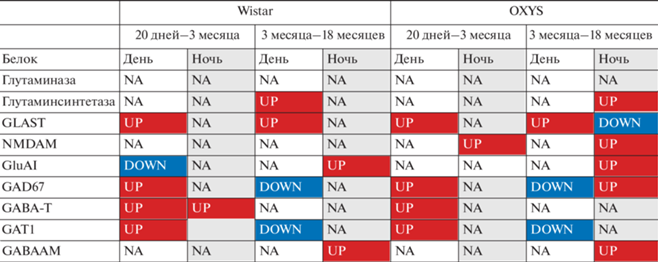
Таким образом, мы показали, что динамика изменений с возрастом исследованных параметров системы глутамат/ГАМК в ночные часы отличается от таковой в дневные – исследованной нами ранее [6]. В табл. 1 приведены обобщенные результаты сравнения направленности изменений. Как видим, с возраста 20 дней до 3 мес. в сетчатке крыс обеих линий изменился – вырос – ночной уровень только одного параметра – GABA‑T – у крыс Wistar и NMDAr1 – у OXYS. При этом у крыс обеих линий однонаправленно изменился дневной уровень четырех из девяти исследованных параметров (GLAST, GAD67, GABA‑T и GAT1), и только у крыс Wistar снизился уровень GluA1. В возрасте 18 мес. как у крыс Wistar, так и у OXYS дневной уровень GAD67 и GAT1 был ниже, а уровень GLAST – выше, чем в возрасте 3 мес., и только у крыс Wistar вырос уровень глутаминсинтетазы. При этом в ночное время у крыс выявлено изменение только двух параметров – увеличение уровня GluA1 и GABAAr1. У крыс OXYS с возраста 3 до 18 мес. ночной уровень GluA1 и GABAAr1 также вырос, но при этом также увеличилось содержание глутаминсинтетазы, NMDAr1 и GAD67 и снизилось – GLAST. Таким образом, наиболее существенно в сетчатке крыс OXYS изменялись c возрастом и отличались от крыс компоненты глутаматергической системы.
Выявленные нами различия в тенденции изменений с возрастом компонентов глутамат и ГАМК-ергических систем в ночное время по сравнению с дневным, можно полагать, связаны с нарушениями циркадного ритма у крыс OXYS. В пользу такого предположения свидетельствуют полученные нами ранее результаты исследования суточных ритмов основного регулятора циркадных ритмов мелатонина, содержание которого в плазме крови крыс OXYS, начиная с возраста 3 мес., не различался в дневное и ночное время [28]. Следует отметить, что нарушения циркадных ритмов, в том числе цикла выработки мелатонина, были выявлены непосредственно в сетчатке пациентов с ВМД [29].
ЗАКЛЮЧЕНИЕ
Сбалансированное взаимодействие медиаторных систем глутамата и ГАМК контролирует многие процессы в ЦНС, а их дисбаланс может способствовать развитию нейродегенеративных заболеваний, в том числе в сетчатке. Информация об изменениях содержания ферментов синтеза и распада глутамата и ГАМК в сетчатке при старении и развитии ВМД крайне ограничена. Проведено исследование изменений содержания этих ферментов в сетчатке с возрастом, выявлены отличия его изменений в ночное время и днем при “здоровом” старении крыс Wistar и при преждевременном – крыс OXYS, у которых развивается ВМД-подобная ретинопатия. Установлено, что прогрессия ВМД-подобной ретинопатии у крыс OXYS происходит на фоне изменений глутаматергической системы в ночное время – повышение уровня глутаминсентатазы, r1 субъединицы рецептора NMDA и снижение уровня транспортера глутамата GLAST – которые могут способствовать развитию нейродегенеративных изменений в сетчатке. В то же время у крыс OXYS не выявлено выраженных изменений ГАМК-ергической системы, которые могли бы вносить заметный вклад в развитие патологического процесса в сетчатке.
Список литературы
García-Layana A., Cabrera-López F., García-Arumí J., Arias-Barquet L., Ruiz-Moreno J.M. // Clin. Interv in Aging. 2017. V. 12. P. 1579–1587.
Mitchell P., Liew G., Gopinath B., Wong T.Y. // Lancet. 2018. V. 392. P. 1147–1159.
Boccuni I., Fairless R. // Life. 2022. V. 12. P. 638.
Armada-Moreira A., Gomes J.I., Pina C.C., Savchak O.K., Gonçalves-Ribeiro J., Rei N., Pinto S., Morais T.P., Martins R.S., Ribeiro F.F., Sebastião A.M., Crunelli V., Vaz S.H. // Front. Cell Neurosci. V. 14. P. 90.
Salesse C. // Journal Francais D’ophtalmologie. 2017. V. 40. P. 239–250.
Telegina D.V., Antonenko A.K., Fursova A.Z., Kolosova N.G. // Biogerontology. 2022. V. 23. P. 571–585.
Kozhevnikova O.S., Fursova A.Z., Markovets A.M., Telegina D.V., Muraleva N.A., Kolosova N.G. // Advances in Gerontology. 2018. V. 31. № 3. P. 339–344.
Telegina D.V., Kozhevnikova O.S., Kolosova N.G. // Biochemistry (Moscow). 2018. V. 83. № 9. P. 1009–1017.
Telegina D.V., Kozhevnikova O.S., Bayborodin S.I., Kolosova N.G. // Scientific Reports. 2017. V. 7. № 1. P. 1–11.
Kolosova N.G., Kozhevnikova O.S., Muraleva N.A., Rudnitskaya E.A., Rumyantseva Y.V., Stefanova N.A., Telegina D.V., Tyumentsev M.A., Fursova A.Z. // Biochemistry (Moscow). 2022. V. 87. P. 1552–1562.
Kozhevnikova O.S., Telegina D.V., Tyumentsev M.A., Kolosova N.G. // International Journal of Molecular Sciences. 2019. V. 20. № 19. P. 4804.
Colwell C.S. // Nat. Rev. Neurosci. 2011. V. 12. P. 553–569.
Pozdeyev N.V., Doroshenko E.M., Lavrikova E.V., Etingof R.N. // J. Biol. Rhythms. 2000. V. 15 № 2. P. 112–121.
Estrada-Rojo F., Escobar C., Navarro L. // Revista mexicana de neurociencia. 2020. V. 21. № 1. P. 31–38.
Chi-Castañeda D., Ortega A. // Frontiers in Endocrinology. 2018. V. 9. P. 340.
Michel S., Itri J., Colwell C.S. // Journal of Neurophysiology. 2002. V. 88. № 2. P. 817–828.
Mizoro Y., Yamaguchi Y., Kitazawa R., Yamada H., Matsuo M., Fustin J.M., Doi M., Okamura H. // PLoS One. 2010. V. 5. № 6. e10951.
Ang G., Brown L.A., Tam S.K.E., Davies K.E., Foster R.G., Harrison P.J., Sprengel R., Vyazovskiy V.V., Oliver P.L., Bannerman D.M., Peirson S.N. // Translational Psychiatry. 2021. V. 11. № 1. P. 1–17.
Biello S.M., Bonsall D.R., Atkinson L.A., Molyneux P.C., Harrington M.E., Lall G.S. // Neurobiology of Aging. 2018. V. 66. P. 75–84.
Steponenaite A., Biello S.M., Lall G.S. // Aging (Albany NY). 2018. V. 10. № 11. P. 3065.
Wang R., Reddy P.H. // Journal of Alzheimer’s Disease. 2017. V. 57. № 4. P. 1041–1048.
Hardingham G.E., Bading H. // Nature Reviews Neuroscience. 2010. V. 11. № 10. P. 682–696.
Pfeiffer R.L., Marc R.E., Jones B.W. // Trends in Endocrinology & Metabolism. 2020. V. 31. № 4. P. 320–329.
Sun D., Jakobs T.C. // The Neuroscientist. 2012. V. 18. № 6. P. 567–588.
Brécier A., Li V.W., Smith C.S., Halievski K., Ghasemlou N. // Biological Reviews of the Cambridge Philosophical Society. 2022.
McCauley J.P., Petroccione M.A., D’Brant L.Y., Todd G.C., Affinnih N., Wisnoski J.J., Zahid S., Shree S., Sousa A.A., De Guzman R.M., Migliore R., Brazhe A., Leapman R.D., Khmaladze A., Semyanov A., Zuloaga D.G., Migliore M., Scimemi A. // Cell Reports. 2020. V. 33. № 2. P. 108255.
Jaliffa C.O., Saenz D., Resnik E., Keller Sarmiento M.I., Rosenstein R.E. // Brain Res. 2001. V. 912. P. 195–202.
Rudnitskaya E.A., Maksimova K.Y., Muraleva N.A., Logvinov S.V., Yanshole L.V., Kolosova N.G., Stefanova N.A. // Biogerontology. 2015. V. 16. № 3. P. 303–316.
Vallée A., Lecarpentier Y., Vallée R., Guillevin R., Vallée J.-N. // International Journal of Molecular Sciences. 2020. V. 21. № 3. P. 820.
Дополнительные материалы отсутствуют.


