Неорганические материалы, 2019, T. 55, № 1, стр. 52-61
Особенности структуры и оптических свойств MoО3, полученного в разных технологических условиях газотранспортного осажденияЭ. П. Домашевская, С. А. Ивков, Аль Хайлани Хасан Исмаил Дамбос, С. В. Рябцев
Э. П. Домашевская 1, *, С. А. Ивков 1, Аль Хайлани Хасан Исмаил Дамбос 1, С. В. Рябцев 1
1 Воронежский государственный университет
394006 Воронеж, Университетская пл., 1, Россия
* E-mail: ftt@phys.vsu.ru
Поступила в редакцию 12.04.2018
Аннотация
Образцы МоО3 получали вариацией технологических условий газотранспортного осаждения при двух различных температурах горячей зоны трубчатой печи (800 и 1100°С) и с различными добавками к основному газу-носителю аргону: О2, паров Н2О или газа N2O. Результаты рентгенографических, электронно-микроскопических и оптических исследований показали, что слоистая структура микрокристаллов и ширина запрещенной зоны МоО3 оказываются чувствительными не только к технологическим условиям газотранспортного осаждения (температуре синтеза и составу газотраспортной среды), но и к механическому воздействию в виде растирания. Под действием паров воды в газотраспортной среде при температуре синтеза 800°С в результате искажения кристаллической решетки внедренными молекулами Н2О МоО3 переходит из основной орторомбической α-фазы (Pbnm) в моноклинную фазу (P21/n) с уменьшением ширины запрещенной зоны от 2.85 до 2.68 эВ. При повышении температуры синтеза до 1100°С примеси водорода и кислорода из паров воды H2O или азота и кислорода из N2O не изменяют слоистую орторомбическую структуру микрокристаллов, но добавление N2O в газотранспортную среду уменьшает значение ширины запрещенной зоны до 2.51 эВ. При механическом воздействии в виде растирания в порошках из микрокристаллов МоО3, синтезированных при высокой температуре 1100°С с добавлением паров воды или N2O к газу-носителю аргону, наряду с основной стабильной орторомбической фазой Pbnm появляется моноклинная фаза P21/n. Микрокристаллы МоО3, синтезированные при температуре 800°С, оказываются более устойчивыми к механическим воздействиям и после растирания содержат одну исходную фазу: орторомбическую Pbnm в случае синтеза кристаллов в аргон-кислородной газотранспортной среде или моноклинную P21/n в случае добавления паров воды к основному газу-носителю аргону.
ВВЕДЕНИЕ
Триоксид молибдена MoO3 – фоточувствительный непрямозонный полупроводник n-типа [1, 2] с шириной запрещенной зоны от 2.9 до 3.15 эВ в монокристаллах [3, 4]. Его валентная полоса образуется 2pz-орбиталями кислорода [5, 6], тогда как зона проводимости образована перекрывающимся орбиталями Мо 4d и О 5s [6]. В стехиометрическом MoO3 были зарегистрированы три экситонных перехода с энергиями 3.7, 4.3 и 4.5 эВ [7].
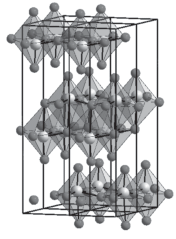
Основная модификация триоксида молибдена α-MoO3 имеет уникальную орторомбическую структуру, которая состоит из слоев молибден-кислородных искаженных октаэдров MoO6 (рис. 1): пр. гр. Pbnm, параметры элементарной ячейки – a = 3.697 Å, b = 13.864 Å и c = 3.963 Å) [7, 8].Область гомогенности фазы на основе МоО3 составляет МоО2.95–3.00.
Благодаря своему уникальному кристаллическому строению и связанным с ним свойствам этот оксид обладает большими потенциальными возможностями использования в различных областях твердотельной электроники. Из-за слоистой структуры и благодаря наличию в ней не только ионов Mo6+, но и Mo5+ данный оксид представляет интерес для использования в электрохимических устройствах и дисплеях. Наноразмерные слои оксида молибдена могут быть использованы при создании термодатчиков, сенсоров, информационных устройств с большим объемом памяти и др.
На основе электрохромного эффекта [9, 10] становится возможным создание устройств, которые, кроме визуализации электрических сигналов, могут быть использованы для управления интенсивностью световых потоков, для записи и регистрации информации светом или визуализации инфракрасного, ультрафиолетового и рентгеновского излучений.
При этом следует учитывать, что координационные октаэдры кристаллической структуры триоксида молибдена могут испытывать существенные искажения в результате внешних воздействий и легирования. Например, авторы [11–13] показали, что искажение кристаллической решетки в гидрированном MoO3, вызванное легированием водородом, может приводить к значительному уменьшению ширины запрещенной зоны.
На сегодняшний день известно довольно много методов получения триоксида молибдена MoO3 с вариацией технологических режимов, среди которых метод химического осаждения из паровой фазы, золь–гель-метод, гидротермальный синтез, сольвотермальный синтез, термическое испарение и др. [14, 15]. Все вышеперечисленные технологии позволяют вырастить нано- и микрокристаллы оксидов молибдена разной морфологии. Однако основным методом получения различных наноструктур МоО3 является метод химического осаждения из паровой фазы (CVD) с конденсацией паров [16].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Химическое осаждение из паровой фазы (CVD) MoO3. Суть данного метода состоит в том, что конечный продукт образуется на подложке-мишени, находящейся в наименее нагретой зоне, в результате взаимодействия газообразных веществ-прекурсоров в горячей зоне или термолиза пара вещества-прекурсора. Химическая чистота продукта, осажденного из газовой фазы, существенно выше, чем при использовании других методов, в том числе и золь–гель-технологии, т.к. вещества, используемые в качестве прекурсоров, очищаются от примесей при переходе в газовую фазу. Обычно весь процесс протекает в кварцевой трубе, вставленной в трубчатую печь. Температура испарения источников, давление системы, используемые газы-носители, а также геометрия системы могут существенно влиять на свойства полученных наноструктур.
В процессе газотранспортного осаждения были получены 4 партии образцов в различных технологических условиях, а именно: с различными добавками (О2, пары Н2О или газ N2O) к основному газу-носителю аргону (Аг) и при различных температурах горячей зоны трубчатой печи – 800 или 1100°С, в которую помещалась пластина металлического молибдена. Оксид молибдена, образующийся на пластине молибдена, испаряется в горячей зоне и переносится в холодную зону, где и осаждается на подложке и стенках кварцевой трубы по ходу газа-носителя. В нашем случае реакция получения триоксида молибдена описывается следующими уравнениями при нормальном атмосферном давлении:
(1)
${\text{Mo}} + {{{\text{А г }}} \mathord{\left/ {\vphantom {{{\text{А г }}} {{{{\text{О }}}_{{\text{2}}}}}}} \right. \kern-0em} {{{{\text{О }}}_{{\text{2}}}}}} \to {\text{Mo}}{{{\text{О }}}_{3}},$(2)
$\begin{gathered} {\text{Mo}} + {{{\text{А г }}} \mathord{\left/ {\vphantom {{{\text{А г }}} {{{{\text{N}}}_{{\text{2}}}}{\text{O}}}}} \right. \kern-0em} {{{{\text{N}}}_{{\text{2}}}}{\text{O}}}}\,\,\,{\text{и л и }}\,\,\,{{{\text{А г }}} \mathord{\left/ {\vphantom {{{\text{А г }}} {{{{\text{Н }}}_{{\text{2}}}}{{{\text{О }}}_{{{\text{п а р ы }}}}}}}} \right. \kern-0em} {{{{\text{Н }}}_{{\text{2}}}}{{{\text{О }}}_{{{\text{п а р ы }}}}}}} \to \\ \to \,\,{\text{Mo}}{{{\text{О }}}_{3}}\left( {{\text{д о п и р о в а н н ы й }}} \right). \\ \end{gathered} $Список исследованных образцов с обозначением условий их получения приведен в табл. 1.
Таблица 1.
Перечень образцов МоО3, полученных в разных технологических условиях газотранспортного осаждения (CVD)
| Образец | Добавка к газу-носителю Ar и температура получения образцов, °С |
|---|---|
| 1 | O2, 800 |
| 2 | H2O, 800 |
| 3 | H2O, 1100 |
| 4 | N2O, 1100 |
Рентгенофазовый анализ (РФА) полученных образцов проводили на дифрактометре ДРОН-4 с СoKα-излучением в режиме пошагового сканирования.
Морфологию поверхности образцов исследовали на сканирующем электронном микроскопе (СЭМ) JXA-840 ЦКП НО ВГУ.
Спектры диффузного отражения образцов получены на спектрофотометре SHIMADZU UV-210A в спектральном диапазоне 300–900 нм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
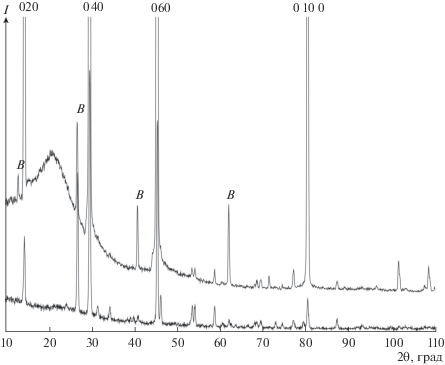
РФА образцов MоО3, полученных газотранспортным осаждением в различных технологических условиях. На рис. 2 приведена дифрактограмма исходного образца 1, полученного с добавлением кислорода к газу-носителю аргону при температуре горячей зоны реактора 800°С. В табл. 2 представлены значения межплоскостных расстояний d (Å) и относительных интенсивностей дифракционных линий этого образца MoO3 в сравнении с соответствующими значениями из Международной базы данных (МБД) (Card 2012 (00-005-0508)) [17] для орторомбического MoO3 с параметрами элементарной ячейки a = 3.962 Å, b = 13.858 Å, c = = 3.697 Å и пр. гр. Pbnm. Перераспределение интенсивностей дифракционных линий образца по сравнению с поликристаллическим образцом МБД свидетельствует о преимущественной ориентации его микрокристаллов в направлении [010].
Рис. 2.
Дифрактограммы образца 1 из табл. 1: верхняя дифрактограмма от исходного образца, нижняя – от того же растертого образца (В – СоКβ-линии).
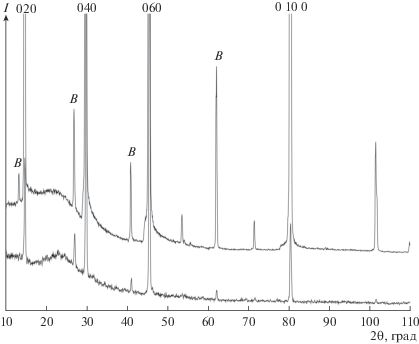
Таблица 2.
Межплоскостные расстояния d и относительные интенсивности дифракционных линий образца MoO3, полученного с добавлением кислорода к газу-носителю аргону при температуре 800°С
| 2θ, град | d, Å | I, % | d, Å | I, % | h k l |
|---|---|---|---|---|---|
| образец 1 | орторомбический MoO3 PDF Card 2012 (00-005-0508) [17] | ||||
| 13.350 | 7.7007 | 0.72 | – | – | – |
| 14.700 | 6.9968 | 38.22 | 6.9300 | 34 | 0 2 0 |
| 26.950 | 3.8413 | 2.11 | 3.8100 | 82 | 1 1 0 |
| 29.850 | 3.4754 | 100.00 | 3.4630 | 61 | 0 4 0 |
| 3.2600 | 100 | 0 2 1 | |||
| 40.950 | 2.5589 | 1.67 | 2.5270 | 12 | 0 4 1 |
| 45.550 | 2.3123 | 99.90 | 2.3090 | 31 | 0 6 0 |
| 53.600 | 1.9853 | 0.59 | 1.9820 | 13 | 2 0 0 |
| 62.150 | 1.7342 | 3.87 | 1.7330 | 17 | 2 1 1 |
| 71.500 | 1.5321 | 0.62 | 1.5040 | 5 | 2 6 0 |
| 80.450 | 1.3861 | 36.43 | 1.3860 | 5 | 0 10 0 |
| 101.500 | 1.1559 | 2.32 | – | – | – |
На рис. 3 и в табл. 3 приведены дифрактограмма и данные РФА для образца 2, полученного с добавлением паров воды при температуре 800°С. Эти данные отличаются от предыдущих (рис. 2, табл. 2) появлением большого числа дополнительных менее интенсивных линий. Сравнение с данными Card 2012 (00-005-1513) [18] для моноклинной фазы триоксида молибдена MoO3〈H2O〉, содержащей связанные молекулы воды (P21/n, параметры элементарной ячейки a = 10.606 Å, b = = 13.822 Å, c = 10.606 Å, α = γ = 90°, β = 91.62°), указывает на совпадение основных отражений. Из этого можно заключить, что встраивание молекул H2O из паров воды в кристаллическую решетку MoO3 при температуре 800°С приводит к формированию моноклинной модификации триоксида молибдена [18].
Таблица 3.
Межплоскостные расстояния d и относительные интенсивности дифракционных линий образца MoO3 + H2O, полученного с добавлением паров воды H2O к газу-носителю аргону при температуре 800° С, и моноклинного MoO3〈H2O〉 [18]
| 2θ, град | d, Å | I, % | d, Å | I, отн. ед. | h k l |
|---|---|---|---|---|---|
| образец 2 | моноклинный MoO3〈H2O〉 PDF Card 2012 (01-007-1513) [18] | ||||
| 12.300 | 8.3552 | 0.26 | 8.3468 | 1 | 1 1 0 |
| 12.600 | 8.1570 | 0.27 | – | – | – |
| 13.350 | 7.7007 | 0.77 | 7.5578 | 67 | $\bar {1}$ 0 1 |
| 14.100 | 7.2930 | 0.33 | 7.3470 | 59 | 1 0 1 |
| 14.750 | 6.9732 | 30.78 | 6.9110 | 999 | 0 2 0 |
| 15.800 | 6.5125 | 0.69 | 6.6312 | 157 | $\bar {1}$ 1 1 |
| 17.350 | 5.9345 | 0.74 | 5.7895 | 3 | 0 2 1 |
| 18.550 | 5.5537 | 0.96 | 5.7680 | 3 | 1 2 0 |
| 19.250 | 5.3535 | 1.09 | 5.3008 | 1 | 0 0 2 |
| 20.150 | 5.1167 | 1.23 | 5.1001 | 46 | $\bar {1}$ 2 1 |
| 20.750 | 4.9703 | 1.37 | 5.0339 | 45 | 1 2 1 |
| 21.050 | 4.9003 | 1.35 | – | – | – |
| 21.300 | 4.8434 | 1.34 | 4.8963 | 199 | 2 1 0 |
| 22.550 | 4.5781 | 1.16 | 4.5211 | 1 | $\bar {1}$ 1 2 |
| 23.750 | 4.3499 | 0.85 | 4.4298 | 1 | 1 1 2 |
| 27.000 | 3.8343 | 2.08 | 3.8730 | 3 | 1 2 2 |
| 29.850 | 3.4754 | 100.00 | 3.4555 | m | 2 3 0 |
| 31.900 | 3.2573 | 0.11 | 3.2809 | m | $\bar {1}$ 1 3 |
| 34.550 | 3.0142 | 0.08 | 3.0099 | 72 | $\bar {3}$ 2 1 |
| 38.500 | 2.7150 | 0.08 | 2.7162 | 5 | $\bar {3}$ 2 2 |
| 39.900 | 2.6234 | 0.08 | 2.6179 | 70 | 4 0 0 |
| 41.000 | 2.5559 | 1.46 | 2.5500 | 1 | $\bar {2}$ 4 2 |
| 45.550 | 2.3123 | 92.53 | 2.3036 | 86m | 0 6 0 |
| 51.050 | 2.0773 | 0.08 | 2.0867 | m | 4 4 0 |
| 53.600 | 1.9853 | 0.21 | 1.9801 | 16m | 1 2 5 |
| 54.300 | 1.9616 | 0.22 | 1.9669 | m | $\bar {2}$ 6 2 |
| 58.900 | 1.8206 | 0.31 | 1.8225 | m | $\bar {4}$ 2 4 |
| 62.150 | 1.7342 | 1.87 | 1.7387 | m | $\bar {1}$ 1 6 |
| 80.450 | 1.3861 | 13.26 | – | – | – |
| 101.550 | 1.1555 | 0.70 | – | – | – |
| 108.500 | 1.1029 | 0.57 | – | – | – |
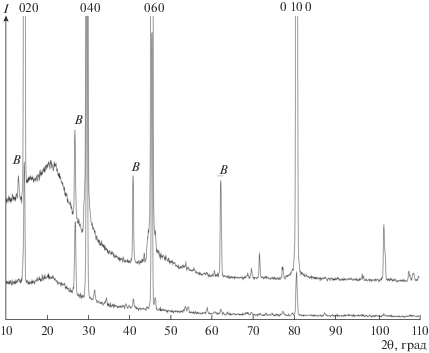
Дифрактограмма образца МоО3, полученного с добавками паров воды к газу-носителю аргону при 1100°С (образец 3), приведена на рис. 4. В табл. 4 представлены значения межплоскостных расстояний d (Å) и относительных интенсивностей дифракционных линий полученного образца в сравнении с данными МБД [17], в соответствии с которыми он имеет орторомбическую структуру с пр. гр. Pbnm, которую мы наблюдали в образце 1. Из этого факта следует, что при температуре синтеза 1100°C исчезают условия, необходимые для связывания молекул Н2О со слоистой кристаллической структурой триоксида молибдена и влияние ионов водорода и кислорода малого размера, источником которых служат пары воды, не приводит к заметным искажениям основной орторомбической модификации кристаллической решетки α-MoO3.
Таблица 4.
Межплоскостные расстояния d и относительные интенсивности дифракционных линий образца MoO3, полученного с добавлением паров воды H2O к газу-носителю аргону при температуре 1100°С, и орторомбического MoO3 [17]
| 2θ, град | d, Å | I, % | d, Å | I, % | h k l |
|---|---|---|---|---|---|
| образец 3 | орторомбический MoO3 PDF Card 2012 (00-005-0508) [17] | ||||
| 13.350 | 7.7007 | 0.61 | – | – | – |
| 14.800 | 6.9498 | 31.32 | 6.9300 | 34 | 0 2 0 |
| 21.100 | 4.8888 | 0.97 | – | – | – |
| 27.000 | 3.8343 | 1.73 | 3.8100 | 82 | 1 1 0 |
| 29.900 | 3.4697 | 100.00 | 3.4630 | 61 | 0 4 0 |
| 3.2600 | 100 | 0 2 1 | |||
| 41.000 | 2.5559 | 1.79 | 2.5270 | 12 | 0 4 1 |
| 45.550 | 2.3123 | 98.44 | 2.3090 | 31 | 0 6 0 |
| 62.150 | 1.7342 | 1.97 | 1.7330 | 17 | 2 1 1 |
| 69.550 | 1.5694 | 0.22 | 1.5690 | 16 | 0 8 1 |
| 71.500 | 1.5321 | 0.51 | 1.5040 | 5 | 2 6 0 |
| 77.000 | 1.4379 | 0.26 | 1.4350 | 12 | 1 9 0 |
| 80.450 | 1.3861 | 24.23 | 1.3860 | 5 | 0 10 0 |
| 101.500 | 1.1559 | 1.16 | – | – | – |
| 107.550 | 1.1096 | 0.20 | – | – | – |
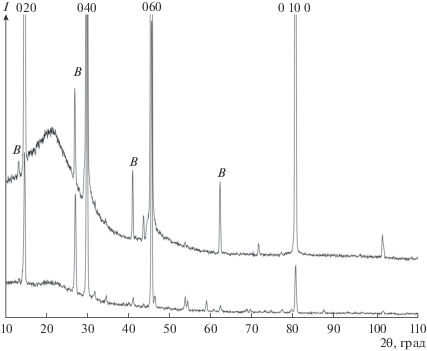
Подобные результаты мы получили и при добавлении N2O к газу-носителю аргону. На дифрактограмме образца 4, полученного при той же высокой температуре 1100°С, но с добавками газа N2О вместо паров воды, приведенной на рис. 5, как и в табл. 5, появляются все те же дифракционные линии орторомбической модификации с пр. гр. Pbnm, что и в образце 3, полученном при той же температуре 1100°С с парами воды в газе-носителе. Это свидетельствует о том, что наличие N2О в газотранспортной среде при высокой температуре также не приводит к существенным искажениям основной орторомбической модификации кристаллической решетки α-MoO3.
Таблица 5.
Ширина запрещенной зоны в образцах MoO3, полученных в различных технологических условиях газотранспортного осаждения
| Образец | Еg, эВ |
|---|---|
| 1 | 2.85 |
| 2 | 2.68 |
| 3 | 2.68 |
| 4 | 2.51 |
Морфология образцов MoO3 по данным СЭМ и устойчивость к растиранию микрокристаллов, полученных в различных технологических условиях газотранспортного синтеза. На рис. 6 представлены СЭМ-изображения образцов MoO3, полученных в различных технологических условиях газотранспортного синтеза.
Рис. 6.
СЭМ-изображения образцов MoO3, 1–4 (слева направо) из табл. 1; сверху вниз изменяется масштаб снимков от 500 мкм (увеличение в 50 раз) в верхнем ряду до 1 мкм (увеличение в 10000 раз) в нижнем ряду.

Полученные результаты показывают, что самые мелкие вытянутые линейчатые кристаллы наблюдаются у образца 1, т.е. в случае добавления О2 к газу-носителю аргону при температуре 800°C. В то время как добавление в газовую среду паров воды H2O и газа N2O приводит к увеличению микрокристаллов, растущих в виде фанерообразных листов с ярко выраженной слоистостью, которая проявляется в виде террас и ступенек роста, хорошо видных при больших увеличениях (рис. 6, образцы 2–4).
После выявления морфологических особенностей синтезированных микрокристаллов мы подвергли их механическому воздействию в виде растирания в керамической ступке с последующим РФА полученных порошков (рис. 2–5, нижние дифрограммы). Сравнение данных РФА, полученных до и после растирания образцов, выявило различную степень устойчивости слоистой кристаллической структуры к механическим воздействиям. Самым устойчивым к механическим воздействиям оказался образец 1, полученный при 800°С с добавлением кислорода к газу-носителю аргону (рис. 2). На дифрактограмме порошка 1 проявились все линии, характерные для исходного образца и образца из МБД [17].
Сохранение исходной моноклинной модификации наблюдается при растирании образца 2, полученного при той же температуре 800°С в присутствии паров воды (рис. 3). В порошке 2 почти все основные линии совпадают с отражениями исходного образца моноклинной сингонии, приведенными в табл. 3.
Другая ситуация наблюдается в порошке 3, полученном с добавлением паров воды к газу-носителю при температуре 1100°С. Сравнение с исходным образцом показывает появление многих дополнительных отражений и совпадение межплоскостных расстояний лишь пяти основных линий с исходным образцом орторомбической сингонии. Большую часть остальные слабых отражений можно отнести к моноклинной фазе MoO3, появляющейся в растертом образце под влиянием механических воздействий.
Похожая ситуация наблюдается при растирании образца 4, полученного при 1100°С с добавлением N2O, который при разложении является источником активного кислорода и менее активного азота. Здесь с исходным образцом орторомбической сингонии совпадает 8 линий. Большинство остальных более слабых отражений можно так же, как и в предыдущем случае, отнести к моноклинной фазе MoO3.
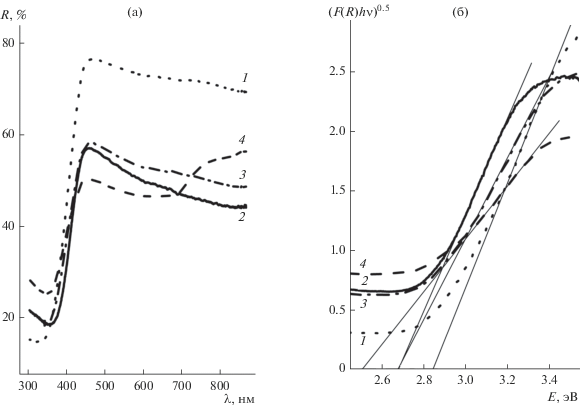
Оптические свойства образцов MoO3. На рис. 7 приведены результаты оптических исследований всех полученных образцов MoO3. Спектры диффузного отражения образцов (рис. 7а) описаны в рамках уравнения Кубелка–Мунка [19] F(R) = (1 – R)2/2R ~ α, где R – коэффициент диффузного отражения, α – коэффициент поглощения (см–1).
Рис. 7.
Экспериментальные спектры диффузного рассеяния (а) и графическое определение ширины запрещенной зоны методом Тауца путем линейной экстраполяции краев поглощения (б) образцов MoO3; номера спектров соответствуют номерам образцов в табл. 1.
Оценка ширины запрещенной зоны образцов MoO3 проведена в рамках известного формализма для зависимости коэффициента поглощения от энергии тестирующего излучения в области фундаментального края: α ~ (hν – Eg)n/hν, где hν – энергия фотонов (эВ), Eg – ширина запрещенной зоны.
Представленные на рис. 7а спектры диффузного отражения образцов MoO3 были преобразованы в зависимость (F(R) hν)0.5 от Е для определения ширины запрещенной зоны, которая была графически рассчитана по методу Тауца [20, 21] из предположения о непрямозонном характере оптических переходов в MoO3 (рис. 7б). Линейная экстраполяция главного края поглощения дает различные величины ширины запрещенной зоны для 4 образцов MoO3 в интервале энергий Eg = 2.85–2.51 эВ (табл. 5).
При этом значение Eg = 2.85 эВ для образца 1 близко к известному интервалу значений 2.90–3.3.15 эВ [22–24]. Уменьшение этой величины до Eg = 2.68 эВ в образце 2 (табл. 5) можно объяснить разными кристаллическими структурами (орторомбическая α-MoO3 и моноклинная MoO3〈H2O〉) образцов, полученных при одинаковой температуре 800°С, но в различной газо/паровой среде (О2 и Н2О соответственно).
Уменьшение Eg до такой же величины происходит и под влиянием примесей в виде ионов водорода и кислорода в результате разложения паров воды или до Eg = 2.51 эВ под влиянием ионов азота и кислорода из N2O при высокой температуре синтеза 1100°С. Все эти изменения могут быть обусловлены значительными отклонениями состава образцов от стехиометрии орторомбической фазы α-MoO3 в условиях высокотемпературного синтеза с добавлением пара H2O или газа N2O в газотранспортную среду.
ЗАКЛЮЧЕНИЕ
Подводя итоги полученным результатам о влиянии технологических параметров синтеза на некоторые свойства триоксида молибдена, следует заключить, что структура, внешняя форма микрокристаллов и ширина запрещенной зоны МоО3 оказываются очень чувствительными к технологическим условиям газотранспортного осаждения: температуре синтеза и составу газотраспортной среды.
При температуре синтеза 800°С под действием паров воды в газотраспортной среде МоО3 переходит из основной орторомбической фазы Pbnm в моноклинную P21/n с уменьшением ширины запрещенной зоны от 2.85 до 2.68 эВ.
При максимально высокой температуре синтеза 1100° С примеси водорода и кислорода из паров воды H2O или азота и кислорода из N2O не изменяют слоистую орторомбическую структуру микрокристаллов, но уменьшают ширину запрещенной зоны до 2.68 и 2.51 эВ соответственно.
При механическом воздействии в виде растирания в порошках из микрокристаллов МоО3, синтезированных при 1100°С с добавлением паров воды или N2O к газу-носителю аргону, вдобавок к основной орторомбической фазе Pbnm появляется моноклинная фаза P21/n.
Микрокристаллы МоО3, синтезированные при температуре 800°С, более устойчивы к механическим воздействиям и после растирания содержат одну исходную фазу: орторомбическую Pbnm в случае синтеза в аргон-кислородной газотранспортной среде или моноклинную P21/n в случае синтеза с добавлением паров воды к основному газу-носителю аргону.
Список литературы
Goodenough J.B. Chemistry and Uses of Molybdenum // Proc. Climax 4th Int. Conf. Eds. Barry H.F., Mitchell P.C. Ann Arbor: Climax Molybdenum Corp., 1982. V. 1. P. 1.
Pichat P., Mozzanega M.N., Hoang-Van C. Room Temperature Photoassisted Formation of Hydrogen Molybdenum Bronzes with Alcohol as Hydrogen Source // Phys. Chem.1988. V. 92. P. 464–467.
Erre R., Legay M.H., Fripiat J.J. Reaction of Molecular Hydrogen with the 100 Face of MoO II // Surf. Sci. 1983. V. 127. P. 69–75.
Deb S., Khoc R. Physical Properties of a Transition Metal Oxide: Optical and Photoelectric Properties of Single Crystal and Thin Film Molybdenum Trioxide // Proc. R. SOC. Lond. A. 1968. V. 304. P. 211–231. doi https://doi.org/10.1098/rspa
Goodenough J.B. Progress in Solid State Chemistry / Ed. Reiss H. London: Pergamon, 1971. V. 5. 145 p.
Halevi P. Electromagnetic Waves. V. 1. Spatial Dispersion in Solids and Plasmas / Ed. Halevi P., Amsterdam: Elsevier, 1992. 339 p.
Andersson G., Magneli A. On the Crystal Structure of Molybdenum Trioxide // Acta Chem. Scand. 1950. V. 4. P. 793–797. 10.3891
Negishi H., Negishi S., Kuroiwa Y., Sato N., Aoyagi S. Anisotropic Thermal Expansion of Layered MoO3 Crystals // Phys. Rev. B. 2004. V. 69. P. 64–111. Cross Ref Google Scholar. doi https://doi.org/10.1103/PhysRevB.69.064111
Yao J., Hashimoto K., Fujishima A. Photochromism Induced in an Electrolytically Pretreated MoO3 Thin Film by Visible Light // Nature. 1992. V. 355. P. 624–626. doi 10.1038/ 355624a0 Cross Ref ADS.
Bechinger C., Ferrere S., Zaban A., Sprague J. B., Gregg A. Photoelectrochromic Windows and Displays // Nature. 1996. V. 383. P. 608–613.
Hu X.K., Qian Y.T., Song Z.T., Huang J.R., Cao R., Xiao J.Q. Comparative Study on MoO3 and HxMoO3 Nanobelts // Chem. Mater. 2008. V. 20. P. 1527–1533.
Balendhran S., Walia S., Nili H., Kalantar-zadeh K. Advances Tn. Two-dimensional Molybdenum Trioxide and Dichalcogenides // Funct. Mater. 2013. V. 23. P. 3952–3970.
Huang P.R., He Y., Cao C., Lu Z.H. Impact of Lattice Distortion and Electron Doping on α-MoO3 Electronic Structure // Sci. Rep. 2014. V. 4. P. 7131. doi https://doi.org/10.1038/ srep07131
Гусев А.И. Нанокристаллические материалы, методы получения и свойства. Екатеринбург: УрО РАН, 1998. 115 с.
Ремпель А.А., Валеева А.А. Материалы и методы нанотехнологий. Уч. Пособие. Екатеринбург: Изд-во Урал. ун-та, 2015. 136 с.
Коцарева К.В. Синтез и морфология гибридных наносистем на основе графена и оксидов Ni, Co, Mo, W и Si: Дис. … канд. хим. наук. Москва. 2017. 210 с.
CPDS – International Center for Diffraction Data. PDF Card 2012 (00-005-0508).
CPDS – International Center for Diffraction Data. PDF Card 2012 (00-005-1513).
Kortum G. Reflectance Spectroscopy. N.Y.: Springer-Verlag, 1969. 361 p.
Tauc J., Grigorovici R., Vancu A. Optical Properties and Electronic Structure of Amorphous Germanium // Phys. Status Solidi. 1966. V. 15. P. 627–637. doi https://doi.org/10.1002/ pssb.19660150224
Tauc J. Optical Properties and Electronic Structure of Amorphous Ge and Si // Mater. Res. Bull. 1968. V. 3. P. 37–46.
Lu J., Sun Ch., Zheng M., Wang Y., Nripan M., van Kan J.A., Mhaisalkar S.G., Sow C.H. Bandgap Engineering of Phosphorene by Laser Oxidation toward Functional 2D Materials // J. Phys. Chem. C. 2012. V. 116. P. 22015–22020.
Mestl G.N., Verbruggen F.D., Knozinger H. Mechanically Activated MoO3. Characterization of Defect Structures // Langmuir. 1995. V. 11. P. 3035-41.
Суровой Э.П., Еремеева Г.О. Термостимулированные превращения в наноразмерных пленках оксида молибдена(VI) // Ползуновский вестник. 2011. Т. 4-1. С. 142–146.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы