Неорганические материалы, 2019, T. 55, № 10, стр. 1123-1129
Получение и исследование свойств порошков и керамики медьзамещенного гидроксиапатита
Ю. О. Никитина 1, Н. В. Петракова 1, *, А. А. Ашмарин 1, Д. Д. Титов 1, С. В. Шевцов 1, Т. Н. Пенкина 1, Е. А. Кувшинова 2, С. М. Баринов 1, В. С. Комлев 1, Н. С. Сергеева 2
1 Институт металлургии и материаловедения им. А.А. Байкова Российской академии наук
119334 Москва, Ленинский пр., 49, Россия
2 Московский научно-исследовательский онкологический институт им. П.А. Герцена –
филиал ФГБУ “НМИЦ радиологии” Минздрава России
125284 Москва, 2-й Боткинский проезд, 3, Россия
* E-mail: petrakova.nv@mail.ru
Поступила в редакцию 12.09.2018
После доработки 08.04.2019
Принята к публикации 20.05.2019
Аннотация
Осаждением из растворов синтезированы медьсодержащие гидроксиапатиты (Cu-ГА) с концентрацией Cu до 2.4 мол.%. Проведено рентгенографическое исследование полученных материалов после термообработки в диапазоне температур от 900 до 1400°С, рассчитаны параметры кристаллических решеток и размер областей когерентного рассеяния. Изучены прочностные свойства при изгибе и микроструктура спеченной керамики на основе Cu-ГА. Показано, что введение более 0.8 мол.% меди снижает термическую устойчивость ГА, приводя к его частичному разложению до трикальцийфосфата моноклинной модификации (α-ТКФ) и переходу в гексагональную форму (β-ТКФ) с возможным концентрированием в ней меди. Увеличение содержания меди приводит к снижению интенсивности спекания ГА наряду с увеличением размера кристаллитов и пористости. В биологических исследованиях in vitro полученные керамические материалы показали цитосовместимость и выраженные матриксные свойства поверхности.
ВВЕДЕНИЕ
Гидроксиапатит (ГА) широко используют для заполнения дефектов костной ткани при хирургическом лечении болезней и травм опорно-двигательного аппарата. Часто процессы заживления и восстановления нормального функционирования кости в послеоперационный период осложнены возникновением инфекционно-воспалительных реакций, в связи с чем лечение сопровождают введением лекарственных средств, в основном антибиотиков. Использование биоматериала, обладающего антимикробной активностью, могло бы послужить альтернативой комплексу сложной и длительной терапии, которая в свою очередь может привести к появлению резистентности у микроорганизмов к используемым лекарственным препаратам.
Настоящая работа посвящена ГА с катионным замещением иона кальция на ион меди, как известно, обладающий антибактериальной активностью [1–4]. Количество вводимой в структуру ГА меди ограничивается вследствие возможности его разложения, а также вероятности цитотоксической реакции на клетки организма.
Целью настоящей работы явились синтез и изучение порошков и керамики медь-замещенных ГА с содержанием меди до 5 мол. % и исследование биологических свойств полученных материалов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Медьсодержащие ГА (Cu-ГА) были синтезированы классическим методом осаждения из водных растворов нитрата кальция и гидрофосфата аммония [5], в качестве источника ионов Cu2+ использовали раствор нитрата меди. Расчет количества вводимых компонентов проводили согласно реакции (1), где х = 0, 0.1, 0.2 и 0.5; значение pH поддерживали на уровне 11 ± 0.5:
(1)
$\begin{gathered} \left( {10--x} \right){\text{Ca}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{2}}}} + x{\text{Cu}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{2}}}} + \\ + \,\,6{{\left( {{\text{N}}{{{\text{H}}}_{4}}} \right)}_{2}}{\text{HP}}{{{\text{O}}}_{4}} + 8{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{OH}} \to \\ \to {\text{C}}{{{\text{a}}}_{{10--{\text{ }}x}}}{\text{C}}{{{\text{u}}}_{x}}{{\left( {{\text{P}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{6}}}}{{\left( {{\text{OH}}} \right)}_{2}} + 6{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 20{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{N}}{{{\text{O}}}_{3}}. \\ \end{gathered} $Продукт синтеза подвергали старению в маточном растворе в течение 24 ч; затем осадок фильтровали на воронке Бюхнера, промывали водой, переносили в спирт, дезагрегировали в нем и снова фильтровали на воронке Бюхнера. Осадок сушили при температуре 70–80°С и просеивали через сито с размером ячейки 100 мкм. Исследование полученных порошков проводили после термообработки на воздухе при 900, 1200, 1300 и 1400°С с выдержкой 1 ч.
Методом рентгенофазового анализа (РФА, Shimadzu XRD-6000) изучали фазовый состав материалов, рассчитывали параметры кристаллической решетки и размер областей когерентного рассеяния (ОКР). Содержание меди устанавливали методом атомно-эмиссионной спектрометрии c индуктивно-связанной плазмой (Jobin-Yvon Ultima 2). Удельную поверхность полученных порошков измеряли методом низкотемпературной адсорбции азота (БЭТ, Micromeritics, TriStar 3000). Методом ИК-спектрометрии (Nicolet Avatar-330) определяли наличие характерных функциональных групп. Спекание материалов изучали путем измерения непрерывной усадки на горизонтальном дилатометре (DIL 402C Netzsch) в атмосфере аргона при непрерывном повышении температуры до 1400°С с постоянной скоростью 10°С/мин. В качестве образцов использовали цилиндрические прессовки (давление 50 МПа) диаметром 5 и высотой 4 мм.
Керамику получали прессованием порошков в стальной пресс-форме с получением образцов в форме балочек с размерами 3 × 3 × 30 мм и последующим их обжигом в печи с SiC-нагревателями на воздухе со скоростью нагрева 5°С/мин и выдержкой в течение 1 ч при 1200, 1300 и 1400°С. По принятым стандартным методикам измеряли характеристики полученной керамики: усадку, плотность, пористость, прочность при изгибе; исследования микроструктуры проводили с использованием сканирующей электронной микроскопии (СЭМ, Carl Zeiss, LEO 1420).
Для биологических исследований in vitro изготавливали керамические пористые гранулы по технологии полимерных ячеистых реплик с последующим обжигом заготовок при 1300°С на воздухе. Цитосовместимость гранул Cu-ГА изучали на модели перевивной клеточной линии остеосаркомы человека MG-63 (Российская коллекция клеточных культур позвоночных, Институт цитологии РАН, Санкт-Петербург). Проводили оценку острой цитотоксичности образцов экстракционным методом (ГОСТ 10993.5-99) и изучение матриксных свойств поверхности при совместном культивировании [6]. Жизнеспособность клеток на этапах культивирования определяли на сроках 1, 3, 7, 10 и 14 сут с помощью МТТ-теста. Материал считали цитосовместимым при отсутствии токсичности и наличии матриксных свойств поверхности: способности опытного образца материала поддерживать клеточную пролиферацию на уровне контрольных значений.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
По результатам химического анализа полученных порошков после их термообработки при 900°С содержание Cu соответствовало 0, 0.4, 0.8 и 2.4 мол.% – образцы 1, 2, 3, 4. Неполное вхождение расчетной меди в продукты синтеза, предположительно, связано с ее вымыванием в составе маточного раствора при фильтровании осадка. Удельная поверхность всех полученных порошков составила 100–110 м2/г, что соответствует среднему размеру частиц около 20 нм. В ИК-спектрах образцов всех составов присутствуют традиционные для ГА полосы поглощения. Следует отметить, что порошки после синтеза обладали окраской от белой (образец 1) до бледно-голубой (образцы 2 и 3) и голубой (образец 4). В результате термообработки материалы приобретали более насыщенную окраску: розовую (2), темно-розовую (3) и темно-малиновую (4). Известно, что наличие двухвалентной меди придает соединениям со структурой апатита интенсивный малиновый цвет, что делает перспективным использование Cu-ГА в качестве неорганических пигментов [7, 8]. При этом ионы меди в основном входят в гексагональные каналы апатита, замещая протоны, а не катионы кальция, с небольшим увеличением объема кристаллической решетки [7, 9].
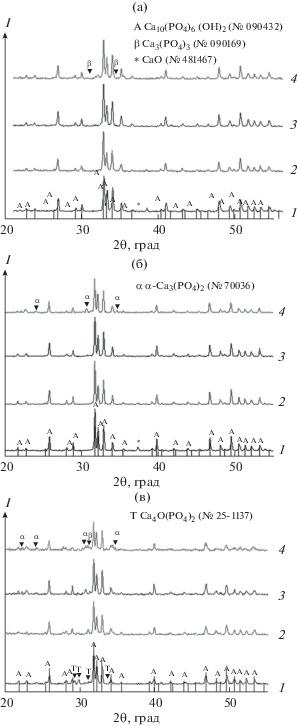
Согласно данным РФА, кристаллической фазой всех синтезированных и термообработанных при 900°С образцов является ГА (рис. 1а). В образце 1 наряду с основной ГА-фазой присутствуют следы оксида кальция (5–10 мас. %); в образце 4 присутствует β-ТКФ (трикальцийфосфат гексагональной модификации) – около 10 мас. %. Повышение температуры обработки до 1200°C не привело к изменению фазового состава материалов, кроме образца 4, в котором весь β-ТКФ трансформировался в α-ТКФ (трикальцийфосфат моноклинной модификации) (рис. 1б). Термообработанные при 1300°С материалы по фазовому составу были идентичны обработанным при 1200°С. После прокаливания при 1400°С в образце 1 оксид кальция не обнаружен, однако присутствует тетракальциевый фосфат (Ca4O(PO4)2, ТеКФ) – около 10 мас. %; появились следы α‑ТКФ в образцах 2 и 3 (до 5 мас. %), в образце 4 количество α-ТФК не изменилось; обнаружены следы β-ТКФ в образце 3 и до 10 мас. % в β-ТФК образце 4 (рис. 1в). Следует отметить, что α- и β-ТКФ являются двумя основными модификациями ТКФ, т.к. остаются стабильными при комнатной температуре. β-Фазу считают низкотемпературной, т.к. при нагревании выше 1180°С она начинает трансформироваться в высокотемпературную α-фазу, стабильную до 1430–1450°С [5, 8, 10]. В этой связи существование β-ТКФ после прокаливания при 1400°С свидетельствует о том, что медь входит в его решетку, предотвращая фазовый переход в α-фазу.
Поскольку ионный радиус меди (0.8 Å) меньше ионного радиуса кальция (1.06 Å) примерно на 25%, ожидалось, что при замещении размеры элементарной ячейки ГА будут уменьшаться. Однако при расчете параметров а и с кристаллических ячеек Cu-ГА, прокаленных при 900°С, прослеживается тенденция соответствия справочным данным для ГА с параметрами 9.418 и 6.884 Å (№ 090432) соответственно; только для образца 2 параметр а увеличен (9.425 Å) (табл. 1). Термообработка при 1200°С приводит к незначительному снижению параметра а образцов 1, 2 и 3 и увеличению для образца 4; параметр с изменяется в пределах ошибки расчетов. Прокаливание при 1400°С привело к увеличению параметров а и с. Размеры ОКР порошков увеличиваются примерно на 15–20% с ростом температуры обработки от 900 до 1200°С, от 3% (1) до 15% (4) с увеличением температуры от 1200 до 1400°С. В ряду увеличения концентрации меди величины ОКР колеблются в пределах ошибки измерений; наиболее интенсивный рост частиц с ростом температуры происходит для образца 4 (46 и 75 нм при 900 и 1400°С соответственно).
Таблица 1.
Результаты расчета параметров кристаллических решеток Cu-ГА
| Образец | a ±0.002, Å |
c ±0.002, Å |
ОКР ±5%, нм |
a ±0.002, Å | c ±0.002, Å |
ОКР ±5%, нм |
a ±0.002, Å |
c ±0.002, Å |
ОКР ±5%, нм |
|---|---|---|---|---|---|---|---|---|---|
| 900°С | 1200°С | 1400°С | |||||||
| 1 | 9.415 | 6.878 | 52 | 9.413 | 6.880 | 63 | 9.424 | 6.882 | 65 |
| 2 | 9.425 | 6.885 | 52 | 9.421 | 6.882 | 62 | 9.426 | 6.887 | 68 |
| 3 | 9.419 | 6.882 | 52 | 9.417 | 6.883 | 60 | 9.419 | 6.892 | 69 |
| 4 | 9.418 | 6.884 | 46 | 9.423 | 6.888 | 60 | 9.428 | 6.900 | 75 |
Полученные данные свидетельствуют о том, что при синтезе медь встраивается в структуру аморфных незакристаллизованных частиц ГА. Образование оксида кальция в чистом ГА и его отсутствие в Cu-ГА объясняется избытком ионов кальция в процессе осаждения в первом случае и его достаточным количеством во втором – при наличии ионов меди в исходном растворе. При термообработке в интервале 900–1300°С происходит кристаллизация и укрупнение частиц ГА, медь находится в решетке, возможно, с неравномерным распределением в объеме кристаллов. Термообработка при 1400°С приводит к частичному разложению ГА до α-ТКФ (до 5–10 мас. %) во всех образцах. Наличие моноклинной модификации ТКФ дает основание полагать, что медь осталась сконцентрированной в структуре ГА. В ином случае замещение приводит к наличию и термической стабильности при 1400°С низкотемпературной модификации β-ТКФ (4). Образование ТеКФ (CaO ⋅ Ca3(PO4)2) в образце 1 связано с взаимодействием оксида кальция с образовавшейся фазой α-ТКФ при частичном разложении ГА.
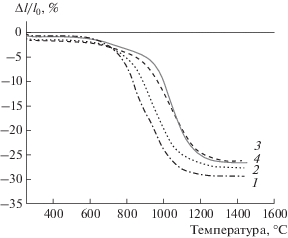
В дальнейшем изучали спекание материалов путем измерения непрерывной усадки с постоянной скоростью 10°С/мин (рис. 2). До температуры около 700°С наблюдается небольшое увеличение усадки (2–3%), примерно одинаковое для всех образцов. Начало процесса активного спекания происходит при 770, 850, 920 и 970°С соответственно для образцов 1, 2, 3 и 4. При дальнейшем нагреве изменяется интенсивность спекания в следующем ряду: 1 > 2 > 3 > 4. Усадка при 1200°С составляет для указанных образцов 30, 27, 24 и 25%; при этом выше 1100°С ход кривых усадки образцов 3 и 4 примерно одинаков.
На рис. 3 представлены микрофотографии поверхности скола керамики Cu-ГА, полученной обжигом при 1200°С. Образец 1 состоит из однородных по размеру кристаллитов около 1 мкм с выраженной органенностью, угол встречи границ 120°. Поры преимущественно межкристаллические, наблюдаются в единичных количествах. Для керамических образцов 2, 3, 4 характерна заметная неравноосность кристаллов поверхности, вероятно, вследствие образования слоистости материала в процессах прессования. Кристаллы неоднородные по размеру и форме, размером от 0.5 до 2.0 мкм. Межкристаллических пор больше, и они более крупные, чем в образце 1. На рис. 4 представлены изображения поверхности скола керамических образцов 1 и 4, полученных обжигом при 1300 (рис. 4а, 4в) и 1400°С (рис. 4б, 4г). В образце 4 наблюдается более интенсивный рост кристаллов – от 2–5 при 1300°С до 10–15 мкм при 1400°С; присутствуют межкристаллические крупные поры – до 0.5–1.0 мкм.
Рис. 3.
Микрофотографии поверхности скола керамики, полученной при 1200°С: образцы 1 (а), 2 (б), 3 (в), 4 (г).

Рис. 4.
Микрофотографии поверхности скола керамических образцов 1 (а, б), 4 (в, г), полученных при 1300 (а, в), 1400°С (б, г).

Наибольшие показатели относительной плотности, прочности при изгибе и минимальные величины открытой пористости наблюдаются для материалов, обожженных при 1300°С (рис. 5). По-видимому, это связано с более полным спеканием при этой температуре с одновременным проявлением термической стабильности фазового состава материалов. При 1400°С образование дополнительных фаз во всех материалах (ТКФ в Cu-ГА и ТеКФ в ГА) приводит к увеличению пористости и снижению плотности образцов, что особенно заметно для образцов 1 и 4 с наиболее измененным фазовым составом. Наибольшая прочность при изгибе 46 МПа наблюдается на обожженном при 1300°С образце 4, для образца 3 величина составляет 40 МПа, для 2 – 25 МПа, для 1 – 21 МПа; величина открытой пористости для всех образцов находится в интервале от 0.5 до 1.5%, относительной плотности – от 95 до 99%.
Рис. 5.
Зависимости относительной плотности (а), открытой пористости (б), прочности при изгибе (в) образцов 1–4 от температуры обжига.
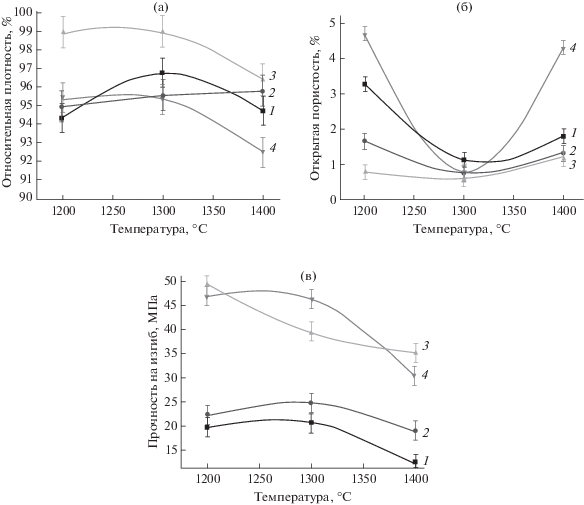
Таким образом, с увеличением количества меди в составе материала происходит замедление спекания, увеличение размера кристаллитов и их неоднородности по размерам, увеличение количества межкристаллитных пор. Это свидетельствует о снижении диффузионной подвижности в высокотемпературных процессах, возможно, вследствие сегрегации меди по границам зерен и наличия деформаций решетки за счет различия в радиусах ионов меди и кальция. На заключительной стадии спекания идут одновременно процессы перераспределения фаз и рост кристаллов.
Биологические исследования in vitro на керамических гранулах медьзамещенных ГА показали, что значения pH вытяжки из всех образцов находились в физиологических пределах (7.4–7.8). Установлено, что все материалы нетоксичны в отношении клеток линии остеосаркомы человека MG-63. Количество жизнеспособных клеток, культивированных на опытных образцах 1–3, к третьим суткам было больше, чем в контрольной культуре (клетки, культивированные на поверхности культурального пластика) (табл. 2). И, несмотря на неравномерность роста, к 14-м суткам наблюдения разница достигала 24–26%. Количество жизнеспособных клеток, культивированных на образце 4, на начальных сроках наблюдения было значительно меньше по сравнению с контрольным значением. Однако при равномерном росте к 14-м суткам на образцах наблюдалось на 45.5% больше жизнеспособных клеток, чем в контрольной культуре. Таким образом, опытные образцы поддерживают клеточную пролиферацию на более высоком уровне, чем в контрольном образце, что свидетельствует о выраженных матриксных свойствах поверхности, а также о цитосовместимости медьзамещенных ГА.
Таблица 2.
Результаты оценки динамики изменения клеточной популяции в биологических исследованиях in vitro
| Образец | Жизнеспособность клеток, культивированных на опытных образцах, в сравнении с контрольным значением (%) в разные сроки наблюдения | ||||
|---|---|---|---|---|---|
| 1 сут | 3 сут | 7 сут | 10 сут | 14 сут | |
| 1 | 80.7 | 112.7 | 98.0 | 133.9 | 124.9 |
| 2 | 81.9 | 109.6 | 91.7 | 104.9 | 124.9 |
| 3 | 99.4 | 107.1 | 103.2 | 105.5 | 126.4 |
| 4 | 64.8 | 77.3 | 96.9 | 91.1 | 145.5 |
ЗАКЛЮЧЕНИЕ
Осаждением из растворов получены порошки ГА с замещением иона кальция на ион меди в количествах 0, 0.4, 0.8 и 2.4 мол. %. Введение меди более 0.8 мол. % снижает термическую устойчивость ГА, приводя к образованию ТКФ моноклинной модификации при 1200°С, ТКФ гексагональной модификации при 1400°С с возможным концентрированием в ней меди. Введение меди в структуру приводит к снижению интенсивности спекания ГА наряду с ростом кристаллов и пористости.
Керамика из медьсодержащих ГА с наиболее оптимальными показателями свойств была получена обжигом при 1300°С. Прочность при изгибе таких материалов возрастает от 21 до 46 МПа в ряду увеличения количества меди.
Биологические исследования показали, что все медьзамещенные ГА цитосовместимы и проявляют выраженные матриксные свойства поверхности. Полученные результаты могут быть использованы в технологии биокерамики для костной хирургии.
Список литературы
Ki Y.Y., Jeong H.B., Jae H.P., Jungho H. Susceptibility Constants of Escherichia Coli and Bacillus Subtilis to Silver and Copper Nanoparticles // Sci. Total Environ. 2007. № 37. P. 3572–35755. https://doi.org/10.1016/j.scitotenv.2006.11.007
Фадеева И.В., Гафуров М.Р., Филиппов Я.Ю., Давыдова Г.А., Савинцева И.В., Фомин А.С., Петракова Н.В., Антонова О.С., Ахметов Л.И., Габбасов Б.Ф., Изотов В.В., Орлинский С.Б., Баринов С.М. Медь-замещенные трикальцийфосфаты // Доклады РАН. 2016. Т. 471. № 6. С. 682–685. https://doi.org/10.7868/S0869565216360123
Хлусов И.А., Карпова М.Р., Муштоватова Л.С., Жданова О.С., Шаркеев Ю.П., Митриченко Д.В., Просолов А.Б., Комков А.Р., Рудаев В.И., Комарова Е.Г., Седельникова М.Б., Литвинова Л.С., Чайкина М.В. Цинк- или медьсодержащие кальцийфосфатные покрытия тормозят in vitro рост патогенной микрофлоры // Новые технологии создания и применения биокерамики в восстановительной медицине. Матер. IV междунар. научно-практической конф. Национальный исследовательский Томский политехнический университет, 2016. С. 94–97.
Marques C.F., Olhero S., Abrantes J.C.C., Marote A., Ferreira S., Vieira S.I., Ferreira J.M.F. Biocompatibility and Antimicrobial Activity of Biphasic Calcium Phosphate Powders Doped with Metal Ions for Regenerative Medicine // Ceram. Int. 2017. V. 43. P. 15719–15728. https://doi.org/10.1016/j.ceramint.2017.08.133
Баринов С.М., Комлев В.С. Биокерамика на основе фосфатов кальция. М.: Наука, 2014. 204 с.
Комлев В.С., Сергеева Н.С., Федотов А.Ю., Свиридова И.К., Кирсанова В.А., Ахмедова С.А., Тетерина А.Ю., Зобков Ю.В., Кувшинова Е.А., Шанский Я.Д., Баринов С.М. Исследование физико-химических и биологических свойств композиционных матриксов в системе альгинат–фосфаты кальция, предназначенных для использования в технологиях прототипирования при замещении костных дефектов // Материаловедение. 2016. № 3. С. 38–42.
Казин П.Е., Зыкин М.А., Третьяков Ю.Д., Янзен М. Синтез и свойства окрашенных медьсодержащих апатитов состава Ca5(PO4)3CuyOy+ δ(OH)0.5 –y– δX0.5 (X = OH, F, Cl) // Журн. неорган. химии. 2008. Т. 53. № 3. С. 409–414.
Неорганические фосфатные материалы / Под. ред. Каназава Т. Киев: Наук. думка, 1998.297 с.
Погосова А., Казин П.Е., Янзен М. Синтез, особенности кристаллической структуры и окраска кальций-иттриевого гидроксиапатита с ионами меди в гексагональных каналах // Журн. неорган. химии. 2013. Т. 58. № 4. С. 439–444. https://doi.org/10.7868/S0044457X13040120
Гурин А.Н., Комлев В.С., Фадеева И.В., Петракова Н.В., Варда Н.С. Сравнительное исследование замещения дефектов костной ткани остеопластическими материалами на основе α- и β-трикальцийфосфата // Стоматология. 2012. № 6. С. 16–21.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы