Неорганические материалы, 2019, T. 55, № 11, стр. 1213-1218
Мезопористые кремнеземные материалы и их сорбционная способность по отношению к ионам вольфрама(VI) и молибдена(VI)
Т. Д. Батуева 1, *, М. Г. Щербань 2, Н. Б. Кондрашова 1
1 Институт технической химии УрО Российской академии наук – филиал Пермского федерального исследовательского центра УрО Российской академии наук
614013 Пермь, ул. Королева, 3, Россия
2 Пермский государственный национальный исследовательский университет
614990 Пермь, ул. Букирева, 15, Россия
* E-mail: tdbatueva@mail.ru
Поступила в редакцию 15.06.2018
После доработки 20.03.2019
Принята к публикации 26.03.2019
Аннотация
Синтезированы сорбенты на основе кремнеземов со структурой пор MCM-41 и МСМ-48, модифицированные гидразидными группами на основе трет-карбоновых кислот фракций Versatic 10 и Versatic 1519. Определены текстурно-структурные свойства исследуемых кремнеземов. Изучены условия сорбции вольфрама(VI) из кислых растворов полученными кремнеземами в зависимости от рН среды и плотности прививки. Определены условия разделения вольфрама(VI) и молибдена(VI) из хлороводородных растворов при их совместном присутствии модифицированным кремнеземом МСМ-41.
ВВЕДЕНИЕ
Проблема извлечения вольфрама и молибдена из бедных технологических растворов в настоящее время является актуальной в связи с сокращением производства в России большинства тугоплавких металлов. Известные методы разделения молибдена и вольфрама в водных растворах основаны на различном поведении соединений этих металлов при осаждении, экстракции и ионообменной сорбции [1]. Одним из эффективных способов очистки растворов является сорбция с использованием органических ионитов или неорганических сорбентов [2]. Отделение вольфрама от молибдена также представляет серьезную проблему, так как в слабокислых растворах (рН 2–3), содержащих эти металлы, разделению препятствует образование смешанных вольфрамомолибденовых полианионов [3–5]. Эффективное разделение возможно лишь при их разрушении с помощью комплексообразующих реагентов, в качестве которых могут быть использованы N',N'-диалкилгидразиды [6, 7].
Химически модифицированные кремнеземы [8–10] удачно сочетают в своем составе положительные свойства высокодисперсной матрицы и функциональной группы, эффективной для выделения ацидокомплексов редких металлов. Следует отметить, что использование для модифицирования кремнеземов гидразидов, синтезированных на основе фракций трет-карбоновых кислот Versatic, позволит проводить концентрирование микрокомпонентов из больших объемов растворов на относительно небольшой массе сорбента в отсутствие органических растворителей, что также является большим преимуществом и делает настоящее исследование актуальным.
Целью данной работы является создание функционализированных кремнеземных сорбентов, способных к селективному извлечению из растворов ионов вольфрама и молибдена.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Кремнеземную основу сорбентов (SiO2) получали методом темплатного синтеза в гидротермальных условиях при температуре выдержки 100°С для MCM-41 – I и 120°С для MCM-48 – II в течение 2 сут. В качестве источника кремния использовали тетраэтоксисилан (TEOS), в качестве структурообразующего агента – цетилтриметиламмония бромид (CTAB). Компоненты синтеза брали в следующих соотношениях:
TEOS 1 : СTAB 0.2 : NH3 3.5 : H2O 100 – при получении SiO2 с гексагональной структурой пор (I);
TEOS 1 : СTAB 0.4 : NaOH 0.4 : H2O 100 – при получении диоксида кремния с кубической биконтинуальной структурой пор (II).
Модификация поверхности мезопористых кремнеземов осуществлялась методом пропитки – образцы: I-ДМГД, II-ДМГД, где ДМГД – N',N'-диметилгидразиды на основе фракций трет-карбоновых кислот CH3R1R2CC(O)ОH Versatic; R1 и R2 – алкильные радикалы, сумма атомов углерода равна 10 и 1519 [11, 12], и была подтверждена методом ИК-спектроскопии в области 150–4000 см–1 на ИК-Фурье-спектрометре IFS-66/S фирмы Bruker (Германия).
Сорбционные свойства синтезированных материалов исследовали следующим образом. К раствору, содержащему ионы вольфрама(VI), для создания необходимого рН добавляли хлороводородную кислоту соответствующей концентрации (в колбе на 100 мл). Затем полученную смесь перемешивали с 0.2 г модифицированного кремнезема. Через час осадок отфильтровывали и измеряли величину рН водной фазы. Остаточное содержание вольфрама(VI) находили фотометрическим методом с раствором тиоцианата калия [13].
Для изучения условий разделения вольфрама(VI) и молибдена(VI) в колбу помещали по 1 мл стандартных растворов этих металлов, расчетное количество хлороводородной кислоты и дистиллированной воды до объема 100 мл, 0.2 г модифицированного кремнезема. Содержимое колбы оставляли на 60 мин. Осадок отфильтровывали, в фильтрате определяли остаточное содержание вольфрама(VI) и молибдена(VI) фотометрически с тиоцианатом калия и аммония соответственно.
Для изучения условий десорбции осадки, содержащие 1.1 г вольфрама(VI), перемешивали с 10 мл водного раствора, содержащего различные количества аммиака. После 20 мин выдерживания определяли содержание вольфрама(VI) в жидкой фазе фотометрическим методом.
Величину статической сорбционной емкости по металлу (ЕМ, моль/г), степень извлечения (Е, %), коэффициенты распределения (D, л/г) и коэффициент разделения β рассчитывали по следующим формулам с погрешностью не более 5%:
где С0 – концентрация металла в исходном растворе, моль/л; Ср– остаточная равновесная концентрация извлекаемого металла в растворе, моль/л; V – объем раствора, л; m – масса навески сорбента, г.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты определения текстурных характеристик (табл. 1) (ASAP 2020 (Micromeritics, США)) показали, что исходные кремнеземные композиты представляют собой мезопористый материал с достаточно развитой удельной поверхностью, составляющей порядка 950 м2/г для сорбента МСМ-41 и 1600 м2/г для МСМ-48. Модифицирование сорбента значительно сократило величину удельной поверхности, однако, учитывая высокое содержание функциональных групп (13–22 ммоль/г) [12] в составе вещества, способных образовывать с ионами вольфрама ионные ассоциаты (комплексы внедрения или присоединения), можно предположить, что использование этих материалов в качестве сорбентов для концентрирования, разделения и извлечения ионов вольфрама из сложных смесей будет эффективным.
Таблица 1.
Текстурные показатели сорбентов
| Сорбент | MCM-48 | MCM-41 | MCM-48 | MCM-41 | ||||
|---|---|---|---|---|---|---|---|---|
| 1/0.2* | 1/0.4* | 1/0.8* | 1/0.2* | 1/0.4* | 1/0.8* | |||
| Удельная поверхность, м2/г | 1620 | 952 | 992 | 555 | 240 | 386 | 278 | 183 |
| Объем пор, см3/г | 1.07 | 0.59 | 0.56 | 0.34 | 0.2 | 0.25 | 0.21 | 0.14 |
| Размер пор, нм | 2.6 | 2.4 | 2.3 | 2.5 | 3.2 | 2.6 | 3.0 | 3.1 |
Исследования влияния на сорбционные процессы времени контактирования фаз показали, что максимальная сорбция W(VI) модифицированными мезопористыми кремнеземными сорбентами на основе МСМ-41 и МСМ-48 достигается в течение часа.
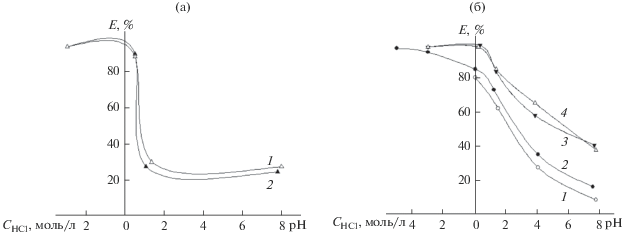
Исследование влияния значений рН на извлечение вольфрама(VI) как исходных кремнеземов МСМ-41, МСМ-48 (рис. 1а), так и модифицированных с различной плотностью прививки (рис. 1б) показало, что высокие степени извлечения вольфрама(VI) (80–100%) достигаются в широком интервале кислотности – от концентрации хлороводородной кислоты 3–5 моль/л и до рН 3 (ЕМ = = 3.5–4.5 ммоль/г). Форма пор незначительно сказывается на адсорбционной способности матрицы – зависимости степени извлечения от рН для сорбентов МСМ-41 и МСМ-48 практически совпадают. Рост плотности прививки функциональных групп на поверхности кремнезема увеличивает сорбционную способность МСМ по отношению к ионам вольфрама(VI). Учитывая сокращение удельной поверхности с ростом плотности прививки, это свидетельствует в пользу протекания химической адсорбции ионов на поверхности модифицированного МСМ.
Рис. 1.
Влияние структуры матрицы, плотности прививки и кислотности среды на извлечение вольфрама МСМ: а – влияние структуры сорбента: МСМ-41 (1), МСМ-48 (2); б – влияние плотности прививки ДМГД на МСМ-41 при различных соотношениях SiO2/ДМГД: 1 – 1 : 0.2; 2 – 1 : 0.4; 3 – 1 : 0.8; 4 – 1 : 1 (mI-ДМГД, II-ДМГД = 0.2 г, СW(VI) = 0.01 моль/л, τ = 60 мин, объем водной фазы 100 мл).
Для десорбции вольфрама(VI) использовали растворы аммиака. Полная десорбция вольфрама(VI) возможна водными растворами аммиака при рН ≥ 5, что соответствует концентрации NH3 ≥ 0.1 моль/л.
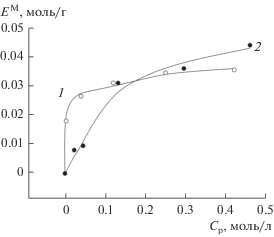
На основе экспериментальных данных, полученных при изменении исходной концентрации вольфрама(VI) в пределах 0.001–0.5 моль/л, построены изотермы сорбции вольфрама(VI) МСМ-41 в среде 0.001М и 3М хлороводородной кислоты (рис. 2).
Рис. 2.
Изотермы сорбции вольфрама(VI): mI-ДМГД = = 0.2 г, объем водной фазы 100 мл, концентрация хлороводородной кислоты 0.001 (1), 3 моль/л (2).
Полученные изотермы имеют лэнгмюровский вид. В связи с этим экспериментальные данные были обработаны в координатах изотермы Лэнгмюра. Расчет характеристик адсорбционных равновесий – величины предельной адсорбции ($Е_{{{\text{max}}}}^{{\text{М}}},$ моль/г) и константы адсорбционного равновесия (КL) – осуществляли путем линеаризации изотермы Ленгмюра [14] по уравнению:
(5)
$\frac{{{{C}_{{\text{p}}}}}}{{{{E}^{{\text{M}}}}}} = \frac{1}{{{{K}_{L}}E_{{\max }}^{{\text{M}}}}} + \frac{{{{C}_{{\text{p}}}}}}{{E_{{\max }}^{{\text{M}}}}},$Константы уравнения и коэффициент корреляции для изотермы 1 (рис. 2) представлены в табл. 2. Полученные значения коэффициентов корреляции не удовлетворяют условию линейной зависимости. Из этого следует, что поверхности как исходного, так и модифицированного МСМ не являются энергетически однородными.
Таблица 2.
Значения констант уравнений Фрейндлиха и Лэнгмюра при адсорбции ионов вольфрама(VI) из растворов с различной кислотностью
| Содержание HCl, моль/л | $Е_{{{\text{max}}}}^{{\text{М}}},$ ммоль/г | KL, л/моль | R2 | 1/n | n | KF | R2 |
|---|---|---|---|---|---|---|---|
| уравнение Лэнгмюра | уравнение Фрейндлиха | ||||||
| 0.001 | 40.02 | 36.45 | 0.9852 | 0.142 | 7.042 | 1.375 | 0.9952 |
| 3 | 68.02 | 4.72 | 0.9219 | 0.598 | 1.67 | 0.772 | 0.9756 |
В связи с этим провели обработку результатов по уравнению Фрейндлиха, линеаризуя полученные данные в координатах ln(EM) = f(lnCp) (табл. 2). Более высокие значения коэффициентов корреляции свидетельствуют в пользу адсорбции на энергетически неоднородной поверхности, когда в процессе адсорбции первоначально заполняются адсорбционные центры с наименьшей энергией, а сам процесс сопровождается ее непрерывным изменением [15].
Как величина $Е_{{{\text{max}}}}^{{\text{М}}},$ рассчитанная по уравнению Лэнгмюра, так и значения KF уравнения Фрейндлиха указывают на то, что изучаемые сорбенты обладают высокой сорбционной способностью по отношению к ионам вольфрама. Значение, обратное показателю степени в уравнении Фрейндлиха 1/n = 0.142, полученное при адсорбции из растворов 0.001М HCl, значительно меньше единицы, что указывает на химический характер сорбции.
Как показывают результаты, представленные на рис. 2, кислотность среды оказывает значительное влияние на протекание адсорбционного процесса: начальные участки изотермы адсорбции, полученной в 0.001М хлороводородной кислоте, отличаются значительной крутизной и стремительным выходом в область предельного заполнения, тогда как в 3М хлороводородной кислоте заполнение поверхности протекает более плавно. Такой характер зависимостей позволяет сделать предположение о различном характере адсорбции: хемосорбции в 0.001М и физической сорбции в 3М HCl.
Это подтверждают значения средних свободных энергий адсорбции, рассчитанные из графиков, построенных в координатах Дубинина–Радушкевича lnEM= f(ε2) (ε = RTln(1 + 1/Cp)) (рис. 3). Значение энергии адсорбции находили как
где KD – угловой коэффициент зависимостей lnEM= f(ε2).Рис. 3.
Расчет свободной энергии адсорбции ионов W(VI) на модифицированном МСМ-41, концентрация хлороводородной кислоты 0.001 (1), 3 моль/л (2).
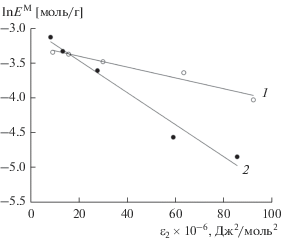
Эти значения составили 8.32 кДж/моль в 0.001М HCl и 4.672 кДж/моль в 3М HCl, что свидетельствует о физической природе взаимодействия ионов вольфрама с поверхностью модифицированного МСМ в 3М HCl и химическом взаимодействии в 0.001М HCl [16].
О разных типах взаимодействия ионов вольфрама(VI) с модифицированным МСМ при извлечении в условиях различной кислотности свидетельствуют и результаты ИК-спектроскопии.
В ИК-спектрах исходного ДМГД10 наблюдаются полосы поглощения амидной группы: валентные колебания свободной группы NH – 3282 см–1, Амид I – 1686 см–1, Амид II – 1530 см–1. В спектре комплексов ДМГД10 с вольфрамом(VI), выделенных при рН 1.2, появляются полосы поглощения солей третичных гидразидов – крыло в области 2700–2400 см–1, что свидетельствует об образовании протонированной формы лиганда в составе комплекса. Интенсивность полосы поглощения NH уменьшается, Амид I сдвигается в длинноволновую область. Появляются полосы поглощения в области 900–750 см–1, относящиеся к колебаниям оксида вольфрама(VI) [17]. В более кислых средах при концентрации хлороводородной кислоты 0.5 и 3 моль/л в спектре наблюдаются полосы исходного гидразида, оксида кремния и оксидов вольфрама, что свидетельствует о том, что при данных условиях в системе протекает не комплексообразование, а физическая сорбция.
При совместном присутствии в растворе в результате образования гетерополианионов вида ${\text{M}}{{{\text{o}}}_{{n - x}}}{{{\text{W}}}_{x}}{\text{O}}_{{3n + a}}^{{2a - }}$ молибден и вольфрам оказывают сильное взаимное влияние на результаты сорбции. Поэтому выводы, полученные при сорбции из индивидуальных растворов, подтверждены сорбцией из растворов, содержащих смесь ионов Мо(VI) и W(VI). Нами была изучена возможность разделения ионов W(VI) и Mo(VI) из хлористоводородных сред модифицированными сорбентами на основе МСМ-41 (табл. 3). Как следует из полученных результатов, в области кислых растворов ионы W(VI) и Mo(VI) извлекаются совместно. Наилучшее разделение возможно при концентрации хлороводородной кислоты 3 моль/л и до рН 1.5.
ЗАКЛЮЧЕНИЕ
Вольфрам(VI) может быть извлечен из хлороводородных сред кремнеземами со структурой пор MCM-41 и МСМ-48, модифицированными N',N'-диметилгидразидыми группами разветвленных высших карбоновых кислот на основе фракций Versatic 10 и Versatic 1519. В интервале от рН 0.5 и до концентрации HCl 3 моль/л извлечение W(VI) I-ДМГД (при соотношениях SiO2 : : ДМГД 1 : 0.8 и 1 : 1) протекает количественно. По мере увеличения рН в случае модифицированных сорбентов происходит переход от физической адсорбции к хемосорбции, что обусловлено способностью привитых групп к комплексообразованию с ионами вольфрама(VI) и делает возможным использование данных сорбентов, несмотря на их меньшую удельную поверхность по сравнению с исходной матрицей. Сорбция вольфрама(VI) и молибдена(VI) при концентрации хлороводородной кислоты от 3 моль/л и до рН 1.5 указывает на возможность совместного извлечения этих элементов и разделения их при использовании сорбента на основе MCM-41 – I-ДМГД.
Список литературы
Фофанова А.А., Трошкина И.Д., Абдрахманов Т.Г. Способ извлечения молибдена из вольфрамсодержащих растворов: Патент 2505612 Россия. Опубл. 27.01.2014.
Блохин А.А. Способ удаления вольфрама из растворов молибдатов: Пат. 2183226 Россия. Опубл. 10.06.2002.
Вольдман Г.М., Миронова Е.А. Состав соединений, образующихся при экстракции пероксомолибдатов и пероксовольфраматов солями четвертичных аммониевых оснований // Журн. неорган. химии. 1990. Т. 35. № 4. С. 888–892.
Вольдман Г.М., Зеликман А.Н. Экстракционные процессы извлечения вольфрама и разделения молибдена и вольфрама // Журн. неорган. химии. 1993. Т. 38. № 7. С. 1234–1245.
Медков М.А., Смольков А.А., Чернышов Б.Н. и др. Экстракция вольфрама длинноцепочечными алифатическими аминами из фторидных растворов // Журн. неорган. химии. 1990. Т. 35. № 9. С. 2421–2424.
Батуева Т.Д., Туктарева Т.А., Байгачева Е.В., Радушев А.В. Способ извлечения из водных сульфатных растворов ионов вольфрама(VI) и/или молибдена(VI): Пат. № 2405049. Россия. Опубл. 27.11.2010.
Батуева Т.Д., Пашкина Д.А., Темерев С.В. Экстракция вольфрама(VI) и молибдена(VI) гидразидами (N',N'-диметилгидразидами) трет-карбоновых кислот Versatic из кислых растворов и их разделение // Изв. Алт. гос. ун-та, 2014. № 3(1). С. 166–172. https://doi.org/10.14258/isvasu(2014)3.1-30
Perez-Quintanilla D., Sanchez A., Hierro I. et al. Preparation, Characterization, and Zn2+ Adsorption Behavior of Chemically Modified MCM-41 with 5-mercapto-l-methyltetrazole // J. Colloid Interface Sci. 2007. V. 313. P. 551–562. https://doi.org/10.1016/j.jcis.2007.04.063
Northcott K.A., Miyakawa K., Oshima S., Komatsu Y., Perera J.M., Stevens G.W. The Adsorption of Divalent Metal Cations on Mesoporous Silicate MCM-41 // Chem. Eng. J. 2010. V. 157. P. 25–28. https://doi.org/10.1016/j.cej.2009.10.038
Lam K.F., Chen X.Q., Yeung K.L., McKay G. Anion Effect on Cu2+ on NH2-MCM-41 // Ind. Eng. Chem. Res. 2008. V. 47. P. 9376–9383. http://pubs.acs.org/doi/abs/10.1021/ie701748b
Aleksandr V. Radushev, Tatiana D. Batueva, Aleksey V. Kataev. Versatic Functional Tert-Carboxylic Acids as Metal Extractive Agents // Separation Science and Technol. 2015. V. 50. № 4. P. 512–519. https://doi.org/10.1080/01496395.2014.968258
Батуева Т.Д., Кондрашова Н.Б., Кузьмичева Н.Д. и др. Физико-химические свойства мезопористых кремнеземов, модифицированных гидразидными и амидными функциональными группами // Журн. прикл. химии. 2017. Т. 90. Вып. 11. С. 1746–1752.
Бусев А.И., Типцова В.Г., Иванов В.М. Практическое руководство по аналитической химии редких элементов. М.: Химия, 1966. С. 252–253.
Фролов Ю.Г. Курс коллоидной химии. Поверхностные явления и дисперсные системы. М.: ООО ТИД “Альянс”, 2004. 464 с.
Adamczuk A. Equilibrium, Thermodynamic and Kinetic Studies on Removal of Chromium, Copper, Zinc and Arsenic from Aqueous Solutions onto Fly Ash Coated by Chitosan // Chem. Eng. J. 2015. V. 274. P. 200–212. https://doi.org/10.1016/j.cej.2015.03.088
Никифорова Т.Е., Козлов В.А., Родионова М.В., Модина Е.А. Сорбция ионов цинка продуктами, содержащими целлюлозную и белковую составляющие // Изв. вузов. Химия и хим. технология. 2009. Т. 52. Вып. 3. С. 27–31.
Бусев А.И., Иванов В.М., Соколова Т.А. Аналитическая химия вольфрама. М.: Наука, 1976. 240 с.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


