Неорганические материалы, 2019, T. 55, № 11, стр. 1235-1240
Протонная проводимость акцепторно допированного Sr2CeO4
В. П. Горелов 1, В. Б. Балакирева 1, *, В. А. Воротников 1, 2
1 Институт высокотемпературной электрохимии УрО Российской академии наук
620219 Екатеринбург, ул. Академическая, 20, Россия
2 Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
620002 Екатеринбург, ул. Мира, 19, Россия
* E-mail: balakireva@ihte.uran.ru
Поступила в редакцию 30.11.2018
После доработки 15.04.2019
Принята к публикации 14.05.2019
Аннотация
Синтезированы керамические образцы Sr2Ce0.95Yb0.05О4 с использованием метода Печини и исследована их электропроводность четырехзондовым методом и методом импеданса в зависимости от температуры (300–900°С), ${{р}_{{{{{\text{О}}}_{{\text{2}}}}}}}$ и ${{р}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ (40–2500 Па). На воздухе при высоких температурах этот материал является смешанным кислородно-дырочным проводником с преимущественно кислородной проводимостью, а при пониженных температурах – преимущественно протонным проводником, причем σ ~ $р_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}.$
ВВЕДЕНИЕ
В 1966 г. Stotz и Wagner представили все квазихимические реакции взаимодействия водяного пара и водорода с оксидами, которые приводят к появлению водородсодержащих дефектов в кристалле [1]. Однако достаточно высокая протонная проводимость в оксидах была обнаружена только спустя 15 лет при изучении перовскита SrCe0.95Yb0.05O3 – α [2]. А так как протонная проводимость этого оксида при определенных условиях была униполярной, это породило исследовательский бум в связи с перспективами практического применения подобных электролитов в твердооксидных топливных элементах [обзоры 3–6].
Стойкость электролитов на основе SrCeO3 в атмосферах, содержащих пары воды и, особенно, СО2, оказалась неудовлетворительной, и исследователи переключились на другие материалы. Однако в системе СеО2–SrO существует еще одно соединение – Sr2CeО4, имеющее, как и SrCeO3, орторомбическую сингонию, но не перовскитовую структуру (пр. гр. Pbam, параметры решетки: a = 6.11897(9) Å, b = 10.3495(2) Å, c = 3.5970(1) Å) [7, 8]. Соединение Sr2CeО4 привлекло внимание исследователей хорошими люминесцентными характеристиками и стабильными физическими и химическими свойствами [7–10].
Принимая во внимание стабильность, а также псевдофлюоритовую структуру подобных соединений, представляло интерес исследовать электрофизические свойства акцепторно допированных материалов на основе Sr2CeО4, в том числе наличие высокотемпературной протонной проводимости, и сравнить со свойствами материалов на основе эквимолярного соединения SrCeO3. Введение акцепторной примеси в подрешетку церия ведет к образованию кислородных вакансий и, как следствие, к растворению водяного пара с их участием. По аналогии с SrCe0.95Yb0.05O3 – α [2] исследование проведено также на допированном иттербием образце Sr2Ce0.95Yb0.05O4 – α.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Изготовление образцов. Образцы Sr2Ce0.95Yb0.05O4 – α (далее Sr2Ce:Yb) были изготовлены классическим методом Печини, основанным на комплексообразовании металлического катиона с лимонной кислотой с последующей полиэтерификацией хелатов с этиленгликолем. Материалами для синтеза образцов служили: SrСО3 (“ос. ч.”), Ce(NO3) ∙ · 6H2O (99.99%), Yb2O3 (99.99%), лимонная кислота (“х. ч.”), этиленгликоль (“х. ч.”). Исходные реактивы растворяли в расчетном количестве азотной кислоты HNO3 (1 : 1). В раствор нитратов последовательно добавляли лимонную кислоту и этиленгликоль и затем раствор медленно упаривали до вязкого состояния при температуре ~120°С. После сжигания и последующей прокалки при 800°С был получен белый пушистый порошок с удельной поверхностью 24 ± 0.2 м2/г. Образцы спекали на воздухе при 1400°С (2 ч) при скорости нагрева и охлаждения 300°С/ч.
РФА выполняли на дифрактометре Rigaku Dmax 2200 (CuKα-излучение) при комнатной температуре после синтеза и после всех опытов. Анализ результатов проводили с использованием базы данных JCPDS.
Измерение электропроводности. Электропроводность измеряли в режиме охлаждения на образцах с платиновыми электродами двумя методами: автоматизированным четырехзондовым методом на постоянном токе в интервале температур 600–900°С и методом импедансной спектроскопии (0.1–106 Гц) с использованием импедансметра Parstat 2273 (USA) в интервале 300–800°C. Платиновые электроды наносили методом окрашивания, припекали при 1000°С (1 ч) и активировали оксидом празеодима. Измерения обоими методами проводили на одних и тех же образцах. Измерения четырехзондовым методом повторяли через 10°С с выдержкой 1 ч при каждой температуре, начиная с температуры 900°С, при которой образцы выдерживали сутки. В случае импедансной спектроскопии длительность выдержек после изменения внешних параметров (температура, ${{р}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$) составляла 1–3 сут. Значения общего сопротивления определяли из импедансных спектров по точке пересечения низкочастотной полуокружности с осью действительных сопротивлений, а по точке пересечения высокочастотной полуокружности были определены объемные сопротивления. Этот метод позволяет измерять электропроводность до более низких температур.
Влажность воздуха (${{р}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 610 и 2500 Па) задавали его циркуляцией через барботеры с контролируемой температурой воды (0 и 24°С). “Сухую” атмосферу создавали циркуляцией воздуха через колонку с цеолитами (остаточное ${{р}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ ~ 40 Па, гигрометр “Байкал-3М”).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты РФА. По данным РФА, синтезированные образцы Sr2Ce:Yb были однофазными и имели орторомбическую кристаллическую структуру, согласующуюся с данными базы JCPDS (ICDD) № 89-5546 для Sr2CeО4 (рис. 1). Геометрическая плотность (отношение массы к геометрическому объему) полученной керамики равна 5.03 г/см3, что составляло 91% от теоретической. Цвет керамики белый, в отличие от практически черного цвета образцов SrCe0.95Yb0.05O3 [11].
Рис. 1.
Дифрактограммы керамического образца Sr2CeO4:5Yb после синтеза при 1400°С (1), после проведенных исследований (2).

Дифрактограмма Sr2Ce:Yb не изменилась и после завершения экспериментов по измерению электропроводности в различных условиях (рис. 1), т.е. материал действительно оставался стабильным в течение всего времени эксперимента.
Дефектность структуры Sr2Ce:Yb. Введение акцепторной примеси Yb3+ в подрешетку Се4+ исследуемого церата приводит к образованию дефектов замещения ${\text{Yb}}_{{{\text{Ce}}}}^{'}$ и кислородных вакансий $V_{{\text{O}}}^{{\centerdot \centerdot }}{\text{:}}$
(1)
${\text{Yb}}{{{\text{O}}}_{{1.5}}}( - {\text{Сe}}{{{\text{O}}}_{{\text{2}}}}) \to {\text{Yb}}_{{{\text{Ce}}}}^{'} + 0.5V_{{\text{O}}}^{{\centerdot \centerdot }} + 1.5{\text{O}}_{{\text{O}}}^{{ \times }}.$Тогда во влажной окислительной атмосфере в оксиде Sr2Ce:Yb будут протекать две классические квазихимические реакции: с кислородом газовой фазы (2) и с водяным паром (3). Эти реакции поставляют в оксид соответственно дырки ${{{\text{h}}}^{\centerdot }}$ и протоны ${\text{OH}}_{{\text{O}}}^{\centerdot },$ локализованные на ионах кислорода ${\text{O}}_{{\text{O}}}^{ \times }{\text{:}}$
(2)
${1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{{{\text{O}}}_{2}} + V_{{\text{O}}}^{{\centerdot \centerdot }} = {\text{ }}2{{{\text{h}}}^{\centerdot }} + {\text{O}}_{{\text{O}}}^{{ \times }},$(3)
${{{\text{Н}}}_{{\text{2}}}}{\text{О}} + V_{{\text{O}}}^{{\centerdot \centerdot }} + {\text{O}}_{{\text{O}}}^{{ \times }} = 2{\text{OH}}_{{\text{O}}}^{\centerdot }.$В соответствии с законом действующих масс, концентрации дырок и протонов будут описываться выражениями
(4)
$р = {{\left( {{{{{К}_{2}}\left[ {V_{{\text{O}}}^{{\centerdot \centerdot }}} \right]} \mathord{\left/ {\vphantom {{{{К}_{2}}\left[ {V_{{\text{O}}}^{{\centerdot \centerdot }}} \right]} {\left[ {{\text{O}}_{{\text{O}}}^{{ \times }}} \right]}}} \right. \kern-0em} {\left[ {{\text{O}}_{{\text{O}}}^{{ \times }}} \right]}}} \right)}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}p_{{{{{\text{O}}}_{2}}}}^{{{1 \mathord{\left/ {\vphantom {1 4}} \right. \kern-0em} 4}}},$(5)
$\left[ {{\text{OH}}_{{\text{O}}}^{\centerdot }} \right] = {{\left( {{{K}_{3}}\left[ {V_{{\text{O}}}^{{\centerdot \centerdot }}} \right]\left[ {{\text{O}}_{{\text{O}}}^{{ \times }}} \right]} \right)}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}p_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}},$Реакции (2) и (3) не являются независимыми, т.к. концентрации дырок, протонов и кислородных вакансий связаны условием электронейтральности
(6)
$р + \left[ {{\text{OH}}_{{\text{O}}}^{\centerdot }} \right] + 2\left[ {V_{{\text{O}}}^{{\centerdot \centerdot }}} \right] = \left[ {{\text{Yb}}_{{{\text{Ce}}}}^{'}} \right].$Поэтому растворение водяного пара в Sr2Ce:Yb, уменьшая концентрацию вакансий, уменьшает и концентрацию дырок.
В восстановительной атмосфере в оксиде появляются электроны и увеличивается концентрация кислородных вакансий вследствие потери оксидом кислорода:
(7)
${\text{O}}_{{\text{O}}}^{{ \times }} = {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{{{\text{О}}}_{2}} + V_{{\text{O}}}^{{\centerdot \centerdot }} + 2{\text{е'}}{\text{.}}$Концентрация электронов в оксиде равна
(8)
$n = {{К}_{7}}{{\left[ {V_{{\text{О}}}^{{\centerdot \centerdot }}} \right]}^{{{{ - 1} \mathord{\left/ {\vphantom {{ - 1} 2}} \right. \kern-0em} 2}}}}p_{{{{{\text{O}}}_{2}}}}^{{{{ - 1} \mathord{\left/ {\vphantom {{ - 1} 4}} \right. \kern-0em} 4}}},$Условие электронейтральности в восстановительной атмосфере имеет вид
(9)
$\left[ {{\text{OH}}_{{\text{O}}}^{\centerdot }} \right] + 2\left[ {V_{{\text{O}}}^{{\centerdot \centerdot }}} \right] = \left[ {{\text{Yb}}_{{{\text{Ce}}}}^{'}} \right]\,\, + \,\,~n.$Электропроводность Sr2CeO4:5Yb. Годографы вектора импеданса образца Sr2Ce:Yb имели вид одной полуокружности (емкость С ≈ 10–10–11 Ф/см2). Из этих годографов (рис. 2) были определены значения общего сопротивления по низкочастотной точке пересечения годографа с осью действительных сопротивлений. При температурах ниже 600°С полуокружность экстраполировалась в начало координат, т.е. общая проводимость была практически равна межзеренной. При высоких температурах (600–800°С) полуокружность отсекала некоторый отрезок от начала координат, что позволяло определить величину сопротивления объема зерен. По этим данным построены температурные зависимости межзеренной и объемной удельной электропроводностей.
Рис. 2.
Спектры электрохимического импеданса керамики Sr2CeO4:5Yb при различных температурах (${{p}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ = 2500 Па).

Измерения общей электропроводности Sr2Ce:Yb 4-зондовым методом в зависимости от влажности воздуха показали, что при высокой температуре (800°С) проводимость Sr2Ce:Yb не зависит от влажности, но при низкой температуре, например 450°С (измерения импедансным методом), такая зависимость от ${{р}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ наблюдается, причем σ ~ $p_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}},$ в соответствии с уравнением (4) (рис. 3). Эти зависимости говорят о малой растворимости водяного пара при высокой температуре, вследствие чего в этой области влажность почти не влияет на проводимость исследуемого оксида. Однако с понижением температуры растворимость водяного пара возрастает, увеличивая долю и величину протонной проводимости согласно уравнению (3). Такое поведение характерно для протонных проводников. Поэтому температурные зависимости электропроводности Sr2Ce:Yb, измеренные при различных влажностях воздуха (${{p}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ = 40, 610 и 2500 Па), в области высоких температур совпадают, а ниже 600°С наблюдается возрастание проводимости с увеличением влажности (рис. 4). Проводимость Sr2CeYb ниже 600°С при высокой влажности (${{p}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ = 2500 Па) линейна, а ее эффективная энергия активации близка к 0.5 эВ (0.53 ± 0.02 эВ), как обычно и наблюдается для протонной проводимости в протонпроводящих оксидах.
Рис. 3.
Зависимости суммарной проводимости Sr2CeO4:5Yb от парциального давления паров воды при 800 и 450°С.
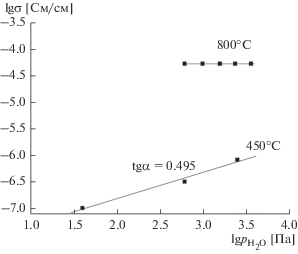
Рис. 4.
Температурные зависимости общей проводимости образцов Sr2CeO4:5Yb, измеренные 4-зондовым методом (темные символы) и методом электрохимического импеданса (светлые символы) при различных ${{p}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}{\text{:}}$ 1 – объемная проводимость, 2 – суммарная – 2500 Па, 3 – 613, 4 – 40 Па; 5 – проводимость керамического образца SrCe0.95Yb0.05O3 – α по данным [12], 6 – проводимость монокристалла SrCe0.95Y0.05O3 – α по данным [13].

Температурные зависимости электропроводности Sr2Ce:Yb, измеренные при ${{p}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ = 610 и 2500 Па, начинают сходиться ниже 400°С (рис. 4), что указывает на насыщение по реакции (3) кислородных вакансий образца водой. Насыщение превращает условие (6) в условие (10):
(10)
$\left[ {{\text{OH}}_{{\text{O}}}^{\centerdot }} \right] \approx \left[ {{\text{Yb}}_{{{\text{Ce}}}}^{'}} \right]$и Sr2Ce:Yb становится практически протонным проводником во влажном воздухе ниже 400°С.
Электропроводность объема зерен Sr2Ce:Yb, которую удалось выделить при высоких температурах, превосходит межзеренную проводимость (рис. 4). Для сравнения отметим, что температурный наклон проводимости нашей керамики близок к наклону для керамики SrCe0.95Yb0.05O3 – α [12], а температурный наклон для объема зерен близок к наклону для монокристалла SrCe0.95Y0.05O3 – α [13]. Величины объемной и межзеренной (общей) проводимостей Sr2Ce:Yb невелики по сравнению с материалами на основе SrCeO3, что обусловлено, вероятно, сильной анизотропией структуры Sr2Ce:Yb [7, 8].
Изучение зависимости электропроводности от парциального давления кислорода четырехзондовым методом при 800°С показало, что при понижении ${{р}_{{{{{\text{О}}}_{{\text{2}}}}}}}$ проводимость уменьшается, указывая на наличие дырочной проводимости, и выходит на плато ионной проводимости (рис. 5). Эта высокотемпературная ионная проводимость в окислительных условиях является кислородной, если принять во внимание, что проводимость не зависит от влажности в этих условиях. Из сравнения ионной проводимости на плато и проводимости в атмосфере воздуха следует (рис. 5), что доля ионной (кислородной) проводимости Sr2Ce:Yb в атмосфере воздуха при 800°С составляет около 76%. С понижением температуры доля ионной проводимости будет повышаться, в том числе, за счет появления протонного переноса. Дырочная проводимость зависит от парциального давления кислорода как $р_{{{{{\text{О}}}_{2}}}}^{{{1 \mathord{\left/ {\vphantom {1 4}} \right. \kern-0em} 4}}},$ так и должно быть, если в условии электронейтральности (6) можно пренебречь концентрациями протонов и дырок по сравнению с концентрацией допанта.
Рис. 5.
Зависимости электропроводности Sr2CeO4:5Yb от парциального давления кислорода при 800°С при ${{p}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ = 2500 Па (±1/4 и –1/6 – tg угла наклона).
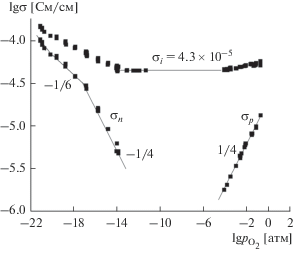
При переходе в восстановительную область проводимость Sr2Ce:Yb увеличивается, и если это увеличение рассматривать как появление электронной (n-типа) проводимости, то вначале наблюдается зависимость от $р_{{{{{\text{О}}}_{{\text{2}}}}}}^{{{{ - 1} \mathord{\left/ {\vphantom {{ - 1} 4}} \right. \kern-0em} 4}}},$ как и должно быть, если условие электронейтральности (9) переходит в условие
(11)
$2\left[ {V_{{\text{O}}}^{{\centerdot \centerdot }}} \right] = \left[ {{\text{Yb}}_{{{\text{Ce}}}}^{'}} \right].$В более восстановительных атмосферах наблюдается зависимость от $р_{{{{{\text{О}}}_{{\text{2}}}}}}^{{{{ - 1} \mathord{\left/ {\vphantom {{ - 1} 6}} \right. \kern-0em} 6}}},$ что соответствует условию электронейтральности
Но подвижность электронов на несколько порядков выше подвижности кислородных вакансий, и при выполнении условия (12) электронная проводимость на столько же порядков будет выше ионной. Из эксперимента же следует, что электронная проводимость в области излома, т.е. в области перехода зависимости от $р_{{{{{\text{О}}}_{{\text{2}}}}}}^{{{{ - 1} \mathord{\left/ {\vphantom {{ - 1} 4}} \right. \kern-0em} 4}}}$ к $р_{{{{{\text{О}}}_{{\text{2}}}}}}^{{{{ - 1} \mathord{\left/ {\vphantom {{ - 1} 6}} \right. \kern-0em} 6}}},$ имеет тот же порядок величины, что и ионная проводимость.
Вопрос о природе появляющегося носителя в водородсодержащей атмосфере требует отдельного изучения. Отметим, что при изучении церата бария BaCe1 – xNdxO3 – α [14] нами также наблюдалось увеличение проводимости в восстановительной области, но, как показывали измерения чисел переноса ионов методом ЭДС, проводимость оставалась ионной. На возможное наличие Н–-переноса в титанате стронция SrTi1 – xFexO3 – x/2 в восстановительной атмосфере может указывать смена знака ЭДС пароводяной концентрационной ячейки при переходе в восстановительную область, о чем сообщали авторы работы [15].
ЗАКЛЮЧЕНИЕ
Проведенные синтез и исследование электропроводности керамических образцов Sr2Ce0.95Yb0.05O4 – α в температурном интервале 300–900°С и широком интервале влажностей атмосферы (${{р}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = = 40–2500 Па) показали, что ионная проводимость в высокотемпературной области (600–900°С) даже во влажном воздухе преимущественно кислородная, а ниже 400–500°С – преимущественно протонная с эффективной энергией активации 0.53 ± 0.02 эВ. Объемная проводимость исследованного церата, которую удалось выделить при высокой температуре, превосходит межзеренную, но обе проводимости уступают проводимостям протонных электролитов на основе SrCeO3, что обусловлено, вероятно, сильной анизотропией структуры Sr2Ce0.95Yb0.05O4 – α.
Список литературы
Stotz S., Wagner C. Die Loslichkeit von Wasserdampf und Wasserstoff in Festen Oxiden // Ber. Bunsen-Ges. Phys. Chem. 1966. B. 70. № 8. P. 781–788.
Iwahara H., Esaka T., Uchida H., Maeda N. Proton Conduction in Sintered Oxides and its Application to Steam Electrolysis for Hydrogen Production // Solid State Ionics. 1981. V. 3/4. P. 359–363.
Malavasi L., Fisher C.A.J., Islam M.S. Oxide-ion and Proton Conducting Electrolyte Materials for Clean Energy Applications: Structural and Mechanistic Features // Chem. Soc. Rev. 2010. V. 39. P. 4370–4387.
Medvedev D.A., Lyagaeva J.G., Gorbova E.V., Demin A.K., Tsiakaras P. Advanced Materials for SOFC Application: Strategies for the Development of Highly Conductive and Stable Solid Oxide Proton Electrolytes // Prog. Mater. Sci. 2016. V. 75. P. 38–79.
Ярославцев А.Б. Основные направления разработки и исследования твердых электролитов // Успехи химии. 2016. Т. 85. № 11. С. 1255–1276.
Norby T. Advances in Proton Ceramic Fuel Cell, Steam Electrolyzers and Dehydrogenation Reactors Based on Materials and Process Optimizations // ECS Transactions. 2017. V. 80. № 9. P. 23–32. https://doi.org/10.1149/08009.0023ecst
Danielson E., Devenney M., Giaquinta D.M, Golden J.H., Haushalter R.C., Mcfarland E.W., Poojary D.M., Reaves C.M., Weinberg W.H., Wu X.D. A Rare-Earth Phosphor Containing One-Dimensional Chains Identified Through Combinatorial Methods // Science. 1998. V. 279. P. 837–839.
Danielson E., Devenney M., Giaquinta D.M., Golden J.H., Haushalter R.C., Mcfarland E.W., Poojary D.M., Reaves C.M., Weinberg W.H., Wu X.D. X-ray Powder Structure of Sr2CeO4: A New Luminescent Material Discovered by Combinatorial Chemistry // J. Mol. Struct. 1998. V. 470. № 1. P. 229–235.
Murthy K.V.R., Rao B.N., Rajasekhar B.N., Kumar B.W.R., Suresh K., Rao B.S. Effect of Flux on the Formation of Sr2CeO4 Phosphor Doped With Er // Phys. Proc. 2012. V. 29. P. 65–69.
Quanlan Xiao, Guoping Dong, Jianrong Qiu. Synthesis and Up-conversion Luminescence of Yb3+/Ln3+ (Ln = Er, Tm, Ho) Co-Doped Strontium Cerate by Pechini Method // J. Am. Ceram. Soc. 2014. V. 97. № 6. P. 1899–1904.
Горелов В.П., Зубанкова Д.С. О некоторых свойствах протонных твердых электролитов на основе SrCeO3 // Электрохимия. 1992. Т. 28. № 7. С. 944–946.
Kosacki I., Tuller H.L. Mixed Conductivity in SrCe0.95Yb0.05O3 Protonic Conductors // Sold State Ionics. 1995. V. 80. P. 223–229.
Shin S., Huang H.H., Ishigame M., Iwahara H. Protonic Conduction in Single Crystals of SrZrO3 and SrCeO3 Doped with Y2O3 // Sold State Ionics. 1990. V. 40/41. P. 910–913.
Арестова Н.В., Горелов В.П. Электропроводность и ионный перенос в перовските BaCe1– xNdxO3 – α // Электрохимия. 1994. Т. 30. № 8. С. 988–990.
Steinsvik S., Larring Y., Norby T. Hydrogen Ion Conduction in Iron-Substituted Strontium Titanate, SrTi1 – xFexO3 – x/2 (0 ≤ x ≤ 0.8) // Solid State Ionics. 2001. V. 143. P. 103–116.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


