Неорганические материалы, 2019, T. 55, № 11, стр. 1224-1229
Синтез композиционного материала на основе смеси фосфатов кальция и альгината натрия
А. А. Цыганова 1, *, О. А. Голованова 1
1 Омский государственный университет им. Ф.М. Достоевского
644077 Омск, пр. Мира, 55-А, Россия
* E-mail: a.a.tsyganova1993@yandex.ru
Поступила в редакцию 06.03.2019
После доработки 15.05.2019
Принята к публикации 06.06.2019
Аннотация
Получен композиционный материал на основе смеси фосфатов кальция и альгината натрия, изучены состав, морфология полученных образцов и динамическое растворение. Установлено, что внедрение порошкового материала в матрицу альгината натрия не изменяет его состав, однако увеличивает удельную поверхность образца и скорость резорбции. Подобраны оптимальные условия синтеза композиционного материала: соотношение наполнитель/матрица, температура и время сушки.
ВВЕДЕНИЕ
В настоящее время актуальными являются вопросы создания остеопластических материалов для медицинских целей [1, 2], что связано с распространенностью патологических состояний костной ткани и старением населения в целом. Индустрия биоматериалов стремительно развивается и каждый год появляются все новые виды остеопластических материaлов: натуральные материалы (скелет кораллов, коллаген, желатин, хитозан) [3–6] и синтетические полимеры (полиэфиры, полилактиды, полигликолиды и их сополимеры) [7, 8], кальцийфосфатная керамика [9, 10] и биостекла [11, 12].
Широкое применение в этой сфере получили ортофосфаты кальция, однако они не отвечают требованиям, предъявляемым к остеопластическим материалам: хорошая переносимость тканями; пористость для обеспечения прорастания кости; биодеградация, соотносимая со скоростью остеорегенерации; возможность стерилизации без изменения качеств; доступность и низкая цена.
Исторически первым для заполнения дефектов костной ткани был предложен синтетический гидроксиапатит (ГА; Са10(РО4)6(ОН)2), мало растворимый в физиологических условиях и, вследствие этого, наименее используемый в настоящее время в медицине. Особое внимание сегодня привлекают материалы на основе октакальциевого фосфата (ОКФ) – прекурсора биологического апатита, который участвует в ранней стадии минерализации, т.е. является центром кристаллизации в кости и зубной эмали с последующим формированием осажденного ГА и далее переходом в ГА с высокой степенью кристалличности [13]. Однако получить чистый ОКФ трудно, ввиду того что он является метастабильной фазой, поэтому его часто используют в смеси с другими фосфатами кальция.
С другой стороны, высокий потенциал применения в медицине имеют биополимеры. В частности, материалы на основе альгината – полисахарида, который обладает широким спектром полезных для человека свойств и может выполнять функцию эластичного каркаса [14]. В настоящее время актуальным является сравнительно новый подход создания композиционных материалов на основе фосфатов кальция и биополимеров [15–17].
Целью данной работы является получение наиболее биорезорбируемого и пористого материала на основе альгината натрия и смеси ортофосфатов кальция.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
На основе данных [18, 19] был выбран способ синтеза смеси ортофосфатов кальция путем осаждения из водного раствора. Осаждение проводилось при температуре 40°С, рН 6.5, τ = 48 ч и введении добавки ионов магния в концентрации 12.5 ммоль/л. В основе данного способа лежит следующая химическая реакция:
(1)
$\begin{gathered} 8{\text{CaC}}{{{\text{l}}}_{{\text{2}}}} + 6{\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{HP}}{{{\text{O}}}_{4}} + 4{\text{NаOH}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = \,\,{\text{C}}{{{\text{a}}}_{{\text{8}}}}{{{\text{H}}}_{{\text{2}}}}{{\left( {{\text{P}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{6}}}}\,\cdot\,\,\,\,5{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 16{\text{NaCl}}. \\ \end{gathered} $Смешивание растворов проводилось при охлаждении (0–5°С).
После вызревания осадка под маточным раствором в течение 48 ч твердую фазу отделяли от раствора фильтрованием, высушивали при температуре ~80°С до постоянной массы и полного удаления химически не связанной воды, взвешивали и исследовали с применением группы физико-химических методов.
Для получения композиционного материала в качестве биополимера использовали альгинат натрия (E-401). Готовили 2%-ную водную суспензию полимера. В суспензию вводили порошковый материал в количестве 10, 20, 50 мас. % и подвергали интенсивному перемешиванию. Вспенивание осуществляли, используя магнитную мешалку. Пену помещали в тигель и высушивали при температуре 200°С (композит 1) и 400°С (композит 2).
Фазовый состав полученных образцов исследован с помощью РФА (ДРОН-3). Дифрактограммы получали “методом порошка”. Съемка дифрактограмм проводилась в интервале 10°–60°. Идентификация пиков на дифрактограммах проводилась с помощью картотеки JCPDS и программных пакетов DifWin4.0 и Crystallographica Search-Match. Содержание присутствующих фаз в образцах определяли по методу корундовых чисел (метод Чанга, программа Crystallographica Search-Match).
По дифрактограммам оценивали размеры кристаллитов по формуле Селякова–Шеррера:
где D – размер кристаллита (Å), который оценивался по рефлексу 002, k – фактор формы, примерно равный 0.9; λ – длина волны, применяемая для анализа (1.54056 Å); βm – физическое уширение линии образца, обусловленное малыми размерами кристаллитов (ширина пика на половине высоты, или интегральная ширина, выражается в радианах и определяется по дифрактограмме образца); θ – угол дифракции (θ = 12.92°).ИК-спектры осадков регистрировали на спектрофотометре ФТ-02. Пробы готовили прессованием в таблетки с KBr.
Измерение удельной поверхности образцов по методу БЭТ проводили на адсорбционном приборе Gemini 2380 по адсорбции стандартного газа азота при 300°С в течение 3 ч.
Морфологию полученных осадков изучали с помощью микроскопа бинокулярного серии XSP-104.
Исследование резорбции полученных образцов проводилось путем их динамического растворения при постоянном перемешивании в растворе 0.9%-ного хлорида натрия (рН ≈ 7), в ацетатном буфере (pH 4.75) и в растворе соляной кислоты (рН 1) при температуре 22°C. Через определенные промежутки времени (τ = 0–90 мин) с помощью прямой потенциометрии фиксировали значения кислотности среды и показателя концентрации ионов кальция в растворе.
Математическую обработку всех данных осуществляли с использованием Static2 и Statistica.10 из статистического пакета StatSoft.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
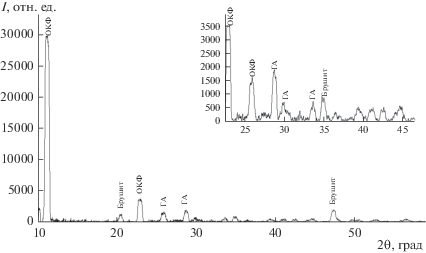
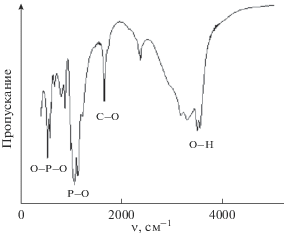
При синтезе смеси ортофосфатов кальция методами РФА и ИК-Фурье-спектроскопии установлено, что полученный осадок представлен фазами ОКФ, брушита и ГА (рис. 1, 2), основным интенсивным линиям которых соответствуют углы 2θ: ОКФ – 4.8°, 11.4°, 22.8°; ГА – 25.9°, 29.6°, 31.8°; брушита – 20.4°, 47.3°, 35.2°. Размеры кристаллитов ОКФ – 2.96 нм, брушита – 2.45 нм, ГА – 2.15 нм.
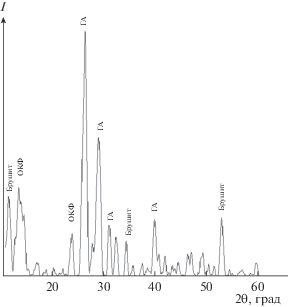
По результатам РФА получено, что внедрение порошкового материала в матрицу альгината натрия не изменяет его состав вне зависимости от соотношения наполнитель/матрица. Так, например, композит с соотношением 20/80 представлен смесью фаз ОКФ, брушита и ГА, основным интенсивным линиям которых соответствуют углы 2θ (рис. 3): ОКФ – 11.4°, 22.8°; ГА – 25.9°, 29.6°, 31.8°, 49.2°; брушита – 20.4°, 35.2°, 52.3°.
Из литературных данных известно, что альгинат натрия подвергается значительному структурированию в присутствии ионов кальция, которые замещают ионы натрия и сшивают полимерные полисахаридные цепи между собой [20], о чем свидетельствует резкое увеличение вязкости суспензии даже при добавлении небольших количеств ортофосфатов кальция.
Поверхность полученных композитов выглядит как пористый матрикс, в котором равномерно распределена твердая фаза (рис. 4).
Рис. 4.
Фотографии композиционного материала на основе альгината натрия с содержанием наполнителя 20%: tсушки = 200 (а), 400°С (б).

Методом БЭТ установлено, что удельная поверхность композиционного материала, характеризующегося соотношением наполнитель/матрица 20/80, возрастает по сравнению с порошковым материалом от 23 до 37 м2/г, а увеличение температуры сушки образца от 200 до 400°С уменьшает удельную поверхность до 33 м2/г.
Для изучения биорезорбируемости образцов было проведено их растворение в 0.1 М растворе HCl, ацетатном буферном растворе и 0.9%-ном растворе NaCl. Экспоненциальная зависимость (рис. 5) соответствует кинетике реакции первого порядка, поэтому в качестве количественной меры растворения можно рассматривать начальную скорость растворения (табл. 1), определенную как тангенс угла наклона линейного участка прямой, построенной в координатах pCa = f(τ).
Рис. 5.
Кинетические кривые растворения (1, 2 соответствуют композитам 1 и 2) композиционного материала с содержанием наполнителя 20% в 0.1 М растворе HCl (а), в ацетатном буферном растворе (б), в 0.9%-ном растворе NaCl (в).
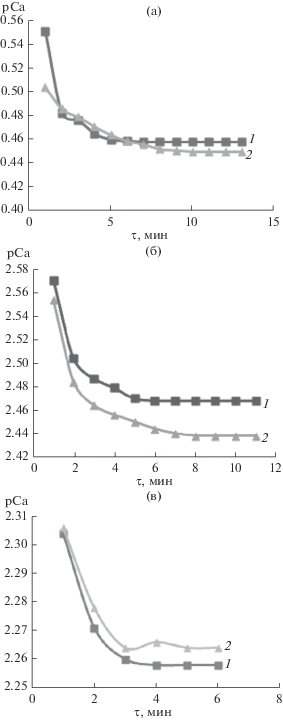
Таблица 1.
Влияние параметров процесса на начальную скорость растворения
| Среда | Соотношение наполнитель/матрица в композите | Начальная скорость, моль/(л мин) | |
|---|---|---|---|
| 200°С* | 400°С* | ||
| 0.1 М раствор HCl | 100/0 | 4.9 | |
| 10/90 | 13.3 | 6.2 | |
| 20/80 | 12.2 | 5.6 | |
| 50/50 | 10.8 | 5.1 | |
| Ацетатный буферный раствор | 100/0 | 12.1 | |
| 10/90 | 18.1 | 15.4 | |
| 20/80 | 17.9 | 13.1 | |
| 50/50 | 16.5 | 12.6 | |
| 0.9%-ный раствор NaCl | 100/0 | 9.0 | |
| 10/90 | 16.6 | 10.2 | |
| 20/80 | 14.9 | 9.6 | |
| 50/50 | 13.8 | 8.8 | |
Из полученных данных (табл. 1) следует, что резорбируемость полученных композитов выше, чем у соответствующего образца без биополимера, но при увеличении соотношения наполнитель/матрица и увеличении температуры сушки композита резорбируемость снижается.
ЗАКЛЮЧЕНИЕ
Предложен способ получения композиционных материалов, свойства которых можно корректировать за счет варьирования соотношения наполнитель/матрица и температуры сушки.
Выяснено, что оптимальная температура сушки 200°С. Образцы, полученные при данной температуре, характеризуются максимальными значениями удельной поверхности и начальной скорости растворения.
Отмечено, что скорость резорбции образцов уменьшается с возрастанием температуры сушки и содержания наполнителя.
Список литературы
Kundu J., Pati F., Shim J.H., Cho D.W. Rapid Prototyping Technology for Bone Regeneration. Principles and Applications. Sawston, Cambridge: Woodhead Publ., 2014. P. 254–284.
Popov V.K., Komlev V.S., Chichkov B.N. Calcium Phosphate Blossom for Bone Tissue Engineering // Mater. Today. 2014. V. 2. P. 96–97.
Angelov A.I., Levin B.V., Chernenko Y.D. Phosphate Ore. Moscow. 2000. P. 120.
Wopenka B., Pasteris J.D. A Mineralogical Perspective on the Apatite in Bone // Mater. Sci. Eng. 2005. V. 25. № 2. P. 131–143.
Dorozhkin S.V. Calcium Orthophosphates // J. Mater. Sci. 2007. V. 42. P. 1061–1095.
Venkatesan J., Kim Se.K. Marine Biomaterials // Springer Handbook of Marine Biotechnology. Heidelberg; Berlin: Springer, 2015. P. 3–19.
Вересов А.Г., Путляев В.И., Третьяков Ю.Д. Химия неорганических биоматериалов на основе фосфатов кальция // Рос. хим. журн. (Журн. Рос. хим. об-ва им. Д.И. Менделеева). 2004. Т. XLVIII. № 4. С. 32–46.
Musskaya O.N., Lesnikovich Yu.A., Kazbanov V.V., Zhitkova N.S. Preparation of Bioactive Mesoporous Calcium Phosphate Granules // Inorg. Mater. 2018. V. 54. № 2. P. 117–124.
Чайкина M.В. Механохимия природных и синтетических апатитов. Новосибирск: Изд-во СО РАН, 2002. С. 223.
Zakharov N.A., Demina L.I., Aliev A.D. et al. Synthesis and Properties of Calcium Hydroxyapatite/Silk Fibroin Organomineral Composites // Inorg. Mater. 2017. V. 53. № 3. P. 333–342.
Сафронова Т.В., Путляев В.И., Шехирев М.А., Кузнецов А.В. Композиционная керамика, содержащая биорезорбируемую фазу // Стекло и керамика. 2007. № 3. С. 31–35.
Громов А.В. Остеопластические материалы нового поколения // Фармацевтические и медицинские биотехнологии: Сб. тез. научн.-практ. конф. Москва. 2012. С. 226.
Komlev V.S., Barinov S.M., Bozo I.I., Deev R.V., Eremin I.I., Fedotov A.Y. et al. Bioceramics Composed of Octacalcium Phosphate Demonstrate Enhanced Biological Behavior // ACS Appl. Mater. Interfaces. 2014. V. 6. № 19. P. 16610–16620.
Гурин А.Н., Федотов А.Ю., Деев Р.В., Комлев В.С. Направленная регенерация костной ткани с использованием барьерной мембраны на основе альгината натрия и октакальциевого фосфата // Клеточная трансплантология и тканевая инженерия. 2013. Т. VIII. № 4. С. 8–12.
Каралкин П.А., Сергеева Н.С., Комлев В.С. и др. Биосовместимость и остеопластические свойства минерал-полимерных композиционных материалов на основе альгината натрия, желатина и фосфатов кальция, предназначенных для 3d-печати костнозамещающих конструктов // Гены & Клетки. 2016. Т. XI. № 3. С. 94–101.
Сергеева Н.С., Комлев В.С., Свиридова И.К. и др. Оценка композиционных материалов состава альгинат–фосфаты кальция, предназначенных для использования в технологиях прототипирования при замещении костных дефектов in vitro // Вестник травматологии и ортопедии им. Н.Н. Приорова. 2015. № 1. С. 28–34.
Гурин А.Н., Комлев B.C., Федотов А.Ю., Берковский А.А., Мамонов В.Е., Ериеорьян А.С. Сравнительная характеристика материалов на основе хитозана, альгината и фибрина в комплексе с р‑трикальцийфосфатом для остеопластики (экспериментально-морфологическое исследование) // Стоматология. 2014. Т. 93. С. 4–10.
Tung M.S., Tomazic B., Brown W.E. The Effects of Magnesium and Fluoride on the Hydrolysis of Octacalcium Phosphate // Arch. Oral Biol. 1992. P. 585–591.
Dorozhkin S.V. Bioceramics of Calcium Orthophosphates // Biomaterials. 2010. V. 31. P. 1465–1485.
Юсова А.А., Гусев И.В., Липатова И.М. Свойства гидрогелей на основе смесей альгината натрия с другими полисахаридами природного происхождения // Химия растительного сырья. 2014. № 4. С. 59–66.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы