Неорганические материалы, 2019, T. 55, № 12, стр. 1335-1341
Сложные оксиды со структурой пирохлора (Ln1.8Fe0.2)FeSbO7 (Ln = Pr–Tb) в реакции окисления СО
О. Г. Эллерт 1, *, А. В. Егорышева 1, Е. Ю. Либерман 2, С. В. Голодухина 1, Д. И. Кирдянкин 1, О. М. Гайтко 1
1 Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский пр., 31, Россия
2 Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
* E-mail: oellert@yandex.ru
Поступила в редакцию 22.02.2019
После доработки 22.04.2019
Принята к публикации 22.05.2019
Аннотация
Методом соосаждения с последующим отжигом синтезирован ряд сложных оксидов (Ln1.8Fe0.2)FeSbO7, где Ln = Pr–Tb. Расчет по методу Ритвельда показал, что все полученные образцы имеют структуру пирохлора (пр. гр. Fd$\bar {3}$mz). Установлено, что соединения (Ln1.8Fe0.2)FeSbO7 проявляют высокую активность в реакции окисления СО. Лучший результат показал (Pr1.8Fe0.2)FeSbO7, температура 90%-ной конверсии СО для которого составила T90 = 385°С. С увеличением атомного номера в ряду Pr–Tb происходит монотонное увеличение T90 с 385 до 550°С. Наиболее вероятно, что такая зависимость объясняется уменьшением дефектности структуры соединений с меньшими радиусами катионов РЗЭ.
ВВЕДЕНИЕ
Монооксид углерода является одним из самых опасных и распространенных веществ, приводящих к ухудшению экологической ситуации на планете. Поэтому реакция каталитического окисления СО не только является прекрасной моделью для изучения гетерогенного катализа, но имеет большое практическое значение для решения проблемы загрязнения окружающей среды. Катализаторы, содержащие в качестве активного компонента золото, палладий и платину, проявляют наибольшую эффективность в этой реакции, однако их существенными недостатками являются высокая стоимость и ограниченность ресурсов благородных металлов. В этой связи создание катализаторов, не содержащих благородные металлы, но обладающих высокой активностью в окислении при относительно невысоких температурах, является актуальной задачей.
В последнее время возрос интерес к гетерогенным катализаторам на основе сложных оксидов редкоземельных и переходных металлов, проявляющих улучшенные каталитические свойства, устойчивость в реакциях окисления в широком интервале температур, способность к редокс-превращениям, высокую мобильность кислорода в кристаллической решетке и имеющих большое количество кислородных вакансий [1–5]. Хорошо известны и эффективны в окислении СО и метана сложные оксиды со структурой шпинели [6–9]. Так, например, MgFe2O4 используется в качестве подложки для создания перспективного катализатора Pt/MgFe2O4 в реакции окисления СО при комнатной температуре [6]. В качестве катализатора парциального окисления метана для получения синтез-газа может использоваться никель-алюминиевая шпинель, допированная переходным металлом (Ni1 – x(М2O3)x)y · γ-Аl2O3, где М – Сr, Мn или Fe, 0.01 ≤ x ≤ 0.99, 0.01 ≤ y ≤ 1 [7]. Механизм полного окисления метана хорошо изучен на примере NiCo2O4, полностью окисляющего метан при температурах 350–550°C [8]. Примером успешного использования в реакциях окисления катализаторов на основе смешанных оксидов d- и f-элементов являются перовскиты ABO3 [10–15].
Ранее [16] был синтезирован ряд новых соединений LnFe0.5Sb1.5O6 (Ln = La–Sm), относящихся к структурному типу PbSbO6 (пр.гр. P$\bar {3}$1m). Эти антимонаты показали более высокую активность в окислении СО, чем перовскиты сходного состава LnFeO3 (Ln = La, Nd, Sm) [10]. Наилучший результат был получен в случае LaFe0.5Sb1.5O6, для которого температура 90%-ной конверсии СО составила 272°С. С ростом порядкового номера лантаноида в ряду La–Sm наблюдалось монотонное увеличение T90 до 426°С. Особенностью структуры LnFe0.5Sb1.5O6 является то, что редкоземельные катионы находятся в изолированных пустотах между плотноупакованными отрицательно заряженными слоями, состоящими из гексагональных колец октаэдров (Sb,Fe)O6. Результаты исследования позволили предположить, что наряду с участием сурьмы и железа важную роль в окислении СО на катализаторах LnFe0.5Sb1.5O6 играет их слоистая структура.
Несмотря на “гибкость” структуры пирохлора A2B2O7, позволяющей варьировать состав соединений в широком диапазоне, а также совмещать различные структурные дефекты, способствующие формированию активных центров на поверхности частиц [17–21], сведения о применении в катализе пирохлоров, содержащих d- и f-элементы, практически отсутствуют. Тем не менее, представляет интерес провести сравнение каталитических свойств ранее изученных нами слоистых соединений LnFe0.5Sb1.5O6 и пирохлоров сходного состава Ln2FeSbO7, обладающих кубической структурой. Синтез, структура и магнитные свойства пирохлоров Ln2FeSbO7 (Ln = Nd, Pr, Gd, Eu, Dy) изучены в работах [22–27].
Целью настоящей работы стало изучение каталитических свойств пирохлоров на примере (Ln1.8Fe0.2)FeSbO7, где Ln = Pr–Tb, в реакции окисления СО.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных реактивов для синтеза Ln1.8Fe0.2FeSbO7 были использованы Ln(NO3)3 · · xH2O (“ос. ч.”) (Ln = Pr, Nd, Sm, Eu, Gd, Tb, x = 5, 6 в зависимости от лантаноида), Fe(NO3)3 · · 9H2O (“х. ч.”), Sb2O3 (“х. ч.”), HClконц (“ос. ч.”), NH4OHконц (“ос. ч.”) и дистиллированная вода. Высокая летучесть сурьмы не позволяет проводить длительные высокотемпературные отжиги, поэтому для синтеза нами был выбран метод соосаждения с последующим отжигом, который позволяет снизить температуру и продолжительность отжига. Однако при этом не решается полностью проблема летучести оксида сурьмы, поэтому навески оксида сурьмы брали с 20%-ным избытком. Остальные компоненты брали в стехиометрическом количестве. Осаждение и последующий отжиг проводили по разработанной ранее методике для LnFe0.5Sb1.5O6, подробно изложенной в [16].
Контроль полноты прохождения реакции проводили методом РФА и весовым методом из расчета полного удаления избытка оксида сурьмы. Состав синтезированных образцов подтвержден методом локального рентгеноспектрального анализа.
Рентгенограммы образцов при комнатной температуре в диапазоне 2θ от 10° до 80° были получены с использованием дифрактометра Bruker D8 Advance (CuKα-излучение, Ni-фильтр, детектор LYNXEYE). Данные дифракции были собраны с шагом 0.005°, время накопления 0.3 с/шаг. Параметры решетки определяли методом Ритвельда c помощью программного обеспечения Topas R (Bruker AXS, Karlsruhe, Germany).
Микроструктуру синтезированных образцов изучали методом растровой электронной микроскопии на трехлучевой рабочей станции CarlZeissNVision40 с функцией локального рентгеноспектрального анализа. Величину удельной площади поверхности порошков определяли методом низкотемпературной адсорбции азота с использованием анализатора АТХ-06 (в качестве газа-носителя использовали гелий марки А) по модели БЭТ.
Каталитическую активность образцов в реакции окисления СО определяли проточным методом с применением газохроматографического анализа. Для этого в U-образный кварцевый реактор загружали 0.3 г катализатора, нагревали до заданной температуры, после чего через реактор пропускали смесь реагентов (производства ОАО “Линде Газ Рус”): 1.2 об. % СО + 10.0 об. % О2 + + 88.8 об. % N2. Опыты проводили при скорости подачи реагентов 60 мл/мин в диапазоне температур от 20 до 150°С. Концентрацию реагентов и продуктов определяли на хроматографе CHROM-5 (Чехия). Конверсию CO (α) рассчитывали по уравнению
Активность катализаторов оценивали по температурам достижения 50- и 90%-ной конверсии CO (Т50 и Т90 соответственно).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
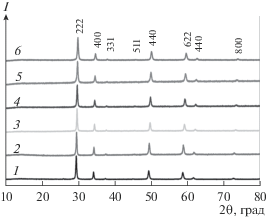
Ранее [24] на примере празеодимсодержащего пирохлора было показано, что соединение со структурой пирохлора реализуется в области составов Pr2 – xFe1 + xSbO7 с х = 0.1–0.4. Состав, соответствующий “идеальной” формуле Pr2FeSbO7, лежит вне этой области. О существовании пирохлора “неидеального” состава (Nd1.8Fe0.2)FeSbO7 сообщалось также в [26]. Поэтому был синтезирован ряд твердых растворов состава (Ln1.8Fe0.2)FeSbO7, Ln = Pr–Tb. Синтез лантансодержащего соединения не проводился, т.к. в системе La2O3–Fe2O3–Sb2O5 фаза со структурой пирохлора не образуется [28]. Однофазность всех синтезированных образцов (Ln1.8Fe0.2)FeSbO7 и их принадлежность к кубической структуре пирохлора подтверждены данными РФА (рис. 1).
Рис. 1.
Рентгенограммы синтезированных соединений со структурой пирохлора Ln1.8Fe1.2SbO7: Ln = Pr (1), Nd (2), Sm (3), Eu (4), Gd (5) и Tb (6).
Изучение морфологии показало, что в ряду Pr–Tb происходит изменение не только размера, но и микроструктуры синтезированных образцов. Pr-содержащий образец состоит из слабоагрегированных кубических частиц размером 50–70 нм (рис. 2). В случае Nd и Sm образцы представляют собой сложные сетчатые структуры, образованные из сросшихся квазисферических частиц с размерами менее 50 нм. Необходимо отметить, что, несмотря на высокую агрегированность, в этой нерегулярной сетке легко выделить отдельные частицы. Для образцов с Eu, Gd и Tb характерно еще большее слияние частиц и уменьшение их размеров. Эти образцы состоят из крупных агрегатов ячеистой структуры, размер частиц в которых не превышает 25 нм (в случае Eu). Удельная площадь поверхности образцов зависела от состава. Ее величина возрастала с 2.0 до 5.5 м2/г с увеличением порядкового номера лантаноида.
Рис. 2.
Микрофотографии синтезированных образцов: Pr1.8Fe1.2SbO7 (а), Nd1.8Fe1.2SbO7 (б), Sm1.8Fe1.2SbO7 (в), Eu1.8Fe1.2SbO7 (г), Gd1.8Fe1.2SbO7 (д), Tb1.8Fe1.2SbO7 (е).

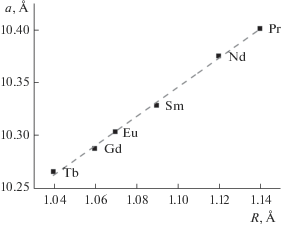
Методом Ритвельда для модели пр. гр. Fd$\bar {3}$mz были уточнены структуры всех соединений (табл. 1). Величины найденных параметров находятся в согласии с известными данными [23–27]. В ряду соединений Ln1.8Fe0.2FeSbO7 с Ln = Pr–Tb параметр кристаллической решетки a линейно уменьшается с уменьшением ионного радиуса РЗЭ (рис. 3). Структуру пирохлора можно представить как трехмерный каркас, состоящий из двух взаимопроникающих подрешеток. Первую образуют соединенные вершинами октаэдры (Fe,Sb)O6, а вторую тетраэдры ОLn4. При этом для кристаллических решеток пирохлоров характерно сильное разупорядочение, связанное с вхождением атомов Fe в часть позиций Ln, что сопровождается возникновением анионных и катионных вакансий [29]. Ранее [22] было показано, что фаза со структурой пирохлора может быть реализована, если радиусы катионов соединения A2B2O7 удовлетворяют условию rA/rB ≤ 1.61. Именно по этой причине не существует фаза со структурой пирохлора в системе La2O3–Fe2O3–Sb2O5. Для нее rA/rB = 1.62, что лишь незначительно превышает величину критерия. Для синтезированных соединений Ln1.8Fe0.2FeSbO7 в ряду Pr–Tb величина rA/rB уменьшается с увеличением порядкового номера лантаноида. Устойчивость соединений с Pr и Nd, соответствующих границе критерия существования фазы пирохлора, должна уступать устойчивости соединений с меньшими радиусами иона РЗЭ, лежащих в середине области допустимых значений rA/rB. Как правило, менее устойчивые соединения характеризуются большей концентрацией дефектов в кристаллической решетке, что дает основание предположить, что число вакансий в синтезированных соединениях растет с увеличением ионного радиуса катиона РЗЭ.
Таблица 1.
Кристаллографические данные соединений Ln1.8Fe0.2SbFeO7 со структурой пирохлора (пр. гр. Fd$\bar {3}$mz)
| Соединение | Pr1.8Fe0.2FeSbO7 | Nd1.8Fe0.2FeSbO7 | Sm1.8Fe0.2FeSbO7 | Eu1.8Fe0.2FeSbO7 | Gd1.8Fe0.2FeSbO7 | Tb1.8Fe0.2FeSbO7 |
|---|---|---|---|---|---|---|
| a, Å | 10.4020(3) | 10.3756(4) | 10.3292(3) | 10.3056(4) | 10.2823(5) | 10.2566(4) |
| V, Å3 | 1125.52(9) | 1116.97(13) | 1102.05(9) | 1094.51(13) | 1087.12(17) | 1078.97(12) |
| ОКР, нм | 49 | 48 | 55 | 47 | 34 | 30 |
| LVol-IB, нм | 24.6(2) | 29.2(5) | 30.6(4) | 25.5(4) | 22.1(3) | 21.4(3) |
| LVol-FWHM, нм | 30.8(4) | 39.8(9) | 38.6(6) | 32.7(6) | 30.7(4) | 28.0(4) |
| Заселенность Fe позиции А (16d) | 0.10(2) | 0.10(3) | 0.10(2) | 0.10(4) | 0.10(5) | 0.10(3) |
| xO | 0.421(2) | 0.415(2) | 0.422(2) | 0.415(3) | 0.414(4) | 0.419(2) |
| Rexp | 3.72 | 4.57 | 3.22 | 3.56 | 3.30 | 3.60 |
| Rwp | 4.31 | 5.70 | 3.50 | 3.76 | 3.67 | 3.69 |
| Rp | 3.37 | 4.47 | 2.76 | 3.00 | 2.92 | 2.94 |
| GOF | 1.16 | 1.25 | 1.09 | 1.06 | 1.11 | 1.02 |
| DW | 1.47 | 1.25 | 1.73 | 1.77 | 1.67 | 1.87 |
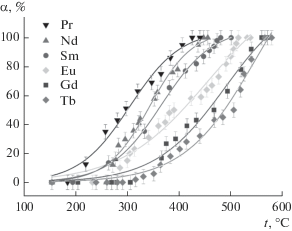
Каталитические тесты показали, что все соединения со структурой пирохлора Ln1.8Fe0.2FeSbO7 (Ln = Pr–Tb) проявляют высокую активность в реакции окисления СО. При этом наилучшие результаты демонстрирует образец с Pr (табл. 2). C увеличением атомного номера температура 90%-ной конверсии СО (Т90) монотонно увеличивается c 385 до 550°С в ряду Pr–Tb. Кривые α(t) для пирохлоров имеют S-образную форму (рис. 4).
Таблица 2.
Сравнение каталитических характеристик LnFe0.5Sb1.5O6, (Ln1.8Fe0.2)FeSbO7 и LnFeO3
| Соединение | LnFe0.5Sb1.5O6 [16] | (Ln1.8Fe0.2)FeSbO7 | LnFeO3 [10] | |
| Структурный тип | Розиаит | Пирохлор | Перовскит | |
| Метод синтеза | Соосаждение с после-дующим отжигом при 1050°C | Соосаждение с последующим отжигом при 900°C | Метод Печини, отжиг при 800°C | |
| Состав реакционной газовой смеси | CO – 1.1% O2 – 8.9% N2 – баланс |
CO – 1.1% O2 – 8.9% N2 – баланс |
CO – 1% O2 – 20% N2 – баланс |
|
| Масса катализатора, г | 0.3 | 0.3 | 0.5 | |
| Объемная скорость потока газа ω, см3 | 12 000 | 12 000 | 12 000 | |
| Удельная площадь поверхности, м2/г | 10 | 9.5 | 2.3–9.7 | |
| Температура 50%-ной конверсии, °C | La | 256 | – | 348 |
| Ce | 276 | – | – | |
| Pr | 291 | 287 | – | |
| Nd | 317 | 330 | 321 | |
| Sm | 328 | 350 | 366 | |
| Eu | – | 396 | – | |
| Gd | – | 462 | – | |
| Tb | – | 500 | – | |
| Температура 90%-ной конверсии, °C | La | 272 | – | 400 |
| Ce | 303 | – | – | |
| Pr | 305 | 385 | – | |
| Nd | 392 | 425 | 388 | |
| Sm | 426 | 464 | 442 | |
| Eu | – | 500 | – | |
| Gd | – | 535 | – | |
| Tb | – | 550 | – | |
Рис. 4.
Зависимости конверсии СО (α) от температуры на катализаторах со структурой пирохлора Ln1.8Fe1.2SbO7.
Каталитическая активность пирохлоров оказалось ниже, чем у изученных нами ранее розиаитов LnFe0.5Sb1.5O6. На это указывают более высокие значения Т50 и Т90 для пирохлоров (табл. 2). В то же время Т50 для пирохлоров примерно такая же, как и в случае соединений близкого состава LnFeO3 со структурой типа перовскита. Таким образом, сравнение активности трех типов структур: слоистой квази-2D-структуры розиаитов LnFe0.5Sb1.5O6 (Ln = La–Sm), кубической 3D пирохлоров Ln1.8Fe1.2SbO7 (Ln = Pr–Tb) и орторомбической перовскитов LnFeO3, показало, что наиболее активным является розиаит, а одной из вероятных причин его высокой активности может быть его слоистая структура. Необходимо отметить, что как для пирохлора, так и для розиаита наблюдается зависимость полной конверсии от атомного номера редкоземельных элементов. Подобный эффект наблюдался также для твердых растворов Ln0.1Zr0.18Ce0.72O2, где Ln = Pr–Lu [30]. По мнению авторов, такая закономерность обусловлена “лантаноидным сжатием” ионов РЗЭ, следствием которого является формирование менее дефектной структуры. В то же время такая зависимость активности от ионного радиуса не является типичной. Например, в [31] показано, что каталитическая активность LnCoO3 подчиняется прямо противоположной зависимости La < Pr < < Nd < Sm < Eu, что хорошо коррелирует с высокой температурой восстановления и энергией связи кислорода на поверхности этих соединений. Анализ кинетики окисления CO в присутствии LnCoO3 [32] показал другой порядок активности – Gd > La > Nd. Что касается Ln1.8Fe1.2SbO7, то, как было показано выше, число вакансий в синтезированных нами соединениях с высокой вероятностью растет с увеличением ионного радиуса катиона РЗЭ, что в свою очередь приводит к повышению каталитической активности.
ЗАКЛЮЧЕНИЕ
Анализ механизмов реакции окисления на сложных оксидах показывает, что, наиболее вероятно, окисление СО протекает на дефектной поверхности соединений, а именно, на активных центрах, содержащих ионы переходных металлов, при непосредственном участии решеточного кислорода и многочисленных вакансий. Очевидно, что в случае пирохлоров Ln1.8Fe1.2SbO7 наряду с железом значительную роль в процессе окисления СО играют ионы сурьмы, а также значительное число вакансий. Появление вакансий связано с разупорядочением структуры пирохлора. При этом количество вакансий возрастает с увеличением ионного радиуса лантаноида.
Список литературы
Satsuma A., Osaki K., Yanagihara M., Ohyama J., Shimizu K. Activity Controlling Factors for Low-Temperature Oxidation of CO over Supported Pd Catalysts // Appl. Catal. B. 2013. V. 132–133. P. 511–518. https://doi.org/10.1016/j.apcatb.2012.12.025
Huang X., Sun H., Wang L., Liu Y., Cao Y. Morphology Effects of Nanoscale Ceria on the Activity of Au/CeO2 Catalysts for Low-Temperature CO Oxidation // Appl. Catal. B. 2009. V. 90. P. 224–232. https://doi.org/10.1016/j.apcatb.2009.03.015
Kudo S., Maki T., Yamada M., Mae K. A New Preparation Method of Au/Ferric Oxide Catalyst for Low Temperature CO Oxidation // Chem. Eng. Sci. 2010. V. 65. № 1. P. 214–219. https://doi.org/10.1016/j.ces.2009.05.044
Liu L., Zhou F., Wang L., Qi X., Deng Y. Low-Temperature CO Oxidation over Supported Pt, Pd Catalysts: Particular Role of FeOx Support for Oxygen Supply During Reactions // J. Catal. 2010. V. 274. № 1. P. 1–10. https://doi.org/10.1016/j.jcat.2010.05.022
Ye Q., Zhao J., Huo F., Wang D., Dai H. Nanosized Au Supported on Three-Dimensionally Ordered Mesoporous β-MnO2: Highly Active Catalysts for the Low-Temperature Oxidation of Carbon Monoxide, Benzene, and Toluene // Micro. Meso. Mater. 2013. V. 172. P. 20–29. https://doi.org/10.1016/j.micromeso.2013.01.007
Zheng B., Wu S., Yang X., Jia M., Zhang W., Liu G. Room Temperature CO Oxidation over Pt/MgFe2O4: A Stable Inverse Spinel Oxide Support for Preparing Highly Efficient Pt Catalyst // ACS Appl. Mater. Interf. 2016. V. 8. № 40. P. 26683–26689. https://doi.org/10.1021/acsami.6b06501
Kikuchi R., Yokoyama M., Tada S., Takagaki A., Sugawara T., Oyama S. Novel Nickel Catalysts Based on Spinel-Type Mixed Oxides for Methane and Propane Steam Reforming // J. Chem. Eng. Jpn. 2014. V. 47. № 7. P. 530–535. https://doi.org/10.1252/jcej.13we305
Tao F., Shan J., Nguyen L., Wang Z., Zhang S., Zhang L., Wu Z., Huang W., Zeng S., Hu P. Understanding Complete Oxidation of Methane on Spinel Oxides at a Molecular Level // Nature Commun. 2015. V. 6. P. 7798. https://doi.org/10.1038/ncomms8798
Severino F., Brito J.L., Laine J., Fierro J.L.G., Lòpez Agudo A. Nature of Copper Active Sites in the Carbon Monoxide Oxidation on CuAl2O4 and CuCr2O4 Spinel Type Catalysts // J. Catal. 1998. V. 177. P. 82–95. https://doi.org/10.1006/jcat.1998.2094
Ciambelli P., Cimino S., De Rossi S., Lisi L., Russo G. AFeO3 (A = La, Nd, Sm) and LaFe1– xMgxO3 Perovskites as Methane Combustion and CO Oxidation Catalysts: Structural, Redox and Catalytic Properties // Appl. Catal. B. Environ. 2001. V. 29. № 4. P. 239–250. https://doi.org/10.1016/S0926-3373(00)00215-0
Seiyama T. Total Oxidation of Hydrocarbons on Perovskite Oxides // Catal. Rev. Sci. Eng. 1992. V. 34. P. 281–300. https://doi.org/10.1080/01614949208016313
Zhong Z., Chen K., Ji Y., Yan Q. Methane Combustion over B-Site Partially Substituted Perovskite-Type LaFeO3 Prepared by Sol-Gel Method // Appl. Catal. A. 1997. V. 156. P. 29–41. https://doi.org/10.1016/S0926-860X(97)00003-3
Salomonsson P., Griffin T., Kasemo B. Oxygen Desorption and Oxidation-Reduction Kinetics with Methane and Carbon Monoxide over Perovskite Type Metal Oxide Catalysts // Appl. Catal. A. 1993. V. 104. P. 175–197. https://doi.org/10.1016/0926-860X(93)85097-9
Zhang H.M., Shimizu Y., Teraoka Y., Miura N., Yamazoe N. Oxygen Sorption and Catalytic Properties of La1 – xSrxCo1 – yFeyO3 Perovskite-Type Oxides // J. Catal. 1990. V. 121. P. 432–440. https://doi.org/10.1016/0021-9517(90)90251-E
Royer S., Duprez D. Catalytic Oxidation of Carbon Monoxide over Transition Metal Oxides // ChemCatChem. 2011. V. 3. P. 24–65. https://doi.org/10.1002/cctc.201000378
Egorysheva A.V., Ellert O.G., Liberman E.Yu., Kirdyankin D.I., Golodukhina S.V., Gajtko O.M., Svetogorov R.D. Synthesis and Characterization of New Isostructural Series LnFe0.5Sb1.5O6 (Ln = La–Sm) Exhibiting High Catalytic Activity in CO Oxidation // J. Alloys Compd. 2019. V. 777. P. 655–662. https://doi.org/10.1016/j.jallcom.2018.11.008
Kamba S., Porokhonskyy V., Pashkin A., Bovtun V., Petzelt J., Nino J.C., Trolier-McKinstry S., Lanagan M.T., Randall C.A. Anomalous Broad Dielectric Relaxation in Bi1.5Zn1.0Nb1.5O7 Pyrochlore // Phys. Rev. B. 2002. V. 66. P. 054106. https://doi.org/10.1103/PhysRevB.66.054106
Valant M., Babu G.S., Vrcon M., Kolodiazhnyi T., Axelsson A.-K. Pyrochlore Range from Bi2O3–Fe2O3–TeO3 System for LTCC and Photocatalysis and the Crystal Structure of New Bi3(Fe0.56Te0.44)3O11 // J. Am. Ceram. Soc. 2012. V. 95. P. 644–650. https://doi.org/10.1111/j.1551-2916.2011.04801.x
Lufaso M.W., Vanderah T.A., Pazos I.M., Levin I., Roth R.S., Nino J.C., Provenzano V., Schenck P.K. Phase Formation, Crystal Chemistry, and Properties in the System Bi2O3–Fe2O3–Nb2O5 // J. Solid State Chem. 2006. V. 179. P. 3900–3910.
Kim J.Y., Kim D.W., Jung H.S., Hong K.S. Voltage-Tunable Dielectric Properties of Pyrochlore Bi–Zn–Nb–Ti–O Solid-Solution Thin Films // Jpn. J. Appl. Phys. 2005. V. 44. P. 6648–6653. https://doi.org/10.1016/j.jssc.2006.08.036
Nguyen B., Liu Y., Withers R.L. The Local Crystal Chemistry and Dielectric Properties of the Cubic Pyrochlore Phase in the Bi2O3–M2+O–Nb2O5 (M2+= Ni2+ and Mg2+) Systems // J. Solid State Chem. 2007. V. 180. P. 549–557. https://doi.org/10.1016/j.jssc.2006.10.039
Knop O., Brisse F., Meads R.E., Bainbridg J. Pyrochlores. IV. Crystallographic and Mössbauer Studies of A2FeSbO7 Pyrochlores // Canad. J. Chem. 1968. V. 46. P. 3829–3832. https://doi.org/10.1139/v68-635
Matsuda C.K., Barco R., Sharma P., Biondo V., Paesano A., Cunha J.B.M., Hallouche B. Iron-Containing Pyrochlores: Structural and Magnetic Characterization // Hyperfine Interact. 2007. V. 175. № 1–3. P. 55–61. https://doi.org/10.1007/s10751-008-9588-x
Егорышева А.В., Эллерт О.Г., Гайтко О.М., Берсенева А.А., Максимов Ю.В. Магнитные свойства твердых растворов со структурой типа пирохлора Pr2xFe1 + xSbO7, Bi2 – xAxFeSbO7, A= La, Pr // Неорган. материалы. 2016. Т. 52. С. 1106–1115. https://doi.org/10.7868/S0002337X16100079
Berndt G., Silva K.L., Ivashita F.F., Paesano A., Blanco M.C., Miner E.V.P., Carbonio R.E., Dantas S.M., Ayala A.P., Isnard O. Structural, Hyperfine and Raman Properties of RE2FeSbO7 Compounds. // J. Alloys Compd. 2015. V. 618. P. 635–642. https://doi.org/10.1016/j.jallcom.2014.08.068
Whitaker M.J., Marco J.F., Berry F.J., Raith C., Blackburn E., Greaves C. Structural and Magnetic Characterisation of the Pyrochlores Bi2 − xFex(FeSb)O7 (x = 0.1, 0.2, 0.3), Nd1.8Fe0.2(FeSb)O7 and Pr2(FeSb)O7 // J. Solid State Chem. 2013. V. 198. P. 316–322. https://doi.org/10.1016/j.jssc.2012.10.021
Jana Y.M., Halder P., Ali Biswas A., Roychowdhury A., Das D., Dey S., Kumar S. Synthesis, X-ray Rietveld Analysis, Infrared and Mössbauer Spectroscopy of R2FeSbO7 (R3+ = Y, Dy, Gd, Bi) Pyrochlore Solid Solution // J. Alloys Compd. 2016. V. 656. P. 226–236. https://doi.org/10.1016/j.jallcom.2015.09.194
Egorysheva A.V., Ellert O.G., Gajtko O.M., Berseneva A.A., Maksimov Yu.V., Svetogorov R.D. Subsolidus Phase Equilibria in the La2O3–Fe2O3–Sb2O5 System and Characterization of Layered Ternary Oxide LaFe0.5Sb1.5O6 // Ceram. Int. 2016. V. 42. P. 13976–13982. https://doi.org/10.1016/j.ceramint.2016.05.211
Krayzman V., Levin I., Woicik J.C. Local Structure of Displacively Disordered Pyrochlore Dielectrics // Chem. Mater. 2007. V. 19. P. 932–936. https://doi.org/10.1021/cm062429g
Малютин А.В., Либерман Е.Ю., Михайличенко А.И., Аветисов И.Х., Кошкин А.Г., Конькова Т.В. Каталитическая активность нанодисперсных твердых растворов М0.1Zr0.18Ce0.72O2, где M – редкоземельный металл, в реакции окисления монооксида углерода // Катализ в промышленности. 2013. № 3. С. 54–59.
Futai M., Yonghua C., Louhui. Characterization of Perovskite-Type Oxide Catalysts RECoO3 by TPR // React. Kinet. Catal. Lett. 1986. V. 31. P. 47–53. https://doi.org/10.1007/BF02062510
George S., Viswanathan B. Catalytic Oxidation of Carbon Monoxide on LnCoO3 Perovskite Oxides // J. Colloid Interface Sci. 1983. V. 95. P. 322–326. https://doi.org/10.1016/0021-9797(83)90191-1
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы