Неорганические материалы, 2019, T. 55, № 2, стр. 168-174
Синхронный термоанализ реакций самораспространяющегося высокотемпературного синтеза порошков оксида скандия
Д. А. Пермин 1, *, Е. М. Гаврищук 1, А. М. Кутьин 1, А. Д. Плехович 1, О. Н. Клюсик 1
1 Институт химии высокочистых веществ им. Г.Г. Девятых Российской академии наук
603951 Нижний, Новгород, ул. Тропинина, 49, Россия
* E-mail: permin@ihps.nnov.ru
Поступила в редакцию 03.07.2018
Аннотация
Методом синхронного термоанализа проведено исследование разложения прекурсоров самораспространяющегося высокотемпературного синтеза (СВС), составленных из нитрата скандия (окислитель) и трех видов горючего: ацетата, ацетилацетоната скандия и глицина. На основании сравнения результатов термогравиметрии и дифференциальной сканирующей калориметрии исходных компонентов синтеза и реакционных смесей показано, что инициирование химических реакций СВС обусловлено термодеструкцией окислителя. Обработкой полученных данных с позиций модифицированного метода Шестека–Бергрена определены кинетические характеристики процессов взаимодействия реагентов в указанных реакционных системах.
Введение
Керамические материалы на основе оксида скандия Sc2O3, легированного ионами редкоземельных элементов (РЗЭ), представляют интерес для использования в качестве активных сред керамических лазеров ближнего ИК-диапазона [1–3]. Получение лазерной керамики неразрывно связано с разработкой методик синтеза исходных порошков для спекания. Одним из методов, успешно используемых для получения таких порошков, является самораспостраняющийся высокотемпературный синтез (СВС) из смесей нитрат скандия + + горючее (прекурсор СВС) [4, 5].
На сегодняшний день работы, посвященные СВС высокодисперсных оксидов металлов, в основном носят прикладной характер. И наряду с подробным исследованием морфологических свойств синтезированных порошков наблюдается недостаточная проработка вопросов, касающихся протекающих процессов. Вместе с тем, механизм химических реакций превращения исходных соединений в соответствующий оксид определяет характеристики получаемого порошкового материала (морфологию, дисперсность, примесный состав и т.д.). И, соответственно, физико-химическое исследование процесса синтеза необходимо для установления общих закономерностей получения высокодисперсных порошков оксидов РЗЭ, прогнозирования условий и свойств продукта в новых реакционных системах, оптимизации технологических параметров синтеза. Так, ранее на основе разработанной методики термодинамического анализа [6] были оценены условия синтеза оксида скандия в системах нитрат скандия–ацетилацетонат скандия, нитрат скандия–глицин, что позволило выбрать соотношения исходных смесей для получения дисперсных порошков, свободных от примеси углерода.
Действенным и информативным методом изучения подобных быстропротекающих процессов является синхронный термоанализ (СТА), совмещающий дифференциальную сканирующую калориметрию (ДСК) и термогравиметрию (ТГ).
Пример сравнительного анализа ДСК- и ТГ-кривых индивидуальных компонентов (ацетата и нитрата иттрия) и ацетатонитратных комплексов иттрия представлен в работе [7]. Для такого типа реакций разложения прекурсоров с одновременным интенсивным газовыделением недостаточно развиты методы обработки кинетических данных. В немногочисленных работах, например, относящихся к реакции нитрата никеля с мочевиной [8, 9], обработка ТГ/ДСК-кривых ограничивается лишь формальной оценкой энергии активации методом Киссенджера.
Наиболее приемлемы для описания реакций СВС, на наш взгляд, более гибкие, параметрически расширенные, полуэмпирические подходы к описанию кинетики фазообразования, основанные, например, на методе Шестака–Бергрена. Так, модифицированный вариант этого метода, дополнительно учитывающий неизотермичность данных ДСК, был успешно использован для анализа кристаллизации теллуритно-вольфраматных стекол [10], а также при описании твердофазных реакций формирования алюмоиттриевого граната из прекурсоров, синтезированных золь–гель-методом [11].
Целью настоящей работы было исследование кинетики и механизма химических реакций СВС оксида скандия при использовании в качестве прекурсоров смесей нитрата, ацетата, ацетилацетоната скандия и глицина методом СТА.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Выбор реакционных систем: нитрат скандия–ацетат скандия (Sc(NO3)3–0.62 Sc(CH3COO)3), нитрат скандия–ацетилацетонат скандия (Sc(NO3)3–0.11Sc(C5H8O2)3), нитрат скандия–глицин (Sc(NO3)3–NH2CH2COOH) и соотношения их компонентов осуществлялся по результатам определения температур, достаточных для реализации СВС, и по необходимому избытку окислителя для получения оксида, свободного от загрязнений углерода [6].
Синтез нитрата скандия осуществляли растворением оксида скандия в стехиометрическом количестве разбавленной азотной кислоты при нагревании. Для получения ацетата скандия Sc(CH3COO)3 к раствору нитрата скандия Sc(NO3)3 добавляли 2 М раствор гидрокарбоната аммония (в мольном отношении 3 : 1) для осаждения карбоната скандия. К полученному карбонату скандия добавляли уксусную кислоту в незначительном избытке до полного растворения. Синтез ацетилацетоната скандия Sc(C5H7O2)3 проводили добавлением ацетилацетона к раствору нитрата скандия в мольном соотношении 1 : 3.5 в присутствии водного раствора аммиака. Прекурсоры СВС получали смешением растворов окислителя и горючего и выпариванием воды при температуре ~100°С. Получение исходных компонентов более подробно описано в [5].
Термический анализ реакционных систем выполняли на синхронном термоанализаторе STA Netzsch 409 PC Luxx. Прибор калибровался по температуре и энтальпии фазовых переходов с использованием рекомендованных стандартных образцов (In, Sn, RbNO3, KClO4, Ag2SO4). Измерения проводились в алюминиевых тиглях со скоростью нагревания 5 К/мин при скорости потока аргона 60 мл/мин. Исследуемые образцы имели массу ~10 мг. Для предотвращения уноса порошка выделяющимися газообразными продуктами тигли закрывались плотно прилегающей крышкой с отверстием в центре диаметром 0.5 мм.
Для интерпретации результатов термического анализа реакционных смесей предварительно были зарегистрированы ТГ/ДСК-кривые индивидуальных компонентов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Термоанализ индивидуальных реагентов. В соответствии с данными [12] потеря около 30% массы гексагидрата нитрата скандия в интервале температур 34–180°С связана с процессами дегидратации и высокотемпературного гидролиза (рис. 1а). Эндотермический эффект с максимумом при 50°С связан с отщеплением сверхстехиометрической воды, а группу эффектов при температурах 118, 195 и 217°С можно идентифицировать как результат высокотемпературного гидролиза с отщеплением азотной кислоты и воды. Эффект в области 263°С, по данным [12], отражает элиминирование азотной кислоты. В области температур 410–480°С удаляются оставшиеся азотсодержащие летучие соединения, и далее масса пробы практически не изменяется, что свидетельствует о полном разложении нитрата скандия до оксида скандия [1] Sc(NO3)3 ⋅ 6H2O → 1/2Sc2O3 + HNO3 + + 2NO2 + 1/2O2 + 5.5H2O.
Рис. 1.
ТГ- (1) и ДСК-кривые (2) термодеструкции гексагидрата нитрата скандия Sc(NO3)3 ⋅ 6H2O (а); ацетилацетоната скандия Sc(C2H5O2)3 (б); тетрагидрата ацетата скандия Sc(CH3COO)3 ⋅ 4H2O (в) и глицина NH2CH2COOH (г).

Два совмещенных эндотермических эффекта с максимумами при температурах 187 и 211°С на ДСК-кривой ацетилацетоната скандия (рис. 1б) можно отнести к процессам плавления и возгонки. Подтверждением этого является убыль массы после 188°С.
Интерпретация ТГ/ДСК-кривых термического разложения ацетата скандия (рис. 1в) при отсутствии литературных данных проведена по аналогии с термодеструкцией ацетата иттрия [7, 13]. Из ряда последовательных эндотермических эффектов с максимумами при 106, 182, 256 и 350°С первые три отражают процесс дегидратации ацетата скандия
а четвертый пик можно связать с разложением на ацетон, оксокарбонат скандия и углекислый газ
Дальнейшая убыль массы при нагревании свидетельствует о том, что оксокарбонат разлагается на оксид скандия и углекислый газ
ТГ/ДСК-кривые глицина (рис. 1г) и их интерпретация в соответствии с данными [14, 15] свидетельствуют о том, что с температуры 240°С начинает протекать реакция поликонденсации (острый эндотермический пик) с интенсивным газовыделением аммиака, что приводит к резкой потере массы. На втором этапе разложения глицина, выше 300°С, продолжающемуся процессу полимеризации сопутствует пиролиз с плавной потерей массы образца [14, 15].
Термоанализ прекурсоров СВС оксида скандия. Взаимодействие нитрата и ацетилацетоната скандия, представленное брутто-реакцией (А), проявляется в виде экзотермического эффекта с пиком при температуре 132°С (рис. 2а)
(A)
$\begin{gathered} {\text{48Sc}}{{\left( {{\text{N}}{{{\text{O}}}_{3}}} \right)}_{3}} + 10{\text{Sc}}{{\left( {{{{\text{C}}}_{5}}{{{\text{H}}}_{8}}{{{\text{O}}}_{2}}} \right)}_{3}} \to \\ \to 29{\text{S}}{{{\text{c}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + 150{\text{C}}{{{\text{O}}}_{2}} + 105{{{\text{H}}}_{2}}{\text{O}} + 72{{{\text{N}}}_{2}}.\quad \\ \end{gathered} $Рис. 2.
ТГ- (1) и ДСК-кривые (2) термодеструкции Sc(NO3)3 – 0.11Sc(C5H8O2)3 (а), Sc(NO3)3 – 0.62Sc-(CH3COO)3 (б) и Sc(NO3)3 – 1.5NH2CH2COOH (в).
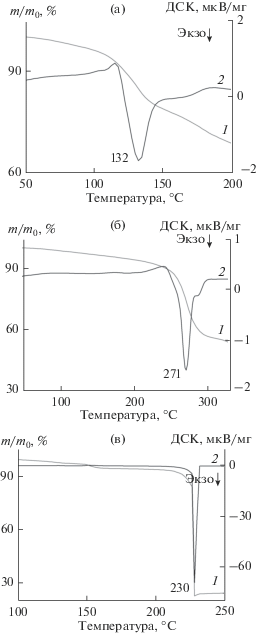
Из результатов ТГ/ДСК-анализа реагентов (рис. 1а и 1б) следует, что взаимодействие обусловлено разложением нитрата скандия с образованием азотной кислоты и ее последующим взаимодействием с ацетилацетонатными группами.
Взаимодействие нитрата и ацетата скандия (реакция (Б)) в виде подобного предыдущему экзотермического пика проявляется при существенно большей температуре 271°С (рис. 2б)
(Б)
$\begin{gathered} 16{\text{Sc}}{{\left( {{\text{N}}{{{\text{O}}}_{3}}} \right)}_{3}} + 10{\text{Sc}}{{\left( {{\text{C}}{{{\text{H}}}_{3}}{\text{COO}}} \right)}_{3}} \to \\ \to 13{\text{S}}{{{\text{c}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + 60{\text{C}}{{{\text{O}}}_{2}} + 45{{{\text{H}}}_{2}}{\text{O}} + 24{{{\text{N}}}_{2}}.\quad \\ \end{gathered} $На термогравиметрической кривой (рис. 2в), соответствующей брутто-реакции нитрата скандия с глицином (В) после незначительного (~7%) снижения массы при температурах до 200°С наблюдается резкое снижение массы на 75%, которому сопутствует интенсивный экзотермический эффект с максимумом при 230°С
(В)
$\begin{gathered} 6{\text{Sc}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{3}}\quad + 10{\text{N}}{{{\text{H}}}_{{\text{2}}}}{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{COOH}} \to \\ \to 3{\text{S}}{{{\text{c}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + 20{\text{C}}{{{\text{O}}}_{2}} + 25{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 14{{{\text{N}}}_{2}}. \\ \end{gathered} $Такая температура, согласно данным термоанализа реагентов (рис. 1), соответствует началу термодеструкции глицина и высокотемпературному гидролизу азотнокислого скандия. Отметим, что значительная интенсивность реакционного взаимодействия азотнокислого скандия с глицином (более чем на порядок превышающая интенсивность двух предшествующих процессов) наиболее характерна для процесса СВС.
Математическая обработка результатов ТГ и ДСК прекурсоров СВС оксида скандия. Количественная обработка полученных данных выполнена с позиции протекания соответствующей брутто-реакции, изменение энтальпии которой
где ∆rH – мольная энтальпия, ξ – координата реакции. После выражения последней через степень протекания реакции α: ξ = α n0 = α ${{{{m}_{0}}} \mathord{\left/ {\vphantom {{{{m}_{0}}} M}} \right. \kern-0em} M}$ и подстановки ее в соотношение (1) получаются уравнения которые связывают текущую удельную теплоту Qm = $ = - \frac{{\Delta H}}{{{{m}_{0}}}}$ с удельной теплотой реакции ${{Q}_{{rM}}}\, = \, - \frac{{{{\Delta }_{r}}H}}{M},$ а также тепловой поток ${{\dot {Q}}_{m}} = \frac{{d{{Q}_{m}}}}{{d\tau }}$ с производной по времени от степени превращения $\dot {\alpha } = \frac{{d\alpha }}{{d\tau }}.$В формуле n0 = ${{{{m}_{0}}} \mathord{\left/ {\vphantom {{{{m}_{0}}} M}} \right. \kern-0em} M}$ – число молей реагентов выражено через их начальную массу ${{m}_{0}}$ и молярную массу реакционной смеси M.
В ДСК измеряемый сигнал ${{S}_{{{\text{Д С К }}}}}$ пропорционален тепловому потоку
(3)
${{S}_{{{\text{Д С К }}}}} = C{{\dot {Q}}_{m}} = C\dot {\alpha }{{Q}_{{rM}}} = {{C}_{N}}\dot {\alpha }$Кинетика реакций СВС, сочетающих химические и фазовые превращения, требует использования достаточно гибких, параметрически расширенных моделей, среди которых можно выделить эмпирический, четырeхпараметрический подход Шестака–Бергрена (ШБ), дифференциальная форма которого имеет вид
(4)
$\dot {\alpha } = \frac{{d\alpha }}{{d\tau }} = kf(\alpha ),\,\,\,\,f(\alpha ) = {{\alpha }^{q}}{{(1 - \alpha )}^{r}}.$Кроме входящих в константу скорости k = $ = A\exp ({{ - {{E}_{a}}} \mathord{\left/ {\vphantom {{ - {{E}_{a}}} {RT}}} \right. \kern-0em} {RT}})$ = ${\text{exp(}}s - {{{{E}_{a}}} \mathord{\left/ {\vphantom {{{{E}_{a}}} {RT}}} \right. \kern-0em} {RT}})$ аррениусовых констант A и E, исходная модель ШБ содержит два степенных параметра q и r.
Для обработки и анализа экспериментальных данных использован функционально модифицированный вариант [10] кинетической модели ШБ, уравнения которого имеют вид
(5)
$\begin{gathered} \dot {\alpha } = \frac{{d\alpha }}{{d\tau }} = k\left( {1 + \frac{{(1 - {{{{T}_{0}}} \mathord{\left/ {\vphantom {{{{T}_{0}}} T}} \right. \kern-0em} T}){{E}_{a}}}}{{RT}}} \right)f(\alpha ), \\ f(\alpha ) = np{{\alpha }^{{{{1 - 1} \mathord{\left/ {\vphantom {{1 - 1} {\left( {np} \right)}}} \right. \kern-0em} {\left( {np} \right)}}}}}{{\left( {1 - {{\alpha }^{{{1 \mathord{\left/ {\vphantom {1 p}} \right. \kern-0em} p}}}}} \right)}^{{{{1 + 1} \mathord{\left/ {\vphantom {{1 + 1} n}} \right. \kern-0em} n}}}}. \\ \end{gathered} $В аналитическом решении уравнений (5)
(6)
$\alpha (\tau ,T) = \frac{1}{{{{{\left( {1 + {1 \mathord{\left/ {\vphantom {1 {{{\tau }^{n}}}}} \right. \kern-0em} {{{\tau }^{n}}}}} \right)}}^{p}}}}$Параметры p и n, заменяющие чисто эмпирические параметры q и r, упрощают интерпретацию результатов, поскольку произведение pn по сути соответствует параметру n в наиболее распространенной модели Джонса–Мейла–Авраами (ДМА).
Кинетические характеристики синтеза оксида скандия по результатам обработки данных ДСК/ТГ. На рис. 3 приведены результаты аппроксимации экспериментальных результатов калориметрического анализа по уравнениям (3), (5), (6), а также измеренные и рассчитанные посредством уравнения (6) величины потери массы за счет выделяющихся в процессе газообразных продуктов.
Рис. 3.
Экспериментальные (1) и рассчитанные (2) ДСК/ТГ-кривые реакций СВС оксида скандия в системах: Sc(NO3)3 – 0.11Sc(C5H8O2)3 (а, б), Sc(NO3)3 – 0.62Sc(CH3COO)3 (в, г) и Sc(NO3)3 – 1.5NH2CH2COOH (д, е).

Рассчитанные методом нелинейной регрессии параметры (кинетические характеристики трех реакций СВС оксида скандия) представлены в табл. 1.
Таблица 1.
Рассчитанные параметры реакций СВС оксида скандия из различных прекурсоров
| Реакция синтеза | Ea, кДж/моль | s | np | CN, мкВ с/мг |
|---|---|---|---|---|
| (А) | 57.35 | 9.71 | 3.56 | 409.54 |
| (Б) | 46.44 | 4.03 | 4 | 254.448 |
| (В) | 8.76 | 0.52 | 4 | 1132.942 |
Результаты расчетов удовлетворительно описывают экспериментальные данные. Для того, чтобы ограничить объем образующихся газообразных продуктов пределами тигля, были использованы навески реагентов очень малой массы (до 10 мг). Наряду с низкой инерционностью термопары это позволяет исключить искажение калориметрических данных, обусловленное размыванием пиков массивных образцов.
Разложение прекурсора СВС Sc(NO3)3–NH2CH2COOH отличается интенсивным и несимметричным экзотермическим эффектом на кривой ДСК, в двух остальных случаях наблюдаются почти симметричные и более чем на порядок менее интенсивные эффекты. Таким образом, химическое взаимодействие, характерное для СВС, наиболее ярко проявлялось при использовании в качестве горючего глицина, что объясняется большим запасом химической энергии горючего и окислителя. Это косвенно отражается в значениях параметра CN, связанного с энтальпией химической реакции (см. уравнения (2) и (3)).
При рассмотрении с позиций модели ДМА процессов кристаллизации по значению произведения параметров np можно сделать вывод о размерности процесса [10]. В нашем случае оно стремится к 4, что соответствует объемному протеканию реакции. Подобную ситуацию можно трактовать как протекание процесса не в классическом варианте СВС, а в режиме теплового взрыва [16]. Однако, учитывая малую массу образцов, для подтверждения данного вывода необходимо проведение дополнительных исследований. Относительно невысокое значение энергии активации взаимодействия нитрата скандия с глицином может свидетельствовать о диффузионно-лимитируемой кинетике исследованных процессов.
ЗАКЛЮЧЕНИЕ
Проведен термоанализ разложения прекурсоров, использованных для СВС высокодисперсных порошков оксида скандия. На основании сравнения ТГ/ДСК-кривых разложения исходных компонентов и смесей окислитель + горючее показано, что инициирование СВС связано с одной из стадий термодеструкции нитрата скандия.
Впервые на основании модифицированной модели ШБ проведена обработка результатов СТА СВС, установлены температурно-временные зависимости степени превращения α(τ, T), необходимые для реализации СВС-синтеза оксида скандия, определены кинетические характеристики реакционного взаимодействия нитрата скандия с ацетилацетонатом скандия, ацетатом скандия и глицином. Исходя из рассчитанных значений энергии активации сделано предположение о том, что взаимодействие нитрата скандия с глицином, в отличие от ацетата и ацетилацетоната скандия, протекает в диффузионном режиме.
Список литературы
Fornasier L., Mix E., Peters V., Petermann K., Huber G. New Oxide Crystals for Solid State Lasers // Cryst. Res. Technol. 1999. V. 34. № 2. P. 255–260.
Snetkov I.L., Palashov O.V. et al. Study of Thermo-Optical Constants of Yb Doped Y2O3, Lu2O3 and Sc2O3 Ceramic Materials // Opt. Express. 2013. V. 21. № 18. P. 21254–21263.
Снетков И.Л., Мухин И.Б., Балабанов С.С., Пермин Д.А., Палашов О.В. Эффективная генерация на лазерной керамике Yb : (YLa)2O3 // Квант. электроника. 2015. Т. 45. № 2. С. 95–97.
Пермин Д.А., Новикова А.В., Гаврищук Е.М., Балабанов С.С., Сорокин А.А. Самораспространяющийся высокотемпературный синтез порошков Lu2O3 для оптической керамики // Неорган. материалы. 2017. Т. 12. С. 1359–1364.
Permin D.A., Gavrishchuk E.M., Klyusik O.N., Egorov S.V., Sorokin A.A. Self-Propagating High-Temperature Synthesis of Sc2O3 Nanopowders Using Different Precursors // Adv. Powder Technol. 2016. V. 27. № 6. P. 2457–2461.
Гаврищук Е.М., Клюсик О.Н., Кутьин А.М., Пермин Д.А. Термодинамический анализ условий самораспространяющегося высокотемпературного синтеза (СВС) нанопорошков оксидов скандия и лютеция // Неорган. материалы. 2015. Т. 51. № 9. С. 1039–1044.
Балабанов С.С., Гаврищук Е.М., Кутьин А.М., Пермин Д.А. Самораспространяющийся высокотемпературный синтез порошков Y2O3 из Y(NO3)3x(CH3COO)3(1 – x) · nH2O // Неорган. материалы. 2011. Т. 47. № 5. С. 484–488.
González-Cortés S.L., Imbert F.E. Fundamentals, Properties and Applications of Solid Catalysts Prepared by Solution Combustion Synthesis (SCS) // Appl. Catal., A. 2013. V. 452. P. 117–131.
Nersisyan H.H., Lee J.H., Ding J.R., Kim K.S., Manukyan K.V., Mukasyan A.S. Combustion Synthesis of Zero-, One-, Two- and Three-Dimensional Nanostructures: Current Trends and Future Perspectives // Prog. Energy Combust. Sci. 2017. V. 63. P. 79–118.
Кутьин А.М., Плехович А.Д., Сибиркин А.А. Кинетика кристаллизации стекол (TеO2)1 – х(MоO3)х по данным ДСК // Неорган. материалы. 2015. Т. 51. № 12. С. 1385–1392.
Kutyin A.M., Rostokina E.Ye., Gavrishchuk E.M., Drobotenko V.V., Plekhovich A.D., Yunin P.A. Kinetics and Formation Mechanism of Yttrium Aluminum Garnet from an Amorphous Phase Prepared by the Sol–Gel Method // Ceram. Int. 2015. V. 41. № 9. P. 10 616–10 623.
Melnikov P., Nascimento V.A., Arkhangelsky I.V., De Oliveira L.C.S., Silva A.F., Consolo L.Z.Z. Thermogravimetric Study of the Scandium Nitrate Hexahydrate Thermolysis and Computer Modeling of Intermediate Oxynitrates // J. Therm. Anal. Calorim. 2015. V. 119. P. 1073–1079.
Ribot J., Toledano P., Sanchez C. X-ray and Spectroscopic Investigations of the Structure of Yttrium Acetate Tetrahydrate // Inorg. Chim. Acta. 1991. V. 185. № 2. P. 239–245.
Huang M., Lv S., Zhou C. Thermal Decomposition Kinetics of Glycine in Nitrogen Atmosphere // Thermochim. Acta. 2013. V. 552. P. 60–64.
Яблоков В.А., Смельцова И.Л., Зеляев И.А., Митрофанова С.В. Исследование термической стабильности глицина, аланина и серина // Журн. общ. химии. 2009. Т. 79. № 8. С. 1344–1346.
Мержанов А.Г. 40 лет СВС: итоги деятельности и их значение. Черноголовка: ИСМАН, 2007. С. 77.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


