Неорганические материалы, 2019, T. 55, № 4, стр. 361-366
Образование металлических и карбидных фаз при совместном разложении (NiEn3)WO4 и гидрида лития в интервале 410–1060°С
С. А. Громилов 1, 2, *, Е. Ю. Герасимов 2, 3, Р. Е. Николаев 1
1 Институт неорганической химии им. А.В. Николаева СО Российской академии наук
630090 Новосибирск, пр. Ак. Лаврентьева, 3, Россия
2 Новосибирский государственный университет
630090 Новосибирск, ул. Пирогова, 2, Россия
3 Институт катализа им. Г.К. Борескова СО Российской академии наук
630090 Новосибирск, пр. Ак. Лаврентьева, 5, Россия
* E-mail: grom@niic.nsc.ru
Поступила в редакцию 06.05.2018
После доработки 17.10.2018
Принята к публикации 03.10.2018
Аннотация
Проведено рентгенографическое исследование процесса образования металлических и карбидных фаз при термическом разложении смеси комплексной соли [NiEn3]WO4 (En – этилендиамин) с LiH в атмосфере Не. Показано, что выдерживание такой смеси при 410°С в течение 10 мин приводит к образованию твердого раствора внедрения Ni(Сх) на основе ГПУ-решетки Ni и твердого раствора замещения W1 – хNix на основе ОЦК-решетки W. Начиная с 510°С к этим фазам добавляется твердый раствор Ni1 – хWх на основе ГЦК-решетки Ni. Появление двойного карбида Ni2W4C зафиксировано при 660°С, а Ni6W6C – при 860°С. В аналогичных условиях (700°С, Не) термическое разложение смеси NiWO4 и LiH привело к образованию W и твердого раствора ГЦК-Ni1 – хWх (х ~ 0.12).
ВВЕДЕНИЕ
Комплексные соли рассматриваются как предшественники нанокристаллических продуктов широкого спектра, в том числе металлических фаз сложных составов (см., например, [1–6]). Наличие атомов кислорода в составе лигандов позволяет получать оксидные фазы. Так, в [7] при нагревании [NiEn3]CrO4 в атмосфере водорода получена смесь нанокристаллических порошков Ni и Cr2O3, а в [8] – (ZnEn3)CrO4 цинкохромитная шпинель. В [9] показано, что при разложении (CoEn3)2W7О24 ⋅ nН2О в атмосфере гелия образуется смесь СоWО4 и WО3, а в атмосфере водорода – вольфрам (~90 мас. %) и двойные карбиды Co6W6C и Co2W4C; подмешивание активированного угля приводит к снижению доли W до 2 мас. % [10]. В [11] двойной карбид Ni2W4C получали двумя способами. В первом готовили смесь NiWO4 и сажистого углерода и далее проводили нагрев в атмосфере аргона (начало восстановления ~700°C), во втором проводили нагрев в атмосфере СО.
Наличие атомов углерода в составе лигандов (например, En) позволяет исключить процедуру подмешивания углеродных фаз при получении карбидов. В этом отношении биметаллические комплексные соли, построенные с участием комплексных катионов [МEn3]2+, можно рассматривать в качестве однокомпонентных предшественников карбидов металлов.
Цель настоящего исследования – изучение продуктов термического разложения (NiEn3)WO4. Представлялось интересным изучить возможности использования гидрида лития LiH для получения полностью восстановленных продуктов. Такой подход был продемонстрирован в ряде работ (см., например, [12–14]).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Cинтез и структура (NiEn3)WO4 представлены в работе [15].
Термическое разложение проводили на установке, описанной в работах [16, 17]. Кристаллы (NiEn3)WO4 и LiH в объемном отношении ~1 : 1 помещали в молибденовый тигель (внешний диаметр 3 мм, внутренний 2 мм, общий объем смеси кристаллов (NiEn)3WO4 и LiH ~ 2 мм3). Использованный для восстановления гидрид лития содержал (по данным РФА) около 30 мас. % LiOH. В качестве инертного газа использовали гелий (99.995%). W/W–Re-термопара была максимально приближена к нагреваемому образцу с тыльной стороны тигля. Процедура нагрева включала два этапа: нагрев до заданной температуры со скоростью 600°С/мин и выдержка при этой температуре в течение необходимого времени. Во время нагрева в камере поддерживали давление гелия 0.2 МПа и осуществляли продувку со скоростью 1 дм3/мин (объем камеры около 0.3 дм3). Для получения достоверных данных о достигнутой температуре в каждой серии нагревов установку калибровали по температурам плавления Zn (420°С), Sb (632°С), Ag (962°С) и Cu (1085°С). В серии экспериментов было установлено, что ошибка определения температуры не превышает 15°C. Была проведена серия опытов при температурах в интервале от 410 до 1060°С. Полученные в результате нагревания продукты содержали Li2O, который отмывали дистиллированной водой.
Рентгенографическое исследование проводили при комнатной температуре по методике [18, 19] на дифрактометре Bruker DUO (геометрия Дебая–Шеррера, микрофокусная трубка Incoatec 1μSCu, фокусирующий коллиматор 0.6 мм, разрешение двухкоординатного CCD-детектора 512 × × 512). Детектор располагался на расстоянии 40 мм от образца и был развернут на угол 2θД = –45° относительно первичного пучка. В качестве внешнего эталона использовали LaB6 (керамика NIST SRM-660) и Si (SRM-640A). В модуле управления гониометром стратегия эксперимента была спланирована таким образом, чтобы образец последовательно располагался в различных положениях относительно первичного пучка (углы χ и ω) и за время накопления дифракционной картины (дебаеграммы) совершал полный оборот вокруг оси φ. При суммировании дебаеграмм и переходе к стандартному виду 2θ(I) использовали программу XRD2DScan [20]. Поправку на внешний эталон LaB6 вводили по программе Dioptas [21]. Использованная методика съемки позволила получить стандартные дифрактограммы и провести качественный и количественный рентгенофазовый анализ (РФА). Идентификация продуктов термического разложения проведена с использованием базы данных PDF-2 [22]. При проведении полнопрофильного уточнения по программе PCW [23] использовали рентгеноструктурные данные базы данных ICSD [24]. Результаты РФА представлены в табл. 1.
Таблица 1.
Результаты РФА продуктов термического разложения смеси (NiEn3)WO4 и LiH в атмосфере гелия
| Образец | 410/10 | 460/1 | 510/1 | 560/1 | 660/1 | 860/1 | 1060/1 | 1060/10 | |
|---|---|---|---|---|---|---|---|---|---|
| Ni(Cх) (P63/mcm) |
a, Å | 2.646(2) | 2.651(2) | 2.643(2) | 2.652(2) | – | – | ||
| с, Å | 4.343(4) | 4.342(4) | 4.344(4) | 4.335(4) | |||||
| Кол-во, мас. % | 98 | 93 | 81 | 79 | |||||
| W1 –хNix (Im3m) |
a, Å | 3.148(3) | 3.151(3) | 3.152(3) | 3.161(3) | – | – | ||
| Кол-во, мас. % | 2 | 7 | 11 | 1 | |||||
| х | 0.05 | 0.04 | 0.04 | 0.01 | |||||
| Ni1 – хWх (Fm$\bar {3}$m) |
a, Å | – | 3.569(3) | 3.561(3) | 3.603(3) | 3.599(3) | 3.594(3) | 3.585(3) | |
| Кол-во, мас. % | 8 | 20 | 15 | 48 | 15 | 50 | |||
| х | 0.09 | 0.07 | 0.15 | 0.15 | 0.14 | 0.12 | |||
| Ni2W4Cх (Fd$\bar {3}$m) |
a, Å | – | 11.247(9) | 11.256(9) | |||||
| Кол-во, мас. % | 85 | 52 | 1 | ||||||
| Ni6W6Cх (Fd$\bar {3}$m) |
a, Å | 10.90(1) | 10.928(9) | 11.200(9) | |||||
| Кол-во мас. % | 4 | 84 | 50 | ||||||
Примечание. Эталонные значения для: ГПУ-Ni – a = 2.506, с = 4.074 Å (P63/mcm) [25]; W – a = 3.1648 Å (Im3m) [22; № 4-806]; ГЦК-Ni – а = 3.5239 Å (Fm$\bar {3}$m) [22]; Ni0.92W0.08 – a = 3.562 Å (Fm$\bar {3}$m) [24; 105455]; Ni2W4C – a = 11.25 Å (Fd$\bar {3}$m) [24; 618587]; Ni6W6C – a = 10.873 Å (Fd$\bar {3}$m) [24; 618588].
Данные просвечивающей электронной микроскопии высокого разрешения (ПЭМВР) были получены на приборе JEM-2010 (разрешение 1.4 Å, ускоряющее напряжение 200 кВ). Прибор оборудован энергодисперсионной приставкой (EDX) XFlash (Bruker, Germany) с разрешением по энергиям 128 эВ. Образец был нанесен методом диспергирования ультразвуком на углеродную подложку, находящуюся на медной сеточке. С помощью Фурье-изображений кристаллической решетки были оценены межплоскостные расстояния и выделены блоки, соответствующие обнаруженным фазам.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Согласно данным РФА (см. табл. 1), при выдерживании смеси кристаллов (NiEn3)WO4 и LiH при 410°С в течение 1 мин (образец 410/1 – температура/время) образуется сложный продукт, содержащий как кристаллические, так и аморфные фазы. Соотношение кристаллических фаз (мас. %): 78 – NiO (18; № 76640); 20 – фаза на основе гексагональной плотноупакованной (ГПУ) решетки никеля Ni; 2 – твердый раствор замещения W1 – хNix на основе объемноцентрированной кубической (ОЦК) решетки W. Значения параметров элементарной ячейки (ПЭЯ) ГПУ-фазы (а = 2.652(4), с = = 4.339(5) Å) заметно отличаются от приведенных в [25] для ГПУ-Ni (см. табл. 1). В нашем эксперименте нельзя полностью исключить возможность внедрения в структуру атомов En-лиганда. Далее условно будем называть эту фазу Ni(Cх). Значение ПЭЯ ОЦК-фазы W1 – хNix (а = 3.151(6) Å) заметно меньше значения для эталона (см. табл. 1). Если ориентироваться на показатель V/Z: для ОЦК-W – 15.85 и ГЦК-Ni – 10.94 Å3, то, согласно правилу Зена, V/Z = 15.64 Å3 соответствует значению х = = 0.04. Такой подход использован для оценки состава фаз ОЦК-W1 – хNix, образовавшихся при других температурах (см. табл. 1). Согласно фазовой диаграмме W–Ni [26], при 410°С замещение атомов W атомами Ni не превышает 1 мол. %.
При увеличении времени выдерживания смеси (NiEn3)WO4 и LiH при 410°С до 10 мин (образец 410/10) фаза NiO полностью исчезла. Если не учитывать аморфные фазы (проведено вычитание фона), то на долю Ni(Cх) приходится 98 мас. %. Остальные 2 мол. % – ОЦК-W1 – хNix. Результаты уточнения ПЭЯ приведены в табл. 1. Контрольный опыт по нагреванию (NiEn3)WO4 без LiH при 410°С в течение 10 мин привел к образованию похожего продукта, т.е. при таких невысоких температурах присутствие LiH не оказывает заметного влияния. Можно отметить, что в изученном интервале полуширины дифракционных линий Ni(Cх) в 4.3 раза больше, чем у ОЦК-W1 –хNix. Т.к. обе фазы не являются стехиометрическими, оценки размеров областей когерентного рассеяния мы не проводили. Повышение температуры нагрева до 460°С (образец 460/1) практически не изменило фазовый состав и ПЭЯ фаз. По данным ПЭМВР, в образце наблюдаются массивные (с размерами более 1 мкм) агрегаты частиц (рис. 1а), состоящие из разориентированных блоков (кристаллитов), находящихся в аморфной матрице. Размеры блоков также варьируются от 2 (рис. 1б) до 20 нм (рис. 1в). Анализ наблюдаемых на снимках межплоскостных расстояний и полученные EDX-спектры позволяют предположить, что первый тип частиц – ОЦК-W1 – хNix, а более крупные частицы (рис. 1г) – Ni(Cх).
Рис. 1.
Изображения ПЭМВР для продукта термического разложения смеси (NiEn3)WO4 и LiH (1 мин, 460°С, гелий, образец 460/1), представляющего собой смесь твердого раствора внедрения Ni(Cх) на основе ГПУ-Ni и твердого раствора замещения ОЦК-W1 –хNix: а – морфология образца, б – частицы Ni(Cх) в аморфной матрице, в – разупорядоченные блоки W1 –хNix, г – частица Ni(Cх) и Фурье-преобразование, выполненное с данного изображения.

Начиная с 510°С (образцы 510/1 и 560/1) в продуктах нагревания, кроме уже указанных фаз Ni(Cх) и ОЦК-W1 – хNix, фиксируется образование твердого раствора Ni1 – хWх на основе гранецентрированной кубической (ГЦК) решетки Ni. Согласно данным [22], ПЭЯ таких фаз лежат в широком интервале – 3.562–3.586 Å. Полученное в опыте 510/1 значение V/Z = 11.365 Å3, согласно правилу Зена, соответствует составу Ni0.91W0.09. По данным табл. 1 можно проследить, что при дальнейшем повышении температуры х достигает 0.15. Такие показатели соответствуют фазовой диаграмме W–Ni, согласно которой вплоть до 700°С замещение атомов Ni атомами W сохраняется на уровне 13 мол. %, а при 1000°С ~ 15 мол. %. Можно отметить, что в продукте 560/1 параметр ОЦК-W1 –хNix в пределах погрешности эксперимента совпадает со значением для эталонного W.
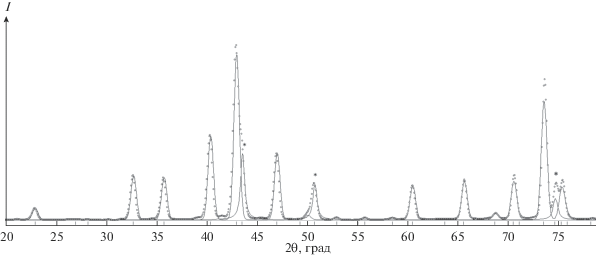
Повышение температуры до 660°С (образец 660/1) привело к радикальному изменению фазового состава: исчезла фаза Ni(Cх) и появился двойной карбид Ni2W4Cх. В базе данных ICSD [24] есть рентгеноструктурные данные для нескольких таких фаз с разными значениями х (см., например, №№ 618589 и 618587). При этом значения параметров кубической ячейки (пр. гр. Fd$\bar {3}$m) лежат в широком интервале – 11.217–11.250 Å. Измеренное нами значение а показывает, что х ≈ 1. Характеризуя вторую фазу – ГЦК-Ni1 – хWх – можно отметить, что значение параметра а = 3.603(3) Å существенно выходит за указанный ранее интервал 3.562–3.586 Å. Это может быть связано как с увеличением значения х, так и с внедрением в структуру легких атомов. Это относится и к аналогичной фазе ГЦК-Ni1 – хWх (образец 860/1). Кроме этого, зафиксировано появление двойного карбида Ni6W6Cх на уровне 4 мас. %. Дальнейшее повышение температуры приводит к уменьшению содержания Ni2W4Cх. Продукт 1060/1 представлен двумя фазами: 15 мас. % Ni1 – хWх и 85 мас. % Ni6W6Cх (см. рис. 3). Увеличение времени выдерживания при этой температуре до 10 мин (образец 1060/10) привело к уменьшению доли Ni6W6Cх.
Рис. 2.
Изображения ПЭМВР для продукта термического разложения (NiEn3)WO4 (без LiH, гелий, 540°С, 1 мин): а – морфология частиц, б – частица Ni(Cх), в – разупорядоченные кристаллиты WO3, г – EDX-спектр, полученный в области 2.
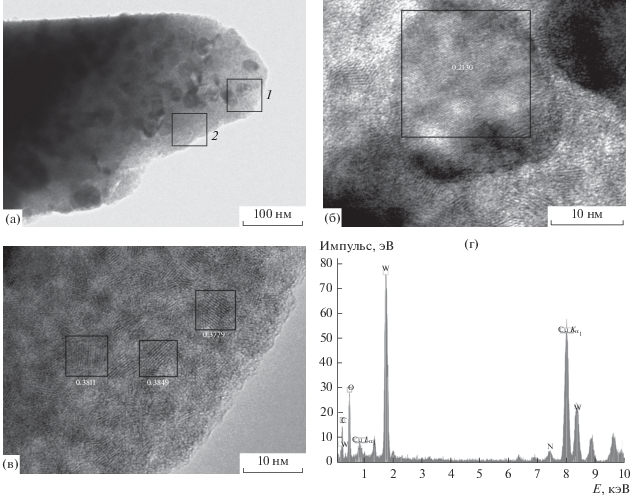
Рис. 3.
Дифрактограмма продукта 1060/1: рефлексы ГЦК-Ni1 –хWх показаны звездочками, остальные рефлексы отнесены к Ni6W6Cх.
Контрольные опыты по нагреванию (NiEn3)WO4 в атмосфере гелия, но без подмешивания LiH показали следующее. В образце, полученном при 540°С, присутствует WO3 [22; № 00-036-0103]. Из-за сложного вида дифрактограммы этой фазы (большое число широких и перекрывающихся рефлексов) идентификация других фаз оказалась практически невозможной. Исследование ПЭМВР показало, что образец представляет собой агрегаты частиц с размерами более 1 мкм (рис. 2а). Непосредственно внутри агрегатов можно выделить два типа частиц – на рис. 2а им соответствуют области 1 и 2. В первом случае это кристаллиты с размерами порядка 10–20 нм (рис. 2б), предположительно имеющие структуру Ni(Cх). Данный тип частиц находится в матрице, состоящей из разориентированных блоков WO3 с размерами 3–10 нм (рис. 2в). Проведенный с области 2 EDX-анализ показывает незначительное количество Ni в данной зоне (рис. 2г), а наблюдаемые межплоскостные расстояния соответствуют набору, характерному для WO3. При повышении температуры термолиза до 600°С, кроме рефлексов WO3, на дифрактограмме появляются рефлексы ГЦК-Ni1 –хWх и WC [22; № 00-036-0103]. Увеличенное (относительно эталона) значение ПЭЯ ГЦК-Ni1 – хWха = 3.557 Å свидетельствует об образовании твердого раствора. Как было отмечено ранее, кроме замещения атомов Ni атомами W нельзя исключать возможность внедрения легких атомов в структуру Ni.
Также для сравнения была проведена серия опытов по термическому разложению смеси NiWO4 и LiH в атмосфере гелия. По данным РФА, образец, полученный в результате нагревания до 700°С, представлял собой смесь двух фаз – 32 мас. % ГЦК-Ni1 – xWx и 68 мас. % ОЦК-W1 –хNix. Значение ПЭЯ ГЦК-Ni1 – xWxа = 3.592(3) Å хорошо коррелирует со значениями для аналогичных фаз – образцы 660/1, 860/1, 1060/1 и 1060/10. В случае ОЦК-W1 – хNix значение а = 3.164(3) Å в пределах погрешности совпадает со значением для эталонного W. Таким образом, подмешивание LiH к NiWO4 позволило уже при 700°С получить полностью восстановленный продукт. Для сравнения, в работе [11] при нагревании смеси NiWO4 и сажистого углерода оксидные фазы исчезли лишь при 1000°С.
ЗАКЛЮЧЕНИЕ
Изучен процесс образования металлических и карбидных фаз при термическом разложении смеси (NiEn3)WO4 с LiH в атмосфере Не. Показано, что при 410°С образуются ГПУ-Ni(Сх) на основе решетки Ni и твердый раствор замещения W1 – хNix на основе ОЦК-решетки W. Начиная с 510°С к этим фазам добавляется твердый раствор Ni1 – хWх на основе ГЦК-решетки Ni. Появление двойного карбида Ni2W4C зафиксировано при 660°С, а Ni6W6C – при 860°С.
Список литературы
Громилов С.А., Коренев С.В., Байдина И.А., Корольков И.В., Юсенко К.В. Синтез [Rh(NH3)5Cl][MCl6] (M = Re, Os, Ir), изучение продуктов их термолиза. Кристаллическая структура [Rh(NH3)5Cl][OsCl6] // Журн. структур. химии. 2002. Т. 43. № 3. С. 527–533.
Коренев С.В., Венедиктов А.Б., Шубин Ю.В., Юсенко К.В., Громилов С.А. Синтез и структура двойных комплексов платиновых металлов – предшественников металлических материалов // Журн. структур. химии. 2003. Т. 44. № 1. С. 58–73.
Коренев С.В., Громилов С.А., Губанов А.И., Венедиктов А.Б. Синтез и свойства твердого раствора [Pd(NH3)4][Ir0.5Os0.5Cl6] // Координац. химия. 2003. Т. 29. № 3. С. 234–236.
Юсенко К.В., Громилов С.А., Байдина И.А., Корольков И.В., Живонитко В.В., Венедиктов А.Б., Коренев С.В. Кристаллическое строение двойных комплексных солей состава [М(NH3)5Cl]2[IrCl6]Cl2 (M = Co, Rh, Ir) // Журн. структур. химии. 2003. Т. 44. № 1. С. 74–82.
Юсенко К.В., Громилов С.А., Корольков И.В., Байдина И.А., Романенко Г.В., Коренев С.В. Синтез и кристаллическая структура двойных комплексных солей [Rh(NH3)5Cl]2[MCl6]Cl2 (М = Re, Os) // Журн. неорган. химии. 2004. Т. 49. № 4. С. 568–573.
Yusenko K.V., Riva S., Carvalho P., Arnaboldi S., Sukhikh A.S., Hanfland M., Gromilov S.A. First Hexagonal Close Packed High-Entropy Alloy with Outstanding Stability under Extreme Conditions and Electrocatalytic Activity for Methanol Oxidation // Scr. Mater. 2017. V. 138. P. 22–27.
Храненко С.П., Комаров В.Ю., Герасимов Е.Ю., Задесенец А.В., Максимовский Е.А., Громилов С.А. [NiEn3]CrO4. Структура, термические свойства, псевдоморфизм // Журн. структур. химии. 2017. Т. 58. № 7. С. 1487–1491.
Громилов С.А., Герасимов Е.Ю., Храненко С.П., Комаров В.Ю., Задесенец А.В. [ZnEn3]CrO4 – предшественник цинкохромитной шпинели // Журн. структурн. химии. 2017. Т. 58. № 7. С. 1482–1486.
Громилов С.А., Храненко С.П., Семитут Е.Ю., Киреенко И.Б. Получение сверхтвердых кумулятивных покрытий путем разложения комплексных солей // Физика горения и взрыва. 2013. Т. 49. № 2. С. 127–132.
Куратьева Н.В., Терешкин И.О. Храненко С.П., Громилов С.А. Кристаллическая структура [CoEn3]2-(W7О24) · 6Н2О // Журн. структур. химии. 2013. Т. 54. № 6. С. 1103–1106.
Лебухова Н.В., Карпович Н.Ф. Углетермическое восстановление вольфраматов кобальта и никеля // Неорган. материалы. 2006. Т. 42. № 3. С. 357–362.
Камарзин А.А., Осадчая Л.И., Соколов В.В., Трушникова Л.Н., Зубарева А.П., Сапрыкин А.И., Троицкий Д.И. Получение металлического тербия и его гидрида // Неорган. материалы. 2000. Т. 36. № 9. С. 1048–1050.
Соколов В.В., Осадчая Л.И., Петрий О.А., Сафонова Т.Я., Вербицкий В.Н., Зотов Т.А. Электрохимическое поведение интерметаллидов типа АВ5, синтезированных восстановлением смеси оксидов и солей гидридом лития // Электрохимия. 2002. Т. 38. № 11. С. 1399–1401.
Sokolov V.V., Osadchaya L.I., Galkin P.S., Zelenin Ju.M., Stonoga Yu. A., Zubareva A.P. Synthesis of Intermetallic Compounds by Using Lithium Hudride // J. Rare Earths. 2002. V. 20. P. 257–258.
Храненко С.П., Сухих А.С., Пищур Д.П., Бунеева П.C., Комаров В.Ю., Громилов С.А. [NiEn3]WO4. Кристаллоструктурные особенности фазового перехода при 269 К // Журн. структур. химии. 2018. Т. 59. № 8.
Gibner Ya., Vasilyeva I. Rapid Heating in High-Temperature Thermo-Microscopic Analysis // J. Therm. Anal. 1998. V. 53. P. 151–160.
Громилов С.А., Николаев Р.Е., Черепанова С.В. Образование “сжатого” и смешаннослойного графита при нагревании импактных алмазов // Журн. структур. химии. 2018. Т. 59. № 2. С. 368–377.
Панченко А.В., Толстых Н.Д., Громилов С.А. Методика рентгенодифрактометрического исследования сростков кристаллов // Журн. структур. химии. 2014. Т. 55. Приложение № 1. С. S24–S29.
Yelisseyev A., Khrenov A., Afanasiev V., Pustovarov V., Gromilov S., Panchenko A., Pokhilenko N., Litasov K. Luminescence of Natural Carbon Nanomaterial: Impact Diamonds from the Popigai Crater // Diamond Relat. Mater. 2015. V. 58. P. 69–77.
Rodriguez-Navarro A. XRD2DScan: New Software for Polycrystalline Materials Characterization Using Two-Dimensional X-ray Diffraction // J. Appl. Crystallogr. 2006. V. 39. № 6. P. 905–909.
Prescher C., Prakapenka V.B. DIOPTAS: a Program for Reduction of Two-Dimensional X-ray Diffraction Data and Data Exploration // High Press. Res. 2015. V. 35. № 3. P. 223–230.
Powder Diffraction File. PDF-2 / Release 2009 // International Centre for Diffraction Data. USA. 2009.
Kraus W., Nolze G. POWDER CELL – a Program for the Representation and Manipulation of Crystal Structures and Calculation of the Resulting X-ray Powder Patterns // J. Appl. Crystallogr. 1996. V. 29. № 3. P. 301–303.
Inorganic Crystal Structure Database, Release 2017, Karlsruhe: Fashinformationszentrum, 2017.
Bolokang A.S., Phasha M.J. Novel Synthesis of Metastable HCP Nickel by Water Quentching // Mater. Lett. 2011. V. 65. P. 59–60.
Хансен М., Андерко К. Структуры двойных сплавов. М.: Металлургиздат, 1962. 1488 с.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


