Неорганические материалы, 2019, T. 55, № 5, стр. 496-500
Получение ZrB2 взаимодействием ZrCl4 с NaBH4 в расплаве бромида калия
С. Е. Кравченко 1, Д. Ю. Ковалев 2, И. И. Коробов 1, Г. В. Калинников 1, С. В. Коновалихин 2, Н. Ю. Хоменко 2, С. П. Шилкин 1, *
1 Институт проблем химической физики Российской академии наук
142432 Московская обл., Черноголовка, пр. Академика Семенова, 1, Россия
2 Институт структурной макрокинетики и проблем материаловедения им. А.Г. Мержанова
Российской академии наук
142432 Московская обл., Черноголовка, ул. Академика Осипьяна, 8г, Россия
* E-mail: ssp@icp.ac.ru
Поступила в редакцию 25.05.2018
После доработки 13.11.2018
Принята к публикации 12.12.2018
Аннотация
Методами рентгенографии, сканирующей электронной микроскопии, РФЭ-спектроскопии, термогравиметрии, измерения удельной поверхности и элементного анализа исследованы продукты взаимодействия ZrCl4 c NaBH4 в расплаве бромида калия под давлением аргона 4 МПа при 740 и 800°C. Показано, что размеры частиц наноразмерного ZrB2, полученного при указанных температурах, составляют ~20 и ~30 нм соответственно.
ВВЕДЕНИЕ
Одним из важнейших в прикладном плане представителей боридов переходных металлов IV группы является диборид циркония, применяемый как в индивидуальном виде, так и в качестве компонента композитных керамических материалов, обладающий высокой термостабильностью, ударо- и износостойкостью, коррозионной и окислительной устойчивостью в жидких и газовых средах. Физико-химические и механические эксплуатационные характеристики диборида циркония обуславливают его применение в химическом машиностроении, металлургии, ядерной энергетике, двигателестроении. Использование наночастиц боридных материалов стимулирует работы, направленные на разработку новых методов синтеза наноразмерных тугоплавких боридов (см., например, [1, 2]).
Способы синтеза наноразмерного ZrB2 связаны с термолизом борогидрида циркония по схеме [3–7]
(1)
${\text{Zr}}{{\left( {{\text{B}}{{{\text{H}}}_{4}}} \right)}_{4}}\xrightarrow{t}{\text{Zr}}{{{\text{B}}}_{2}} + {{{\text{B}}}_{2}}{{{\text{H}}}_{6}} + 5{{{\text{H}}}_{2}},$который получают по реакции [8]:
(2)
$\begin{gathered} \quad{\text{ZrC}}{{{\text{l}}}_{4}}\quad + \,4{\text{М B}}{{{\text{H}}}_{4}}\quad\xrightarrow{t}{\text{Zr}}{{({\text{B}}{{{\text{H}}}_{4}})}_{4}} + \\ + \,\,4{\text{М Cl}},{\text{ г д е }}\,\,{\text{M}}--{\text{Li,Na,}} \\ \end{gathered} $либо с высокотемпературным карботермическим восстановлением смеси порошкообразных ZrO2 и В4С при 1400°С [9], или с механохимической обработкой смеси порошков оксида циркония и бора с последующим отжигом при 1100°С [10], или взаимодействием ZrCl4 с BCl3 в атмосфере водорода [11].
Методом высокоэнергетического разрушения могут быть получены наноразмерные порошки различных соединений, включая ZrB2 [12].
Дисперсные порошки диборида циркония образуются при высокотемпературном электрохимическом синтезе в ионных расплавах различного химического состава и природы [13, 14]. Ранее была показана принципиальная возможность получения ZrB2 при взаимодействии порошков циркония и бора в ионном расплаве безводного тетраборнокислого натрия и при взаимодействии ZrCl4 с NaBH4 в отсутствие растворителя [15–17].
Целью настоящей работы является синтез наноразмерных частиц диборида циркония взаимодействием ZrCl4 с NaBH4 в расплаве KBr в реакторе-автоклаве при повышенных температурах и давлениях. Данная работа является непосредственным продолжением исследований [15, 16].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные реагенты. Борогидрид натрия с чистотой 99.5% получали перекристаллизацией технического препарата из 1 N раствора NaOH и сушили в вакууме 1.3 × 10–1 Па при 100°С. В работе использовали товарный тетрахлорид циркония чистотой 99.9%, бромид калия (температура плавления 734°С, температура кипения 1435°С) “х. ч.” и аргон высокой чистоты – 99.998% (ТУ 2114-005-0024760-99). Источником водорода с чистотой не менее 99.999% служил автономный лабораторный генератор водорода, содержащий в качестве рабочего материала гидридную фазу на основе интерметаллического соединения TiFe [18].
Методы анализа. Рентгенофазовый анализ (РФА) полученных порошков ZrB2 проводили на дифрактометре ДРОН-3 с монохроматором на вторичном пучке в режиме пошагового сканирования на излучении CuKα в интервале углов 2θ = = 20°–90° с шагом съемки 0.02° и экспозицией 4 с в точке. Профильный анализ рентгенограмм осуществлялся в программном пакете “Буревестник”. Расчет метрики ячейки и параметров тонкой структуры проводился по 11 отражениям. Инструментальное уширение учитывалось по уширению линий эталона – LaB6 (SRM 660b). Для расчета среднего размера кристаллитов (областей когерентного рассеяния) использовался метод вторых моментов.
Термогравиметрические исследования выполняли методом синхронного термического анализа на термоанализаторе Netzch STA 409 PC Luxx, сопряженном с квадрупольным масс-спектрометром QMS 403 C Aеolos при линейном нагреве образца со скоростью 10°С/мин в потоке аргона в интервале температур от 20 до 1000°С.
Электронно-микроскопические исследования и рентгеновский энергодисперсионный анализ осуществляли на комплексе, состоящем из растрового сканирующего автоэмиссионного электронного микроскопа Zeiss Supra 25 и рентгеноспектральной установки INCA x-sight. Электронно-микроскопические изображения получали при низких ускоряющих напряжениях электронного пучка (~4 кВ). При таких ускоряющих напряжениях вклад в регистрируемый сигнал от подложки минимален либо отсутствует вовсе. Электронно-микроскопические снимки порошкообразных образцов ZrB2 различной дисперсности обрабатывались как массив частиц по распределению количества частиц и их размера с помощью программы Image-Pro Express 4.0.
Рентгенофотоэлектронные спектры регистрировали на спектрометре Specs. Спектры возбуждали излучением MgKα (hν = 1253.6 эВ). При съемке спектров остаточное давление в вакуумной камере спектрометра не превышало 3 × 10–7 Па. Мощность источника составляла 225 Вт.
Удельную поверхность образцов (Sуд) находили по величине адсорбции криптона при температуре жидкого азота после удаления из твердой фазы летучих примесей в вакууме 1.3 × 10–3 Па при температуре 300°C и рассчитывали по методу БЭТ. Площадь, занимаемую адсорбированной молекулой криптона, принимали равной 19.5 × × 10–20 м2. Относительная погрешность определения не превышала ±10%.
Содержание бора определяли потенциометрическим титрованием щелочью маннитборной кислоты после осаждения циркония из анализируемого раствора, цирконий – комплексонометрическим титрованием в присутствии ксиленолового оранжевого по стандартным методикам, бром определяли турбидиметрически по стандартным методикам, а также рентгеновским энергодисперсионным анализом. Содержание водорода определяли на CHNS/O-элементном анализаторе Vario Micro cube Elementar. Давление в системе измеряли образцовыми манометрами класса точности 0.4.
Методика эксперимента. Взаимодействие ZCl4 с NaBH4 в мольном соотношении 1 : 10 в расплаве KBr осуществляли следующим образом: в реактор-автоклав из нержавеющей стали в атмосфере аргона высокой чистоты помещали кварцевую ампулу с тетрахлоридом циркония, борогидридом натрия и бромидом калия. Затем автоклав вакуумировали при комнатной температуре в течение 5 мин, заполняли аргоном под давлением 4 МПа и нагревали 25 ч при заданной температуре (740 или 800°С). Далее температуру в реакторе доводили до комнатной и продукты реакции вакуумировали еще в течение 0.5 ч. После вскрытия реактора в атмосфере аргона полученную реакционную массу последовательно обрабатывали охлажденной дистиллированной водой, ацетоном, этиловым спиртом и вакуумировали при 40°С в течение 5–6 ч до остаточного вакуума 1.3 × 10–1 Па. Затем полученный порошок снова помещали в реактор, обрабатывали водородом в проточном режиме под давлением 5 МПа при 100°С, вакуумировали при комнатной температуре до остаточного вакуума 1.3 × 10–1 Па и выгружали из реактора в атмосфере аргона.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1, 2 и в табл. 1 представлены результаты и условия исследования взаимодействия ZrCl4 с NaBH4 в мольном соотношении 1 : 10 в расплаве KBr при температурах 740 и 800°С под давлением аргона 4 МПа. Для сравнения представлены результаты и условия получения ZrB2 при взаимодействии ZrCl4 с NaBH4 в отсутствие расплава KBr [15, 16]. Выделенный из реакционной смеси диборид циркония, по результатам химического и рентгеновского энергодисперсионного анализов, имеет состав ZrB2.01–2.03, следов бромид- иона и водорода в нем не обнаружено.
Рис. 1.
Дифрактограммы порошка ZrB2, полученных при взаимодействии ZrCl4 и NaBH4 в расплаве KBr при 740 (1) и 800°С (2).
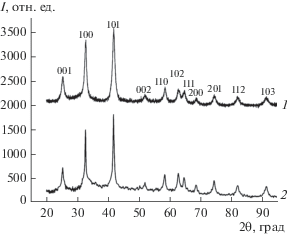
Рис. 2.
Электронные микрофотографии частиц порошка ZrB2, полученных при взаимодействии ZrCl4 и NaBH4 в расплаве KBr при 740 (а) и 800°С (б).

Таблица 1.
Условия и результаты исследования взаимодействия ZrCl4 с NaBH4 при мольном соотношении 1 : 10 в расплаве KBr и без него при различных температурах
РФА показал, что синтезированный продукт является диборидом циркония (гексагональная сингония, пр. гр. P6/mmm). Значимого количества примесных фаз не обнаружено, т.е. материал является однофазным (рис. 1). Параметры ячейки полученного ZrB2 согласуются с порошковой базой данных PDF2 (табл. 1). Размер областей когерентного рассеяния Dhkl для частиц ZrB2, полученных при температурах 740 и 800°С, составил ~12 и ~27 нм соответственно. По данным сканирующей электронной микроскопии, порошок диборида циркония, полученный при 740 и 800°С, состоит из частиц различной формы, часть из которых близка к сферическим с диаметром ~20 и ~30 нм (рис. 2а, 2б и табл. 2). Диаметр частиц, синтезируемых при температурах 740 и 800°С, оцененный из результатов измерения удельной поверхности в приближении сферической формы частиц (Sуд = 65.6 и 29.6 м2/г соответственно при теоретической плотности ZrB2 6.104 г/см3), составляет ~15 и ~33 нм.
Таблица 2.
Средний диаметр частиц ZrB2, полученных при взаимодействия ZrCl4 с NaBH4 при мольном соотношении 1 : 10 в расплаве KBr и без него при различных температурах
| Образец | Средний диаметр частиц, оцененный из данных электронной микроскопии, нм | Dhkl, нм | Средний диаметр частиц, оцененный из данных Sуд, нм |
|---|---|---|---|
| 1 | ~15 | ~13 | ~14 |
| 2 | ~30 | ~28 | ~32 |
| 3 | ~20 | ~12 | ~15 |
| 4 | ~30 | ~27 | ~33 |
В табл. 2 сопоставлены средние диаметры частиц ZrB2, оцененные из дифракционных данных, измерения удельной поверхности и электронной микроскопии. При нагревании в атмосфере аргона от 20 до 1000°С полученные частицы диборида циркония не испытывают заметных преобразований, связанных с выделением, поглощением тепла или изменениями формы и массы.
Для уточнения качественного состава поверхности частиц порошков диборида циркония, полученных при взаимодействии ZrCl4 с NaBH4 в расплаве КBr, регистрировали их РФЭ-спектры, согласно которым основным компонентом порошков является ZrB2: энергия связи электронов на 3d5/2-уровне Zr равна 179.2–179.5 эВ, на 1s-уровне B – 188.0–188.3 эВ, что не противоречит данным [19]. Наряду с линиями, характерными для диборида циркония, присутствуют линии, указывающие на присутствие в поверхностных слоях ZrB2 оксидов циркония и бора (183.4–183.5, 187.5–187.6, 192.5–192.7, 531.6–531.7 эВ), что находится в хорошем соответствии с данными [20, 21].
ЗАКЛЮЧЕНИЕ
В случае применения расплава KBr в качестве реакционной среды при взаимодействии ZrCl4 с NaBH4 реакция протекает быстрее, чем в ранее разработанных методиках. При этом образуются наноразмерные частицы ZrB2 различной дисперсности со средним размером от ~10 до ~30 нм без их консолидации при высоких температурах взаимодействия исходных реагентов.
Список литературы
Andrievski R.A., Khatchoyan A.V. Nanomaterials in extreme environments, Fundamentals and Applications. Berlin: Springer Int. Publ., Switzerland, 2016. 107 p.
Андриевский Р.А. Наноструктурные дибориды титана, циркония и гафния: синтез, свойства, размерные эффекты и стабильность // Успехи химии. 2015. Т. 84. Вып. 5. С. 540–554.
Jensen J.A., Gozum J.E., Pollina D.M., Girolami G.S. Titanium, Zirkonium and Hafnium Tetrahydroborates as “tailored” CVD Precursors for Metal Diboride Thin Films // J. Am. Chem. Soc. 1988. V. 110. № 5. P. 1643–1644.
Rice G.W., Woodin R.L. Zirconium Borohydride as a Zirconium Boride Precursors // J. Am. Chem. Soc. 1988. V. 71. № 4. P. 181–183.
Wayda A.L., Schneemeyer L.F., Opila R.L. A Low-Temperature Film Deposition of Zirconium and Hafnium Borides for the Borohydrides, M(BH4)4 // Appl. Phys. Lett. 1988. V. 53. № 5. P. 361–363.
Andrievski R.A., Kravchenko S.E., Shilkin S.P. Some Properties of Ultrafine Zirconium Boride Powders and Films // Jpn. J. Appl. Phys. 1994. V. 10. P. 198–199.
Кравченко С.Е., Торбов В.И., Шилкин С.П. Наноразмерный диборид циркония: синтез, свойства // Журн. неорган. химии. 2011. Т. 56. № 4. С. 506–509.
Reid W.E., Bish M.I., Brenner A. 111 Preparation and Electrolysis of Titanium and Zirconium Compounds in Nonaqueus Media // J. Electrochem. Soc. 1957. V. 104. P. 21–29.
Hong Zhao, Yu He, Zongzhe Jin. Preparation of Zirconium Boride Powder // J. Am. Ceram. Soc. 1995. V. 78. № 9. P. 2534–2536.
Millet P., Hwang T. Preparation of TiB2 and ZrB2 Influence of a Mechano-Chemical Treatment on the Borothermic Reduction of Titania and Zirconia // J. Mater. Sci. 1996. V. 31. P. 351–355.
Berthon S., Male G. Synthese du Diborure de Zirconium par CVD a basse Temperature et Basse Pression. Caracterisation des Depots // Ann. Chim. 1995. V. 20. № 1. P. 13–24.
Авакумов Е.Г. Механические методы активации химических процессов. М.: Наука, 1989. 306 с.
Кузнецов С.А., Глаголевская А.Л., Беляевский А.Т., Девяткин С.В., Каптаи Д. Высокотемпературный электрохимический синтез порошков диборида циркония из хлоридно-фторидных расплавов // Журн. прикл. химии. 1997. Т. 70. Вып. 10. С. 1646–1649.
Шаповал В.И., Малышев В.В., Новоселова И.А., Кушхов Х.Б. Современные проблемы высокотемпературного электрохимического синтеза соединений переходных металлов IV–VI А групп // Успехи химии. 1995. Т. 64. № 2. С. 133–141.
Бурлакова А.Г., Кравченко С.Е., Домашнев И.А., Винокуров А.А., Надхина С.Е., Волкова Л.С., Шилкин С.П. Особенности получения наноразмерных порошков диборида циркония различной дисперсности // Журн. общ. химии. 2017. Т. 87. № 5. С. 712–717.
Кравченко С.Е., Бурлакова А.Г., Домашнев И.А., Надхина С.Е., Дремова Н.Н., Винокуров А.А., Шил-кин С.П. Образование наночастиц диборида циркония при взаимодействии тетрахлорида циркония с борогидридом натрия // Неорган. материалы. 2017. Т. 53. № 8. С. 817–821.
Luyang Chen, Yunle Gu, Zeheng Yang, Liang Shi, Jianhua Ma, Yitai Qian. Preparation and Some Properties of Nanocrystalline ZB2 Powders // Scripta Materialia. 2004. V. 50. P. 959–961.
Семененко К.Н., Шилкин С.П., Бурнашева В.В., Волкова Л.С., Мозгина Н.Г. Взаимодействие некоторых интерметаллических соединений, образованных редкоземельными металлами и металлами триады железа, с азотом в присутствии водорода // Журн. общ. химии. 1987. Т. 57. В. 4. С. 729–732.
Алешин В.Г., Харламов А.Н., Чудинов М.Г. Изучение поверхностного состояния тугоплавких соединений методом рентгеновской фотоэлектронной спектроскопии // Изв. АН СССР. Неорган. материалы. 1979. Т. 15. № 4. С. 672–676.
Kaufmann R., Klewe-Nebenius H., Moers H., Pfenni G., Jenett H., Ache H.J. XPS Studies of the Thermal Behaviour of Passivated Zircaloy – 4 Surfaces // Surface Interface Analysis. 1988. V. 11. P. 502–509.
Ong C.W., Huang H., Zheng B., Kwok R.W.M., Hui Y.Y., Lau W.M. X-ray Photoemission Spectroscopy of Nonmetallic Materials: Electronic Structures of Boron and BxOy // J. Appl. Phys. 2004. V. 95. № 7. P. 3527–3534.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


