Неорганические материалы, 2019, T. 55, № 5, стр. 554-561
Разработка композитной биокерамики на основе анализа фазовых равновесий в системе Ca3(PO4)2–CaNaPO4–CaKPO4
Н. К. Орлов 1, В. И. Путляев 1, 2, *, П. В. Евдокимов 1, 2, Т. В. Сафронова 1, 2, А. В. Гаршев 1, 2, П. А. Милькин 1
1 Факультет наук о материалах Московского государственного университета им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, стр. 73, Россия
2 Химический факультет Московского государственного университета им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, стр. 3, Россия
* E-mail: valery.putlayev@gmail.com
Поступила в редакцию 03.10.2018
После доработки 20.11.2018
Принята к публикации 05.12.2018
Аннотация
На основе анализа фазовых равновесий в системе Са3(РО4)2–СаNaPO4–CaKPO4 при 500 и 1200°С предложены составы композитной биокерамики, принадлежащие при температуре спекания к однофазной области твердого раствора фазы А (Ca5Na2(PO4)4), двухфазной области А + β-Са3(РО4)2 и трехфазной области А + Х (Са8К2(РО4)6) + β-Са3(РО4)2. Более высокие значения прочностных свойств – микротвердости по Виккерсу (HV) и трещиностойкости (KIc) – наблюдались для керамических образцов, находящихся в процессе спекания в однофазном поле фазы А (HV = 265 МПа и KIc = 0.31 МПа м1/2), и для образцов из трехфазного поля А + Х + β-Са3(РО4)2 (HV ≤ 235 МПа и KIc = 0.22 МПа м1/2). Предложенные в работе керамические материалы на основе фосфатов кальция-натрия-калия обладают невысокой и практически постоянной скоростью растворения (резорбции) при рН 5 на уровне 2 × 10–4 мин–1.
ВВЕДЕНИЕ
Биокерамика на основе фосфатов кальция является перспективным материалом для использования в травматологии, ортопедической и челюстно-лицевой хирурги для замещения и реконструкции костной ткани. Способность материала к растворению в среде организма (резорбируемость) является одним из ключевых свойств биокерамики [1]. Керамика из гидроксиапатита (ГА), Са10(РО4)6(ОН)2 наиболее известного кальцийфосфатного материала, практически не подвергается резорбции [2–4]. В последние годы ее применение ограничивают в пользу более растворимой керамики из трикальцийфосфата (ТКФ) β-Са3(РО4)2 (β-ТКФ) или бифазных композитов ГА/ТКФ [4, 5]. С термодинамической точки зрения, путь к повышению растворимости лежит через модификацию химического состава фосфата, ослабляющую энергию его кристаллической решетки и/или усиливающую гидратацию образующихся при растворении ионов. В этой связи интерес представляют двойные и тройные фосфаты кальция с общей формулой Са3 –хМ2х(РО4)2 (М = Na и/или K) и многофазные керамические материалы на их основе [6].
Фазовые равновесия в системе Са3(РО4)2–СаNaPO4–CaKPO4, в частности двойные фазовые диаграммы Ca3(PO4)2–CaKPO4, Ca3(PO4)2–CaNaPO4 и CaNaPO4–CaKPO4, представлены в работах [7–9]. Фазовые равновесия в двойных системах и кристаллохимия образующихся в них фаз позволяют предположить наличие обширного поля твердого раствора α-СаМРО4 с глазеритоподобной структурой в тройной системе при высоких температурах. Катионное упорядочение при понижении температуры приводит к образованию ограниченных рядов твердых растворов. Соответствующие фазовые превращения сопровождаются заметными объемными эффектами, что влияет на прочностные свойства керамики и ее растворимость. Однако точный вид фазовой диаграммы тройной системы до сих пор неизвестен; в работе [7], например, приведена лишь реконструкция проекции тройной диаграммы на основании известных к тому моменту сведений о диаграммах двойных систем.
Таким образом, целью настоящей работы стало экспериментальное построение некоторых изотермических сечений тройной диаграммы Са3(РО4)2–СаNaPO4–CaKPO4, формирование на основе данных о фазовых равновесиях композитной керамики различного фазового состава, оценка прочностных свойств и растворимости сформированной керамики.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез тройных фосфатов кальция и щелочных металлов проводили твердофазным методом согласно следующим реакциям:
(1)
$\begin{gathered} y{\text{CaKP}}{{{\text{O}}}_{4}} + \left( {1{\text{ }}--y} \right){\text{CaNaP}}{{{\text{O}}}_{4}} \to \\ \to \,\,{\text{Ca}}{{{\text{K}}}_{y}}{\text{N}}{{{\text{a}}}_{{1--{\text{ }}y}}}{\text{P}}{{{\text{O}}}_{4}}, \\ \end{gathered} $(2)
$\begin{gathered} \left( {1--x} \right){\text{C}}{{{\text{a}}}_{3}}{{\left( {{\text{P}}{{{\text{O}}}_{4}}} \right)}_{2}} + 2xy{\text{CaKP}}{{{\text{O}}}_{4}} + \\ + \,\,2x\left( {1--y} \right){\text{CaNaP}}{{{\text{O}}}_{4}} \to \\ \to \,\,{\text{C}}{{{\text{a}}}_{{3--x}}}{{\left( {{{{\text{K}}}_{y}}{\text{N}}{{{\text{a}}}_{{1--y}}}} \right)}_{{2x}}}{{\left( {{\text{P}}{{{\text{O}}}_{4}}} \right)}_{2}}. \\ \end{gathered} $Исходная смесь для синтеза Ca3(PO4)2 включала необходимые количества CaCO3 (“х. ч.”), Ca2P2O7 (синтезирован разложением при 800°С брушита – СаНРО4 ∙ 2Н2О, осажденного из 0.6 М растворов Ca(NO3)2 и (NH4)2HPO4, оба квалификации “х. ч.”); для синтеза двойных фосфатов – Ca2P2O7, Na2CO3 (“х. ч.”), К2СО3 (“х. ч.”). Смеси были размолоты в планетарной мельнице в течение 10 мин в среде ацетона, а затем подвергнуты обжигу в интервале температур 800–1200°C продолжительностью до 36 ч.
Диффузионные отжиги для определения границ многофазных областей методом рентгеноспектрального микроанализа (РСМА) проводили для таблетированных образцов в течение двух недель при температуре t = 500°С. Выбор времени отжига τ с учетом диффузионной длины l ~ 10 мкм, необходимой для уверенного определения локального состава методом РСМА, опирался на использование диффузионного соотношения l2 ~ Dτ, в предположении значения коэффициента диффузии лимитирующего массоперенос иона (ортофосфатного аниона) D ~ 10–14 см2/с.
Плотные керамические образцы изготавливали одноосным односторонним прессованием синтезированных порошков тройных фосфатов кальция и щелочных металлов (10 мас. % парафина в качестве пластификатора) на ручном прессе Carver C (США) в таблетки диаметром 8 мм при давлении 200 MПa c последующим обжигом при 1200°С в течение 12 ч.
Рентгенофазовый анализ (РФА) проводили на дифрактометре D/Max-2500 с вращающимся анодом (Rigaku, Япония). Съемку осуществляли в режиме на отражение с использованием CuKср-излучения в интервале углов 2θ = 3°–70°. Идентификацию фаз проводили с использованием базы данных ICDD PDF-2.
Исследование микроструктуры образцов проводили на растровом электронном микроскопе с автоэмиссионным источником LEO SUPRA 50VP (Carl Zeiss, Германия). Ускоряющее напряжение электронной пушки составляло 3–20 кВ. Изображения получали во вторичных электронах при увеличениях до 100 000× при помощи детектора типа SE2. Шлифование и полировку керамических образцов проводили на шлифовальных машинах DAP-V/Pedemin и TegraPol-11 (Struers, Дания) с автоматическим вращателем образцов TegraForce-1 (Struers, Дания) по методике F (Metalog Guide, Struers, Дания), на заключительном этапе полировки использовалась суспензия оксида алюминия с размером частиц <1 мкм. Для проявления границ зерен полученные образцы подвергались термотравлению при t = 1050°C в течение 30 мин. При исследовании методом РСМА на образцы был нанесен слой углерода (напылительная установка QT-150T ES, Quorum Technologies, Великобритания).
Рентгеноспектральный микроанализ проводили на микроскопе SUPRA 50VP, снабженном системой энергодисперсионного микроанализа INCA Energy 300 (Oxford Instruments, Великобритания), при ускоряющем напряжении 20 кВ. Для анализа были выбраны СаК-, PK-, NaK- и KK-линии спектра. Состав определяли как для больших участков поверхности, размером 20 × 20 мкм, так и локально в отдельных точках с областью генерации сигнала ~1 мкм.
Дифференциальный термический (ДТА) и термогравиметрический (ТГ) анализ образцов проводили с использованием синхронного термоанализатора с вертикальной загрузкой образцов STA 409 PC Luxx (Netzsch, Германия). Измерения проводили на воздухе в интервале температур от комнатной до 1200°С со скоростями нагрева 5 и 10°С/мин в алундовых тиглях.
Дилатометрический анализ линейной усадки прессованных образцов проводили в политермическом режиме до t = 1400°C с различной скоростью нагрева в горизонтальном дилатометре DIL 402 C (Netzsch, Германия).
Прочностные свойства оценивали методом микроиндентирования на испытательной машине ИТВ-5-М (Россия) приложением различной нагрузки (от 2 до 5 H) к поверхности керамических образцов с помощью микроиндентора Виккерса.
Трещиностойкость рассчитывали по формуле Эванса–Чарльза [10]
(3)
${{K}_{{{\text{I}}c}}} = 0.0752P{{C}^{{{{ - 3} \mathord{\left/ {\vphantom {{ - 3} 2}} \right. \kern-0em} 2}}}},$Твердость по Виккерсу рассчитывали по формуле
(4)
${{H}_{V}} = {{KF} \mathord{\left/ {\vphantom {{KF} {{{d}^{2}}}}} \right. \kern-0em} {{{d}^{2}}}},$Кинетику растворения керамики определяли методом pH-статирования (pH 5) путем титрования [6] на автоматическом титраторе Titration Excellence T50 (Mettler Toledo, Швейцария) 0.025 M раствором лимонной кислоты (H3Сit) керамических образцов определенной степени дисперсности (220–400 мкм). Навеска образца соответствовала концентрации ионов кальция [Ca2+] = 3 ммоль/л. По объему затраченной на титрование кислоты определяли степень превращения в реакции
(5)
$\begin{gathered} {\text{C}}{{{\text{a}}}_{{{\text{3}}--x}}}{{({{{\text{K}}}_{y}}{\text{N}}{{{\text{a}}}_{{{\text{1}}--y}}})}_{{\text{2}}}}_{x}{{({\text{P}}{{{\text{O}}}_{{\text{4}}}})}_{{\text{2}}}} + {\text{2}}{{{\text{H}}}_{{\text{3}}}}С it \to \\ \to ({\text{3}}--x){\text{C}}{{{\text{a}}}^{{{\text{2}} + }}} + {\text{2}}xy{{{\text{K}}}^{ + }} + {\text{2}}x({\text{1}}--y){\text{N}}{{{\text{a}}}^{ + }} + \\ + \,\,{\text{2}}{{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{{\text{4}}}^{ - } + {\text{2H}}С i{{t}^{{{\text{2}}--}}}. \\ \end{gathered} $РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В двойной системе Са3(РО4)2–CaNaPO4 упорядочение твердого раствора при понижении температуры приводит к фазе со структурой нагельшмидтита состава Ca5Na2(PO4)4 при 980°С (фаза А, эвтектоидно распадается при этой температуре на β-ТКФ и β-CaNaPO4) [8, 9]. В системе Са3(РО4)2–CaKPO4 нагельшмидтитный твердый раствор ниже 1260°С превращается в Са8К2(РО4)6 (фаза Х, апатит с пустыми каналами [8, 11]), которая ниже 1130°С эвтектоидно распадается на β-ТКФ и β-CaКPO4. В системе CaNaPO4–CaKPO4 упорядочение высокотемпературного твердого раствора ниже 657°С приводит к фазе β‑СаNa0.4K0.6PO4 (фаза С, идеализированный состав, является сверхструктурой с мотивом, близким к нагельшмидтиту) [7, 12]. Эвтектоидные превращения можно частично предотвратить закалкой. Однако переходы α/β-CaNaPO4, α/β‑CaКPO4 и α/β-СаNa0.4K0.6PO4 происходят с очень большой скоростью. Наибольшим объемным эффектом ΔV/V = +6% характеризуется переход α/β-CaNaPO4 [8, 13]. Это приводит к микрорастрескиванию керамических композитов, содержащих большое количество данной фазы. Фазы α/β-CaКPO4 и α/β-СаNa0.4K0.6PO4 имеют наибольшую растворимость среди других составов тройной системы, однако с увеличением содержания калия растет цитотоксичность материалов [6, 8]. По этой причине практический интерес представляет композитная керамика, основанная на составах богатой натрием части треугольника Са3(РО4)2–CaNaPO4–CaKPO4, прилежащей к вершине Са3(РО4)2.
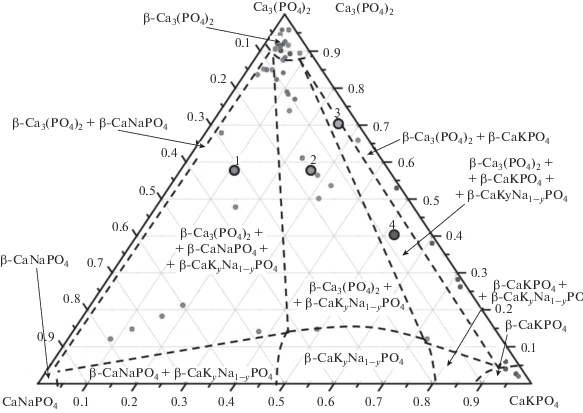
Фазовые отношения при 500°C. Для установления фазовых границ в низкотемпературной области диаграммы был произведен длительный диффузионный отжиг составов 1–4 (крупные точки на рис. 1). По результатам РСМА не удалось установить точных границ трехфазных областей. Из рис. 1 видно, что в результате отжига исходные фигуративные точки 1–4 имеют тенденцию к смещению в сторону вершин фазового треугольника и к середине стороны CaNaPO4–CaKPO4, т.е. к фазе С (β-CaKyNa1 – yPO4). Сильный разброс в составах отдельных зерен (фаз) в соответствующих смесях свидетельствует, во-первых, о малом размере зерен в исследуемых керамических образцах, что затрудняет определение химического состава отдельного зерна методом РСМА, поскольку при этом электронным пучком “захватываются” и соседние зерна (это хорошо видно по тем точкам, что лежат вблизи исходных брутто-составов); во-вторых, что использованного времени отжига было недостаточно для установления равновесия вследствие того, что коэффициент диффузии наименее подвижного иона может быть ниже предположенного. Тем не менее, качественную картину фазовых отношений при 500°С рис. 1 передает правильно, это также подтверждают данные РФА всех отожженных образцов, т.е. никаких иных фаз кроме β-Са3(РО4)2, фазы С, β-CaNaPO4 и β-CaKPO4 при данной температуре не существует. Следовательно, любая керамика системы Са3(РО4)2–CaNaPO4–CaKPO4, охлажденная от температуры спекания не слишком быстро, будет представлять собой композит, составленный из этих фаз в соответствии с представляемой при 500°С картиной фазовых равновесий. В этой связи резорбционные характеристики таких композитов помимо микроструктуры будут определяться также растворимостью составляющих композит фаз. Увеличение растворимости будет связано с увеличением доли наиболее растворимых фаз β-CaKyNa1 – yPO4 или β-CaKPO4.
Рис. 1.
Эскиз изотермического сечения фазовой диаграммы Са3(РО4)2–CaNaPO4–CaKPO4 при 500°С; крупные точки 1–4 указывают на составы, подвергнутые диффузионному отжигу, мелкие точки – результаты РСМА отожженных составов.
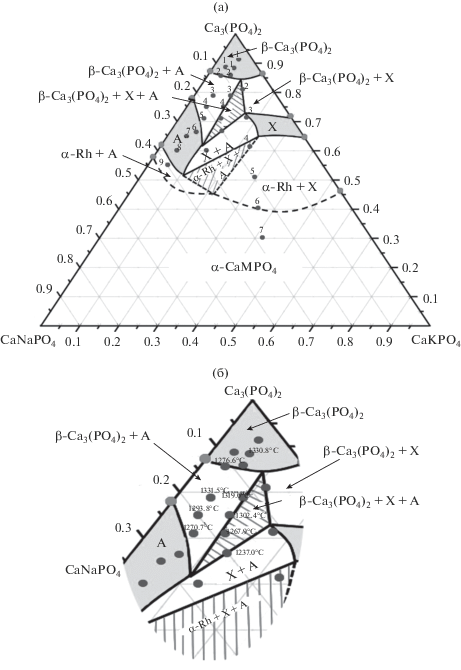
Фазовые отношения при 1200°С. Для построения высокотемпературного изотермического сечения были выбраны составы вдоль трех направлений: вдоль линий ТКФ–CaK0.2Na0.8PO4, ТКФ–CaK0.4Na0.6PO4 и ТКФ–CaK0.6Na0.4PO4. Результаты РФА закаленных образцов приведены в табл. 1. Были получены однофазные образцы из области твердых растворов на основе фаз А и β-ТКФ, а также двухфазные и трехфазные образцы. Результаты РФА позволили провести примерные границы фазовых областей исследуемой тройной системы (рис. 2а). Для определения верхней температурной границы существования данных фазовых полей образцы были исследованы с помощью ДТА в диапазоне 1150–1400°С. Температуры фазовых превращений (указаны цифрами около составов на рис. 2б) фактически характеризуют границы, отделяющие многофазные поля от обширного поля высокотемпературного твердого раствора α-СаМРО4.
Таблица 1.
Фазовый состав смесей, закаленных с 1200°С
| Состав | Фазы | ||
|---|---|---|---|
| линия ТКФ–CaK0.2Na0.8PO4 | линия ТКФ–CaK0.4Na0.6PO4 | линия ТКФ–CaK0.6Na0.4PO4 | |
| 1 | β-Ca3(PO4)2 | β-Ca3(PO4)2 | β-Ca3(PO4)2 |
| 2 | β-Ca3(PO4)2 + А | β-Ca3(PO4)2 | β-Ca3(PO4)2 + Х |
| 3 | β-Ca3(PO4)2 + А | β-Ca3(PO4)2 + А | Х + А |
| 4 | β-Ca3(PO4)2 + А | β-Ca3(PO4)2 + А + Х | β-Ca3(PO4)2 + А + Х |
| 5 | β-Ca3(PO4)2 + А | β-Ca3(PO4)2 + А + Х | Х + α-Rh* |
| 6 | А | β-Ca3(PO4)2 + А + Х | Х + α-Rh* |
| 7 | А | А + Х | α-Rh* |
| 8 | А | – | – |
| 9 | А + α-Rh* | – | – |
Рис. 2.
Изотермическое сечение фазовой диаграммы Са3(РО4)2–CaNaPO4–CaKPO4 при 1200°С (а) и температуры фазовых превращений (указаны цифрами около фигуративных точек), характеризующие границу, отделяющую многофазные поля от поля высокотемпературного твердого раствора α-СаМРО4 (б).
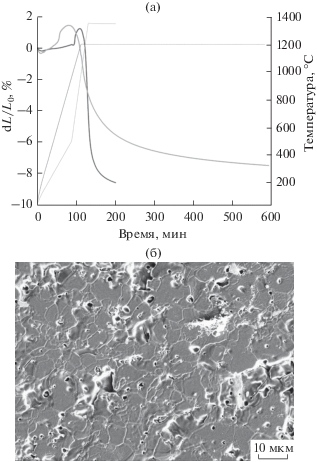
Для формирования композитной керамики были выбраны три состава, соответствующие однофазной (фаза А), двухфазной (фаза А + ТКФ) и трехфазной областям (фаза А + ТКФ + фаза Х) при 1200°С с одинаковым начальным содержанием ТКФ (табл. 2). Керамика была изготовлена при помощи изотермического спекания при 1200°С в течение 12 ч. Такая температура спекания была выбрана на основании дилатометрического исследования уплотнения (рис. 3а), а также из соображений сохранности выбранного фазового состава в условиях спекания. Например, повышение температуры до 1350°С смещает, по крайней мере, составы керамики 1 и 2 в область высокотемпературного твердого раствора α-СаМРО4, что затрудняет уплотнение (см. рис. 3а: значительное уплотнение происходит на политермическом участке, при выходе на изотерму уплотнение существенно замедляется). Вероятно, это связано с превалированием рекристаллизационных явлений над уплотнением в фазах типа СаМРО4 с большим содержанием щелочного металла. В принципе, вклад рекристаллизации заметен при наблюдении микроструктуры керамики на основе любого из составов 1–3 (рис. 3б): достаточно крупные зерна в сочетании с внутризеренной пористостью. Следует отметить, что закалкой не удается сохранить фазовый состав керамики при 1200°С, в конечном итоге при охлаждении керамика любого состава, по данным РФА, представляет собой композит из фаз β-Са3(РО4)2, С, β-CaNaPO4 в различных пропорциях, т.е. описывается фазовыми отношениями при 500°С.
Таблица 2.
Составы композитной керамики
| Состав | С, мол. % | ||
|---|---|---|---|
| ТКФ | CaNaPO4 | CaKPO4 | |
| 1 | 71 | 26 | 3 |
| 2 | 71 | 21 | 8 |
| 3 | 71 | 16 | 13 |
Рис. 3.
Дилатометрические кривые усадки образца композитной керамики состава 2 при различных режимах спекания (а) и микроструктура композитной керамики состава 2 (б).
Прочностные свойства полученных керамических материалов были оценены на основании измерения микротвердости по Виккерсу и трещиностойкости методом микроиндентирования (рис. 4а, 4б). Значения микротвердости для составов 2 и 3 группируются около двух величин, что связано с неравномерным распределением фаз по объему образца или же с неоднородностью плотности керамики, неизбежной при спекании композитов. Измеренные значения микротвердости и трещиностойкости в значительной мере определяются и тем, что полученная керамика обладает заметным уровнем пористости (для всех образцов плотность составляет 83 ± 2%). Распространение трещины от отпечатка микроиндентора (рис. 4б, 4в) указывает, что ее торможение происходит преимущественно за счет переориентации и попадания в поры. При объяснении отличия трещиностойкости керамики состава 2 от двух остальных при схожести микроструктуры и значений плотности следует учесть, что единственным различием в предыстории этих образцов является нахождение в различных фазовых полях в процессе спекания при 1200°С. Фазы β-Са3(РО4)2 и А, составляющие образец 2, по-видимому, сильно различаются по скоростям уплотнения и рекристаллизации, что приводит к неоднородному спеканию композита. В образце 3 содержание фазы А уменьшено за счет апатитоподобной фазы Х, которая, несомненно, ближе к ТКФ, в том числе и по характеру спекания. Неоднородность спекания может вызывать напряженное состояние керамического образца. При его охлаждении быстрые фазовые превращения деформационного характера, присущие фазам данной системы [8, 14], будут развиваться также неоднородно, усиливая микрорастрескивание керамики.
Рис. 4.
Микротвердость (HV) (а) и трещиностойкость (KIc) (б) образцов композитной керамики; распространение трещины от отпечатка микроиндентора для образцов керамики составов 1 (в) и 2 (г).

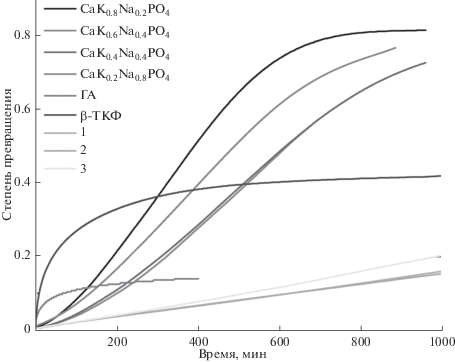
Резорбционные свойства (рис. 5) показывают, что при увеличении доли калия в керамике слабо увеличивается растворимость вследствие увеличения доли фазы β-CaKyNa1 – yPO4, обладающей набольшей растворимостью среди других фаз. Изученная трехфазная керамика растворяется практически с постоянной достаточно малой скоростью (порядка 2 × 10–4 мин–1) в отличие от керамических гранул составляющих ее фаз. Это является хорошей предпосылкой для прогнозирования скорости растворения будущего материала, поскольку в таком случае становится возможным скомпенсировать падение прочности растворяющегося имплантата врастанием в него новообразующейся костной ткани. В целом, кинетические кривые растворения исследованных в работе керамик практически совпадают, что свидетельствует об определяющей роли микроструктуры в процессе растворения, которая не слишком сильно отличается для рассматриваемых трех составов. Это означает, что при практически одинаковых резорбционных свойствах керамики можно выбрать образцы, демонстрирующие лучшие прочностные характеристики – 1 или 3, спекаемые при 1200°С в одно- и трехфазной областях.
Рис. 5.
Кинетика растворения композитной керамики составов 1, 2 и 3 в сравнении с кинетическими кривыми растворения керамических гранул составов системы CaNaPO4–CaKPO4, ТКФ и ГА, взятыми из [6].
ЗАКЛЮЧЕНИЕ
В области температур спекания керамики (1200°С) в фазовых равновесиях участвуют фазы ТКФ (β-Са3(РО4)2), А (Са5Na2(PO4)4), X (Са8К2(РО4)6) и α-CaKyNa1 – yPO4. При охлаждении ниже 500°С в равновесие вступают фазы β-ТКФ, β-CaKyNa1– yPO4, β-CaNaPO4 и β-CaKPO4. Практический интерес, с точки зрения использования в качестве резорбируемой биокерамики, представляют составы, принадлежащие при температуре спекания к однофазной области твердого раствора фазы А, двухфазной области А + β-ТКФ и трехфазной области А + Х + β-ТКФ, а при охлаждении представляющие собой композиты фаз β-ТКФ, β-CaKyNa1 –yPO4, β-CaNaPO4.
Для керамики, находящейся в процессе спекания в двухфазном поле А + β-ТКФ, неоднородное спекания композита приводит к худшим прочностным свойствам в сравнении с двумя другими (HV ≤ 210 МПа и KIc = 0.15 МПа м1/2). Для образцов, находящихся в процессе спекания в однофазном поле фазы А, прочностные свойства достигали HV = 265 МПа и KIc = 0.31 МПа м1/2, а для образцов из трехфазного поля А + Х + β-ТКФ – HV ≤ 235 МПа и KIc = 0.22 МПа м1/2.
Предложенные в работе керамические материалы на основе фосфатов кальция-натрия-калия обладают невысокой и практически постоянной скоростью растворения (резорбции) при рН 5 на уровне 2 × 10–4 мин–1, что позволяет рассматривать их как перспективные материалы для остеопластики.
Список литературы
Баринов С.М. Керамические и композиционные материалы на основе фосфатов кальция для медицины // Успехи химии. 2010. Т. 79. № 1. С. 15–32.
Vallet-Regi M. Ceramics for Medical Applications // J. Chem. Soc., Dalton Trans. 2001. V. 2. № 2. P. 97–108.
Bohner M. Physical and Chemical Aspects of Calcium Phosphates Used in Spinal Surgery // Eur. Spine J. 2001. V. 10. P. 114–121.
Russmueller G. et al. Tricalcium Phosphate-Based Biocomposites for Mandibular Bone Regeneration–A His, Tological Study in Sheep // J. Cranio-Maxillofacial Surgery. 2015. V. 43. № 5. P. 696–704.
LeGeros R.Z., Lin S., Rohanizadeh R., Mijares D. Biphasic Calcium Phosphate Bioceramics: Preparation, Properties and Applications // J. Mater. Sci.-Mater. Med. 2003. V. 14. № 3. C. 201–209.
Орлов Н.К., Путляев В.И., Евдокимов П.В., Сафронова Т.В., Климашина Е.С., Милькин П.А. Резорбция кальцийфосфатной биокерамики Са3 – хМ2х(РО4)2 (M = Na, K) в модельных растворах // Неорган. материалы. 2018. Т. 54. № 5. С. 523–531.
Znamierowska T. Uklad Ca3(PO4)2–CaKPO4–CaNaPO4 // Zesz. Nauk. Politech. Slask. Ser.: Chem. 1982. T. 709[100]. C. 35–56.
Евдокимов П.В., Путляев В.И., Иванов В.К., Гаршев А.В., Шаталова Т.Б., Орлов Н.К., Климашина Е.С., Сафронова Т.В. Фазовые равновесия в системах трикальциевый фосфат–смешанный фосфат кальция и натрия (калия) // Журн. неорган. химии. 2014. Т. 59. № 11. С. 1462–1471.
Ando J. Phase Diagrams of Ca3(PO4)2–Mg3(PO4)2 and Ca3(PO4)2–CaNaPO4 Systems // Bull. Chem. Soc. Jpn. 1958. V. 31. № 2. P. 201–205.
Evans A.G., Charles E.A. Fracture Toughness Determinations by Indentation // J. Am. Ceram. Soc. 1976. V. 59. № 7–8. P. 371–372.
Bredig M.A. Isomorphism and Allotropy in Compounds of the Type A2XO4 // J. Phys. Chem. 1942. V. 46. № 6. P. 747–764.
Berger G., Gildenhaar R., Ploska U. Rapid Resorbable, Glassy Crystalline Materials on the Basis of Calcium Alkali Orthophosphates // Biomaterials. 1995. V. 16. № 16. P. 1241–1248.
Путляев В.И., Евдокимов П.В., Гаршев А.В. и др. Прочностные характеристики резорбируемой остеокондуктивной керамики на основе двойных фосфатов кальция и щелочных металлов // Изв. вузов. Физика. 2013. T. 56. № 10. P. 72–77.
Евдокимов П.В. Синтез двойных фосфатов Ca(3 – x)М2x(PO4)2 (М = Na, K) для создания макропористой биокерамики со специальной архитектурой: дис. … канд. хим. наук: 02.00.21. М.: МГУ. 2015. 144 с.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


