Неорганические материалы, 2019, T. 55, № 5, стр. 501-508
Электрохимическая интеркаляция натрия в композиты на основе фосфата железа (III) и углерода
В. В. Озерова 1, С. А. Новикова 2, А. А. Чеканников 3, Т. Л. Кулова 4, А. М. Скундин 4, А. Б. Ярославцев 2, *
1 Российский химико-технологический университет имени Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
2 Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский пр., 31, Россия
3 Сколковский институт науки и технологий
143026 Москва, ул. Нобеля, 3, Россия
4 Институт физической химии и электрохимии им. А.Н. Фрумкина Российской академии наук
119071 Москва, Ленинский пр., 31, корп. 4, Россия
* E-mail: yaroslav@igic.ras.ru
Поступила в редакцию 13.08.2018
После доработки 10.11.2018
Принята к публикации 30.11.2018
Аннотация
С помощью осаждения в водной среде, в микроэмульсии и в микроэмульсии в присутствии мезопористого углеродного материала получены материалы на основе аморфного фосфата железа (III). Термическая обработка аморфного FePO4 приводит к получению кристаллического FePO4 гексагональной модификации. Установлено, что интеркаляция натрия в режиме работы натрий-ионного аккумулятора протекает лучше в материалы на основе аморфного FePO4. Значение разрядной емкости материала на основе аморфного FePO4, синтезированного микроэмульсионным методом в присутствии мезопористого углеродного материала G_157M, составляет ~183 мАч/г и является суммой емкости по внедрению натрия в FePO4 и емкости при восстановлении функциональных групп на поверхности мезопористого углерода.
ВВЕДЕНИЕ
В последние десятилетия литий-ионные аккумуляторы (ЛИА) стали широко используемыми носителями энергии [1–3]. Однако мировые запасы соединений лития ограничены, что делает невозможным применение ЛИА для полного удовлетворения быстрорастущего спроса на устройства для хранения энергии, в том числе получаемой из возобновляемых источников, таких как солнце, ветер и вода [4]. Натрий – шестой по распространенности элемент, поэтому представляется целесообразным частичное замещение соединений лития натриевыми аналогами [5–8].
В качестве одного из перспективных катодных материалов для натрий-ионных аккумуляторов (НИА) рассматривают фосфат натрия-железа [9–12]. Ему свойственна высокая теоретическая емкость (154 мАч/г), доступность составляющих компонентов, безопасность и экологичность [11, 13]. Тем не менее, с применением данного материала возникают трудности по причине “закрытой” структуры термодинамически стабильной фазы со структурой маричита (m-NaFePO4), в которой отсутствуют пути диффузии катионов натрия [14, 15]. В научной литературе существует противоречие в вопросе о перспективности m-NaFePO4 как катодного материала для НИА. В 2015 г. Kang et al. опубликовали сведения о том, что синтезированный твердофазным методом m-NaFePO4 показал емкость в 142 мАч/г (92% от теории) [10]. В ряде экспериментальных работ отмечалось, что этот материал практически не проявляет электрохимической активности [16–19]. Позднее в работах [11, 12] показано, что изначально невысокая (15–25 мАч/г) емкость нанокомпозитов возрастала вплоть до ~150 мАч/г после помола в планетарной мельнице, приводящего к частичной аморфизации материала и уменьшению размера частиц.
Фосфат натрия-железа обладает низкой электронной и ионной проводимостью [11], что является серьезным недостатком: наличие высокой ионной и электронной проводимости необходимо для возможности быстрого заряда/разряда аккумулятора, так как данные процессы сопровождаются переносом катионов и электронов [20]. Электрохимические характеристики электродных материалов для метал-ионных аккумуляторов с низкой электропроводностью можно улучшить с помощью допирования [21–24], уменьшения размера частиц [2, 25–27] и создания композитов с углеродом [28–34]. Помимо увеличения электропроводности, углеродное покрытие препятствует агломерации частиц при синтезе и способствует получению более мелкодисперсного материала. Для изготовления электродных материалов используются различные формы углерода, такие как аморфный углерод, графит, графен, углеродные нанотрубки [28–34].
Описан ряд методов синтеза NaFePO4, включая ионный обмен из LiFePO4 [9], ДМСО-метод [11], золь–гель-метод [35], твердофазный [10] и гидротермальный синтез [17], а также получение FePO4 и последующее электрохимическое внедрение натрия [36, 37]. Последний из методов позволяет получить аморфный NaFePO4 без дополнительной механоактивации материала с целью его аморфизации.
Получение FePO4 обычно проводится термической обработкой его гидратированной формы, синтезированной осаждением путем сливания водных растворов фосфатов – NaH2PO4, NH4H2PO4 или (NH4)2HPO4 – и солей железа(III) – Fe(NO3)3 ⋅ · 9H2O или FeCl3 [36, 37]. Разновидностью данного способа является микроэмульсионный метод. При таком синтезе осаждение частиц фосфата железа (III) осуществлется в микрокаплях водной фазы, диспергированных в органической фазе и стабилизированных с использованием Triton-X-100 в качестве ПАВ. Это снижает склонность образующихся частиц к агломерации. По сравнению с простым осаждением FePO4 в водной среде синтез микроэмульсионным методом приводит к образованию меньших по размеру частиц с более развитой поверхностью [31].
В случае FePO4 из-за легкости восстановления Fe3+ до Fe2+ нанесение углеродного покрытия не может быть проведено за счет нанесения источника углерода на электродный материал или его прекурсор с последующим термическим разложением в инертной среде. Поэтому композиты FePO4/С обычно получают с использованием готовых углеродных материалов, например, таких как углеродные нанотрубки [31, 38, 39].
Целью данной работы являлось сравнительное исследование возможности электрохимического внедрения катионов натрия в нанокомпозиционные материалы на основе аморфного и кристаллического FePO4, полученного с помощью различных методов синтеза, и углерода.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных реагентов для синтеза исследуемых соединений состава FePO4 и FePO4/С использовались Fe(NO3)3 ⋅ 9H2O (Sigma-Aldrich, >98%), NH4H2PO4 (Sigma-Aldrich, >98%), циклогексан (ЭКОС-1, “ч. д. а.”), Triton-X100 (Labgrade), 1-бутанол (Химмед, “ч.”), NH4OH (Химмед, “ос. ч.”), HNO3 (Химмед, “ос. ч.”), сажа (Timcal, Belgium), мезопористый углеродный материал G_157M (ООО “НаноТехЦентр” (Тамбов, Россия)).
Для получения FePO4 ⋅ nH2O сливали 0.1 M растворы NH4H2PO4 и Fe(NO3)3 ⋅ 9H2O. Затем при постоянном перемешивании с помощью раствора NH4OH доводили рН до 3, при этом наблюдалось выделение осадка. Смесь перемешивали в течение 1 ч при 45°C и 12 ч без нагрева. Полученный осадок отделяли центрифугированием, тщательно промывали дистиллированной водой и сушили при 60°C. Полученный по этой методике образец далее обозначен FePO4 ⋅ nH2O-{I}.
Для получения FePO4 ⋅ nH2O микроэмульсионным методом готовили 0.1 M растворы NH4H2PO4 и Fe(NO3)3 ⋅ 9H2O и две микроэмульсии (А и Б) состава вода/циклогексан/тритон Х-100/н-бутиловый спирт в объемном соотношении 7 : 5 : 3 : 1. Водная фаза микроэмульсий А и Б была представлена 0.1 М растворами Fe(NO3)3 ⋅ 9H2O и NH4H2PO4 соответственно. Микроэмульсии А и Б сливали при перемешивании, с помощью раствора NH4OH доводили рН до 3 и перемешивали при 45°C в течение 6 ч. Продукт синтеза отделяли центрифугированием, тщательно промывали этиловым спиртом и дистиллированной водой и сушили при 60°C. Полученный по этой методике образец далее обозначен FePO4 ⋅ nH2O-{II}.
Также был проведен микроэмульсионный синтез FePO4 в присутствии мезопористого углеродного материала (ООО “НаноТЦ”, Тамбов). При этом углеродный материал G_157M (20 мас. % к FePO4) добавляли к микроэмульсии А, перемешивали 30 мин, подвергали ультразвуковому диспергированию в течение 1 ч и далее проводили микроэмульсионный синтез, как описано ранее. Полученный по этой методике образец далее обозначен FePO4 ⋅ nH2O/C-{III}.
Безводные фосфаты железа получали термической обработкой FePO4 ⋅ nH2O при различных температурах (425–700°C в течение 6 ч) на воздухе или в инертной атмосфере. Далее безводные аморфные фосфаты, полученные в результате отжига гидратированных форм при 425°C, обозначены FePO4-{I}, FePO4-{II} и FePO4/С-{III}. Для получения композитов с углеродом к материалам FePO4-{I} и FePO4-{II} добавляли 20 мас. % сажи и мололи в планетарной мельнице в течение 12 ч при 400 об./мин. Полученные композиты обозначены FePO4/С-{I} и FePO4/С-{II}.
В результате отжига при 700°C на воздухе получали кристаллические материалы c-FePO4-{I}, c-FePO4-{II}, c- FePO4-{III}. Получение композита с углеродом на основе кристаллического FePO4 осуществлялось механическим способом за счет смешения c-FePO4-{III} и мезопористого углеродного материала (~17.6 мас. % С к композиту).
Рентгенофазовый анализ (РФА) образцов осуществлялся с использованием дифрактометра Rigaku D/MAX 2200 (излучение CuKα). Для обработки спектров использовался пакет программ Rigaku Application Data Processing. Обработка рентгенограмм проводилась в программе FullProf Suite (WinPlotr), параметры кристаллической решетки уточняли с помощью дистрибутива Checkcell.
Размер областей когерентного рассеяния (ОКР) рассчитывался по уширению пиков на дифрактограммах с использованием формулы Шеррера:
где d – размер кристаллитов, λ – длина волны использованного излучения (λ(CuKα) = 1.5406 Å), θ – дифракционный угол положения пика (рад), B – ширина пика на полувысоте (рад), b – приборное уширение (рад), k = 0.9 – постоянная Шеррера. Приборное уширение было определено с помощью стандарта LaB6.Термогравиметрический анализ (ТГА) проводили с использованием термовесов Netzsch-TG 209 F1 в платиновых тиглях в атмосфере аргона или на воздухе (температурный интервал 25–800°C, скорость нагрева 10°С/мин). Состав выделяющихся газов идентифицировали с помощью масс-спектрометра Netzsch Aeolos QMS 403 C.
Анализ микроструктуры образцов и исследование элементного состава материалов проводились с использованием сканирующего электронного микроскопа Carl Zeiss NVision 40, оснащенного рентгеноспектральным детектором Oxford X-Max. Съемку микрофотографий осуществляли при ускоряющем напряжении 1 кВ. Рентгеноспектральный микроанализ проводили при ускоряющем напряжении 20 кВ.
Удельную площадь поверхности образцов определяли методом БЭТ на основании изотерм адсорбции-десорбции жидкого азота, полученных на анализаторе текстурных характеристик АТХ-06 Катакон. Образцы предварительно дегазировали при температуре 200°С в течение 30 мин.
Эксперименты по спектроскопии комбинационного рассеяния проводились на спектрометре DXRxi Raman Imaging Microscope (Thermo Fisher Scientific): лазер 532 нм, мощность лазера 0.2–0.6 мВт, было сделано 50 накоплений, каждое накопление в течение 0.5 с.
Электрохимические эксперименты проводили методом гальваностатического циклирования с помощью АЗРВРИК 50 mA–10 V (ОАО “НТТ Бустер”, Россия) в диапазоне потенциалов 4.1–1.5 В при плотности тока 15 мА/г (~0.1 С) в герметичных тефлоновых ячейках. Использовалась трехэлектродная схема (FePO4/Na/Na). Сборка ячеек осуществлялась в перчаточном боксе с атмосферой сухого аргона (ОАО “Спекс”, содержание кислорода и воды <10 ppm). Электродная сборка была обернута в нетканый пропиленовый сепаратор толщиной 25 мкм (НПО “Уфим”, Москва). 1 M NaClO4 (Sigma-Aldrich, ≥99.0%) в смеси этиленкарбоната и пропиленкарбоната (объемное соотношение 1 : 1) был использован в качестве электролита. Содержание воды в электролите, измеренное кулонометрическим титрованием по Фишеру (917 Ti-Touch, Швейцария), не превышало 15 ppm.
Для приготовления электродов композиты FePO4/C (80%) смешивали с проводящей добавкой ‒ сажей (Timcal, Belgium) (10%), связующим (10%) – поливинилиденфторидом (PVDF, Sigma-Aldrich), растворенным в безводном N-метил-2-пирролидоне (NMP, Sigma-Aldrich, 50 ppm H2O). Полученную массу после тщательного перемешивания наносили на сетку из нержавеющей стали навеской 2.5 мг/см2. Получившийся электрод прессовали при 100 МПа и сушили под вакуумом при 120°C в течение 8 ч. Значения емкости рассчитывали на массу синтезированного образца FePO4/C.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
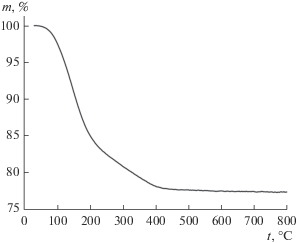
Состав и морфология. По данным ТГА (рис. 1) с масс-спектрометрическим анализом газообразных продуктов при нагревании всех полученных образцов FePO4 ⋅ nH2O единственным газообразным продуктом разложения является вода (M/z = = 18). Содержание воды в FePO4 ⋅ nH2O составило 2.4, 3.4 и 4.0 молекул на формульную единицу для образцов, полученных способами {I}, {II}, {III} соответственно. Потеря массы полностью завершается к 425°С.
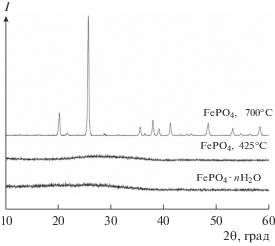
Исходные образцы FePO4 ⋅ nH2O, а также FePO4, отожженные при 425°С, являются рентгеноаморфными (рис. 2). Рентгенограммы кристаллических FePO4, отожженных при 700°С на воздухе, соответствуют гексагональной модификации FePO4 (Card № 84-0876 ICDD PDF2) (рис. 2). Размер ОКР c-FePO4 составил 70, 58 и 34 нм для образцов, полученных способами {I}, {II} {III} соответственно.
По данным рентгеноспектрального микроанализа соотношение Fe : P : O в исследуемых образцах составляет 1 : 1 : 4, что соответствует формуле FePO4.
Полученные аморфные материалы FePO4, по данным электронной микроскопии, состоят из наночастиц размером 20–30 нм (рис. 3). При этом материалы, синтезированные микроэмульсионным методом (FePO4-{II} и FePO4/С-{III}), характеризуются более развитой поверхностью. Размер чаcтиц c-FePO4-{III}, по данным СЭМ, варьируется от 50 до 200 нм со средним значением ~100 нм. Это значение выше величины ОКР, т.е. материал представляет собой агломераты из отдельных кристаллитов.
Содержание углерода в FePO4/С-{III}, полученном осаждением фосфата в присутствии мезопористого углеродного материала, определенное путем отжига образца на воздухе до постоянной массы, составило 17.6 мас. %. В КР-спектрах мезопористого углеродного материала (G_157M) интенсивная полоса с максимумом при ~1590 см–1 относится к G-полосе монокристаллического графита (sp2-гибридизация углерода), полоса при ~1350 см–1 соответствует D-полосе поликристаллического графита. Наряду с ними можно выделить еще 2 широкие полосы в областях около 1200 и 1490 см–1 (последняя из которых располагается между линиями D и G), соответствующие углеродным фрагментам, различающимся по строению (I(dif)) [40–42]. Соотношение I(sp2)/I(dif) составило ~1.5, что свидетельствует о том, что углеродное покрытие представлено преимущественно структурой графита, для которой характерна высокая электронная проводимость [40–42].
Электрохимическое тестирование. Исследуемые материалы были подвергнуты гальваностатическому разряду при плотности тока 15 мА/г (С/10), в ходе которого происходила электрохимическая интеркаляция натрия. Затем проводили циклирование (заряд–разряд, что соответствовало процессам экстракции и внедрения натрия) при токе 15 мА/г. На рис. 4 приведены зарядно-разрядные кривые исследуемых образцов.
Рис. 4.
Зарядно-разрядные кривые образцов FePO4/С-{I} (а), FePO4/С-{II} (б), FePO4/С-{III} (в) и c-FePO4/С-{III} (г) (плотность тока 15 мА/г).
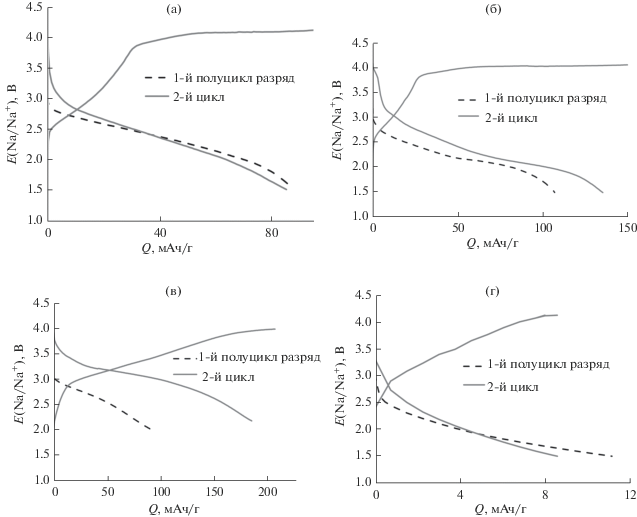
Значения разрядной емкости при циклировании аморфных образцов увеличиваются в ряду FePO4/С-{I} < FePO4/С-{II} < FePO4/С-{III} (рис. 4а–4в), что коррелирует с уменьшением размера частиц материалов. Более высокие значения емкости материалов с меньшим размером частиц обусловлены понижением длины диффузионного пути в частицах материала и увеличением доли поверхности материала, которая обычно характеризуется большей скоростью переноса заряда [2, 43]. В то же время кристаллический материал даже с минимальным размером частиц (c-FePO4-{III}) показал разрядную емкость лишь 11 мАч/г на первом цикле, которая после пяти циклов уменьшалась до 7 мАч/г.
Таким образом, в качестве катодного материала хорошо работают именно аморфные материалы. При этом следует отметить, что для материалов FePO4/С-{II} и FePO4/С-{III} разрядная емкость на втором цикле существенно превосходила емкость исходного образца (рис. 4б, 4в). Причиной этого может быть уменьшение размера частиц за счет изменения объема в ходе циклирования. Этот эффект не наблюдался для более крупнодисперсного материала FePO4/С-{I} (рис. 4а), наиболее вероятно, из-за низкой степени использования объема катодного материала. В случае FePO4/С-{II} обратимая емкость увеличивалась до 134 мАч/г, однако при дальнейшем циклировании значения емкости постепенно уменьшались (рис. 4б). Наиболее интересный результат был получен для материала FePO4/С-{III}, синтезированного микроэмульсионным методом в присутствие 17.6% мезопористого углеродного материала. Его обратимая емкость на втором цикле увеличивалась до теоретических значений и сохранялась при циклировании (рис. 4в). Кроме того, внедрение натрия в образец FePO4/С-{III} заканчивалось при потенциале 2.2 В, в отличие от образцов FePO4/С-{I} и FePO4/С-{II}, для которых этот процесс заканчивался при потенциале 1.5 В.
Низкие значения емкости кристаллического FePO4, на первый взгляд, могут показаться неожиданными, поскольку широко известен катодный материал LiFePO4, заряженной формой которого является FePO4. В результате электрохимического делитирования LiFePO4 с последующим натрированием можно получить NaFePO4, обладающий электрохимической активностью [9]. Однако NaFePO4, полученный ионным обменом из LiFePO4, имеет орторомбическую структуру оливина, в которой ионы железа находятся в октаэдрическом окружении, благоприятном как для Fe3+, так и для Fe2+ [43]. В то же время, в гексагональной структуре FePO4 ионы Fe3+ имеют тетраэдрическое окружение [44, 45], которое стабилизирует степень окисления Fe3+ и препятствует восстановлению до Fe2+ [43]. В результате электрохимическая интеркаляция натрия происходит только в разупорядоченный поверхностный слой c-FePO4/С.
По соотношению экспериментальной и теоретической разрядных емкостей был определен состав материалов после электрохимического внедрения натрия NaδFePO4/С (табл. 1). Для композита на основе аморфного образца FePO4/С-{III} экспериментальная разрядная емкость при токе 15 мА/г равна 183 мАч/г, что формально соответствует внедрению ~1.25 молей катионов Na+ на формульную единицу фосфата. Превышение δ единицы объясняется восстановлением функциональных групп на поверхности мезопористого углерода. Это потверждается данными о том, что мезопористый углерод показал обратимую емкость 50 мАч/г в диапазоне потенциалов 2.5–2.0 В. Рассчитанные значения δ коррелируют с данными о составе натрированных образцов, полученными с помощью РСМА.
ЗАКЛЮЧЕНИЕ
В работе получены и охарактеризованы материалы на основе аморфного фосфата железа (III), а также кристаллического в гексагональной модификации. Установлено, что электрохимическая интеркаляция натрия протекает лучше в материалы на основе аморфного FePO4. Показано, что значение разрядной емкости материала на основе аморфного FePO4, синтезированного микроэмульсионным методом в присутствии мезопористого углеродного материала G_157M, составляет около 183 мАч/г и является суммой емкости по внедрению натрия в FePO4 и емкости при восстановлении функциональных групп на поверхности мезопористого углерода.
Список литературы
Larcher D., Tarascon J. Towards Greener and More Sustainable Batteries for Electrical Energy Storage // Nat. Chem. 2015. V. 7. № 1. P. 19–29. https://doi.org/10.1038/ nchem.2085
Ярославцев А.Б., Кулова Т.Л., Скундин А.М. Электродные наноматериалы для литий-ионных аккумуляторов // Успехи химии. 2015. Т. 84. № 8. С. 826.
Juner Z., Wierzbicki T., Li W. A Review of Safety-Focused Mechanical Modeling of Commercial Lithium-Ion Batteries // J. Power Sources. 2018. V. 378. P. 153–168. https://doi.org/10.1016/j.jpowsour.2017.12.034
Chagnes A., Swiatowska J. Lithium Process Chemistry: Resources, Extraction, Batteries, and Recycling // Elsevier Inc. 2015. 300 p.
Islam M.S., Fisher C.A. Lithium and Sodium Battery Cathode Materials: Computational Insights into Voltage, Diffusion and Nanostructural Properties // Chem. Soc. Rev. 2014. V. 43. № 1. P. 185–204. https://doi.org/10.1039/ C3CS60199D
Kundu D., Talaie E., Duffort V., Nazar L.F. The Emerging Chemistry of Sodium Ion Batteries for Electrochemical Energy Storage // Angew. Chem. Int. Ed. 2015. V. 54. № 11. P. 3431–3448. https://doi.org/10.1002/anie.201410376
Hwang J.-Y., Myung S.-T., Sun Y.-K. Sodium-Ion Batteries: Present and Future // Chem. Soc. Rev. 2017. V. 46. № 12. P. 3529–3614. https://doi.org/10.1039/C6CS00776G
Скундин А.М., Кулова Т.Л., Ярославцев А.Б. Натрий-ионные аккумуляторы (Обзор) // Электрохимия. 2018. Т. 54. № 2. С. 131–174. https://doi.org/10.7868/ S0424857018020019
Oh S.-M., Myung S.-T., Hassoun J., Scrosati B., Sun Y.-K. Reversible NaFePO4 Electrode for Sodium Secondary Batteries // Electrochem. Commun. 2012. V. 22. № 1. P. 149–152. https://doi.org/10.1016/j.elecom.2012.06.014
Kim J., Seo D.-H., Kim H., Park I., Yoo J.-K., Jung S.-K., Park Y.-U., Goddard III W.A., Kang K. Unexpected Discovery of Low-Cost Maricite NaFePO4 as a High-Performance Electrode for Na-Ion Batteries // Energy Environ. Sci. 2015. V. 8. № 2. P. 540–545. https://doi.org/10.1039/ c4ee03215b
Kapaev R., Chekannikov A., Novikova S., Yaroslavtsev S., Kulova T., Rusakov V., Skundin A., Yaroslavtsev A. Mechanochemical Treatment of Maricite-Type NaFePO4 for Achieving High Electrochemical Performance // J. Solid State Electrochem. 2017. V. 21. № 8. P. 2373–2380. https://doi.org/10.1007/s10008-017-3592-5
Kapaev R.R., Chekannikov A.A., Novikova S.A., Kulova T.L., Skundin A.M., Yaroslavtsev A.B. Activation of NaFePO4 with Maricite Structure for Application as a Cathode Material in Sodium-Ion Batteries // Mendeleev Commun. 2017. V. 27. № 3. P. 263–264. https://doi.org/10.1016/j.mencom.2017.05.015
Masquelier C., Croguennec L. Polyanionic (Phosphates, Silicates, Sulfates) Frameworks as Electrode Materials for Rechargeable Li (or Na) Batteries // Chem. Rev. 2013. V. 113. № 8. P. 6552–6591. https://doi.org/10.1021/cr3001862
Moreau P., Guyomard D., Gaubicher J., Boucher F. Structure and Stability of Sodium Intercalated Phases in Olivine FePO4 // Chem. Mater. 2010. V. 22. № 14. P. 4126–4128. https://doi.org/10.1021/cm101377h
Kundu D., Talaie E., Duffort V., Nazar L.F. The Emerging Chemistry of Sodium Ion Batteries for Electrochemical Energy Storage // Angew. Chem. Int. Ed. 2015. V. 54. № 11. P. 3431–3448. https://doi.org/10.1002/ anie.201410376
Sun A., Beck F.R., Haynes D., Poston J.A., Jr., Narayanan S.R., Kumta P.N., Manivannan A. Synthesis, Characterization, and Electrochemical Studies of Chemically Synthesized NaFePO4 // Mater. Sci. Eng. B. 2012. V. 177. P. 1729–1733. https://doi.org/10.1016/j.mseb.2012.08.004
Prosini P.P., Cento C., Masci A., Carewska M. Sodium Extraction from Sodium Iron Phosphate with a Maricite Structure // Solid State Ion. 2014. V. 263. P. 1–8. https://doi.org/10.1016/j.ssi.2014.04.019
Kosova N.V., Podugolnikov V.R., Devyatkina E.T., Slobodyuk A.B. Structure and Electrochemictry of NaFePO4 and Na2FePO4F Cathode Materials Prepared via Mechanochemical Route // Mater. Res. Bull. 2014. V. 60. P. 849–857. https://doi.org/10.1016/j.materresbull.2014.09.081
Yang S.-B., Son J.-T. Synthesis and Characterization of Carbon-Coated Nano-Sized Na0.9FePO4 // J. Korean Phys. Soc. 2016. V. 69. № 3. P. 443–447. https://doi.org/10.3938/ jkps.69.443
Скундин А.М., Брылев О.А. Наноматериалы в современных источниках тока. М.: Факультет наук о материалах, 2011. 56 с.
Yang X., Zhang S.M., Zhang J.X., Xu M.Y., Ren P., Li X.C., Yan L.C. The Study on Synthesis and Modification for Iron Phosphate // Funct. Mater. Lett. 2011. V. 4. P. 323–326. https://doi.org/10.1142/S1793604711002226
Сафронов Д.В., Новикова С.А., Кулова Т.Л., Скундин А.М., Ярославцев А.Б. Диффузия лития в материалах на основе фосфата лития-железа, легированных кобальтом и магнием // Неорган. материалы. 2012. Т. 48. № 5. С. 598–605.
Stenina I.A., Sobolev A.N., Yaroslavtsev S.A., Rusakov V.S., Kulova T.L., Skundin A.M., Yaroslavtsev A.B. Influence of Iron Doping on Structure and Electrochemical Properties of Li4Ti5O12 // Electrochim. Acta. 2016. V. 219. P. 524–530. https://doi.org/10.1016/j.electacta.2016.10.034
Liu Q., Liu W., Li D., Wang Z. Synthesis and Characterization of Grape-Like LiFe0.97M0.03PO4/C (M = Ni, Co, Mn) composites // Mater. Lett. 2016. V. 162. P. 87–90. https://doi.org/10.1016/j.matlet.2015.09.129
Zaghib K., Guerfi A., Hovington P., Vijh A., Trudeau M., Mauger A., Goodenough J.B., Julien C.M. Review and Analysis of Nanostructured Olivine-Based Lithium Rechargeable Batteries: Status and Trends // J. Power Sources. 2013. V. 232. P. 357–369. https://doi.org/10.1016/j.jpowsour.2012.12.095
Zhang S.M., Zhang J.X., Xu S.J., Yuan X.J., He B.C. Li Ion Diffusivity and Electrochemical Properties of FePO4 Nanoparticles Acted Directly as Cathode Materials in Lithium Ion Rechargeable Batteries // Electrochim. Acta. 2013. V. 88. P. 287–293. https://doi.org/10.1016/ j.electacta.2012.10.029
Капаев Р.Р., Новикова С.А., Кулова Т.Л., Скундин А.М., Ярославцев А.Б. Синтез наноразмерных пластинок LiFePO4 для катодных материалов литий-ионных аккумуляторов // Российские нанотехнологии. 2016. Т. 11. № 11–12. С. 55–57.
Wang J., Sun X. Understanding and Recent Development of Carbon Coating on LiFePO4 Cathode Materials for Lithium-Ion Batteries // Energy Environ. Sci. 2012. V. 5. № 1. P. 5163–5185. https://doi.org/10.1039/C1EE01263K
Li H., Zhou H. Enhancing the Performances of Li-Ion Batteries by Carbon-Coating: Present and Future // Chem. Commun. 2012. V. 48. P. 1201–1217. https://doi.org/10.1039/ C1CC14764A
Kucinskis G., Bajars G., Kleperis J. Graphene in Lithium Ion Battery Cathode Materials // J. Power Sources. 2013. V. 240. P. 66–79. https://doi.org/10.1016/j.jpowsour.2013.03.160
Wang W., Gao P., Zhang S., Zhang J. A Cylindrical FePO4/MWCNTs Composite with a 3D Conductive Network Structure Used as a Cathode Material for Lithium-Ion Batteries // J. Alloys Compd. 2016. V. 692. P. 908–914. https://doi.org/10.1016/j.jallcom.2016.08.002
Wang G., Ma Z., Shao G., Kong L., Gao W. Synthesis of LiFePO4@carbon Nanotube Core-Shell Nanowires with a High-Energy Efficient Method for Superior Lithium Ion Battery Cathodes // J. Power Sources. 2015. V. 291. P. 209–214. doi.org/https://doi.org/10.1016/j.jpowsour.2015.05.027
Стенина И.А., Букалов С.С., Кулова Т.Л., Скундин А.М., Табачкова Н.Ю., Ярославцев А.Б. Влияние углеродного покрытия на электрохимические свойства наноразмерных материалов на основе титаната лития // Российские нанотехнологии. 2015. Т. 10. № 11–12. С. 25–31.
Eftekhari A. LiFePO4/C Nanocomposites for Lithium-Ion Batteries // J. Power Sources. 2017. V. 343. P. 395–411. https://doi.org/10.1016/j.jpowsour.2017.01.080
Danks A., Hall S., Schnepp Z. The Evolution of ‘Sol–Gel’ Chemistry as a Technique for Materials Synthesis // Mater. Horizons. 2016. V. 3. № 2. P. 91–112. https://doi.org/10.1039/C5MH00260E
Chen L., Wu P., Xiea K., Li J., Xu B., Cao G., Chen Y., Tang Y., Zhou Y., Lu T., Yang Y. FePO4 Nanoparticles Embedded in a Large Mesoporous Carbon Matrix as a High-Capacity and High-Rate Cathode for Lithium-Ion Batteries // Electrochim. Acta. 2003. V. 92. P. 433–437. https://doi.org/10.1016/j.electacta.2013.01.048
Zhu Y., Tang S., Shi H., Hu H. Synthesis of FePO4 ⋅ xH2O for Fabricating Submicrometer Structured LiFePO4/C by a Co-Precipitation Method // Ceram. Int. 2014. V. 140. P. 2685–2690. https://doi.org/10.1016/j.ceramint.2013.10.055
Xu S., Zhang S., Zhang J., Tana T., Liu Y. A Maize-Like FePO4@MCNT Nanowire Composite for Sodium-Ion Batteries via a Microemulsion Technique // J. Mater. Chem. A. 2014. V. 2. P. 7221–7228. https://doi.org/10.1039/c4ta00239c
Wang J., Sun X. Understanding and Recent Development of Carbon Coating on LiFePO4 Cathode Materials for Lithium-Ion Batteries // Energy Environ. Sci. 2012. V. 5. № 1. P. 5163–5185. https://doi.org/10.1039/ C1EE01263K
Wilcox J.D., Doeff M.M., Marcinek M., Kostecki R. Factors Influencing the Quality of Carbon Coatings on LiFePO4 // J. Electrochem. Soc. 2007. V. 154. № 5. P. A389–A395. https://doi.org/10.1149/1.2667591
Christmann K. Introduction to Surface Physical Chemistry. N.Y.: Springer, 1991. 274 p.
Doeff M.M., Hu Y., McLarnon F., Kostecki R. Effect of Surface Carbon Structure on the Electrochemical Performance of LiFePO4 // Electrochem. Solid-State Lett. 2003. V. 6. № 10. P. A207–A209. https://doi.org/10.1149/ 1.1601372
Song Y., Zavalij P.Y., Suzuki M., Whittingham M.S. New Iron(III) Phosphate Phases: Crystal Structure and Electrochemical and Magnetic Properties // Inorg. Chem. 2002. V. 41. P. 5778–5786. https://doi.org/10.1021/ic025688q
Tang P., Holzwarth N.A.W., Du Y. A. Comparison of the Electronic Structures of Four Crystalline Phases of FePO4 // Phys. Rev. B. 2007. V. 76. P. 174118. https://doi.org/10.1103/PhysRevB.76.174118
Masquelier C., Reale P., Wurm C., Morcrette M., Dupont L., Larcher D. Hydrated Iron Phosphates FePO4 ⋅ · nH2O and Fe4(P2O7)3 ⋅ nH2O as 3 V Positive Electrodes in Rechargeable Lithium Batteries // J. Electrochem. Soc. 2002. V. 149. № 8. P. A1037–A1044. https://doi.org/10.1149/1.1489686
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы